抑郁症患者药物治疗前后单核细胞中microRNA表达水平变化与抑郁症状的关系
2015-06-28张巧丽过伟张理义赵林范惠民钟爱芳牛威戴运华孙欣羊卢正斌陈升东宋红涛
张巧丽,过伟,张理义,赵林,范惠民,钟爱芳,牛威,戴运华,孙欣羊,卢正斌,陈升东,宋红涛
·临床研究·
抑郁症患者药物治疗前后单核细胞中microRNA表达水平变化与抑郁症状的关系
张巧丽,过伟,张理义,赵林,范惠民,钟爱芳,牛威,戴运华,孙欣羊,卢正斌,陈升东,宋红涛
目的探讨抑郁症患者药物治疗前后单核细胞中microRNA(miRNA)的表达水平与抑郁症状的关系。方法纳入2012年8月-2013年10月解放军102医院收治的81例未经药物治疗、符合DSM-Ⅳ诊断标准的抑郁症患者作为病例组,纳入同期81例正常人作为对照组。抽取3例患者和3例正常人,采用基因芯片筛查出26种miRNA,然后以实时荧光定量PCR技术检测两组单核细胞中9种miRNA(miR-146b、miR-1972、miR-26b、miR-29b、miR-338、miR-4485、miR-4498、miR-4743和miR-874)的表达水平。选取病例组中20例患者,分别在用药前和用药(包括文拉法辛、舍曲林、米氮平等)6周后检测miRNA表达水平,并采用汉密顿抑郁量表(HAMD)和临床疗效总评量表(CGI)对治疗前及治疗6周后的临床症状及疗效进行评估。结果与对照组比较,病例组单核细胞中5种miRNA(miR-26b、miR-4743、miR-4498、miR-4485、miR-1972)表达上调,差异有统计学意义(P<0.05)。抗抑郁药治疗前后,ΔmiRNA-1972、ΔmiRNA-4485、ΔmiRNA-4498、ΔmiRNA-4743与阻滞因子的改善程度呈正相关(P<0.05),ΔmiRNA-26b与日夜变化因子的改善程度呈负相关(P<0.05)。Logistic回归分析显示,miRNA-4485能解释阻滞因子变异量的28.8%(P<0.05)。结论抑郁症患者单核细胞中miR-26b、miR-4743、miR-4498、miR-4485和miR-1972可能作为反映抑郁症转归的生物标记物。
抑郁症;微RNAs;生物学标记
抑郁症是一种慢性情绪障碍,影响着世界上近3亿人口,其终生患病率高达19%[1-2]。虽然目前导致抑郁症的确切分子和细胞机制尚不清楚,但有研究证实,近50%的抑郁症罹患风险与基因因素相关[3]。既往研究指出,抑郁症可能是因突触可塑性受损致使大脑无法恰当地适应环境所致[4-5]。此外,还有证据显示抑郁症与学习和记忆功能受损相关[6-7]。非编码小分子RNA又被称为microRNA (miRNA),是一类长度在22nt左右,能调控编码区蛋白表达水平的内源性小分子RNA[8]。有研究认为:miRNA对大脑的发育和功能调节具有重要作用[9],而一些miRNA的表达水平会随着大脑皮质的发育而不断改变[10]。miRNA不仅参与神经功能的调节[11-12],还与突触可塑性有关[13]。Schratt等[14]研究发现,miRNA在突触部位的产物可能受到二乙基溴乙酰胺的控制,且可能与钙蛋白酶依赖作用相关。由此可见,miRNA在抑郁症患者单核细胞中的差异性表达可能与抑郁症的发病机制密切相关。Maussion等[15]在一项包括38例自杀者和18例对照的研究中发现,两种miRNA在完成自杀的人群中表达上调。Smalheiser等[16]认为,在抑郁症患者中应激可能是调节miRNA表达的最相关的因素。这些研究表明,miRNA可能不仅与抑郁症的病理生理相关,而且与抑郁症的某些症状也具有很高的相关性,但相关的证据较少,且主要是通过对具有某些典型特征(例如自杀行为)的患者的研究获得。目前,我国抑郁症的诊断依据主要来源于症状学,而抑郁症患者单核细胞中miRNA的表达水平与其抑郁症状的相关性国内外报道均较少。本研究试图通过对汉密顿抑制量表(HAMD)总分及各因子分与miRNA的相关性进行分析,寻找miRNA与抑郁症不同症状相关的证据,以期探索不同miRNA对抑郁症病理生理机制的作用。
1 资料与方法
1.1 研究对象 以2012年8月-2013年10月解放军102医院门诊以及精神病科连续收治的81例患者作为病例组。入组标准:①符合美国精神疾病诊断和统计手册第4版(DSM-Ⅳ)抑郁症诊断标准;②首发患者或入组前3个月内未服抗抑郁药物;③年龄15~68岁。排除标准:①患有其他精神疾病;②患有脑外伤等躯体或神经系统疾病;③有酗酒或药物滥用史;④入组前1个月内有输血史;⑤入组前3个月内使用过无抽搐电休克治疗(MECT)者。81例患者中男33例,女48例,年龄33.62±15.17(15~56)岁。纳入解放军102医院的工作人员、体检人员、大学生群体及社区群众共81例作为对照组。入组标准:①无精神疾病家族史;②近1个月内无重大创伤事件;③近1个月内无输血史。81例对照均为汉族,其中男30例,女51例,年龄32.59±14.79(15~68)岁,与病例组一般情况的差异无统计学意义(P>0.05)。本研究获得医院医学伦理委员会批准,所有受试者或受试家属(监护人)均签署知情同意书。
1.2 量表评估 在用药前及用药6周后由3名精神科主治医师或心理医生使用汉密顿抑郁量表(HAMD)和临床疗效总评量表(CGI)对病例组受试者进行评定。评定前,所有参与研究人员进行统一培训,统一方法学,标准化施测过程。其中HAMD使用总分和各因子分统计,CGI使用疗效总评分(global improvement,GI)统计。
HAMD是临床上评定抑郁状态最常用的量表[17],含7个评价因子:①焦虑/躯体化;②体重;③认知障碍;④日夜变化;⑤阻滞;⑥睡眠障碍;⑦绝望感。本量表经中国本土化并经信、效度检验后,可用于中国人群[18]。
CGI最先由WHO设计,用于评定临床疗效,可适用于任何精神科治疗和研究对象[19]。本量表经中国本土化并经信、效度检验,可用于中国人群[20]。以CGI量表中GI分值作为评定标准,将“显著进步”和“进步”归为高效组(基本治愈),将“稍进步”和“无变化”归为低效组(未愈)。
1.3 基因芯片筛查、总RNA抽提及荧光定量PCR检测 基因芯片筛查:应用Affymetrix miRNA 3.0芯片,取抑郁症患者3例、正常对照3例共6个样本进行预检测和分析。样品总RNA利用NanoDrop ND-2100(Thermo Scientific)定量并经Agilent 2100(Agilent Technologies)检测RNA完整性。RNA质检合格后,样本的标记、芯片的杂交以及洗脱参照芯片标准流程进行操作。首先,总RNA经过Ploly A加尾,再进一步用生物素标记。标记好的RNA与芯片杂交,经洗涤和染色后利用Affymetrix Scanner 3000(Affymetrix)扫描得到原始图像。数据分析:将原始数据导入Expression Console软件(Version 1.3.1,Affymetix),利用RMA的方法进行标准化后得到的结果,包含原始信号值、标准化信号值、检出情况以及详细的注释信息。在筛选差异miRNA之前,先进行探针过滤,选择至少有一个样品标记为“Detected”的探针保留用于后续筛选。“Detected”在病例组及对照组均被标记两次及以上则表明存在生物学重复,此时利用t检验的P值和标准化信号值的差异倍数(Fold change)进行筛选,标准为Fold change≥2.0且P≤0.05。对于无生物学重复者,仅利用Fold change值进行筛选,标准为Fold change≥2.0。总RNA抽提主要试剂和耗材、主要仪器以及荧光定量PCR参照文献[21]进行。
1.4 药物干预 在81例患者中,随机选取20例进行临床药物干预及随访观察,每日给予口服文拉法辛(Venlafaxine,150~225mg)、米氮平(Mirtazapine,22.5~45mg)和舍曲林(Sertraline,50~150mg)治疗。
1.5 统计学处理 采用SDS 2.4和Data Assist V3.0软件进行数据读取和分析,在剔除掉不合格样本后选择RNU48为内参进行数据标准化,将抑郁症各用药组与正常对照组进行miRNA差异表达分析。全部数据采用SPSS 17.0软件进行统计分析。使用Wilcoxon秩和检验、Pearson相关分析、logistic回归分析探究miRNA表达水平与抑郁症状的关系。所有统计分析均为双侧显著性检验,P<0.05为差异有统计学意义。
2 结 果
2.1 抑郁症患者基因芯片筛查结果 通过基因芯片筛查,发现26种成熟miRNA在病例组和对照组间存在差异表达,其中5种在病例组中上调,21种在病例组中下调。结合国内外文献,选取其中9种miRNA进行后续定量PCR验证。
2.2 药物治疗前两组单核细胞中miRNA表达水平的比较 Wilcoxon秩和检验显示,在选取的9种miRNA中,有5种(miR-26b、miR-4743、miR-4498、miR-4485、miR-1972)在病例组治疗前单核细胞中的表达水平与对照组比较差异有统计学意义(P<0.05),且病例组ΔCt值的中位数均小于正常对照组(表1)。
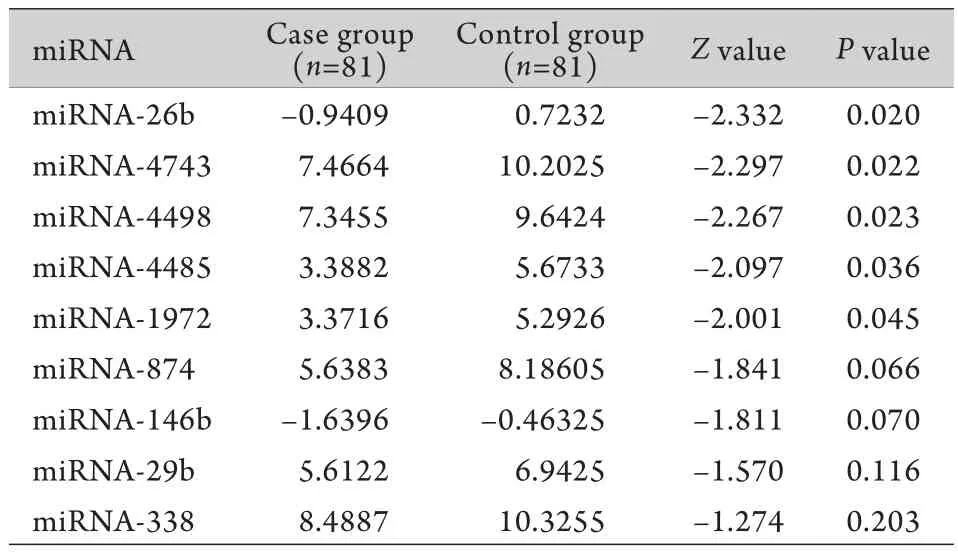
表1 病例组药物治疗前与对照组miRNA表达水平比较(ΔCt中位数)Tab.1 Comparison of miRNA expression levels between case group and control group before treatment (ΔCt median)
2.3 不同疗效组药物治疗前后单核细胞中miRNA表达水平的比较 抗抑郁药物治疗6周后,高效组共有14例,低效组共有6例。取治疗前和治疗6周后各症状群及量表总分的差值,用于衡量治疗前后各症状的改善程度。取治疗前和治疗6周后各miRNA表达水平的差值(ΔmiRNA),用于衡量治疗前后各miRNA表达水平的变化。采用两相关样本的秩和检验,比较高效组和低效组miRNA表达水平差值,结果显示:抗抑郁药物治疗6周后,高效组单核细胞中miRNA表达水平高于治疗前,其中miRNA-1972和miRNA-4498表达水平的差异有统计学意义(P<0.05);低效组单核细胞中miRNA表达水平与治疗前相比差异无统计学意义(P>0.05,表2)。
表2 不同疗效组药物治疗前后单核细胞中miRNA表达水平变化(±s)Tab.2 Comparison of the miRNA level between groups with different curative effect before and after antidepressants treatment (±s)
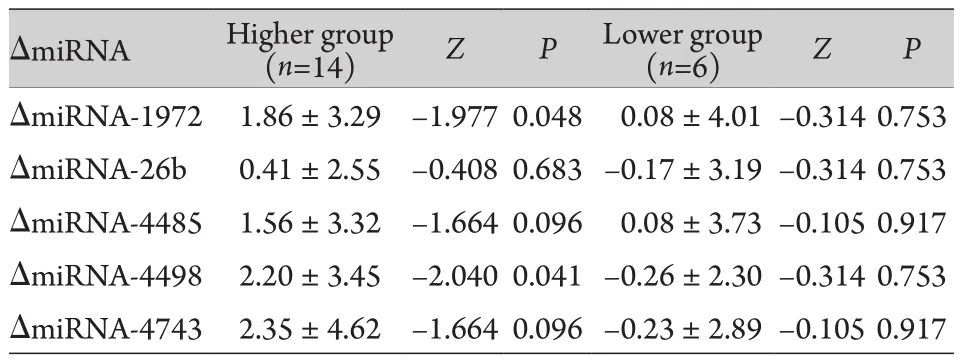
表2 不同疗效组药物治疗前后单核细胞中miRNA表达水平变化(±s)Tab.2 Comparison of the miRNA level between groups with different curative effect before and after antidepressants treatment (±s)
(n=14) Z P Lower group(n=6) Z PΔmiRNA-1972 1.86±3.29 –1.977 0.048 0.08±4.01–0.314 0.753 ΔmiRNA-26b 0.41±2.55 –0.408 0.683–0.17±3.19–0.314 0.753 ΔmiRNA-4485 1.56±3.32 –1.664 0.096 0.08±3.73–0.105 0.917 ΔmiRNA-4498 2.20±3.45 –2.040 0.041–0.26±2.30–0.314 0.753 ΔmiRNA-4743 2.35±4.62 –1.664 0.096–0.23±2.89–0.105 0.917 ΔmiRNA Higher group
2.4 抗抑郁治疗前后miRNA的变化与HAMD总分、各因子分及GI的相关性分析 将HAMD总分、各因子分的改变程度及GI得分与ΔmiRNA行Pearson相关分析,结果显示:ΔmiRNA-1972、ΔmiRNA-4485、ΔmiRNA-4498、ΔmiRNA-4743与阻滞因子的改善程度呈正相关(P<0.05),ΔmiRNA-26b与日夜变化因子的改善程度呈负相关(P<0.05),ΔmiRNA与GI无显著相关(P>0.05,表3)。
2.5 ΔmiRNA对部分抑郁症状群变化影响的logistic回归分析 以ΔmiRNA为自变量,以阻滞因子和日夜变化因子的疗效作为二分类变量,进行logistic回归分析。两因子的疗效以减分率(Δ阻滞因子得分/0周阻滞因子得分)来评价。阻滞因子、日夜变化因子的减分率<0.5作为低疗效,>0.5作为高疗效。结果显示,ΔmiRNA-4498进入以阻滞因子为二分类变量的回归方程,能解释阻滞症状群改善程度的28.8%,偏回归系数为0.438,标准误为0.209(P<0.05);以日夜变化因子的疗效为二分类变量的logistic回归分析结果无统计学意义(P>0.05)。
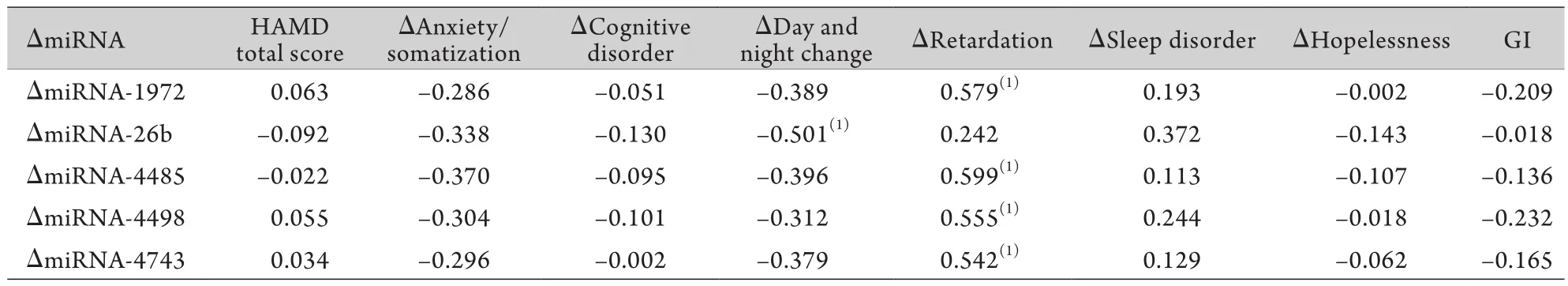
表3 ΔmiRNA与HAMD总分、各因子分及GI的相关性分析(r值)Tab.3 Correlation of miRNA expression alteration and HAMD and GI score changes before and after antidepressants treatment (r)
3 讨 论
大量研究表明miRNA在大脑中存在表达[22],并可调节大脑中基因水平的差异性表达[23]。Xu等[24]通过检验重度抑郁症患者外周血及对死亡患者大脑灰质进行尸检,发现大量miRNA的表达。Fan等[25]研究发现miRNA与重度抑郁症的发病机制相关。由此可认为,某些miRNA的异常表达在重度抑郁症病理生理学中具有潜在的意义。Kosik[26]和Dwivedi[27]研究发现在情感障碍尤其是抑郁症患者可检测到miRNA显著表达。
有证据表明,miRNA在抑郁症分子信号肽中具有重要作用[28],且可能与抑郁症状有关。本研究发现,治疗6周后患者单核细胞中miRNA-1972、miRNA-4485、miRNA-4498、miRNA-4743表达水平的变化与其阻滞症状的改善程度呈正相关,即miRNA-1972、miRNA-4485、miRNA-4498、miRNA-4743表达水平越低,阻滞症状越严重。Logistic回归分析表明,miRNA-4498表达水平改变与阻滞症状群的改善程度有显著的线性关系,抑郁症患者单核细胞中miRNA-4498的表达水平可预测患者28.8%的阻滞症状群。miRNA-4498由Jima等[29]于2010年首次报道。目前,miRNA-1972、miRNA-4485、miRNA-4498、miRNA-4743与疾病关系的相关研究尚少。此外,本研究还发现,miRNA-26b表达水平的变化与日夜变化症状改善程度呈负相关,即miRNA-26b表达水平越高,抑郁症患者日夜变化症状就越严重,这也与抑郁症的临床特征相符。Absalon等[30]对阿尔茨海默病患者的大脑进行尸检,病理学检查结果发现,从发病早期开始,其miRNA-26b表达水平即显著上升。该研究还发现,miRNA-266的异常表达可引起tau-蛋白磷酸化,从而导致神经元细胞凋亡,但目前miRNA-26b的表达与抑郁症的相关研究尚少。
目前抑郁症的药物治疗主要包括选择性5-HT回收抑制剂(SSRI)、5-HT和去甲肾上腺素双重回收抑制剂(SNRI)、去甲肾上腺素和特异性5-HT能药物(NaSSA)[31]。有研究显示,某些药物可影响miRNA表达水平,在长期应用锂盐和2-丙戊酸钠药物治疗后,海马组织中miRNA的表达发生改变,并发现锂盐治疗组中37种miRNA出现差异性表达,2-丙戊酸钠治疗组中31种miRNA出现差异性表达[32]。本研究中使用的抗抑郁药物文拉法辛、米氮平和舍曲林分别为SNRI、NaSSA及SSRI。相关分析结果显示,miRNA-1972、miRNA-4485、miRNA-4498、miRNA-4743、miRNA-26b与临床疗效总评分(GI)并无显著相关性。Mouillet-Richard等[33]对抗抑郁药物调节路径进行研究发现,miRNA的抗抑郁药物调控作用可能与miRNA基因水平差异性表达或与处于不同成熟期有关。有文献报道,抑郁症患者使用艾司西酞普兰治疗12周后,其单核细胞中miRNA共30种miRNA的表达水平发现改变,其中28种miRNA表达上调,包括本研究中的miRNA-26b,另外2种miRNA显著下调,但不包括本研究中其他4种miRNA[32]。
综上所述,抑郁症患者单核细胞内miRNA表达水平的异常与抑郁症的发病有明显关联,miRNA-1972、miRNA-4485、miRNA-4498、miRNA-474、miRNA-26b可能作为抑郁症转归的生物标记物,用于监测疾病状态,预测疗效和预后,但其具体作用机制有待进一步研究。
[1] Vos T, Flaxman AD, Naghavi M,et al. Years lived with disability (YLDs) for 1160 sequelae of 289 diseases and injuries 1990-2010: a systematic analysis for the Global Burden of Disease Study 2010[J]. Lancet, 2012, 380(9859): 2163-2196.
[2] Andrade L, Caraveo-Anduaga JJ, Berglund P,et al. The epidemiology of major depressive episodes: results from the International Consortium of Psychiatric Epidemiology (ICPE) Surveys[J]. Int JMethodsPsychiatr Res, 2003, 12(1): 3-21.
[3] Fava M, Kendler KS. Major depressive disorder[J]. Neuron, 2000, 28(2): 335-341.
[4] Duman RS, Malberg J, Nakagawa S,et al. Neuronal plasticity and survival in mood disorders[J]. Biol Psychiatr, 2000, 48(8): 732-739.
[5] Fossati P, Radtchenko A, Boyer P. Neuroplasticity: from MRI to depressive symptoms[J]. Eur Neuropsychopharmacol, 2004, 14(5): 503-510.
[6] Horan WP, Pogge DL, Borgaro SR,et al. Learning and memory in adolescent psychiatric inpatients with major depression: a normative study of the California Verbal Learning Test[J]. Arch Clin Neuropsychol, 1997, 12(6): 575-584.
[7] Bearden CE, Glahn DC, Monkul ES,et al. Patterns of memory impairment in bipolar disorder and unipolar major depression[J]. Psychiatr Res, 2006, 142(2-3): 139-150.
[8] Lee RC, Feinbaum RL, Ambros V,et al. The C. Elegansheterochronic gene lin-4 encodes small RNAs with antisense complementarity to lin-14[J]. Cell, 1993, 75(5): 843-854.
[9] Natalie JB, Murray JC. MiRNA dysregulation inschizophrenia[J]. Neurobiol Dis, 2012, 46(2): 263-271.
[10] Miska EA, Alvarez-Saavedra E, Townsend M,et al. Microarray analysis of miRNA expression in the developing mammalian brain[J]. Genome Biol, 2004, 5(9): R68.
[11] Cheng HY, Papp JW, Varlamova O,et al. MiRNA modulation of circadian-clock period and entrainment[J]. Neuron, 2007, 54(5): 813-829.
[12] Sun XY, Song HT, Zhao L,et al. Effects of antipsychotics on microRNA expression of peripheral blood in schizophrenia patients[J]. Med J Chin PLA, 2014, 39(12): 969-974. [孙欣羊,宋红涛, 赵林, 等. 精神分裂症患者外周血microRNA表达水平在抗精神病药物治疗前后的变化[J]. 解放军医学杂志, 2014, 39(12): 969-974.]
[13] Schratt GM, Tuebing F, Nigh EA,et al. A brain specific miRNA regulates dendritic spine development[J]. Nature, 2006, 439(7074): 283-289.
[14] Schratt G. MicroRNAs at the synapse[J]. Nat Rev Neurosci, 2009, 10(12): 842-849.
[15] Maussion G, Yang J, Yerko V,et al. Regulation of a truncated form of tropomyosin-related kinase B (TrkB) by Hsa-miR-185* in frontal cortex of suicide completers[J]. PLoS One, 2012, 7(6): e39301.
[16] Smalheiser NR, Luqli G, Rizavi HS,et al. MicroRNA expression is down-regulated and reorganized in prefrontal cortex of depressed suicide subjects[J]. PLoS One, 2012, 7(3): e33201.
[17] Hamilton M. Development of arating scale for primary depressive illness[J]. Br J Soc Clin Psychol, 1967, 6(4): 278-296.
[18] Zhang ZJ. Scale manual of behavioral medicine[M]. Beijing: Chinese Medicine Electronic Audiovisual Press, 2005. 77-485. [张作记. 行为医学量表手册[M]. 北京: 中华医学电子音像出版社, 2005. 77-485.]
[19] Guy W. ECDEU assessment manual for psychopharmacology[M]. Rockville MD: U.S. National Institute of Health, Psychopharmacology Research Branch, 1976. 218-221.
[20] Wu WY. Clinical global impression (CGI)[J]. Shanghai Archi Psychiatr, 1984, 2(1): 76-77. [吴文源. 临床疗效总评量表(CGI)[J]. 上海精神医学, 1984, 2(1): 76-77.]
[21] Sun XY, Song HT, Zhao L,et al. A case-control study of aberrant expression of microRNA in schizophrenia patients[J]. Chin J Behav Med Brain Sci, 2013, 22(12): 1095-1098. [孙欣羊, 宋红涛, 赵林, 等. 精神分裂症患者单核细胞MicroRNA异常表达的对照研究[J]. 中华行为医学与脑科学杂志, 2013, 22(12): 1095-1098.]
[22] Sempere LF, Freemantle S, Pitha-Rowe I,et al. Expression profiling of mammalian microRNAs uncovers a subset of brainexpressed microRNAs with possible roles in murine and human neuronal differentiation[J]. Genome Biol, 2004, 5(3): R13.
[23] Krichevsky AM, King KS, Donahue CP,et al. A microRNA array reveals extensive regulation of microRNAs during brain development[J]. RNA, 2003, 9(10): 1274-1281.
[24] Xu Y, Liu H, Li F,et al. A polymorphism in the microRNA-30e precursor associated with major depressive disorder risk and P300 waveform[J]. J Affect Dis, 2010, 127(1-2): 332-336.
[25] Fan HM, Sun XY, Guo W,et al. Differential expression of microRNA in peripheral blood mononuclear cells as specific biomarker for Major Depressive Disorder patients[J]. J Psychiatr Res, 2014, 59: 45-52.
[26] Kosik KS. The neuronal microRNA system[J]. Nat Rev Neurosci, 2006, 7(12): 911-920.
[27] Dwivedi Y. Evidence demonstrating role of microRNAs in the etiopathology of major depression[J]. J Chem Neuroanat, 2011, 42(2): 142-156.
[28] Hansen KF, Obrietan K. MicroRNA as therapeutic targets for treatment of depression[J]. Neuropsychiatr Dis Treat, 2013, 9: 1011-1021.
[29] Jima DD, Zhang J, Jacobs C,et al. Deep sequencing of the small RNA transcriptome of normal and malignant human B cells identifies hundreds of novel microRNAs[J]. Blood, 2010, 116(23): e118-e127.
[30] Absalon S, Kochanek DM, Raghavan V,et al. MiR-26b, upregulated in Alzheimer's disease, activates cell cycle entry, tauphosphorylation, and apoptosis in postmitotic neurons[J]. J Neurosci, 2013, 33(37): 14645-14659.
[31] Cao L, Zhang Y, Liu BC. Therapeutic effect of venlafaxine hydrochloride sustained tablet combined with electroacupuncture on the treatment of depression with somatic symptoms[J]. J Logist Univ PAPF (Med Sci), 2013, 22(9): 796-798. [曹雷, 张颖, 刘百川. 盐酸文拉法辛缓释片联合电针治疗抑郁症伴躯体症状疗效分析[J]. 武警后勤学院学报(医学版), 2013, 22(9): 796-798.]
[32] Zhou R, Yuan P, Wang Y,et al. Evidence for selective microRNAs and their effectors as common long-term targets for the actions of mood stabilizers[J]. Neuropsychopharmacology, 2009, 34(6): 1395-1405.
[33] Mouillet-Richard S, Baudry A, Launay JM,et al. MicroRNAs and depression[J]. Neurobiol DisNeurobiol Dis, 2012, 46(2): 272-278.
[34] Bocchio-Chiavetto L, Maffioletti E, Bettinsoli P,et al. Blood microRNA changes in depressed patients during antidepressant treatment[J]. Eur Neuropsychopharmacol, 2013, 23(7): 602-611.
Relationship between depressive symptoms and miRNA expression level in monocytes of patients with depression before and after antidepressant treatment
ZHANG Qiao-li1, GUO Wei2, ZHANG Li-yi2*, ZHAO Lin1, FAN Hui-min3, ZHONG Ai-fang2, NIU Wei2, DAI Yunhua4, SUN Xin-yang3, LU Zheng-bin4, CHEN Sheng-dong2, SONG Hong-tao51Department of Psychiatry, Postgraduate School, Xuzhou Medical College, Xuzhou, Jiangsu 221003, China
2Mental Diseases Prevention and Treatment Center of PLA, 102 Hospital of PLA, Changzhou, Jiangsu 213003, China
3Department of Psychiatry and Psychology, Second Military Medical University, Shanghai 200433, China
4GoPath Laboratories, LLC, Illinois 60637, USA
5Department of Mental Health, Clinical Medicine College, Jiangsu University, Zhenjiang, Jiangsu 212013, China
*Corresponding author, E-mail: zly102@126.com
This work was supported by the Grants for Medical Science, Technology Innovation (2012) of Nanjing Command (12MA002)
ObjectiveTo explore the correlation of depressive symptoms to the microRNA (miRNA) expression level in monocytes of patients with depression before and after antidepressant treatment.MethodsEighty-one patients with depression, admitted to the 102 Hospital of PLA from Aug. 2012 to Oct. 2013, having not
antidepressants treatment and meeting the criteria as listed in Diagnostic and Statistical Manual 4th edition (DSM-IV), were selected as case group. Eighty-one normal individuals served as control group. With Affymetrix Expression Array, 26 miRNAs were identified from 3 individuals from each group as candidate miRNA, and among them 9 miRNAs (miR-146b, miR-1972, miR-26b, miR-29b, miR-338, miR-4485, miR-4498, miR-4743 and miR-874) in monocytes were selected for quantitative real-time reverse transcription polymerase chain reaction (RTPCR) assessment. Twenty patients from the case group were selected for the assessment of miRNA expression levels, and the clinicalsymptoms and treatment effect were evaluated using Hamilton Depression Scale (HAMD) and Clinical Global Impression (CGI), before and 6 weeks after antidepressant (venlafaxine, sertraline, mirtazapine, etc.) treatment.ResultsCompared with the control group, the expression levels of miRNA-26b, miRNA-4743, miRNA-4498, miRNA-4485 and miRNA-1972 of the case group were significantly up-regulated (P<0.05). The variance of expression level of miRNA-4743, miRNA-4498, miRNA-4485 and miRNA-1972 was respectively positively correlated with improvement in retardation factors (P<0.05), meanwhile the variance of expression level of miRNA-26b was negatively correlated with the improvement of day and night change factors (P<0.05). Logistic regression analysis demonstrated that the alteration of miRNA-4485 expression may account 28.8% of retardation variance (P<0.05).ConclusionThe miRNA-4743, miRNA-4498, miRNA-4485, miRNA-1972 and miRNA-26b in monocytes may serve as the biomarkers for the prognosis of depressive disorder.
depressive disorder; microRNAs; biological markers
R749.42
A
0577-7402(2015)02-0128-05
10.11855/j.issn.0577-7402.2015.02.08
2014-06-11;
2014-08-07)
(责任编辑:李恩江)
南京军区2012年医学科技创新课题(12MA002)
张巧丽,硕士研究生。主要从事精神病学与医学心理学方面的研究
221003 江苏徐州 徐州医学院研究生学院精神卫生系(张巧丽、赵林);213003 江苏常州 解放军102医院全军心理疾病防治中心(过伟、张理义、钟爱芳、牛威、陈升东);200433 上海 第二军医大学临床医学院精神卫生系(范惠民、孙欣羊);60637 GoPath Laboratories, LLC, Illinois, USA(戴运华、卢正斌);212013 江苏镇江 江苏大学临床医学院精神卫生系(宋红涛)
张理义,E-mail:zly102@126.com
