房颤射频消融治疗的现状与困境
2015-06-28陈爱华宋旭东杨平珍
陈爱华,宋旭东,杨平珍
·专家论坛·
房颤射频消融治疗的现状与困境
陈爱华,宋旭东,杨平珍

陈爱华,医学博士,主任医师,教授,博士生导师,南方医科大学珠江医院副院长。现任广东省医学会第七届理事、广东省老年保健协会副会长、广东省健康教育协会医院专业委员会副主任委员、广东省医学会老年分会第七届委员会常委、广州市海珠区第十四届政协委员,并担任《南方医科大学学报》和《解放军医学杂志》编委。长期从事心血管危险因素综合防治和血管内皮系统损伤发生机制的研究,近年主要从事心肌缺血-再灌注损伤发生机制及防治方面的研究。主编、参编《现代心血管病学》、《实用高血压病学》、《现代冠心病监护治疗学》、《公众急救自救大全》等多部专著。主持国家自然科学基金资助课题1项,获军队医疗成果二等奖1项。在国内外发表学术论文80余篇,SCI收录论文10余篇,培养博士研究生20名,硕士研究生16名。
房颤的机制目前仍不清楚,关于其触发及维持机制存在不同认识,与此相关的射频消融治疗策略也未能达成一致。近年来关于房颤的基础研究取得了较大进展,诸如房颤转子、自主神经丛等学说也得到了临床支持,并影响到射频消融治疗房颤的策略。本文对房颤机制及消融现状进行了分析。
心房颤动;导管消融术;肺静脉隔离;房颤转子
房颤是一种常见的心律失常,在总体人群中的发病率接近1%。在过去的十年中,导管消融术在房颤治疗中得到了越来越广泛的应用。关于房颤的发生及维持机制存在三大主流假说:多发子波折返假说、局灶激动学说和主导折返环伴颤动样传导理论。当前在房颤发生和维持机制等方面的研究取得了相当大的进展,有研究发现,某些房颤可由快速激动的异位兴奋灶触发,且导管消融这些异位兴奋灶可以“治愈”房颤[1],这一里程碑式的发现提示肺静脉、左心房后壁以及该区域的自主神经丛可作为激动和维持房颤的解剖或电学基质。然而,关于房颤发生及维持机制的理论仍存在争议,而且由此衍生而来的射频消融方式也远未达到统一。本文就房颤相关机制及目前的射频消融策略进行分析。
1 房颤的发生及维持机制学说
长期以来,房颤的发生和维持机制一直是临床和基础研究的热点[2-4]。作为心电生理学界最后一个尚未攻克的堡垒,我们甚至不清楚房颤发生和维持的基础[5-6];虽然今天已经可以通过计算机模拟实时观察到房颤的分布特征,但却丝毫没有改变争议的本质。目前一般认为肺静脉前庭是主要的房颤触发源,房颤可能是以多发子波形式在心房中维持,并由左房自主神经丛、Marshall韧带等共同参与(图1)。
1.1 多发子波假说 一些学者认为,如果存在合适的维持房颤基质,局灶性触发可以导致持续的高频房颤折返波。这些高频折返波产生多个子波导致空间分布离散并产生颤动样传导[8]。有证据表明,高频率心房刺激持续至少24h可使离子通道发生重构,心房电学基质发生改变,促进折返维持和增加触发活动,从而使房颤维持,即所谓“房颤导致房颤”。
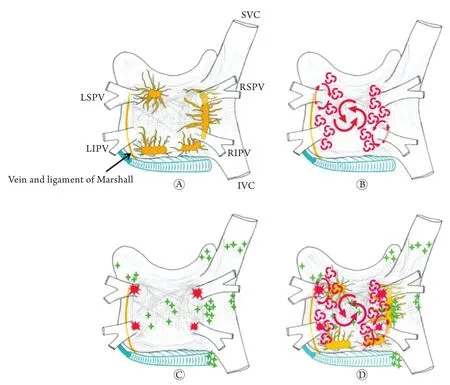
图1 房颤机制示意图[7]Fig. 1 Diagram of mechanisms of atrial fibrillation
20世纪80年代后期,房颤多子波假说被广泛接受为主要的房颤理论。根据这一假说,房颤是多个独立的子波同时存在并随机分布于左、右心房的结果。依据该房颤模型,心房内同时存在一定数量的子波,这些子波的存在取决于心房传导速度、不应期以及可激动的心房质量。房颤的维持需要最小数量共存子波、缓慢传导、缩短的有效不应期、增加的心房质量,而心房肌重构导致传导延迟和阻滞,增加了心房有效不应期的空间离散度,促进了房颤的维持。值得注意的是,外科迷宫术就是建立在这一房颤理论的基础上的,即房颤的维持需要一定临界数量的折返子波,每一个子波都需要一定临界质量的可激动心房组织。目前外科迷宫术取得了令人瞩目的成就,也是内科房颤射频消融参考和模仿的对象。然而,实验和临床研究表明,尽管在一些病例中维持房颤的子波在心房中随机分布,但心房不应期和房颤周长(atrial fibrillation cycle length,AFCL)却似乎并非随机分布。例如在狗的心脏中,左房的AFCL比右房显著缩短,并在左房后壁发现有更短的AFCL存在。
2012年,Narayan等[9]通过心房进行所谓“局灶电激动和转子调频技术”(focal impulse and rotor modulation,FIRM)标测,直接观测到了持续房颤患者存在稳定的房颤转子,这与以往认为房颤不存在转子或者转子不稳定的认识不同,这些转子稳定地存在于左房或右房,有些接近通常的房颤消融线,同时转子的轴心往往会发生相对缓慢的移位。FIRM技术将2个64极网篮电极(Constellation,Boston Scientific Inc.,Natick,MA,USA)放置在左、右心房,对自发或诱发的房颤进行多点同步标测,而专门的分析软件(RhythmViewTM,Topera Inc,San Diego,CA,USA)可自动分析标测记录的电位,找到房颤维持的基础即FIRM。
1.2 局灶触发 研究证实,兔心房局部注射乌头碱可诱发房颤,而将注射乌头碱的部位去除后,房颤也随之中止[10]。Haissaguerre等[11]研究发现,房颤可能由一些异位兴奋灶所触发,且导管消融这些异位兴奋灶可治疗房颤。Haissaguerre等[11]对45例药物难治性房颤患者进行右侧线性消融,长期成功率较低。这些研究人员还发现,线性消融往往由于消融线的不连续(Gap)而致心律失常,而许多患者最终通过消融单一异位兴奋灶而治愈,这些异位灶通常存在于左上或右上肺静脉口或上腔静脉附近。上述发现引导研究者通过标测和消融异位兴奋灶来治疗阵发性房颤,而这些病灶多数存在于肺静脉肌袖。由此,现已确定肺静脉肌袖是房颤发生的重要触发源。
1.3 肺静脉的电学结构与基质 虽然早在1966年Nathan等[12]就已经注意到肺静脉肌袖的存在,但直到有研究发现肺静脉肌袖可能与房颤的触发相关,关于肺静脉肌袖的解剖及电生理的研究才得到重视。肺静脉肌袖由心房肌纤维从左房向肺静脉延伸1.0~3.0cm,厚度1.0~1.5mm,然后逐渐减少[13]。肺静脉的局灶兴奋可能会触发或者驱动房颤发生[14],其机制尚不完全清楚,但已发现肺静脉肌袖的确存在异常心肌传导细胞,如P细胞、移行上皮细胞和蒲肯野纤维,异常的离子通道和动作电位使肺静脉肌袖具有致心律失常作用[15]。另外有研究发现,当左房压增加10cmH2O时,肺静脉肌袖电活动增加,左房-肺静脉联合处会成为主导转子区[16]。
1.4 心房组织的房颤电学基质 在过去的几年中,实验和临床研究发现了心房在房颤电学重构中的多种变化,例如,心房局部激动速率即AFCL,心房解剖重构,左房后壁的子波碰撞、分裂以及折返,心房结构各向异性,以及左至右的电传导速度梯度等,这些电学机制对于房颤的维持起到了关键作用。此外,动物研究发现,房颤时的局部快速电活动可能是由单个或多个快速旋转的主导波(主转子)在左房的颤动样传导所导致。在亚细胞水平,左房后壁存在着高密度的自主神经丛以及密度更大的内向整流性钾通道(IKi),似乎可以解释该区域在房颤中不应期缩短以及主频梯度离散分布的特点[17]。
上述研究提供了经验性的理论,即左房似乎是大多数房颤患者的病灶中心,同时也为环肺静脉消融、左房线性消融提供了理论及实践基础。有研究证明,在阵发性房颤患者,主频最高的位点位于肺静脉口部位,在该处进行消融可以成功终止房颤,成功率高达87%[18]。然而,在慢性房颤患者中,却很难找到类似高频主频的位点,因此慢性房颤射频消融手术成功率也较低,似乎说明慢性房颤患者的心房发生了解剖或电重构,改变了心房的电生理特性[19],而且更加有利于房颤的维持,形成一种恶性循环。
1.5 心脏自主神经因素 房颤的神经调节过程比较复杂,受来自中央自主神经系统(神经节前)和心内自主神经系统(ANS)的调控。心内交感神经系统,即自主神经丛(GP),位于心外膜脂肪垫内以及Marshall韧带内。GP受多重神经调控,包括中央ANS、传入神经元、传出副交感神经和交感神经元,以及众多不同神经节间或同一神经节内不同神经元之间的信息整合。由GP刺激诱发的房颤需要交感神经和迷走神经活性的支持。迷走神经兴奋可以使心房和肺静脉肌细胞动作电位时程及有效不应期缩短,交感神经兴奋则可增加钙负荷和自律性[20]。与心房肌细胞相比,肺静脉肌细胞具有更短的动作电位时程和更高的自主刺激敏感性,这也许可以解释在阵发性房颤的肺静脉隔离过程中,消融自主神经节可以使肺静脉内自主兴奋的频率降低[21],而这些自主神经轴突再生可能导致房颤晚期复发。在环肺静脉消融的基础上结合GP消融似乎有很好的协同效应,可以提高慢性房颤的手术成功率[22]。此外有研究观察了GP与复杂心房碎裂电位(complex fractionated atrial electrograms,CFAE)的关系。射频消融手术中在GP的解剖位置经常可以标测到CFAE,而在动物研究中,在包含GP的脂肪垫处进行高频刺激或注射乙酰胆碱后可记录到CFAE[23]。由此,在动物模型以及阵发性或持续性房颤患者中,在标准消融的基础上进一步减少或消除CFAE,至少可以降低房颤复发的概率。
1.6 房颤巢 2004年有学者提出了房颤巢(atrial fibrillation nest,AFN)的概念[24],该研究对40例房颤患者经快速傅立叶转换(fast fourier transform,FFT)后发现存在两种不同电位类型的心房肌:一种是致密心肌(compact myocardium,CM),另一种为纤维心肌(fibrillar myocardium,FM)。致密心肌表现为快速、协调、传导不应期正常,代表均一、细胞连接正常的心肌构成,在FFT曲线上表现为基于一个高振幅的频率和快速均一递减的和谐波;而纤维心肌则表现为各向异性,短不应期,激动频率较周围组织高,推测该心肌纤维的连接减少,心肌束稀疏,使电传导速度和不应期离散度增加,容易通过左房后壁诱发颤动波,心内电图表现为类似碎裂电位,即AFN,FFT曲线上表现为除基础频率外,还有其他高振幅、宽分布的不规则和谐波,这些相对高振幅和高频率的信号使曲线右移。AFN的形成可能与微折返、邻近心肌束相互作用及触发活动有关。AFN主要位于左房顶部、左房间隔、肺静脉脉前庭、左后壁、上腔静脉与右房连接处、右房侧壁、右房前壁和右房间隔,左侧AFN的频度明显高于右侧,为后者的9.7倍。AFN可能与心脏神经丛或其附近的高密度神经突触区的消融密切相关。在动物模型中通过刺激迷走神经发现,窦性节律时仅60%的CFAE区域存在AFN,另外22%无CFAE区域存在AFN,由此可推测,消除CFAE与AFN是两种不同的策略[25]。
2 心房颤动的射频消融
Cox等[26]在1991年报道的迷宫术(Maze)是房颤非药物治疗的一个里程碑。此后,Cox-Maze Ⅲ成为了外科手术治疗房颤的金标准。在此基础上发展起来的经皮导管射频消融术治疗房颤则代表了近20年来医学科技发展的最前沿水平。1994年,Haissaguerre等[1]开始尝试模仿外科迷宫术进行射频消融手术。1998年,Haissaguerre等[11]采用肺静脉节段性消融治疗房颤取得了巨大成功,标志着射频消融治疗房颤时代的开始。1999年,Pappone等[27]首先开展了CARTO系统指导下的心房三维重建,开启了房颤消融的三维时代。目前随着科技的发展,治疗房颤的器械也在日新月异,就能量来源来说,有射频、冷冻、激光、超声等。然而,无论选择何种器械,其治疗策略依旧离不开目前对于房颤发生及维持机制的认识。基于对房颤触发及维持机制的理解,目前的主要术式为环肺静脉隔离,在此基础上有些术者增加房顶线、二尖瓣峡部线、三尖瓣峡部线、上下肺静脉隔离线、上腔静脉隔离线等,此外,碎裂电位等消融方式也可作为房颤消融的补充(图2)。
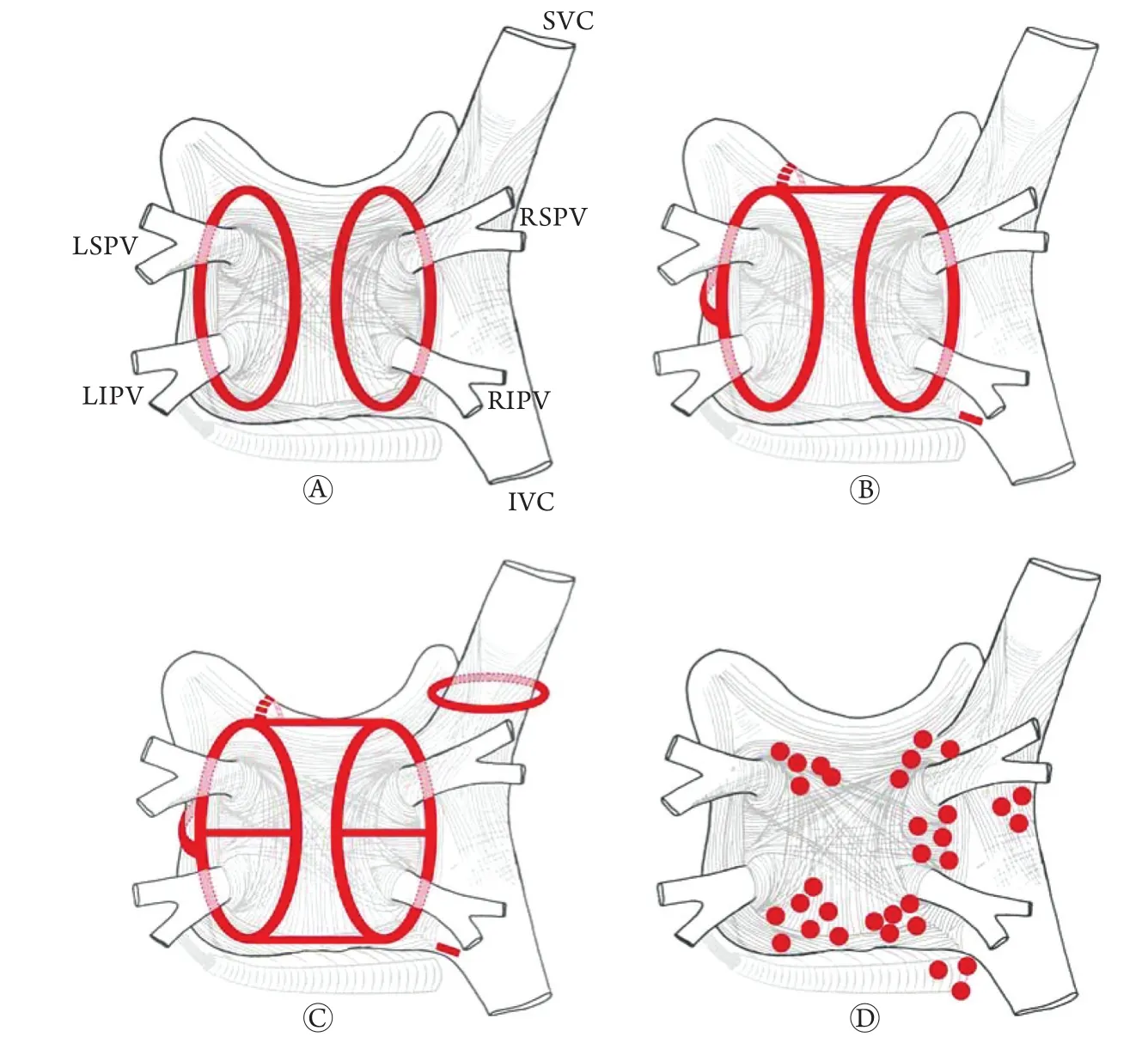
图2 房颤射频消融术式[7]Fig. 2 Modus of radiofrequency ablation for atrial fibrillation
2.1 环肺静脉电隔离术 Haissaguerre等[28]最早开展节段性肺静脉电隔离,通过标测肺静脉电位和心房电位,“节段性”地消融左心房和肺静脉之间的电“优势传导”或电“突破”部位(即肺静脉肌袖),消融终点是肺静脉与心房之间的完全电隔离。但单纯节段性肺静脉电隔离治疗房颤成功率低,且存在肺静脉狭窄的可能性。
环肺静脉前庭消融最初由Pappone等[29]在CARTO三维系统指导下完成。肺静脉前庭是肺静脉与左心房的移行区,研究发现肺静脉前庭中存在房颤触发灶,肺静脉快速激动在此易形成颤动样传导,因此理论上不但可针对肺静脉触发机制,还能通过消除左心房内房颤的维持基质等进一步提高房颤消融成功率。同时因消融远离肺静脉开口,减少了肺静脉狭窄的发生。但是该方法不以肺静脉隔离为终点进行环肺静脉线性消融,其近期和远期成功率均不高。
Ouyang等[30]提出了在环状标测电极导管指导下行环肺静脉线性消融以达到肺静脉电隔离的方法,即环肺静脉电隔离术,与Pappone等[29]早期所倡导的环肺静脉线性消融主要的不同点在于,前者具有明确的消融终点,即达到同侧上、下肺静脉电隔离。目前该手术策略已成为阵发性房颤消融的主流手术方式,同时也是持续性房颤消融的基础。
2.2 左心房线性消融术 环肺静脉隔离术治疗阵发性房颤成功率高,但治疗持续性房颤仍有较高的复发率,因此在环肺静脉隔离术的基础上增加手术径线成为必然。Pappone等[31]在Cox-Maze Ⅲ术式的基础上提出了改良的环肺静脉线性消融术,即在环肺静脉线性消融的基础上增加了左心房3条径线的消融:左房后顶部连接左右肺静脉消融环的径线,左房后底部连接左右肺静脉消融环的径线,连接左下肺静脉和二尖瓣环的峡部径线。左心房线性消融术能够明显减少消融术后左房房速的发生,也是目前许多文献报道中所采用的消融术式。然而,必须注意的是,上述3条阻滞线虽然可以增加手术成功率,但若阻滞线不完整反而可能增加术后房速的发生,因此,对上述3条阻滞线的完整性进行检测十分必要。
日本学者Kumagai等[32]采用的所谓“Box”左房隔离术,则完全在左房顶部、底部、左右肺静脉前壁线划出完整消融线,隔离左房后壁以及肺静脉,目前这种术式仍在少数中心采用,理论上讲,如果能够达到消融线完整,效果应该至少不比“两环三线”更差,但是缺乏更多的循证医学证据。
2.3 非肺静脉起源的阵发性房颤的消融 阵发性房颤中,有超过1/3的患者起源于肺静脉以外,包括左房后壁、上腔静脉、下腔静脉、冠状窦口、界脊、卵圆窝、Marshall韧带等,对这些非典型部位进行消融,可能终止阵发性房颤。
2.4 CFAE的消融 Nademanee等[33]2004年报道了在房颤心律下对心房内的CFAE部位进行消融,这标志着房颤消融由解剖消融进入心房基质改良的阶段。CFAE定义为:①心房波的碎裂电图由2个或2个以上的波折组成和(或)心房波连续10s以上无恒定基线且伴有延长的连续心房激动波;②连续10s心房激动平均周长≤120ms。CFAE电位振幅0.05~0.25mV,双极电图记录滤波30~500Hz。CFAE区域消融需使CFAE电位消失,其理想消融终点为房颤及其他房性心律失常终止且不再被诱发。但是此方法的主要问题是重复性不好。据Oral等[34]的报道,100例慢性心房颤动患者,在CFAE消融后14个月时成功率仅为33%。
2.5 神经节(丛)的消融 心脏自主神经系统与房颤的发生和维持存在着密切的关系,消融自主神经节(丛)可以作为一种补充消融策略以增加房颤消融的成功率[35-37]。左房4个主要的自主神经丛(左上,左下,右前,右下)位于肺静脉前庭边界的心外膜脂肪垫内。将通过高频刺激心内膜可以产生明显迷走神经反应的区域定位为GP区域,在该区域进行射频消融,直到迷走神经反应消失。
2.6 递进式和个体化消融策略 持续性房颤和慢性房颤可采取在心房不同区域进行递进式或个体化消融的策略,消融过程包括肺静脉电隔离和上腔静脉隔离、冠状静脉窦隔离,左房基质电位的消融(包括连续电位、碎裂电位、消融导管远近端存在激动顺序阶差的电位、与左心耳相比激动周长短的电位,终点为局部电位激动规律化或频率变慢),以及左房顶部和二尖瓣、三尖瓣峡部线性消融(严格实现峡部双向阻滞),消融终点是房颤终止,直接转为窦性心律。恢复窦性心律后,验证肺静脉隔离和线性消融的完整性,必要时补点消融。虽然这种消融方式成功率高,但是术中其他房性心动过速发生率高,放电消融时间长,操作时间长,并且左房过度消融有导致左心耳激动显著延迟和电隔离的不良后果。
2.7 针对“Rotor”的消融 在所谓“FIRM”研究的基础上,Narayan等[38]设计了CONFIRM试验(conventional ablation for atrial fibrillation with or without focal impulse and Rotor modulation trial),对入选该研究的92例房颤患者施行了107次消融。按1:2的比例将其分为心房全景标测指导下消融+传统消融组(n=36)和单纯的传统消融组(n=71),该研究的持续性房颤患者比例为72%。首先对可以在术中维持房颤的101例进行FIRM标测。结果发现,97%的患者存在局灶和转子(2.1±1.0个/例)。在心房FIRM标测指导下消融+传统消融组中,首先进行房颤源(房颤转子或激动灶)的消融,随后进行传统环肺静脉隔离+左房顶部线消融。单纯消融房颤源后,绝大多数(86%)房颤可以即刻终止,或者周长显著延长,在首次消融术后中位数为273d的随访时间里,FIRM消融组的窦性心律维持率远高于单纯的传统消融组(82.4%vs44.9%)。进一步分析发现,消融房颤源组维持窦律的比例显著高于不消融房颤源组(80.4%vs18.2%)。CONFIRM研究结果表明,FIRM标测将房颤的病理生理机制作为消融靶目标,为持续性房颤患者的导管消融提供了新的策略。但是其他电生理中心未能重复证实,软件算法未能公开,CONFIRM研究也并非随机对照研究,其研究的可信度还有待证实。目前针对转子或局灶激动的消融可能只是肺静脉隔离术的补充,而环肺静脉隔离仍是房颤导管消融的基石。因此慢性房颤的消融方式仍亟待优化和发展。
3 小 结
房颤的射频消融导管治疗发展至今仅有20年的历史,但围绕房颤发生及维持机制的争论已经持续了近一个世纪。从房颤多子波假说到肺静脉触发起源,再到目前计算机软件实时计算出房颤的转子发生,房颤基础理论的更新带来的是外科手术及导管射频消融术式的不断改进。然而,对于房颤“治愈”的最终目标而言,现有的术式成功率仍然不高,未来的工作依旧任重而道远。
[1] Haissaguerre M, Marcus FI, Fischer B,et al. Radiofrequency catheter ablation in unusual mechanisms of atrial fibrillation: report of three cases[J]. J Cardiovasc Electrophysiol, 1994, 5(9): 743-751.
[2] Han B, Wang JC, Zhang T,et al. Expression of calpain-2 in human left atrium in rheumatic atrial fibrillation[J]. J Shandong Univ (Health Sci), 2014, 52(4): 93-96. [韩波, 王建春, 张涛, 等. 风湿性心房颤动患者左心房组织中钙蛋白酶-2的表达[J]. 山东大学学报(医学版), 2014, 52(4): 93-96.]
[3] Li YF, Dong SY, Xiao F,et al. Predictive value of Syntax score for early onset of postoperative primary atrial fibrillation after off-pump coronary artery bypass grafting[J]. Med J Chin PLA, 2014, 39(5): 416-420. [李一帆, 董士勇, 肖锋, 等. Syntax积分对非体外循环冠状动脉旁路移植术后早期新发房颤的预测作用研究[J]. 解放军医学杂志, 2014, 39(5): 416-420.]
[4] Pan BB, Fu L, Zhao FL. The relationship between parathyroid hormone and atrial fibrillation[J]. Chin J Pract Intern Med, 2013, 33(S1): 107-108. [潘彬彬, 富路, 赵发利. 甲状旁腺素与心房颤动关系的研究[J]. 中国实用内科杂志, 2013, 33(S1): 107-108.]
[5] Sheng W, Li LB, Lu JY. Role of TGF-β, MMPs and TIMPs in persistent atrial fibrillation associated with rheumatic mitral stenosis[J]. Med J Chin PLA, 2014, 39(8): 614-617. [盛炜, 李力兵, 陆江阳. TGF-β、MMPs和TIMPs在风湿性心脏病二尖瓣狭窄合并持续性房颤中的作用[J]. 解放军医学杂志, 2014, 39 (8): 614-617.]
[6] Zhang LL, Zhou Y, Li XH,et al. Myocardial MMPs and TIMPs mRNA expressions in Chinese population with atrial fibrillation: a Metaanalysis[J]. J Shandong Univ (Health Sci), 2015, 53(1): 47-53, 62. [张伶俐, 周莹, 李小荷, 等. 中国房颤人群心肌组织中MMPs与TIMPs的mRNA表达水平的Meta分析[J]. 山东大学学报(医学版), 2015, 53 (1): 47-53, 62.]
[7] Calkins H, Kuck KH, Cappato R,et al. 2012 HRS/EHRA/ECAS Expert Consensus Statement on Catheter and Surgical Ablation of Atrial Fibrillation: recommendations for patient selection, procedural techniques, patient management and follow-up, definitions, endpoints, and research trial design[J]. Europace, 2012, 14(4): 528-606.
[8] Everett TH, Wilson EE, Verheule S,et al. Structural atrial remodeling alters the substrate and spatiotemporal organization of atrial fibrillation: a comparison in canine models of structural and electrical atrial remodeling[J]. Am J Physiol Heart Circ Physiol, 2006, 291(6): H2911-H2923.
[9] Narayan SM, Krummen DE, Shivkumar K,et al. Treatment of atrial fibrillation by the ablation of localized sources: CONFIRM (Conventional Ablation for Atrial Fibrillation With or Without Focal Impulse and Rotor Modulation) trial[J]. J Am Coll Cardiol, 2012, 60(7): 628-636.
[10] Scherf D, Romano FJ, Terranova R. Experimental studies on auricular flutter and auricular fibrillation[J]. Am Heart J, 1948, 36(2): 241-251.
[11] Haissaguerre M, Jais P, Shah DC,et al. Spontaneous initiation of atrial fibrillation by ectopic beats originating in the pulmonary veins[J]. N Engl J Med, 1998, 339(10): 659-666.
[12] Nathan H, Eliakim M. The junction between the left atrium and the pulmonary veins. An anatomic study of human hearts[J]. Circulation, 1966, 34(3): 412-422.
[13] Chen XM, Gerds-Li JH, Li ZC. Mapping and isolation of pulmonary veins using a novel cryoballoon technique: short-and mid-term outcomes[J]. Chin J Pract Intern Med, 2014, 34(1): 54-57. [陈小明, Jin-Hong Gerds-Li, 李自成. 新型冷冻球囊导管消融技术治疗心房颤动中短期随访研究[J]. 中国实用内科杂志, 2014, 34(1): 54-57.]
[14] Weiss C, Gocht A, Willems S,et al. Impact of the distribution and structure of myocardium in the pulmonary veins for radiofrequency ablation of atrial fibrillation[J]. Pacing Clin Electrophysiol, 2002, 25(9): 1352-1356.
[15] Chen YC, Pan NH, Cheng CC,et al. Heterogeneous expression of potassium currents and pacemaker currents potentially regulates arrhythmogenesis of pulmonary vein cardiomyocytes[J]. J Cardiovasc Electrophysiol, 2009, 20(9): 1039-1045.
[16] Kalifa J, Jalife J, Zaitsev AV,et al. Intra-atrial pressure increases rate and organization of waves emanating from the superior pulmonary veins during atrial fibrillation[J]. Circulation, 2003, 108(6): 668-671.
[17] Voigt N, Trausch A, Knaut M,et al. Left-to-right atrial inward rectifier potassium current gradients in patients with paroxysmal versus chronic atrial fibrillation[J]. Circ Arrhythm Electrophysiol, 2010, 3(5): 472-480.
[18] Lin YJ, Tsao HM, Chang SL,et al. Role of high dominant frequency sites in nonparoxysmal atrial fibrillation patients: insights from highdensity frequency and fractionation mapping[J]. Heart Rhythm, 2010, 7(9): 1255-1262.
[19] Ma J, Ma CS, Li XW. Relationship between three-dimensional electrocardiographic P ring features and atrial fibrillation (AF) recurrence after radiofrequency ablation in AF patients[J]. Med J Chin PLA, 2013, 38(10): 847-850. [马君, 马长生, 李学文. 房颤患者立体心电图P环特点与射频消融术后复发的关系[J]. 解放军医学杂志, 2013, 38(10): 847-850.]
[20] Lu SP, Du RY, Zheng QS. Electrophysiological mechanism of fibrillation induced by acetylcholine in dogs[J]. Med J Chin PLA, 2002, 27(8): 721-723. [卢少平, 杜日映, 郑强荪. 乙酰胆碱诱发犬房颤的电生理机制[J]. 解放军医学杂志, 2002, 27(8): 721-723.]
[21] Pokushalov E, Turov A, Shugayev P,et al. Catheter ablation of left atrial ganglionated plexi for atrial fibrillation[J]. Asian Cardiovasc Thorac Ann, 2008, 16(3): 194-201.
[22] Katritsis DG, Giazitzoglou E, Zografos T,et al. Rapid pulmonary vein isolation combined with autonomic ganglia modification: a randomized study[J]. Heart Rhythm, 2011, 8(5): 672-678.
[23] Po SS, Nakagawa H, Jackman WM. Localization of left atrial ganglionated plexi in patients with atrial fibrillation[J]. J Cardiovasc Electrophysiol, 2009, 20(10): 1186-1189.
[24] Pachon MJC, Pachon MEI, Pachon MJC,et al. A new treatment for atrial fibrillation based on spectral analysis to guide the catheter RF-ablation[J]. Europace, 2004, 6(6): 590-601.
[25] Oh S, Kong HJ, Choi EK,et al. Complex fractionated electrograms and AF nests in vagally mediated atrial fibrillation[J]. Pacing Clin Electrophysiol, 2010, 33(12): 1497-1503.
[26] Cox JL, Schuessler RB, D'Agostino HJ Jr,et al. The surgical treatment of atrial fibrillation. Ⅲ. Development of a definitive surgical procedure[J]. J Thorac Cardiovasc Surg, 1991, 101(4): 569-583.
[27] Pappone C, Oreto G, Lamberti F,et al. Catheter ablation of paroxysmal atrial fibrillation using a 3D mapping system[J]. Circulation, 1999, 100(11): 1203-1208.
[28] Haissaguerre M, Jais P, Shah DC,et al. Electrophysiological end point for catheter ablation of atrial fibrillation initiated from multiple pulmonary venous foci[J]. Circulation, 2000, 101(12): 1409-1417.
[29] Pappone C, Rosanio S, Oreto G,et al. Circumferential radiofrequency ablation of pulmonary vein ostia: A new anatomic approach for curing atrial fibrillation[J]. Circulation, 2000, 102(21): 2619-2628.
[30] Ouyang F, Ernst S, Chun J,et al. Electrophysiological findings during ablation of persistent atrial fibrillation with electroanatomic mapping and double Lasso catheter technique[J]. Circulation, 2005, 112(20): 3038-3048.
[31] Pappone C, Manguso F, Vicedomini G,et al. Prevention of iatrogenic atrial tachycardia after ablation of atrial fibrillation: a prospective randomized study comparing circumferential pulmonary vein ablation with a modified approach[J]. Circulation, 2004, 110(19): 3036-3042.
[32] Kumagai K, Muraoka S, Mitsutake C,et al. A new approach for complete isolation of the posterior left atrium including pulmonary veins for atrial fibrillation[J]. J Cardiovasc Electrophysiol, 2007, 18(10): 1047-1052.
[33] Nademanee K, McKenzie J, Kosar E,et al. A new approach for catheter ablation of atrial fibrillation: mapping of the electrophysiologic substrate[J]. J Am Coll Cardiol, 2004, 43(11): 2044-2053.
[34] Oral H, Chugh A, Yoshida K,et al. A randomized assessment of the incremental role of ablation of complex fractionated atrial electrograms after antral pulmonary vein isolation for long-lasting persistent atrial fibrillation[J]. J Am Coll Cardiol, 2009, 53(9): 782-789.
[35] Pappone C, Santinelli V, Manguso F,et al. Pulmonary vein denervation enhances long-term benefit after circumferential ablation for paroxysmal atrial fibrillation[J]. Circulation, 2004, 109(3): 327-34.
[36] Scherlag BJ, Nakagawa H, Jackman WM,et al. Electrical stimulation to identify neural elements on the heart: their role in atrial fibrillation[J]. J Interv Card Electrophysiol, 2005, 13(Suppl 1): 37-42.
[37] Cheng XF, Liang F, Zhang Q,et al. Treatment of atrial fibrillation with radiofrequency modified maze Ⅲ and ganglionic plexus ablation[J]. J Shandong Univ (Health Sci), 2013, 51(2): 53-56. [程显峰, 梁飞, 张骞, 等. 同期射频消融改良迷宫Ⅲ术+心脏神经节丛消融治疗心房颤动[J]. 山东大学学报(医学版), 2013, 51(2): 53-56.]
[38] Narayan SM, Krummen DE, Clopton P,et al. Direct or coincidental elimination of stable rotors or focal sources may explain successful atrial fibrillation ablation: on-treatment analysis of the CONFIRM trial (Conventional ablation for AF with or without focal impulse and rotor modulation)[J]. J Am Coll Cardiol, 2013, 62(2): 138-147.
Current status and dilemma of radiofrequency ablation for atrial fibrillation
CHEN Ai-hua, SONG Xu-dong, YANG Ping-zhen
Department of Cardiology, Zhujiang Hospital, Nanfang Medical University, Guangzhou 510282, China
The mechanism of triggering and maintaining atrial fibrillation (AF) is still not clear. There are different understandings about triggering and maintenance of AF, and therapeutic strategies relevant to them could not reach an agreement. In recent years, basic researches on AF have made greater progress. For example, the atrial rotor and autonomic nerve plexus theories has also been identified clinically, and it changed the strategies of radiofrequency ablation treatment for AF. This article summarizes the mechanism and current status of AF ablation.
atrial fibrillation; catheter ablation; pulmonary vein isolation; atrial rotor
R541.75
A
0577-7402(2015)02-0085-07
10.11855/j.issn.0577-7402.2015.02.01
2014-08-15;
2014-12-08)
(责任编辑:张小利)
510282 广州 南方医科大学珠江医院心内科(陈爱华、宋旭东、杨平珍)
