口服普萘洛尔对婴幼儿血管瘤相关生长因子及凋亡因子表达水平的影响
2015-06-28李铭郭志辉谢义德周亚宽陈小松江成鸿詹明坤王立敏
李铭,郭志辉,谢义德,周亚宽,陈小松,江成鸿,詹明坤,王立敏
口服普萘洛尔对婴幼儿血管瘤相关生长因子及凋亡因子表达水平的影响
李铭,郭志辉,谢义德,周亚宽,陈小松,江成鸿,詹明坤,王立敏
目的观察口服普萘洛尔对婴幼儿血管瘤病灶内相关生长因子及凋亡因子表达水平的影响。方法选择2010年5月-2011年12月收治的年龄≤3个月、血管瘤病灶位于肢体或隐蔽部位、家属要求手术治疗但具备单独口服普萘洛尔治疗条件、排除用药禁忌证、先前未接受过任何治疗的病例作为研究对象,共39例。所有患者均在局麻下夹取血管瘤体组织活检,然后口服普萘洛尔(每次1mg/kg,每12h服药一次)8周,继而手术切除瘤体。通过HE染色观察用药前后组织结构及细胞形态的变化,采用免疫组化、实时荧光定量RT-PCR检测用药前后病灶组织内ADRB1、ADRB2、ERK、Akt、NF-κB、VEGFA、Cyclin D1、Cyclin E1、Ki-67、Bax、Bcl-2、caspase-8、Fas、FasL、caspase-9、caspase-3表达水平的变化,并分别用CD34、Ki-67免疫组化染色及TUNEL染色检测用药前后病灶内新生血管密度(MVD)、细胞增殖情况(Ki-67阳性率)以及细胞凋亡指数。结果与用药前比较,口服普萘洛尔后血管瘤病灶内ADRB1、ADRB2、ERK、Akt、NF-κB、VEGFA、Cyclin D1、Cyclin E1、Ki-67、Bcl-2表达水平明显下降(P<0.01),Bax、caspase-3、caspase-9表达水平明显增高(P<0.01),Fas、FasL、caspase-8表达水平无明显改变(P>0.05)。与用药前比较,用药后病灶内MVD、Ki-67阳性率明显下降(P<0.01),凋亡指数明显增高(P<0.01)。结论普萘洛尔可通过调节MAPKs和PI3K-Akt通路抑制血管瘤增殖,促进内源性凋亡,但对外源性凋亡途径无明显影响。
普萘洛尔;血管瘤;血管生成蛋白质类;凋亡诱导因子
婴幼儿血管瘤是婴幼儿最常见的良性肿瘤,发病率约为10%[1],自然病程多分为3个阶段,即快速生长期、稳定期、消退期,约50%的患儿血管瘤在5岁前可完全消退,到9岁前这一比例可达90%[2-3]。尽管血管瘤大多能够自限,但其对婴幼儿的潜在危害却不能忽视,如迅速增大并累及重要组织器官,出现破溃、出血、感染等并发症。因此目前仍主张对婴幼儿血管瘤采取适当、有效的治疗措施[4],选择治疗方案的原则为以最小的代价控制瘤体生长,尤其是不进一步破坏容貌,或形成新的医源性损害。目前针对婴幼儿血管瘤的治疗方案主要有手术切除、口服激素、局部注射平阳霉素、同位素敷贴、激光治疗等,但均存在一定的局限性[5]。2008年法国Bordeaux儿童医院Léauté-Labréze等[6]报道普萘洛尔可显著抑制婴幼儿血管瘤,其后又有数篇文献报道2~3mg/(kg.d)的普萘洛尔对血管瘤有明显治疗效果[7-15]。由于普萘洛尔副作用相对较小,应用于儿童至今尚无死亡及严重心血管事件的报道,因此迅速成为临床治疗婴幼儿血管瘤的首选方案[16]。Léauté-Labréze等[6]通过临床观察发现患儿治疗后短期内即明显见效,出现瘤体变薄,颜色变浅,表面皱缩,皮温下降,推测普萘洛尔可能通过改变瘤体血管的血流动力学特性、减少局部供血而发挥作用,但目前仍没有系统的关于其治疗机制的文献报道。本课题组在临床观察中还发现,患儿在治疗满一个疗程后未见复发,且有患者中途停止治疗但瘤体仍继续消退[15],这些现象无法单纯用血流动力学原理解释。本研究拟通过测定口服普萘洛尔前后血管瘤病灶内血管内皮细胞的增殖、凋亡水平及相关因子表达是否存在差异,探讨普萘洛尔能否在体内抑制血管瘤血管内皮细胞增殖并促进其凋亡,并对其相关机制进行初步探讨。
1 资料与方法
1.1 研究对象 选择2010年5月-2011年12月福建医科大学附属协和医院整形外科收治的年龄≤3个月、血管瘤病灶位于肢体或隐蔽部位、家属要求手术治疗但具备单独口服普萘洛尔治疗条件、排除用药禁忌证(如哮喘等)、先前未接受过任何治疗的病例作为研究对象,共39例,其中男16例,女23例,年龄57.6±11.3d(小33d,最大2个月零3周)。经过与家属沟通并获得书面同意,治疗前先按口服普萘洛尔诊疗常规,局部消毒铺巾,用皮肤活检枪在局麻下夹取血管瘤体组织,后口服8周盐酸普萘洛尔片(河南天方药业股份有限公司生产,每次口服剂量为1mg/kg,每12h服药一次),继而手术切除瘤体。本治疗及研究经本院伦理委员会核准。
1.2 主要试剂
1.2.1 免疫组化试剂 鼠抗人CyclinD1、CyclinE1、NF-κB、Bax、Bcl-2、VEGFA、CD34、Fas、FasL、caspase-8、caspase-9、caspase-3单克隆抗体(福州迈新),鼠抗人ADRB1、ADRB2、ERK、KT单克隆抗体(美国Sigma),辣根过氧化物酶标记羊抗鼠单克隆抗体(北京中杉金桥,PV9002),DAB显色试剂盒(北京中杉金桥),中性树脂。MIB-1(用于Ki-67检测)、末端脱氧核苷酸转移酶(TdT,用于TUNEL检测)为福州迈新产品。
1.2.2 Real-time RT-PCR试剂 Trizol(TaKaRa RNAiso plus),反转录试剂盒(TaKaRa PrimeScript® RT reagent Kit,DRR037A),荧光定量试剂盒(TaKaRa SYBR® Premix ExTaqTMⅡ,DRR820A),内参引物(TaKaRa Human-GAPDH-Primer,B702A),其余引物由TaKaRa公司合成,具体序列见表1。
1.3 主要仪器 Applied BioSystems 2720 Thermal Cycler PCR仪,Applied BioSystems 7500荧光定量PCR仪, Thermo NANO DROP 1000分光光度计,Eppendorf Centrifuge 5430R高速低温离心机,Nikon显微镜及摄像头。
1.4 方法
1.4.1 组织材料处理 每例治疗前及治疗后的标本收集后用PBS溶液洗净,切取1~2mm3小块,置入液氮罐内冻存,其余标本浸入4%中性甲醛溶液内固定。
1.4.2 HE染色 常规组织块脱水透明,浸蜡包埋,4μm切片,置于70℃恒温烤箱1.5h;常规脱蜡及水化,PBS冲洗2min×3次,苏木素染色2min,1%盐酸乙醇分化,流动双蒸水冲洗30min,伊红染色2min,流动双蒸水冲洗30min;常规梯度乙醇脱水、透明,中性树脂封固,光镜下观察组织及细胞形态特点并拍照。
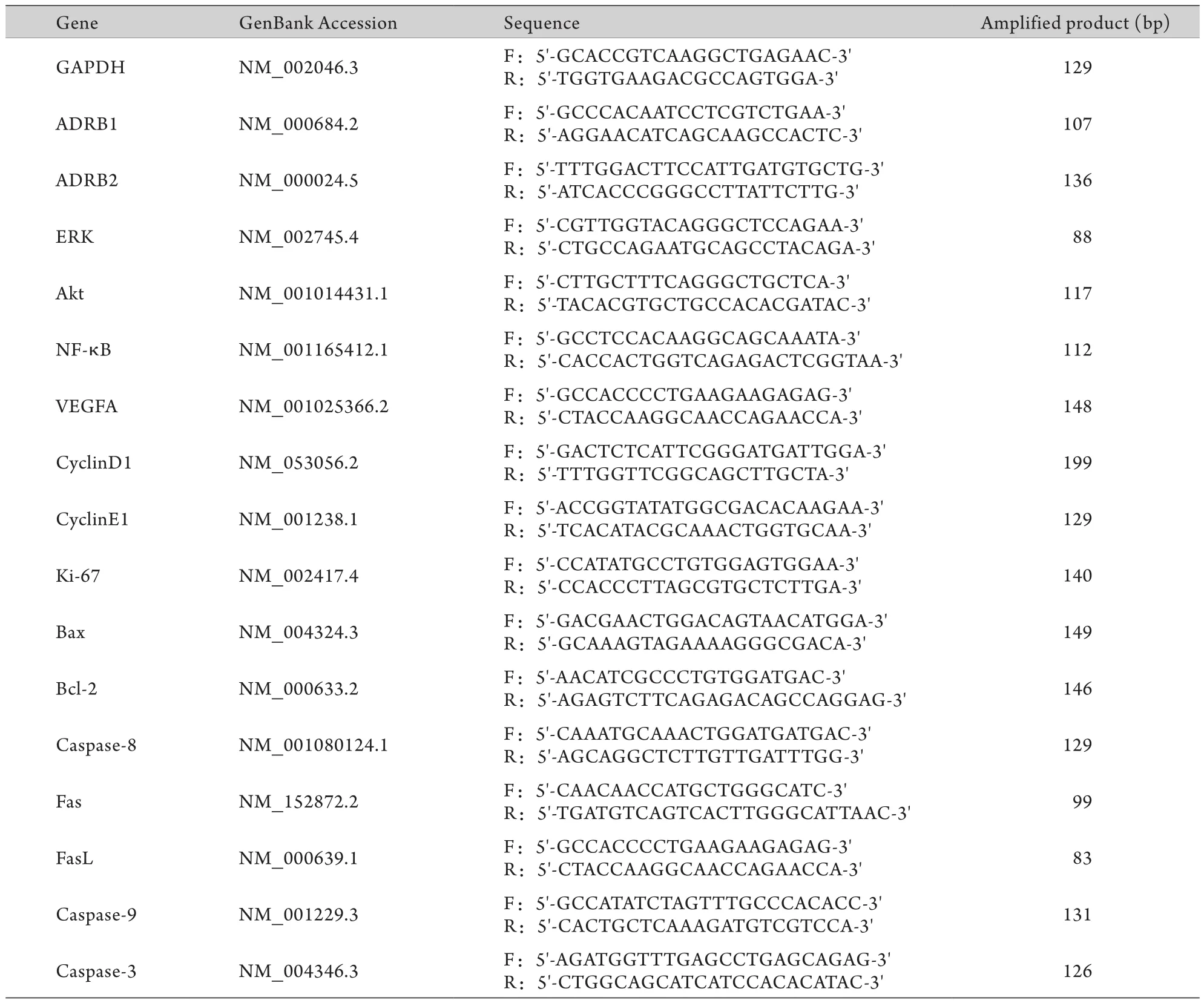
表1 实时荧光定量RT-PCR引物序列Tab. 1 Primers used for real-time RT-PCR
1.4.3 免疫组化检测 选择PBS代替一抗作为阴性对照,选择已确定阳性表达的样本作为阳性对照,参照PV9002试剂盒说明书进行操作。将4μm组织切片置于70℃恒温烤箱中1.5h,常规脱蜡及水化,滴加3%过氧化氢去离子水溶液,室温孵育4min;抗原修复液中热修复2min;滴加一抗,室温孵育2h;滴加聚合物辅助剂,室温孵育15min;滴加辣根过氧化物酶标记山羊抗鼠IgG抗体(二抗),室温孵育15min;每步骤之间用PBS溶液冲洗3min×5次。滴加DAB显色5min,双蒸水中洗涤5min;苏木精复染2~3min,1%盐酸乙醇分化,双蒸水冲洗10~15min;常规梯度乙醇脱水、透明,中性树脂封固,镜下观察并拍照。应用Image Pro Plus 6.0软件,选择每张切片的空白处进行校正后,测定互不重叠的4个400倍视野下阳性反应的平均积分光密度、阳性反应面积,计算阳性面积率。
1.4.4 RNA提取及实时荧光定量RT-PCR检测 提取各样本组织RNA,RNA纯度及浓度要求:A260/A280介于1.85~2.00,浓度≥100ng/μl。不符合者重新提取RNA。按照DRR037A反转录试剂盒说明,配置80μl反转录反应体系,按37℃ 15min、85℃ 5s、4℃的程序进行反转录。将获得的cDNA样本参照DRR820A荧光定量试剂盒说明书在96孔PCR反应板上配制标准20μl反应体系,各样品均设3个复孔,然后置于荧光定量PCR仪内,按两步法标准PCR扩增程序进行反应(95℃ 30s;95℃ 5s,60℃ 34s,循环40次;95℃ 15s;60℃ 1min;95℃ 15s)。保存并确认Real-time PCR的扩增曲线和融解曲线。将cDNA样本按10倍梯度稀释后,绘制标准曲线,计算扩增效率。各待测基因相对于内参GAPDH的相对表达量按下列公式计算,结果以中位数/四分位间距表示。1/相对表达量=其中Etarget为待测基因扩增效率,Ct-target为待测基因Ct值,EGAPDH为内参扩增效率,Ct-GAPDH为内参Ct值。
1.4.5 微血管密度(MVD) 先在200倍视野下挑选微血管内皮细胞染色清晰、背景对照良好的区域,然后在400倍视野下计数10个互不重叠的视野中血管内皮细胞CD34阳性血管数目,管腔≥8个红细胞直径和含管壁肌层的血管不进入计数。单个棕黄色内皮细胞或细胞簇计为1个血管。剔除染色不清、难以分辨的细胞。取10个视野的平均值作为该切片的MVD值。
1.4.6 Ki-67阳性率 每张Ki-67阳性切片选取5个阳性细胞(细胞核中见深棕色颗粒者)最多、互不重叠的400倍视野,计算100个血管内皮细胞中阳性细胞所占的百分比。未见阳性细胞的切片记为0。
1.4.7 凋亡指数(AI) 每张TUNEL阳性切片选取5个阳性细胞(细胞核中见深棕色颗粒者)最多的、互不重叠的400倍视野,计算500个血管内皮细胞中阳性细胞所占的百分比。未见阳性细胞的切片记为0。
1.5 统计学处理 采用SPSS 19.0软件进行统计分析。平均积分光密度、MVD结果以表示,用药前后差异的比较采用配对t检验;阳性面积率、AI、Ki-67阳性率以M(Q)表示,用药前后差异的比较采用配对样本的Wilcoxon符号秩和检验;各待测基因的相对表达量以M(Q)表示,用药前后差异的比较采用REST 2009软件进行分析。P<0.05为差异有统计学意义。
2 结 果
2.1 HE染色结果 口服普萘洛尔治疗前所有血管瘤病灶均呈现典型的增生期特征,新生血管排列致密,部分内皮细胞呈团块状增生,血管内皮细胞胞核肥大而淡染。治疗后病灶部分区域开始呈现退化期特征,血管排列较治疗前稀疏,血管腔增大,周围结缔组织或脂肪组织浸润增多(图1)。

图1 口服普萘洛尔治疗前后血管瘤病灶组织的变化(HE ×400)Fig. 1 Hemangiomas lesions before and after oral propranolol treatment (HE ×400)
2.2 免疫组化染色结果
2.2.1 CD34染色结果与MVD计数情况 CD34主要表达于血管内皮细胞胞质中。口服普萘洛尔前病灶内新生血管致密,可见部分内皮细胞呈团块状增生,胞质内有大量浓密棕黄色颗粒,计算MVD值为96.3±18.4。口服普萘洛尔8周后病灶内新生血管密度明显降低,管腔增大,周围结缔组织增多,内皮细胞胞质内棕黄色颗粒浓度较前降低,计算MVD值为42.3±12.8。配对t检验显示用药前后MVD值差异有统计学意义(t=18.458,P<0.01,图2)。
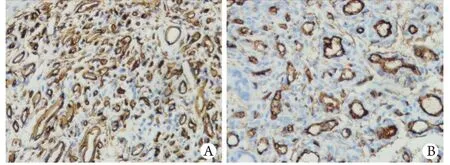
图2 口服普萘洛尔治疗前后血管瘤病灶内CD34的表达情况(免疫组化 ×400)Fig. 2 Expression of CD34 in hemangiomas lesions before and after oral propranolol treatment (Immunohistochemistry ×400)
2.2.2 Ki-67染色情况及Ki-67阳性率 Ki-67主要表达于血管内皮细胞胞核内,阳性反应呈深棕色团块状(图3)。39例患者用药前Ki-67阳性率为44.5%(10.7%),用药后为10.3%(4.3%),差异有统计学意义(Z=–5.442,P<0.01)。

图3 口服普萘洛尔治疗前后血管瘤病灶内Ki-67的表达情况(免疫组化 ×400)Fig. 3 Expression of Ki-67 in hemangiomas lesions before and after oral propranolol treatment (Immunohistochemistry ×400)
2.2.3 TUNEL染色情况及AI TUNEL阳性反应主要位于细胞核内,偶可见于细胞间,呈深棕色或黑色颗粒状。39例患者用药前AI(中位数/四分位间距)为0.70%/0.65%,用药后为21.20%/15.85%,差异有统计学意义(Z=–5.442,P<0.01)。
2.2.4 其他免疫组化染色结果 ADRB1、ADRB2主要在血管内皮细胞胞膜表达,胞质内亦有表达,口服普萘洛尔治疗后表达水平有所下降。ERK、Akt、VEGFA、Bcl-2四种蛋白均主要定位于血管内皮细胞胞质内,用药后胞质内棕黄色颗粒减少。Bax、caspase-9、caspase-3三种蛋白亦主要定位于胞质内,但用药后胞质内棕黄色颗粒增加。NF-κB、Cyclin D1、Cyclin E1三种蛋白均定位于血管内皮细胞胞核内,用药后表达水平下调(胞核内棕黄或深棕褐色染色减少)。经统计学分析,上述蛋白治疗前后表达水平差异均有统计学意义(P<0.01),而Fas、FasL、caspase-8蛋白表达在用药前后差异无统计学意义(表2)。
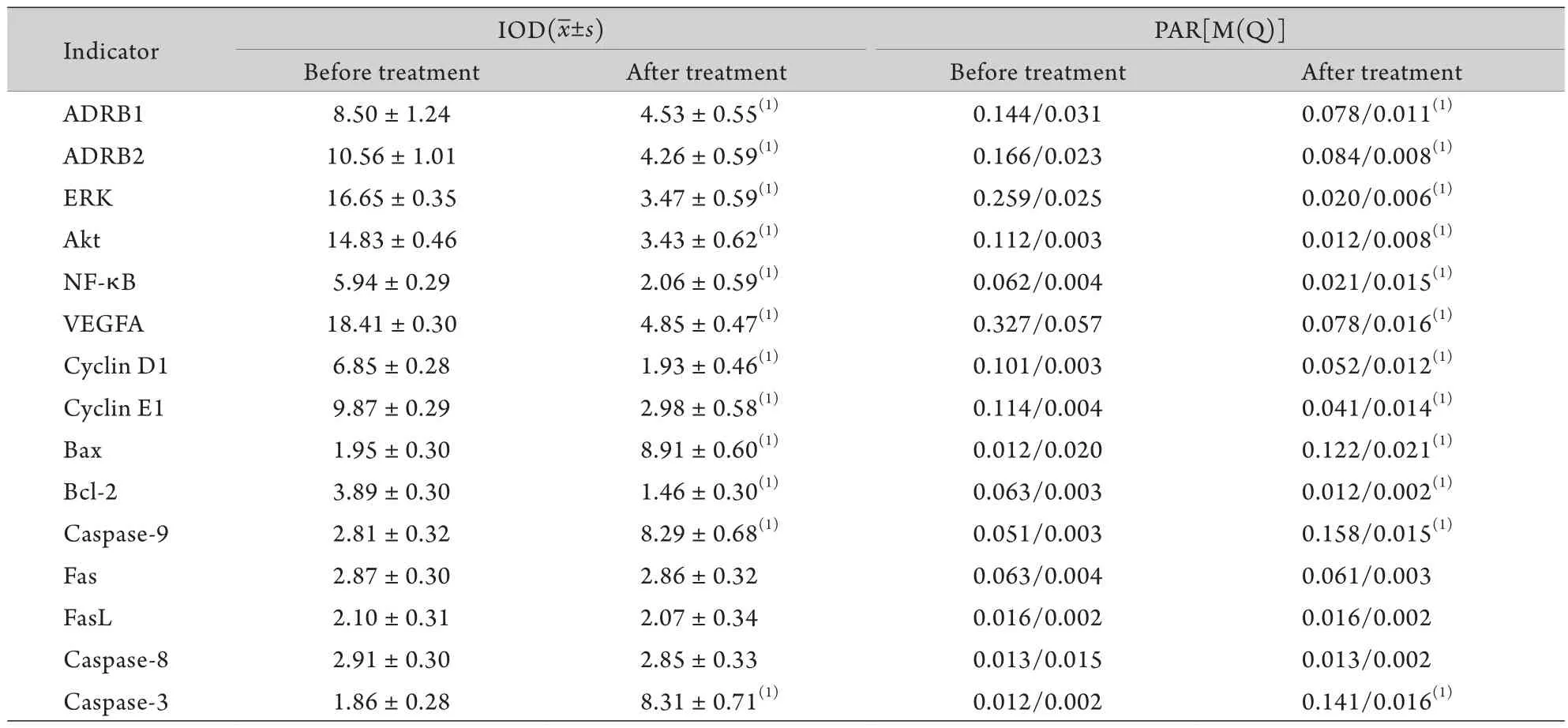
表2 口服普萘洛尔治疗前后免疫组化检测结果(n=39)Tab.2 Immunohistochemical findings of hemangiomas before and after oral propranolol treatment (n=39)
2.3 Real-time RT-PCR检测结果 各样本各指标扩增曲线均到达平台期,3个复孔重复性良好。融解曲线形成高窄单峰,未检测到引物二聚体形成。REST 2009软件分析显示,与口服普萘洛尔治疗前比较,用药后血管瘤组织中ADRB1、ADRB2、ERK、Akt、VEGFA、NF-κB、Cyclin D1、Cyclin E1、Bcl-2 mRNA表达水平明显下降,Bax、caspase-9、caspase-3 mRNA表达水平明显上升,差异均有统计学意义(P<0.01),Fas、FasL、caspase-8 mRNA表达水平无明显改变(数据略),与免疫组化染色变化趋势一致。
3 讨 论
目前研究认为,血管瘤发生的基本机制是血管生长及修复紊乱,其主要特征是毛细血管内皮细胞增生[17],但确切的发病机制未完全明确[18]。目前普遍认可的观点是血管瘤的发生发展与VEGF等促血管生成因子高表达有关[19]。有研究发现VEGF、Cyclin D1、Cyclin E、Ki-67的转录及表达在血管瘤增生期均明显高于消退期,且增生期血管瘤内皮细胞及其邻近上皮细胞的VEGF、Cyclin D1、Cyclin E、Ki-67表达水平明显高于远处上皮细胞,说明病变部位VEGF等因子高表达是增生期血管瘤内皮细胞异常增殖、瘤体快速增长的原因之一[20-24]。Chen等[25]研究证实VEGF可通过细胞膜VEGFR-2受体激活PKB,再通过PI3K-Akt途径激活后续信号调控血管内皮细胞的增殖和分化。Cyclin D1、Cyclin E是重要的细胞周期调控蛋白,其中Cyclin D1高表达可使血管内皮细胞G1期缩短,体积变小,对分裂原的依赖性减弱,快速通过G1/S检查点,加速从G1期到S期的转换,促进细胞的分裂、增生;Cyclin E高表达出现在G1期晚期、S期早期,其过表达可激活CDK2,同样加速G1/S期转换,促进细胞的分裂、增生[26]。Ki-67的表达与细胞增殖状态密切相关,已作为衡量组织增殖水平的指标在恶性肿瘤的诊断中广泛应用,同时还可客观反映血管瘤内皮细胞的增殖功能。在血管瘤消退期,VEGF、Ki-67表达均明显下降,而Fas/FasL、caspase-3表达水平明显增高,同时TUNEL标记的凋亡细胞明显增多,证实消退期血管瘤内皮细胞大量凋亡,并很可能与Fas/ FasL通路有关[20-24]。
普萘洛尔是第一个应用于临床的非选择性β受体阻滞剂,其左旋异构体可通过可逆性地与β1、β2肾上腺素能受体结合,产生稳定细胞膜结构的药理学作用,以及降低心率、降低心输出量、收缩外周血管、降低外周血管血流量的临床效应,目前在临床上主要用于各种快速性心律失常、心绞痛、高血压、嗜铬细胞瘤等的治疗。有学者在体外培养的胃癌细胞株检测到β1、β2肾上腺素受体表达,在胰腺癌细胞株检测到β2受体表达[27-28]。β受体作为G蛋白偶联受体,在与普萘洛尔或ICI 118551(选择性β2受体阻滞剂)等受体阻滞剂结合后,其下游Ras和Src酪氨酸激酶依赖的MAPKs通路和PI3K-Akt通路被阻断,从而抑制ERK和Akt磷酸化,使NF-κB表达下调,减少其与细胞核内相应增强子元件结合,下调以VEGF为主的多种细胞因子基因的转录。同时ERK为介导Cyclin D1表达所必需的重要通道,其表达减低可抑制Cyclin D1表达,阻断细胞由G1期进入S期。同时,ERK和Akt磷酸化受抑制及VEGF等生长因子表达水平减低,可使Bad发生去磷酸化而活化,Bax表达上升,Bcl-2表达下降,促使线粒体细胞色素C释放,并且激活caspase-9和caspase-3,产生促凋亡作用[27-32]。
本研究发现,在口服普萘洛尔治疗前,婴幼儿血管瘤组织亦有β1、β2肾上腺素受体蛋白及其mRNA表达,而口服普萘洛尔8周后,病灶组织内两种受体蛋白表达及mRNA转录水平较前下降,同时 ERK、Akt、NF-κB、VEGFA、Cyclin D1、Cyclin E1、Ki-67、Bcl-2等作为β受体下游因子的基因转录及蛋白表达水平也出现下降,Bax、caspase-9因子的基因转录及蛋白表达水平上升,AI上升,差异有统计学意义,提示普萘洛尔在蛋白质修饰以及基因转录水平均可阻断β受体下游的MAPKs和PI3K-Akt胞内信号传导通路,抑制ERK和Akt磷酸化,使NF-κB表达下调,减少以VEGF为主的多种细胞因子的表达,同时还可抑制Cyclin D1、Cyclin E1的表达,阻断细胞由G1期进入S期。另外,普萘洛尔通过抑制ERK和Akt磷酸化以及降低VEGF等生长因子的表达水平,使Bad发生去磷酸化而活化,Bax表达上升,Bcl-2表达下降,促使线粒体细胞色素C的释放,并且激活caspase-9和caspase-3,通过内源性凋亡途径促进血管瘤组织内血管内皮细胞凋亡,从而抑制血管瘤病灶的增殖。这可能是普萘洛尔治疗婴幼儿血管瘤的重要机制之一。
本研究还发现,在口服普萘洛尔治疗后,婴幼儿血管瘤病灶内β1、β2肾上腺素受体mRNA相对表达量下降幅度明显大于积分光密度值、阳性面积率下降幅度,提示β1、β2肾上腺素受体mRNA表达水平下降较受体蛋白表达水平下降明显,且β2下降比例更大,具体机制不明,但考虑与口服普萘洛尔治疗疗效呈“先快后慢”的临床特点有关。当β1、β2肾上腺素受体表达量下降后,普萘洛尔作为β受体阻滞剂的作用位点减少,抑制血管瘤发展的效应也相应减低。因而在临床上可以观察到,应用普萘洛尔治疗婴幼儿血管瘤早期,血管瘤瘤体颜色转暗、瘤体表面张力减低较为明显、迅速,随后瘤体消退速度逐渐减慢,甚至出现消退停滞的“耐药”现象。
此外,本研究中免疫组化和实时荧光定量RTPCR结果均提示,口服用药治疗前后Fas、FasL、caspase-8表达水平无明显差异,且FasL蛋白表达水平及基因丰度均较低,考虑普萘洛尔通过外源性凋亡途径使血管内皮细胞发生凋亡的效应并不显著。这一点与血管瘤自身消退机制有所不同。
[1] Drolet BA, Swanson EA, Frieden IJ,et al. Infantile hemangiomas:an emerging health issue linked to an increased rate of low birth weight infants[J]. J Pediatr, 2008, 153(5): 712-715.
[2] Eivazi BM, Ardelean W, Baumler HP,et al. Update on haemangiomas and vascular malformations of the head and neck[J]. Eur Arch Otorhinolaryngol, 2009, 266(2): 187-197.
[3] Werner JA, Dunne AA, Lippert BM,et al. Optimal treatment of vascular birthmarks[J]. Am J Clin Dermatol, 2003, 11(4): 745-756.
[4] Bruckner AL, Frieden IJ. Hemangiomas of infancy[J]. J Am Acad Dermatol, 2003, 48(4): 477-493.
[5] Akhavan A. Current treatments for infantile hemangiomas[J]. J Drugs Dermatol, 2010, 9(2): 176-180.
[6] Léauté-Labréze C, Dumas de la Roque E, Hubiche T,et al. Propranolol for severe haemangiomas of infancy[J]. N Engl J Med, 2008, 358(24): 2649-2651.
[7] Theletsane T, Redfern A, Raynham O,et al. Life-threatenting infantile haemangioma:a dramatic response to propranolol[J]. J Eur Acad Dermatol Venerol, 2009, 23(12): 1465-1466.
[8] Bigorre M, Van Kien AK, Valette H. Beta-blocking agent for treatment of infantile hemangioma[J]. Plast Reconstr Surg, 2009, 123(6): 195e-196e.
[9] Denoyelle F, Leboulanger N, Enjolras O,et al. Role of propranolol in the therapeutic strategy of infantile laryngotracheal hemangioma[J]. Int J Pediatr Otorhinolaryngol, 2009, 73(8): 1168-1172.
[10] Bonifazi E, Colonna V, Mazzotta F,et al. Propranolol in rapidly growing hemangiomas[J]. Eur J Pediatr Dermatol, 2008, 18(3): 185-192.
[11] Eivazi B, Teymoortash A, Stiller S,et al. Betablockers-new perspectives for infantile hemangiomas of the head and neck[J]. Laryngorhinootologie, 2010, 89(4): 230-231.
[12] Lawley LP, Siegfried MD, Todd JL. Propranolol treatment for haemangioma of infancy:risks and recommendations[J]. Pediatr Dermatol, 2009, 26(5): 610-614.
[13] Sans V, de la Roque ED, Berge J,et al. Propranolol for severe infantile hemangiomas: follow-up report[J]. Pediatrics, 2009, 124(3): e423-e431.
[14] Buckmiller L, Dyamenahalli U, Richter GT. Propranolol for airway hemangiomas: case report of novel treatment[J]. Laryngoscope, 2009, 119(10): 2051-2054.
[15] Zhan MK, Xie YD, Guo ZH,et al. Preliminary clinical study on the treatment of severe infantile hemangioma with high-dose propranolol in China[J]. Chin J Plast Surg, 2011, 27(3): 166-169.[詹明坤, 谢义德, 郭志辉, 等. 大剂量普萘洛尔治疗严重婴幼儿血管瘤的初步临床观察[J]. 中华整形外科杂志, 2011, 27(3): 166-169.]
[16] Zhong SX, Tao YC, Zhou JF,et al. Evaluation on efficacy of different doses of propranololin treatment[J]. J Jilin Univ (Med Ed) 2014, 40(4): 880-883. [钟淑霞, 陶育纯, 周俊峰, 等. 不同剂量普奈洛尔治疗婴儿血管瘤的疗效评价[J]. 吉林大学学报(医学版), 2014, 40(4): 880-883.]
[17] Sgonc R, Fuerhapter C, Boeck G,et al. Induction of apoptosis in human dermal microvascular endothelial cells and infantile hemangiomas by interferon-alpha[J]. Int Arch Allergy Immunol, 1998, 117(3): 209-214.
[18] Chen X, Chang HS, Liu Y,et al. The expression and significance of Tie2 methylation in infantile hemangioma[J]. J Logist Univ PAPF (Med Sci), 2014, 23(11): 905-908. [陈向, 畅海升, 刘茵,等. 血管生成素受体Tie2甲基化变异在婴幼儿血管瘤中的表达和意义[J]. 武警后勤学院学报(医学版), 2014, 23(11): 905-908.]
[19] Xu RJ, Wang FG, Dang W,et al. Influences of laser treatment on the expressions of the plasma vascular endothelial growth factor and basic fibroblast growth factor in children cutaneous hemangioma[J]. J Shandong Univ (Health Sci), 2013, 51(4): 96-99. [徐荣建, 王法刚, 党伟, 等. 激光治疗对婴幼儿皮肤血管瘤患者血浆VEGF及bFGF表达的影响[J]. 山东大学学报(医学版), 2013, 51(4): 96-99.]
[20] Chang J, Most D, Bresnick S,et al. Proliferative hemangiomas: analysis of cytokine gene expression and angiogenesis[J]. Plast Reconstr Surg, 1999, 103(1): 1-9.
[21] Jang Y, Arumugam S, Ferguson M,et al. Changes in matrix composition during the growth and regression of human hemangiomas[J]. J Surg Res, 1998, 80(1): 9-15.
[22] Dosquet C, Coudert MC, Wassef M,et al. Importance of bFGF ("basic fibroblast growth factor") for diagnosis and treatment of hemangiomas[J]. Ann Dermatol Venereol, 1998, 125(5): 313-316.
[23] Liao HY, Xin X, Ouyang TX. Expression of Fas and Fas ligand in endothelial cells of infantile hemangioma[J]. Aacdem J Sec Mil Med Univ, 2008, 29(11): 1296-1299. [廖洪跃, 邢新, 欧阳天祥. Fas、FasL在婴幼儿血管瘤内皮细胞的表达[J]. 第二军医大学学报, 2008, 29(11): 1296-1299.]
[24] Liu H, Dang YM, Guo YF. Expression and significance of caspase-3 and survivin at different stages of hemangioma in children[J]. J Appl Clin Pediatr, 2009, 24(1): 51-52.[柳宏, 党雅梅, 郭应芳. Caspase-3和Survivin在儿童皮肤血管瘤表达的意义[J]. 实用儿科临床杂志, 2009, 24(1): 51-52.]
[25] Chen F, Tan Z, Dong CY,et al. Combination of VEGF(165)/ Angiopoietin-1 gene and endothelial progenitor cells for therapeutic neovascularization [J]. Eur J Pharmacol, 2007, 568(1-3): 222-230.
[26] Schraml P, Bucher C, Bissig H,et al. Cyclin E overexpression and amplification in human tumous[J]. J Pathol, 2003, 200(3): 375-382.
[27] Liao X, Che X, Zhao W,et al. Effects of propranolol in combination with radiation on apoptosis and survival of gastric cancer cellsin vitro[J]. Radiat Oncol, 2010, 5: 98.
[28] Shan T, Ma Q, Zhang D,et al. β2-adrenoceptor blocker synergizes with gemcitabine to inhibit the proliferation of pancreatic cancer cellsviaapoptosis induction[J]. Eur J Pharmacol, 2011, 665(1-3): 1-7.
[29] Zhang D, Ma Q, Wang Z,et al. β2-adrenoceptor blockage induces G1/S phase arrest and apoptosis in pancreatic cancer cellsviaRas/Akt/NF-κB pathway[J]. Mol Cancer, 2011, 10: 146.
[30] Emilio H, Elisa C, Alessandra G,et al. Taming the PI3K team to hold inflammation and cancer at bay[J]. Pharmacol Therapeut, 2008, 118(2): 192-205.
[31] Hsiem M, Conti M. G-protein-coupled receptor signaling and the EGF network inendocrine systems[J]. Trends Endocrin Met, 2005, 16(7): 320-326.
[32] Parekh P, Rao KV. Overexpression of cyclin D1 is associated with elevated levels of MAP kinases, Akt and Pak1 during diethylnitrosamine-induced progressive liver carcinogenesis[J]. Cell Biol Int, 2007, 31(1): 35-43.
Effect of propranolol on the expression of growth factors and apoptotic factors related to infantile hemangiomas
LI Ming, GUO Zhi-hui*, XIE Yi-de, ZHOU Ya-kuan, CHEN Xiao-song, JIANG Cheng-hong, ZHAN Ming-kun, WANG Li-min
Plastic Surgery Department, Union Hospital Affiliated to Fujian Medical University, Fuzhou 350001, China
*Corresponding author, E-mail: guokex@tom.com
This work was supported by the Fujian Medical Innovative Foundation (2012-CX-17), and the Provincial University Project Funded by Fujian Education Department (JK2012020)
ObjectiveTo investigate the effects of propranolol on the expression of growth factors and apoptotic factors related to infantile hemangiomas, and explore the underlying mechanisms for treatment of hemangiomas by propranolol.MethodsOral propranolol was administered to 39 patients ≤3 months with hemangiomas during the proliferative phase, and they were in accordance with the inclusion criteria of the treatment. Patients who had contraindications to treatment were excluded, and informed consent from their family members was obtained. Biopsy of the lesion under local anesthesia was done before medication. The oral dose of propranolol was 1mg/kg per 12 hours. After 8 weeks of treatment, the hemangioma was resected. The specimens taken before and after treatment were scrutinized for changes in tissue structure and cell form after HE staining. The expressions of the proteins ADRB1, ADRB2, ERK, Akt, NF-κB, VEGFA, Cyclin D1, Cyclin E1, Ki-67, Bax, Bcl-2, caspase-8, Fas, FasL, caspase-9, and caspase-3 in the focal tissue were determined with immunohistochemistry and real-time fluorescence quantitative RT-PCR. At the same time, the microvessel density (MVD) value, Ki-67 index and apoptosis index before and after treatment were also determined and compared using CD34, Ki-67 and TUNEL staining technique, respectively. Meanwhile, the mRNA expressions ofthese factors were assessed with quantitative real-time RT-PCR.ResultsAfter 8 weeks of treatment, all the protein content and mRNA expressions of ADRB1, ADRB2, ERK, Akt, NF-κB, VEGFA, Cyclin D1, Cyclin E1, Ki-67, Bcl-2, and MVD value and Ki-67 index were decreased significantly (P<0.01), while the protein and mRNA expressions of Bax, caspase-3, caspase-9, and apoptosis index were increased significantly (P<0.01). However, there was no obvious change in the expressions of Fas, FasL and caspase-8 after treatment.ConclusionPropranolol can inhibit proliferation and promot intrinsic apoptotic pathway of hemangioma through regulating the MAPKs and PI3K-Akt pathways, but it shows no influence on the extrinsic apoptotic pathway.
propranolol; hemangiomas; angiogenic proteins; apoptosis inducing factor
R732.2
A
0577-7402(2015)02-0121-07
10.11855/j.issn.0577-7402.2015.02.07
2014-07-13;
2014-12-22)
(责任编辑:胡全兵)
福建省医学创新课题(2012-CX-17);福建省教育厅资助省属高校项目(JK2012020)
李铭,医学硕士。主要从事血管瘤与血管畸形的基础与临床研究
350001 福州 福建医科大学附属协和医院整形外科(李铭、郭志辉、谢义德、周亚宽、陈小松、江成鸿、詹明坤、王立敏)
郭志辉,E-mail:guokex@tom.com
