模拟航空正加速度(+10Gz)暴露下大鼠肝脏组织中NF-κB的表达及其意义
2015-06-28刘垒张洪义胡深常鹏史斌李文兵
刘垒,张洪义,胡深,常鹏,史斌,李文兵
·军事医学·
模拟航空正加速度(+10Gz)暴露下大鼠肝脏组织中NF-κB的表达及其意义
刘垒,张洪义,胡深,常鹏,史斌,李文兵
目的探讨模拟航空正加速度(+10Gz)暴露下大鼠肝组织中NF-κB的表达情况及其意义。方法健康成年雄性SD大鼠24只,随机均分为对照组及实验A、B、C组,后3组分别在+10Gz加速度下验离心作用0.5、24、48h。实验结束后采血检测血清天冬氨酸转氨酶(AST)、丙氨酸转氨酶(ALT)水平;取大鼠肝组织,采用Western blotting和免疫组化染色检测NF-κB的表达。结果离心作用结束后,与对照组相比,A组大鼠毛发蓬乱,不进食水,静卧不动;B组大鼠毛发散乱,稍进食水,活动量减少;C组大鼠毛发顺畅但少光泽,已正常进食水,四处活动。与对照组相比,B组ALT、AST水平均升高,且B组高于A组和C组(P<0.05),A组与C组比较差异无统计学意义(P>0.05)。Western blotting和免疫组化染色结果显示,A、B、C组大鼠肝组织NF-κB表达水平均明显高于对照组(P<0.05),且B组明显高于A组和C组(P<0.05),A组与C组比较差异无统计学意义(P>0.05)。免疫组化切片显示,肝组织内NF-κB阳性产物主要位于肝细胞内,亦可见于炎症细胞及Kupffer细胞内,可分为胞质型、核型、核浆型等三个类型,单独或混合存在。结论模拟航空正加速度(+10Gz)暴露下大鼠肝组织中NF-κB表达水平明显增高,可能与加速度引起的肝脏应激损伤有关。
加速度;肝损伤;NF-κB;免疫组织化学;印迹法,蛋白质
随着航空和军事技术的发展,飞行员经常、反复地暴露于正加速度(+Gz)环境中,身体各器官系统会产生一定的应激反应。目前国内外关于+Gz对脑、心、肾等重要器官影响的研究较多[1-2],如重复持续+Gz对大鼠心脏和大脑的影响已得到证实[3-4],但其对肝脏影响的病理生理研究较少。近年来,我国航空事业迅猛发展,飞行员特殊训练和高性能战斗机的使用对航空医学提出了新的要求。本研究通过离心机实验模拟重复持续性正加速度(+10Gz)对大鼠肝脏的影响,观察高+Gz下肝脏细胞的损伤情况及肝组织中NF-κB含量的变化。
1 材料与方法
1.1 材料 清洁级健康成年雄性Wistar大鼠24只,体重195~215g(由军事医学科学院动物中心提供,合格证号SCKK-2012-C004)。NF-κBp65 mAb、牛血清白蛋白(Sigma公司,美国),DAB显色剂(ZSGBBIO公司,北京),预染的蛋白标记物(Thermo公司),β-actin单克隆抗体、羊抗兔二抗(中杉公司,北京),蛋白提取混合剂(凯基公司,中国);BCA蛋白测定试剂盒(索莱宝公司,中国);Tris碱、甘氨酸(AMRESCO公司,美国),光学显微镜(Olympus BX51,日本),图像分析系统(CMIAS,空军总医院);PVDF膜、琼脂糖水平电泳槽、转膜仪(Bio-Rad Laboratories,Hercules,美国),低温离心机5810R、微型高速离心机(Eppendorf,Hamburg,德国),Tanon1600凝胶成像系统(天能科技公司,上海)。
1.2 分组 大鼠适应性饲养1周后进行实验,随机分为对照组、实验A组、实验B组、实验C组,每组6只。实验A、B、C组分别采用+10Gz离心作用0.5、24h和48h。
1.3 造模与取材 参照有关加速度暴露方法建立模型[5],各实验组离心作用结束后,大鼠采用10%水合氯醛(0.5ml/100g)腹腔注射麻醉,无菌条件下经腹正中线开腹,下腔静脉采血,迅速切取肝脏标本,每只动物肝脏切割保存5块大小约为1cm×1cm×1cm的组织,切割部位随机选取,使用生理盐水冲洗肝组织上残留的血液,用10%甲醛固定;其余部分迅速液氮冷冻保存。对照组实验保存标本方法同实验组。
1.4 血清转氨酶ALT和AST水平测定 大鼠麻醉后常规从肝下下腔静脉采血4ml,用全自动生化分析仪检测血清天冬氨酸转氨酶(AST)、丙氨酸转氨酶(ALT)水平。
1.5 免疫组化检测大鼠肝组织NF-κB的表达 肝组织常规石蜡包埋,每块标本随机连续切片5张,厚度5μm,采用ABC法进行免疫组化,主要过程包括:H2O2/甲醛封闭内源性过氧化物酶,正常绵羊血清封闭,胰蛋白酶消化,PBS漂洗5min×3次。滴加一抗NF-κB(1:100),4℃冰箱孵育过夜,0.01mol/L PBS洗5min×3次,加生物素化二抗和ABC复合物,37℃孵育30min,DAB显色,常规脱水、透明,中性树胶封片,光镜下观察。
NF-κB阳性表达判定:以细胞核和(或)胞质中有明显的棕黄色颗粒为阳性。在光学显微镜下观察整张切片的表达情况,每张切片随机选取5个阳性染色区域(400倍视野),计数阳性细胞,并采用CMIAS病理分析系统测定平均吸光度(MOD)、积分吸光度(IOD)和平均灰度值(AGQ),每个标本取5个视野的平均值进行定量分析。阳性细胞越多,各值越大,表示免疫反应越强。
1.6 Western blotting检测大鼠肝组织NF-κB蛋白的表达 秤取肝脏组织块100mg,在液氮中充分研磨,移入玻璃匀浆器,加入蛋白提取混合剂1.5ml,充分匀浆后冰浴下超声处理,4℃下13 000r/min离心10min,取上清,加样,160V电泳1h;电泳完毕后切取60~94kD和27~45kD区,转膜液浸泡20min,转膜(100V,100min);在水平摇床上用TBST浸泡PVDF膜10min,室温下脱色,摇床上摇动封闭1~3h,用TBS稀释一抗(NF-κB 1:200,GAPDH 1:10 000),与PVDF膜一起在4℃条件下摇动孵化过夜,然后用TBST在脱色摇床上洗10min×3次,加碱性磷酸酶标记的二抗(TBS稀释),与PVDF膜在常温下育孵2~3h,在脱色摇床上用TBST洗10min×3次,然后用碱性磷酸酶底物BCIP/NBT显色10min。采用Quantity One v4.6.2软件进行吸光度值分析,结果以目的蛋白条带与对应β-actin(内参照)条带吸光度的比值表示。
1.7 统计学处理 采用SPSS 16.0软件进行统计分析,数据结果以表示,多组间比较采用完全随机设计的单因素方差分析,进一步两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 实验动物基本情况 各组动物在实验期间均无死亡。实验期间,观察到大鼠毛发散乱,失去光泽,急躁不安,暂不进食,精神较差,但随着时间延长,实验组大鼠都逐渐恢复至正常饮食和活动。
2.2 血清转氨酶ALT和AST水平 与对照组相比,实验各组ALT、AST水平均升高,且实验A组和C组低于实验B组(P<0.05),但A组与C组相比差异无统计学意(P>0.05,表1)。
2.3 免疫组化染色结果分析 实验组大鼠肝细胞内可见NF-κB蛋白阳性表达,呈棕黄色颗粒,主要定位于细胞核、细胞质中,分布不均,呈单个散在或小片状分布,可分为胞质型、核型、核浆型等三个类型,单独或混合存在,而对照组仅见少量颗粒状阳性表达。在实验组肝细胞核型阳性表达的切片中,可见全核阳性者,也可见局部碎点状阳性者,且主要位于核仁区(图1)。CMIAS病理分析系统定量分析结果显示,实验各组的MOD值均高于对照组,且实验B组高于实验A组和实验C组(P<0.05),但实验A组与C组比较差异无统计学意义(P>0.05,表2)。
表1 各组大鼠血清转氨酶AST和ALT比较(U/L,±s,n=6) Tab. 1 Comparison of serum ALT and AST levels in different groups (U/L,±s,n=6)

表1 各组大鼠血清转氨酶AST和ALT比较(U/L,±s,n=6) Tab. 1 Comparison of serum ALT and AST levels in different groups (U/L,±s,n=6)
(1)P<0.05 compared with control group; (2)P<0.05 compared with group A; (3)P<0.05 compared with group B
64±3(1)(2) 216±30(1)(2)C 44±4(3) 123±31(3)Group ALT AST Control 32±6 126±40 A 48±5 135±22 B

图1 加速度对大鼠肝脏NF-κB表达的影响(免疫组化 ×400)Fig. 1 Impact of acceleration on NF-κB expression in rat liver (Immunohistochemistry ×400)A. Control group; B. NF-κB expression, nuclear plasma type; C. Hepatocyte nuclear expression of NF-κB, showing full and partial broken punctate positive, mainly in the nucleolus area; D. NF-κB positive products can also be found within inflammatory cells and Kupffer cells
表2 各组大鼠肝细胞内NF-κB表达的免疫组化定量分析(±s,n=6)Tab. 2 Quantitative analysis of NF-κB expression in rat liver determined by immunohistochemical assay (±s,n=6)

表2 各组大鼠肝细胞内NF-κB表达的免疫组化定量分析(±s,n=6)Tab. 2 Quantitative analysis of NF-κB expression in rat liver determined by immunohistochemical assay (±s,n=6)
AOD. Average optical density, IOD. Integrated optical density, AGQ. Average gray of quantitative analysis. (1)P<0.05 compared with control group; (2)P<0.05 compared with group A; (3)P<0.05 compared with group B
Group AOD IOD AGQ Control 0.11±0.01 4.85±0.08 45.76±1.46 A 0.26±0.02(1) 11.24±0.41(1) 91.50±1.15(1)B 0.34±0.01(1)(2) 15.960±0.58(1)(2) 110.26±1.11(1)(2)C 0.12±0.03(1)(3) 5.56±0.39(1)(3) 47.10±1.40(1)(3)
2.4 Western blotting结果分析 与对照组相比,实验A、B组肝组织NF-κB蛋白表达均明显增高(P<0.05),且实验B组明显高于实验A组和C组(P<0.05),实验A组与C组之间比较差异无统计学意义(P>0.05,图2)。
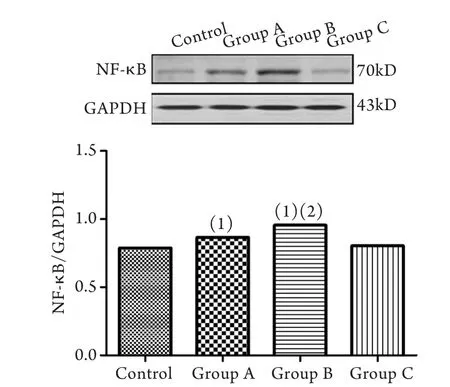
图2 各组大鼠肝组织NF-κB蛋白表达水平比较(Western blotting)Fig. 2 Expression of NF-κB protein in liver of different groups (Western blotting)(1)P<0.05 compared with control group; (2)P<0.05 compared with group A
3 讨 论
NF-κB于1996年首先报道为B淋巴细胞核抽取物中检出的可与免疫球蛋白轻链基因增强子κB序列特异结合的核蛋白因子[6]。从蛋白家族分类可知,NF-κB属于Rel蛋白家族,是二聚体蛋白分子,包含多种亚单位结构,其中NF-κB p56是目前研究较为清楚的一员,表达广泛,生物活性强,易于检测。NF-κB可介导多种炎性介质和急性期反应蛋白的表达,参与细胞凋亡的调控。在正常的真核细胞中,NF-κB通常与IκB抑制蛋白形成稳定的复合物,处于失活状态;当多种异常因素如高压、低氧、强射线、高温、低温等作用于细胞后,NF-κB可被激活,从而启动和调控转录程序,发挥相应的生物学效应[6-8]。
据报道,NF-κB参与肝脏多种病变的调控,当肝脏受到急性损伤后,该蛋白可发挥重要的生物活性作用[9]。Salazar-Montes等[10]报道肝脏急性损伤30min后NF-κB即被激活,这与本实验的结果相似。有研究发现创伤性或炎症性肝损伤后,NF-κB活性可出现明显升高,且这种升高与肝功能的变化呈正相关[11]。另有研究发现NF-κB可通过调控其下游基因的结构而间接加重肝脏损伤[11-12]。
现代高性能战斗机在飞行中产生的加速度可高达+9Gz以上,其持续时间可达15~45s,超出了人体正常的耐受限度。由于+Gz暴露导致血液向下端肢体和胃肠道分布,回心血量减少,因此有学者推测其可导致肝动脉和门静脉向肝脏和胆道系统的供血明显减少,通过诱导肝脏内微循环损害导致肝胆系统继发性损伤。在+Gz重复暴露下,大鼠肝脏超氧化物歧化酶(SOD)含量明显降低,导致肝脏氧自由基代谢能力下降。另有研究显示,在持续性+Gz暴露下,大鼠肝脏糖异生增加,从而可适应不同G值的作用[13]。
本研究通过Western blotting半定量检测和免疫组化染色证实,在模拟航空加速度作用后早期(24h 内),大鼠肝脏组织中NF-κB表达水平明显升高,考虑与离心加速度造成的肝脏分子水平的应激反应有关。本研究还发现离心过程中大鼠毛发散乱,失去光泽,急躁不安,暂不进食,精神较差,但随着时间延长(24~48h后),实验组大鼠逐渐恢复至正常饮食和活动。这一现象与肝组织中NF-κB表达先升后降的结果一致,提示肝脏NF-κB表达改变在离心后效应中具有一定意义。
总之,在加速度应激环境下,血液再分布以及器官挤压造成的肝脏急性应激损伤,NF-κB发挥着参与细胞的凋亡作用,但具体机制需待进一步研究。
[1]Zhang L, Luo HL, Liu XD. Effect of exposure to positive acceleration (+Gz) on the expression of TNF-α and ICAM-1 in swine with coronary artery stenosis[J]. Med J Chin PLA, 2014, 39(6):498-502. [张泠, 罗惠兰, 刘兴德. 正加速度暴露对冠状动脉狭窄小型猪模型TNF-α和ICAM-1表达的影响[J]. 解放军医学杂志, 2014, 39(6):498-502.]
[2]Wang L, Duan Mu LJ, Jiao L,et al. Changes in myocardial action potential of rabbit with myocardial ischemia exposed to repeated positive acceleration (+Gz)[J]. Med J Chin PLA, 2014, 39(7):581-585.[王兰, 端木鲁健, 焦琳, 等. 反复正加速度暴露致兔缺血心肌动作电位变化的研究[J]. 解放军医学杂志, 2014, 39(7):581-585.]
[3]Hu S, Zhang HY, Zhao G,et al. The increasing expression of GRP78 in rats liver cells after different repeat and sustained +Gz exposure[J]. Basic Clin Med, 2015, 35(1):17-21.[胡深, 张洪义, 赵刚, 等. 不同+Gz重复持续暴露对大鼠肝脏组织损伤及GRP78的表达影响[J].基础医学与临床, 2015, 35(1):17-21.]
[4]Zawadzka-Bartczak EK, Kopka LH. Centrifuge braking effects on cardiac arrhythmias occurring at high +Gz acceleration[J]. Aviat Space Environ Med, 2004, 75(5):458-460.
[5]Guillaume AI, Osmont D, Gaffié D,et al. Physiological implications of mechanical effects of +Gz accelerations on brain structures[J]. Aviat Space Environ Med, 2002, 73(3):171-177.
[6]Sen R, Baltimore D. Inducibility of kappa immunoglobulin enhancer-bin- ding protein Nf-kappa B by a posttranslational mechanism[J]. Cell, 1986, 47(6):921-928.
[7]Leeman JR, Gilmore TD. Alternative splicing in the NF-kappaB signaling pathway[J]. Gene, 2008, 423(2):97-107.
[8]Su JD, Wu LF. Relationship between nuclear factor-kappa B and cell apoptosis[J]. World Chin J Dig, 2007, 15(12):1411-1416.[苏剑东, 吴灵飞. NF-kappaB与细胞凋亡[J]. 世界华人消化杂志, 2007, 15(12):1411-1416.]
[9]Czaja MJ. Cell signaling in oxidative stress-induced liver injury[J]. Semin Liver Dis, 2007, 27(4):378-389.
[10]Salazar-Montes A, Ruiz-Corro L, Sandoval-Rodriguez A,et al. Increased DNA binding activity of NF-kappaB, STAT-3, SMAD3 and AP-1 in acutely damaged live[J]. World J Gastroenterol, 2006, 12(37):5995-6001.
[11]Yang WJ, Yu ZP, Zhang QY,et al. Changes of DNA binding activity of nuclear factor κappaB and its significance in liver damage after traumatic inflammation[J]. J Hepatopancreatobil Surg, 2006, 18(1):13-15.[杨文军, 余正平, 张启瑜, 等. 核因子-κB活性在创伤性炎症大鼠肝脏损伤中的变化及其意义[J]. 肝胆胰外科杂志, 2006, 18(1):13-15.]
[12]Wang CY, Fan YQ, Chi BR,et al. Roles of nuclear factor-kappa B, tumor necrosis factor-α and Bcl-2 in acute hepatic injury and their mechanisms[J]. World Chin J Dig, 2008, 16(25):2804-2808. [王春妍, 范玉强, 迟宝荣, 等. 核因子-kappa B及其下游因子TNF-alpha、Bcl-2在急性肝损伤中的作用及机制[J]. 世界华人消化杂志, 2008, 16(25):2804-2808.]
[13]Daligcon BC, Oyama J, Hannak K. Increased gluconeogenesis in rats exposed to hyper-G stress[J]. Life Sci, 1985, 37(3):235-241.
Expression of nuclear factor-kappa B in hepatic tissue and its significance in rats after repeated and sustained +10Gz exposure
LIU Lei, ZHANG Hong-yi*, HU Shen, CHANG Peng, SHI Bin, LI Wen-bing
Department of Hepatobiliary Surgery, Air Force General Hospital, Beijing 100142, China
*< class="emphasis_italic">Corresponding author, E-mail: zhhyiyi1487@163.com
, E-mail: zhhyiyi1487@163.com
This work was supported by the “Twelfth Five-Year Plan” Medical Science and Technology Research Project of PLA (CKJ12J022)
ObjectiveTo observe the injury to liver cells, and to investigate the changes in nuclear factor-kappa B (NF-κB) in the liver tissue after exposure to positive ten acceleration (+10Gz).MethodsTwenty-four adult male Wistar rats were randomly assigned to four groups:blank control, exposure groups A, B, and C. The rats of three exposure groups were subjected to centrifugal force of +10Gz for 0.5, 24, and 48h respectively, which was carried out in an Air Force Institute of Aviation Medicine. Plasma aspartate aminotransferase (AST) and alanine aminotransferase (ALT) were determined. Liver tissue was harvested for immunohistochemistry, and Western blotting was performed for expression of NF-κB.ResultsAfter +10 Gz exposure, rats of the group A showed shaggy hair, apathetic to food, and laid still, while group B rats showed shaggy hair, took a little food with lowering of activity level. The rats in group C showed normal activities. Both the levels of serum AST and ALT were elevated, and they were higher in group B than that of groups A and C (P<0.05), however, there was no statistically significant difference between groups A and C (P>0.05). Western blotting and immunohistochemical staining showed that the NF-κB expression levels were significantly higher in exposure groups than in control group (P<0.05), and significantly higher in group B than that in groups A and C (P<0.05), but there was no statistical difference between groups A and C (P>0.05). Immunohistochemical examination revealed NF-κB-positive products were localized predominantly in the hepatocytes, and also in the inflammatory cells and Kupffer cells. These products could be divided into three types:cytosolic type, karyotype, and nuclear-cytoplasm type, and they existed alone or in combination.ConclusionExposure to +10Gz, especially in the early stage, acts as a stress to induce the activation of NF-κB, suggesting that NF-κB plays an important role in the cascade reactions and adaptation to the acceleration stress.
acceleration; liver injury ; NF-kappa B; immunohistochemistry; blotting, Western
R852.21
A
0577-7402(2015)07-0595-04
10.11855/j.issn.0577-7402.2015.07.17
2014-12-09;
2015-01-17)
(责任编辑:李恩江)
全军医学科技“十二五”项目面上项目(CKJ12J022)
刘垒,硕士研究生。主要从事航空环境下加速度对肝胆系统影响的研究
100142 北京 空军总医院肝胆外科(刘垒、张洪义、胡深、常鹏、史斌、李文兵)
张洪义,E-mail:zhhyiyi1487@163.com
