不同感染途径HIV患者治疗后的耐药突变及影响因素分析
2015-06-28路新利康现江赵宏儒赵翠英王伟白广义李岩陈素良
路新利,康现江,赵宏儒,赵翠英,王伟,白广义,李岩,陈素良
不同感染途径HIV患者治疗后的耐药突变及影响因素分析
路新利,康现江,赵宏儒,赵翠英,王伟,白广义,李岩,陈素良
目的分析河北省不同感染途径的HIV患者治疗后基因突变情况及其相关影响因素。方法采集正在接受抗病毒治疗的HIV患者血浆,采用基因型检测法检测HIV-1 pol区突变基因并分析其耐药性。结果266例患者中157例发生了基因突变,耐药发生率59.0%。266例患者中高度耐药发生率为NVP 65.8%(175/266)、3TC 41.7%(111/266)、FTC 41.7%(111/266)、EFV 30.1%(80/266)、DDI 5.6%(15/266)、D4T 4.1%(11/266)、AZT 3.0%(8/266)、ABC 3.0%(8/266)。经血感染的HIV患者耐药发生率高于性途径和母婴途径,但χ2检验结果显示这3种途径之间在NNRTIs编码区Y181C、K103N、V108I、K101E等主要突变位点(χ2=4.796,P=0.531),NRTIs编码区M184V/I、M41L、T215F、T215Y(χ2=5.261,P=0.511),PIs编码区A71V/T、L10I、M46L、Q58E(χ2=6.150,P=0.407)的差异均无统计学意义。OR值计算和95%CI分析表明,患者年龄、感染途径、CD4+T淋巴细胞数、初始治疗方案与HIV-1耐药突变的发生存在显著相关性(P<0.05)。结论在HIV治疗过程中应适时进行CD4+T淋巴细胞、病毒载量和耐药监测,评估疾病进程,使引起耐药的相关因素的影响降到最低,并及时更新治疗方案。
HIV;抗病毒药;突变
河北省自1989年发现首例艾滋病感染者以来,经过20世纪90年代局部地区的疫情暴发,感染途径已经从单一的传播模式发展到目前的血液传播、性传播、母婴传播共存,以性传播为主[1]。治疗模式开始是自费治疗,2003年国家开始执行免费抗病毒治疗后,随着治疗范围的扩大和药物使用频率的提高,造成通过这些途经感染的患者体内HIV-1 RNA基因位点发生适应性变异,产生耐药毒株,进而引发严重的临床和流行病学问题[2-3]。本研究对正在参加抗病毒治疗的266例患者体内HIV-1 RNA pol区位点突变进行分析,以了解河北省辖区内不同感染途径的HIV患者的耐药情况和相关影响因素。
1 资料与方法
1.1 研究对象 招募河北省内正在参加抗病毒治疗的艾滋病患者,采集其EDTA抗凝全血10ml,取50μl进行CD4+T淋巴细胞绝对数检测,余分离血浆后行病毒载量(VL)检测。选取266例病毒载量≥1000拷贝/ml的患者行血浆耐药基因型检测,并调查个人基本情况及治疗情况。
1.2 CD4+T淋巴细胞数和HIV载量测定 采用美国BD公司流式细胞仪(FACSCount)和美国Roche公司COBAS AMPLlCOR自动载量仪及其配套试剂盒,分别测定CD4+T淋巴细胞绝对数和HIV-1载量。
1.3 HIV-1 RNA提取及耐药基因型检测 采用基因型检测法对病毒载量≥1000拷贝/ml的HIV患者进行HIV-1基因型检测。提取HIV-1 RNA,通过两轮聚合酶链反应(PCR)对目的基因片段进行扩增,采用1%琼脂糖凝胶电泳鉴定PCR产物,PCR阳性结果交由上海生工生物工程技术服务有限公司进行序列测定。采用Contig Express软件做序列拼接处理原始核苷酸序列,参照测序图谱进行基因序列修订后,直接进入Web站点http://hivdb.stanford.edu进行耐药性分析[3]。
1.4 统计学处理 采用SPSS 17.0软件进行χ2检验,分析比值比(OR)和95%可信区间(95%CI)。
2 结 果
2.1 HIV-1 RNA位点突变结果 266例患者中共发现157例体内的HIV-1 RNA产生了针对反转录酶抑制剂(RTIs)或蛋白酶抑制剂(PIs)的位点突变,耐药发生率为59.0%(157/266)。266例患者中高度耐药发生率为NVP 65.8%(175/266)、3TC 41.7%(111/266)、FTC 41.7%(111/266)、EFV 30.1%(80/266)、DDI 5.6%(15/266)、D4T 4.1%(11/266)、AZT 3.0%(8/266)、ABC 3.0%(8/266),具体情况见表1。
表1数据显示,在反转录酶编码区,与核苷类反转录酶抑制剂(NRTIs)相关的突变位点中,HIV-1 RNA pol区位点184、215、41突变率位居前三,突变频率依次为41.7%、19.2%、10.2%,其中有3例患者出现了TAMS突变,2例患者出现了Q151M复合体突变;与非核苷类反转录酶抑制剂(NNRTIs)相关的突变位点中,基因突变率在前三位的位点为103、181和108位点,突变频率依次为22.9%、21.4%、9.0%。在蛋白酶编码区,共有54例患者发生位点突变,包括主要突变V32AV、Q58E、M46IM、M46L和次要突变L10I、A71V/T(表2)。同时,在发生突变的各主要位点中,血液途径感染HIV者发生基因突变的频率高于经性途径和母婴途径感染的HIV患者,例如在NNRTIs编码区,经血感染患者Y181C的耐药突变频率为11.7%,高于经性途径(8.3%)和母婴传播(1.5%)者,具体如表1、表2所示。但χ2检验结果显示这三种途径之间在NNRTIs编码区Y181C、K103N、V108I、K101E等主要突变位点(χ2=4.796,P=0.531),NRTIs编码区M184V/I、M41L、T215F、T215Y(χ2=5.261,P=0.511),PIs编码区A71V/T、L10I、M46L、Q58E(χ2=6.150,P=0.407)的差异均无统计学意义。
2.2 耐药相关影响因素分析 结果显示,年龄、治疗时间、感染途径、CD4+T淋巴细胞数、初始治疗方案与HIV-1的耐药性存在相关性(P<0.05),具体情况如表3所示。

表1 HIV-1 RNA反转录酶编码区位点突变[例(%)]Tab.1 Locus mutations in HIV-1 RNA reverse transcriptase coding region [n(%)]
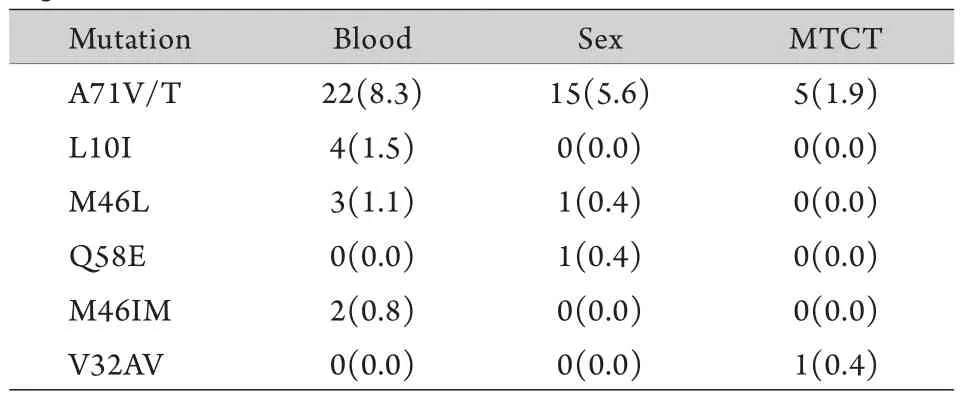
表2 HIV-1 RNA蛋白酶编码区耐药突变[例(%)]Tab.2 Tolerance mutations in HIV-1 RNA protease coding regions [n(%)]
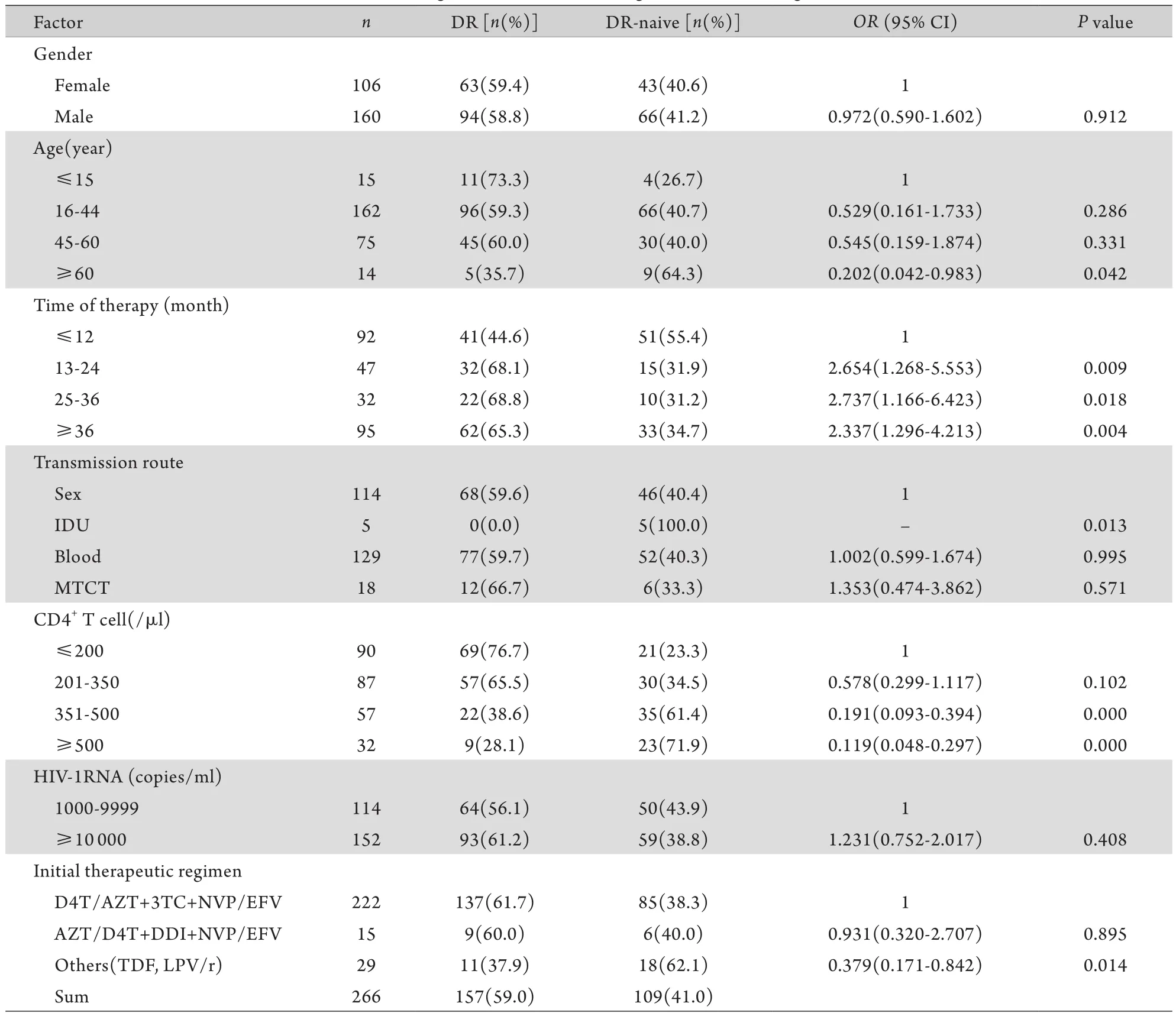
表3 HIV患者耐药相关影响因素分析Tab.3 Influencing factors related to drug-resistance among HIV/AIDS
3 讨 论
本研究显示,此次检测对象中有59.0%的患者不同程度地对PIs或RIs产生了耐受性,低于河南的70.8%~72.3%[5-6],高于Frentz等[7]的同类报道,且不同感染途径的HIV患者体内HIV-1 RNA位点突变频率存在差异。HIV-1 RNA pol区基因位点突变(表1、2)使患者对治疗方案中的所有药物都产生了不同程度的耐受性[8-9],提示我们长期使用某一种药物或某一种治疗方案易使基因发生适应性突变,造成药物的治疗效果降低。同时部分患者对ABC、FTC、NFV、TPV/r、ETR等未使用过的药物也产生了耐受性,分析原因可能是这些患者感染了传播性耐药毒株或者自然变异所致。但是有些位点突变不会引起耐药,例如蛋白酶编码区的位点71突变频率高达15.8%,然而该位点突变与V32AV和L10I一样没有引起任何PIs药效降低或失效,在一些情况下这些位点突变和一些药物的耐受性密切相关[10]。
本研究对血浆中核酸含量大于1000拷贝/ml的病例进行耐药性测定,发现经不同传播途径感染HIV的患者体内HIV-1 RNA pol区位点突变频率存在差异,但无统计学意义(P>0.05)。无论是蛋白酶编码区上46、58、72位点还是反转录酶编码区上41、103、181、184等位点,通过血液感染艾滋病的患者发生耐药的频率均大于性传播和母婴传播,这与河北省1989年以来传播途径的变化有关,2005年以前发现的感染者主要是经血传播者,这部分患者治疗较早,2005年以后经性接触感染者占优势,经血液和母婴传播趋势下降[1],参加治疗的患者以性接触者为主,可以推测血液感染者治疗时间长是导致耐药突变率上升的原因,也证明了治疗时间是影响耐药发生的主要相关因素。另外,OR值计算和95%CI分析也表明其他因素如患者年龄、感染途径、CD4+T淋巴细胞数、初始治疗方案与HIV-1耐药突变的发生存在显著相关性(P<0.05)。
本研究结果提示我们应加强对HIV/AIDS患者的耐药性监测和检测,监控耐药变异情况,使引起耐药的相关因素的影响降到最低,并适时更新治疗方案,以获得较好的疗效。
[1]Guo ZJ. Analysis on HIV/AIDS epidemic data in Hebei province during 1989 to 2009[J]. Chin J Derm Venereo, 2010, 28(4):737-738. [郭占景. 1989年-2009年河北省艾滋病流行病学资料分析[J]. 中国皮肤性病学杂志, 2010, 28(4):737-738.]
[2]Zhang F, Dou Z, Ma Y,et al. (2009) Five-year outcomes of the China national free antiretroviral treatment program[J]. Ann Intern Med, 151(4):241-251.
[3]Li XF, Yu ZJ, Liang HX,et al. Analysis on effects of HAART from 377 Chinese AIDS[J]. J Zhengzhou Univ (Med Sci), 2013, 48(2):235-238.[李晓菲, 余祖江, 梁红霞, 等. 艾滋病患者抗病毒督导治疗疗效分析[J]. 郑州大学学报(医学版), 2013, 48(2):235-238.]
[4]Li HP, Li H, Yang K,et al. Research of clincial efficacy in patients treated with antivirus drug and the untreated controls at partial region, Henan province and drug resistance[J]. Chin J Microbiol Immunol, 2005, 25(3):194-198. [李韩平, 李宏, 杨坤, 等. 河南省部分艾滋病患者抗病毒治疗的临床效果以及基因型耐药分析[J]. 中华微生物学和免疫学杂志, 2005, 25(3):194-198.]
[5]Li XP, Xing H, Wang Z,et al. Study of HIV-1 drug resistance in patients receiving free antiretroviral therapy in China[J]. Virol Sin, 2007, 22(3):233-240.
[6]Dongbao Y, Donald S, Massimo G,et al. Systematic review of HIV drug resistance assessment in the western pacific region[J]. AIDS Reviews, 2011, 13(4):214-216.
[7]Frentz D, Boucher CA, vande Vijver DA. Temporal changes in the epidemiology of transmission of drug-resistant HIV-1 across the world[J]. AIDS Rev, 2012, 14(1):17-27.
[8]Lu XL, Zhao HR, Zhang YQ,et al. Drug resistance mutation of HIV-1 in HIV/AIDS patients infected by blood transfusion[J]. Med J Chin PLA, 2013, 38(3):230-234. [路新利, 赵宏儒, 张玉琪, 等. 经血液感染的HIV-1耐药基因突变研究[J]. 解放军医学杂志, 2013, 38(3):230-234.]
[9]Robert WS, Jonathan MS. HIV-1 drug resistance mutations:an updated framework for the second decade of HAART[J]. AIDS Rev, 2008, 10(2):67-84.
[10]Victoria A, Johnson MD, Vincent C,et al. Special contribution–2011 update of the drug resistance mutations in HIV-1[J]. Top Antivir Med, 2011, 19(4):156-164.
Drug resistance mutations and their influencing factors in the patients infected with HIV-1 through different routes after antiretroviral therapy
LU Xin-li1, KANG Xian-jiang1*, ZHAO Hong-ru2, ZHAO Cui-ying2, WANG Wei2, BAI Guang-yi2, LI Yan2, CHEN Su-liang2*1College of Life Sciences, Hebei University, Baoding, Heibei 071002, China
2Disease Prevention and Control Center of Hebei Province, Shijiazhuang 050021, China
*< class="emphasis_italic">Corresponding authors. KANG Xian-jiang, E-mail: xjkang@hbu.edu.cn; CHEN Su-liang, E-mail: hebeicdc2013@sina.com
s. KANG Xian-jiang, E-mail: xjkang@hbu.edu.cn; CHEN Su-liang, E-mail: hebeicdc2013@sina.com
ObjectiveTo analyze HIV-1 drug resistance mutations and relative factors in the patients infected with HIV-1 through different routes after having
highly active anti-retroviral therapy (HAART) in Hebei province.MethodsPlasma samples were collected from patients who were infected with HIV through different routes. Detection of HIV-1 RNA pol region was carried out by detection of genotype, and HIV drug resistance mutations were analyzed.ResultsAmong 266 patients, 157 developed mutation. The rate of the drug-resistance was 59.0%. Among 266 patients, drug-resistance rates were ranked from high to low as follows:NVP 65.8% (175/266), 3TC 41.7% (111/266), FTC 41.7% (111/266), EFV 30.1% (80/266), DDI 5.6% (15/266), D4T 4.1% (11/266), AZT 3.0% (8/266) and ABC 3.0% (8/266). The drug-resistance rate of blood infection patients was much higher than that of sexual and mother-to-child transmission ones, butχ2-test indicated that the differences in main mutation sites (Y181C, K103N, V108I, K101E in NNRTIS coding region, M184V/I, M41L, T215F, T215Y in NRTIs coding region and A71V/ T, L10I, M46L, Q58E in PIs coding region) were not statistically significant (P>0.05) among the patients infected through three routes. The results ofORvalue and the 95% confidence interval (CI) indicated that age, infection routes, CD4+cell count and initial therapeutic plan had a significant relevance to HIV-1 drug resistance mutation (P<0.05).ConclusionTimely monitor of CD4+cell number, viral load and drug resistance, and evaluation of progression of AIDS, are essential to minimize the influence of related factors on drug resistance, and to renew the therapeutic plan in time during HAART in order to enhance the therapeutic effects.
HIV; antiviral agents; mutation
R512.91
A
0577-7402(2015)07-0591-04
10.11855/j.issn.0577-7402.2015.07.16
2014-12-26;
2015-06-10)
(责任编辑:熊晓然)
路新利,博士研究生。主要从事艾滋病的防治工作
071002 河北保定 河北大学生命科学学院(路新利、康现江);050021 石家庄 河北省疾病预防控制中心(赵宏儒、赵翠英、王伟、白广义、李岩、陈素良)
康现江,E-mail:xjkang@hbu.edu.cn;陈素良,E-mail:hebeicdc2013@sina.com
