拉帕替尼诱导人鼻咽癌CNE-2Z细胞周期阻滞和细胞凋亡观察
2015-06-28屠彦红李娜高士秀肖鹤宋若会
屠彦红,李娜,高士秀,肖鹤,宋若会
拉帕替尼诱导人鼻咽癌CNE-2Z细胞周期阻滞和细胞凋亡观察
屠彦红,李娜,高士秀,肖鹤,宋若会
目的探讨拉帕替尼对人鼻咽癌CNE-2Z细胞周期和凋亡的影响及其作用机制。方法采用CCK-8法检测拉帕替尼对CNE-2Z细胞增殖的影响,PI染色后以流式细胞术进行细胞周期分析,Annexin V/PI双标记法检测细胞凋亡,实时定量PCR检测细胞周期相关分子Cyclin D1、P21和P53的mRNA表达水平,Western blotting检测Cyclin D1、P21、P53及凋亡相关蛋白Mcl-1和Bax的表达,利用Apo-ONE Homogeneous caspase-3/7检测试剂盒检测Caspase-3/7酶活性。结果拉帕替尼呈剂量依赖性地抑制CNE-2Z细胞增殖,并可诱导CNE-2Z细胞发生明显的细胞周期G0/G1期阻滞,促进细胞凋亡,下调Cyclin D1并上调P21、P53 mRNA和蛋白表达,下调Mcl-1和上调Bax蛋白表达,并诱导CNE-2Z细胞内caspase-3/7激活。结论拉帕替尼可有效抑制人鼻咽癌CNE-2Z细胞增殖,诱导细胞周期阻滞并促进其凋亡,可作为治疗鼻咽癌的潜在药物。
拉帕替尼;鼻咽肿瘤;细胞周期;细胞凋亡
鼻咽癌(nasopharyngeal carcinoma,NPC)是中国常见的恶性肿瘤之一。尽管鼻咽癌的治疗和早期诊断已取得显著进展,但Ⅲ期和Ⅳ期患者的预后依然很差,局部区域复发和远处转移仍是鼻咽癌治疗失败的两大主因[1]。因此,寻找新的对鼻咽癌安全有效的治疗药物是目前亟待解决的问题。表皮生长因子受体(epidermal growth factor receptor,EGFR)和人类表皮生长因子受体2(human epidermal growth factor receptor-2,HER2)同属于表皮生长因子酪氨酸激酶受体家族。其中,EGFR与多种肿瘤的发生和发展密切相关,如结肠癌、乳腺癌、肺癌、前列腺癌和膀胱癌等均伴随EGFR的过表达。此外,在大约30%的乳腺癌和卵巢癌患者体内检测到HER2基因增高或过表达。近年研究证实,超过30%的鼻咽癌患者体内HER2过表达,且与预后差、转移快相关[2-3]。拉帕替尼(lapatinib)是一类口服的双靶点小分子酪氨酸激酶抑制剂,同时作用于EGFR和HER2两个靶点[4],目前在临床上与卡培他滨(capecitabine)合并用于治疗经一线药物治疗失败的晚期或转移性乳腺癌[5],但在鼻咽癌中的研究尚处于起步,国内未见相关报道。本研究采用人鼻咽癌细胞系CNE-2Z,研究拉帕替尼对该细胞系增殖、细胞周期和凋亡的影响,并初步探讨其作用机制。
1 材料与方法
1.1 主要试剂及仪器 细胞系CNE-2Z购自中国医学科学院基础医学研究所细胞资源中心。拉帕替尼购自美国Selleck公司;化合物储存液用DMSO配制,使用时用培养液稀释,使DMSO终浓度不超过0.05%;RPMI 1640培养液、胎牛血清均购自美国Gibco公司;碘化丙啶(PI)、RNAase购自美国Sigma公司;CCK-8试剂盒购自日本Dojindo公司;Annexin V-FITC检测试剂盒购自北京宝赛生物技术有限公司;Z-VAD-FMK、Apo-ONE Homogeneous caspase-3/7试剂盒购自美国Promega公司;抗Cyclin D1、P21、P53、Mcl-1和Bax等单克隆抗体均购自Cell Signaling公司;GAPDH抗体及辣根过氧化物酶标记的二抗购自Santa Cruz公司;辣根过氧化物酶显色底物ECL购自Cell Signaling公司。FACSCalibur流式细胞仪购自美国BD公司;DNM-9602G型酶标仪购自北京普朗新技术有限公司;CO2培养箱购自日本三洋公司;微孔板荧光检测仪(Wallac Victor)购自美国Perkin Elmer公司;定量PCR仪购自美国Bio-Rad公司。
1.2 细胞培养 将CNE-2Z细胞接种于含10%胎牛血清、1×105U/L青霉素、100mg/L链霉素的RPMI 1640培养液中,在5%CO2、饱和湿度、37℃培养箱中培养,每2~3d传代1次。
1.3 CCK-8法检测细胞增殖 取对数生长期的CNE-2Z细胞接种于96孔培养板中,每孔2×104个细胞。培养24h后,吸弃培养液,加新鲜含10%血清培养液180μl,对照组加入含0.05% DMSO的培养液20μl,药物处理组加入不同浓度的拉帕替尼溶液各20μl,使终浓度分别为1.56、3.13、6.25、12.5、25、50及100μmol/L,其中DMSO含量不超过0.05%。同时设立调零组(无细胞组),加入200μl培养液。培养48h后加入10μl CCK-8孵育2h,酶标仪于波长490nm处读取吸光度(A)值。根据公式计算细胞存活率:细胞存活率(%)=[(A药物处理组-A调零组)/ (A对照组-A调零组)]×100%。绘制剂量效应曲线,计算拉帕替尼对CNE-2Z细胞的半数抑制浓度(IC50)。
1.4 PI单染法检测细胞周期 取对数生长期细胞,以2×105/ml密度接种于6孔板中,使拉帕替尼终浓度为6.25、12.5、25μmol/L,空白对照组给予等体积的DMSO。培养24h后,离心收集细胞(500g×5min),70%冰乙醇4℃固定过夜,细胞离心弃上清,PBS溶液洗涤2次,加入100μl(1mg/ml) RNase A酶,37℃处理30min,PI(100μg/ml)染色,流式细胞仪上机检测。
1.5 Annexin V/PI双标方法检测细胞凋亡 细胞处理同1.4。培养48h后,离心收集单细胞悬液(500g×5min),PBS洗涤1次,每个样品中加入100μl Annexin V-FITC,室温孵育15min,加入400μl PI(50μg/ml),流式细胞仪检测。
1.6 Caspase-3/7活性检测 Caspase-3/7活性检测按Apo-ONE Homogeneous caspase-3/7试剂盒说明书进行。细胞经药物处理后,加入100μl含Z-DEVD-罗丹明110的caspase-3/7缓冲液,培养板置室温避光反应2h,用微孔板荧光检测仪测定在激发光波长485nm、发射光波长535nm处的荧光值。
1.7 实时定量PCR检测细胞周期相关分子mRNA表达 取对数生长期的CNE-2Z细胞,以2×105/ml密度接种于60mm细胞培养皿中,使拉帕替尼终浓度为6.25、12.5μmol/L,空白对照组加入相同含量的DMSO。24h后离心收集细胞,用Trizol试剂提取细胞总RNA,用分光光度法测浓度,按照Thermo反转录试剂盒说明书进行操作,各目的基因及内参基因GAPDH的引物见表1。反应程序为:95℃ 10min;95℃ 15s,60℃ 60s,收集荧光,39个循环。以GAPDH为内参照。采用比较循环阈值法(2–ΔΔCt)分析各组中mRNA的相对表达量。

表1 实时定量PCR引物Tab.1 Primers used in real-time quantitative PCR
1.8 Western blotting检测细胞周期和细胞凋亡相关分子蛋白表达 取对数生长期的CNE-2Z细胞,以2×105/ml密度接种于60mm细胞培养皿中,使拉帕替尼终浓度为6.25、12.5μmol/L,空白对照组加入相同含量DMSO。24h后离心收集细胞,加入裂解缓冲液冰浴15min,4℃ 12 000×g离心10min后取上清测蛋白浓度,加入上样缓冲液,100℃下变性7min。每份样品取20μg蛋白样品进行SDS-PAGE,将电泳分离的蛋白转移到硝酸纤维素膜上,5%脱脂牛奶室温封闭1h后加入一抗4℃过夜。TBST洗脱3次,每次10min。加入相应的二抗,室温孵育1h,TBST洗脱3次,每次10min。化学发光剂ECL孵育显影。
1.9 统计学处理 采用SPSS 16.0软件进行统计学分析。计量资料以表示,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 拉帕替尼对CNE-2Z细胞增殖的抑制作用 倒置显微镜下观察,CNE-2Z细胞呈单层生长,细胞形态为多角形或短梭形。经拉帕替尼处理后,细胞密度明显降低,细胞质透亮度下降,部分细胞胞突回缩变圆,脱落呈悬浮状,可见细胞碎片。上述变化随着拉帕替尼作用浓度的增加而加重(图1)。CCK-8检测结果显示,不同浓度的拉帕替尼处理CNE-2Z细胞48h后,对细胞增殖均有抑制作用,拉帕替尼浓度越高,其增殖抑制效应越强,呈明显的剂量依赖性(图2)。48h的IC50为13.96±1.05μmol/L。

图1 拉帕替尼对CNE-2Z细胞形态的影响(比例尺=400μm)Fig.1 Effect of lapatinib on the morphology of CNE-2Z cells (bar=400μm)

图2 拉帕替尼对CNE-2Z细胞增殖的影响Fig.2 Effect of lapatinib on the proliferation of CNE-2Z cells
2.2 拉帕替尼对CNE-2Z细胞周期的影响 流式细胞仪检测结果显示,不同浓度(6.25~25μmol/L)的拉帕替尼作用于CNE-2Z细胞24h后,G0/G1期细胞比例均明显升高(P<0.05或P<0.01),S期细胞比例明显减少(P<0.05),但对G2/M期细胞比例没有明显影响,提示拉帕替尼诱导CNE-2Z细胞发生显著的G0/ G1期周期阻滞(表2、图3)。
2.3 拉帕替尼诱导CNE-2Z细胞凋亡 采用Annexin V/PI双标法分析拉帕替尼对CNE-2Z细胞凋亡的影响,结果显示,12.5和25μmol/L拉帕替尼处理细胞48h,细胞凋亡率随着拉帕替尼的浓度增高而增加,与对照组相比差异有统计学意义(P<0.05或P<0.01),表明较高浓度拉帕替尼可显著诱导CNE-2Z细胞发生凋亡(图4)。
表2 拉帕替尼对CNE-2Z 细胞周期的影响(%,±s,n=3)Tab.2 Effect of lapatinib on the cell cycle distribution of CNE-2Z cells (%,±s,n=3)

表2 拉帕替尼对CNE-2Z 细胞周期的影响(%,±s,n=3)Tab.2 Effect of lapatinib on the cell cycle distribution of CNE-2Z cells (%,±s,n=3)
(1)P<0.05, (2)P<0.01 compared with control group
Group G0/G1 S G2/M Control 45.05±6.88 41.81±7.39 13.14±3.17 Lapatinib(μmol/L) 6.25 73.99±4.72(2) 17.60±4.99(2) 8.41±1.07 12.5 68.63±8.26(1) 16.83±3.52(2) 14.54±4.74 25.0 68.87±7.55(1) 16.66±5.19(2) 14.46±2.77
2.4 拉帕替尼对CNE-2Z细胞周期和细胞凋亡相关分子的影响 拉帕替尼处理CNE-2Z细胞后,采用RT-qPCR检测细胞周期调控因子的mRNA表达水平,结果显示Cyclin D1 mRNA表达水平较对照组明显下降(P<0.01),而P21和P53 mRNA表达水平较对照组显著增加(P<0.01,图5)。Western blotting检测结果显示,不同浓度拉帕替尼处理后CNE-2Z细胞中Cyclin D1蛋白表达水平明显降低,而P21和P53蛋白表达水平明显升高,同时可见促凋亡分子Bax蛋白表达水平明显升高,而抗凋亡分子Mcl-1蛋白表达水平明显降低(图6)。

图3 拉帕替尼对CNE-2Z细胞周期的影响Fig.3 Effect of lapatinib on the cell cycle distribution of CNE-2Z cells

图4 拉帕替尼对CNE-2Z细胞凋亡的影响Fig.4 Lapatinib induced apoptosis in CNE-2Z cellsA. Measurement of apoptosis in CNE-2Z cells; B. Statistic analysis of apoptosis rate; (1)P<0.05, (2)P<0.01 compared with control group (0μmol/L lapatinib)
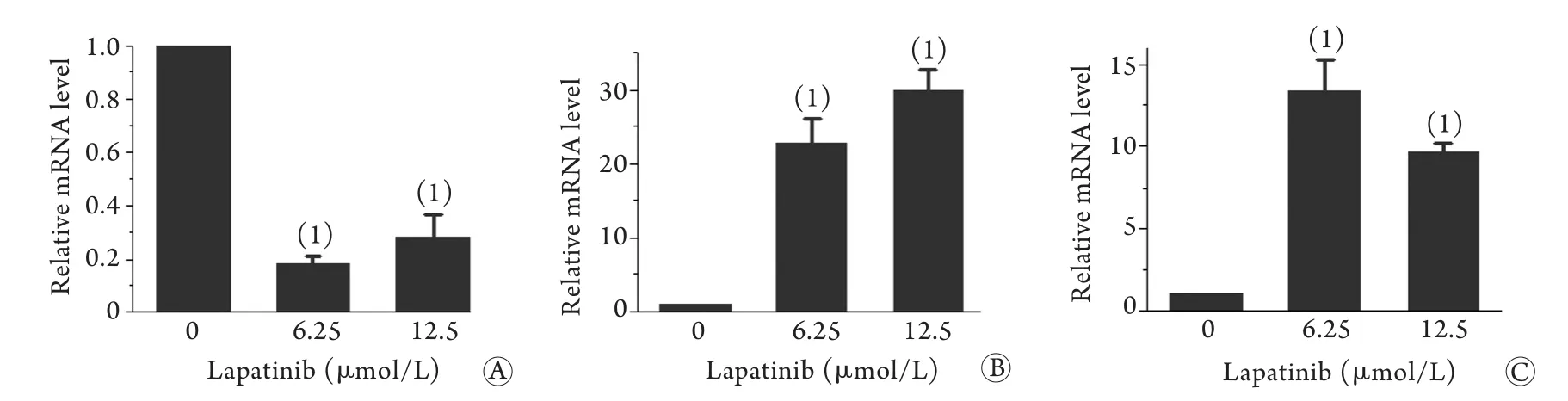
图5 拉帕替尼对细胞周期调控因子mRNA表达的影响Fig.5 Lapatinib regulated mRNA expression of cell cycle related moleculars A. Cyclin D1; B. P21; C. P53; (1)P<0.01 compared with control group (0μmol/L lapatinib)
2.5 拉帕替尼对CNE-2Z细胞caspase-3/7酶活性的影响 采用Apo-ONE Homogeneous caspase-3/7试剂盒检测caspase-3/7激酶活性变化,结果显示,CNE-2Z细胞经拉帕替尼处理24h后,随着药物浓度的增高,caspase-3/7酶活性逐渐增强,其中12.5~25μmol/L拉帕替尼作用后caspase-3/7酶活性与对照组比较明显升高(P<0.01,图7)。

图6 拉帕替尼对细胞周期和细胞凋亡相关分子蛋白表达的影响Fig.6 Lapatinib regulated protein expression of cell cycle and apoptosis related moleculars

图7 拉帕替尼对Caspase3/7酶活性的影响Fig.7 Measurement of caspase 3/7 activation by kinase activity assay(1)P<0.01 compared with blank control group (0μmol/L)
3 讨 论
EGFR和HER2及其相关下游信号通路的异常表达与多种恶性肿瘤的发生发展密切相关,许多新型靶向治疗药物均是通过抑制这两种受体的活性而发挥抗癌作用的。拉帕替尼通过同时靶向抑制EGFR 和HER2及其介导的肿瘤细胞增殖和生长的信号通路而发挥抗肿瘤活性,目前在临床上用于联合卡培他滨治疗HER2过度表达且既往接受过包括蒽环类、紫杉醇、曲妥珠单抗(赫赛汀)治疗的晚期或转移性乳腺癌[5]。此外,拉帕替尼还对胰腺癌、食管癌等其他肿瘤具有明显的抑制作用[6-7]。国外研究也证明拉帕替尼具有抑制鼻咽癌细胞增殖的作用[8]。
本研究发现拉帕替尼可显著抑制CNE-2Z细胞增殖,并诱导细胞周期G0/G1期阻滞。Cyclin D1是周期蛋白家族中重要的调控因子。在细胞周期进程中,Cyclin D1与CDK4/6结合并激活CDK4/6为细胞从G0期进入G1期所必需[9]。P21是一种细胞周期抑制蛋白,可通过抑制CDK4/6-Cyclin D复合物导致细胞周期G1期阻滞。此外,P21是抑癌基因P53的下游信号分子,P53可以转录激活P21基因,调控P21的表达[10]。本研究结果显示,拉帕替尼可能通过降低Cyclin D1表达,并引起P21和P53的表达上调,从而使CNE-2Z细胞发生G0/G1期阻滞。
本研究发现,较高浓度拉帕替尼能诱导CNE-2Z细胞发生凋亡。Bcl-2家族成员与细胞凋亡密切相关,其抗凋亡成员和促凋亡成员之间可竞争性形成同源或异源二聚体(如Bcl-2/Bax、Mcl-1/Bax等)而决定细胞是否发生凋亡[11]。Mcl-1和Bax分别是Bcl-2家族中重要的凋亡抑制蛋白和凋亡促进蛋白,研究表明下调Mcl-1或(和)上调Bax可以引起肿瘤细胞凋亡[12-13]。此外,Bcl-2家族成员可通过线粒体内外膜上的蛋白间接或直接影响线粒体途径凋亡的发生,并激活caspase家族,产生caspase级联反应执行细胞凋亡[14];而caspase-3/7是caspase家族中的主要凋亡执行者,其活化是凋亡进入不可逆阶段的标志。本研究发现,拉帕替尼可显著下调Mcl-1蛋白的表达,并增加促凋亡蛋白Bax的表达,同时激活caspase-3/7,共同促进细胞凋亡的发生。
综上所述,本研究结果显示,拉帕替尼能显著抑制CNE-2Z细胞增殖,并诱导细胞周期阻滞和细胞凋亡,细胞周期相关分子Cyclin D1、P21和P53以及细胞凋亡调控蛋白Bax和Mcl-1均可能参与了上述过程,该结果为拉帕替尼临床治疗鼻咽癌提供了一定的理论基础和实验依据。
[1]Teo PM, Kwan WH, Lee WY,et al. Prognosticators determining survival subsequent to distant metastasis from nasopharyngeal carcinoma [J]. Cancer, 1996, 77(12):2423-2431.
[2]Ma BB, Poon TC, To KF,et al. Prognostic significance of tumor angiogenesis, Ki 67, p53 oncoprotein, epidermal growth factor receptor and HER2 receptor protein expression in undifferentiated nasopharyngeal carcinoma–a prospective study[J]. Head Neck, 2003, 25(10):864-872.
[3]Chua DT, Nicholls JM, Sham JS,et al. Prognostic value of epidermal growth factor receptor expression in patients with advanced stage nasopharyngeal carcinoma treated with induction chemotherapy and radiotherapy[J]. Int J Radiat Oncol Biol Phys, 2004, 59(1):11-20.
[4]Baselga J. Targeting tyrosine kinases in cancer:the second wave[J]. Science, 2006, 312(5777):1175-1178.
[5]Ahn ER, Vogel CL. Dual HER2-targeted approaches in HER2-positive breast cancer[J]. Breast Cancer Res Treat, 2012, 131(2):371-383.
[6]Komoto M, Nakata B, Nishii T,et al.In vitroandin vivoevidence that a combination of lapatinib plus S-1 is a promising treatment for pancreatic cancer[J]. Cancer Sci, 2010, 101(2):468-473.
[7]Mimura K, Kono K, Maruyama T,et al. Lapatinib inhibits receptor phosphorylation and cell growth and enhances antibody-dependent cellular cytotoxicity of EGFR- and HER2-overexpressing esophageal cancer cell lines[J]. Int J Cancer, 2011, 129(10):2408-2416.
[8]Lui VW, Lau CP, Ho K,et al. Anti-invasion, anti-proliferation and anoikis-sensitization activities of lapatinib in nasopharyngeal carcinoma cells[J]. Invest New Drugs, 2011, 29(6):1241-1252.
[9]Sherr CJ, Roberts JM. Living with or without cyclins and cyclindependent kinases[J]. Genes Dev, 2004, 18(22):2699-2711.
[10]Poon RY. DNA damage checkpoints in nasopharyngeal carcinoma [J]. Oral Oncol, 2014, 50(5):339-344.
[11]Jacobson MD. Apoptosis:Bcl-2-related proteins get connected[J]. Curr Biol, 1997, 7(5):R277-R281.
[12]Xia GH, Chen BA, Lu HX,et al. Regulation of 2-methoxyestradiol-induced cell apoptosis by Mcl-1 and Bax genes in myelodisplastic syndrome[J]. J Exp Hema, 2009, 17(5):1246-1248. [夏国华, 陈宝安, 芦慧霞, 等. Mcl-1和Bax基因在2-甲氧基雌二醇诱导骨髓增生异常综合征细胞凋亡中的调控作用[J]. 中国实验血液学杂志, 2009, 17(5):1246-1248.]
[13]Wu YD, Chen Y, He J,et al. The study of the effect of curcumin on apoptosis-regulating protein Mcl-1, Bax and Bak in acute myeloid leukemia HL-60 cell line[J]. Act Univ Med Tongji, 2001, 30(1):25-27. [吴裕丹, 陈燕, 何静, 等. 姜黄素在急性髓性白血病HL-60细胞中对凋亡调控蛋白Bax、Bak、Mcl-1的影响[J]. 同济医科大学学报, 2001, 30(1):25-27.]
[14]Thornberry AF, Lazenbik Y. Caspases:enemies within[J]. Science, 1998, 281(5381):1312-1316.
Lapatinib induced cell cycle arrest and apoptosis in CNE-2Z cells
TU Yan-hong1, LI Na2, GAO Shi-xiu1, XIAO He2, SONG Ruo-hui1*1Department of Otorhinolaryngology, First Hospital Affiliated to Anhui University of Chinese Medicine, Hefei 230031, China
2Institute of Basic Medicine, Academy of Military Medical Sciences, Beijing 100850, China
*< class="emphasis_italic">Corresponding author, E-mail: song_0515@126.com
, E-mail: song_0515@126.com
This work was supported by the Fund of Anhui "Twelfth Five-Year" TCM Clinical Academic and Technological Lead Talents Training (2011-539)
ObjectiveTo explore the effect of lapatinib on the cell cycle and apoptosis of human CNE-2Z nasopharyngeal carcinoma (NPC) cells, and to study the related mechanisms. Methods CCK-8 assay was used to assess the proliferation of CNE-2Z cells treated by lapatinib. After PI staining, the cell cycle distribution was determined by flow cytometry. Apoptosis was analyzed using Annexin V/PI double binding assay. The mRNA expression of cell cycle related molecular Cyclin D1, P21 and P53 was assessed with real time PCR. The expression of protein Cyclin D1, P21, P53, and apoptosis related protein Mcl-1 and Bax was determined by Western blotting. The enzymatic activity of caspase-3/7 was measured by using Apo-ONE Homogeneous Caspase-3/7 Assay kit. Results Lapatinib inhibited the proliferation of CNE-2Z cells in a dose-dependent manner. Various concentrations of lapatinib induced significant G0/G1phase arrest and promoted apoptosis of CNE-2Z cells. Lapatinib significantly down-regulated Cyclin D1 expression, but up-regulated P21 and P53 expression at mRNA and protein levels. Lapatinib also induced down-regulation of Mcl-1 with up-regulation of Bax protein expression, and activated Caspase-3/7 in CNE-2Z cells. Conclusion Lapatinib may effectively inhibit proliferation, induce cell cycle arrest and promote apoptosis of CNE-2Z cells, so it may serve as a potent therapeutic agent against nasopharyngeal carcinoma.
lapatinib; nasopharyngeal carcinoma; cell cycle; apoptosis
R739.6
A
0577-7402(2015)07-0568-06
10.11855/j.issn.0577-7402.2015.07.11
2015-03-11;
2015-05-07)
(责任编辑:李恩江)
安徽省“十二五”中医临床学术和技术带头人才培养对象基金(2011-539)
屠彦红,医学硕士。主要从事鼻、咽喉疾病的中西医结合治疗
230031 合肥 安徽中医药大学第一附属医院耳鼻喉科(屠彦红、高士秀、宋若会);100850 北京 军事医学科学院基础医学研究所(李娜、肖鹤)
宋若会,E-mail:song_0515@126.com
