螺内酯对截肢创伤后大鼠肾损伤的防护作用及其机制
2015-06-28张颖张海峰任青爱谢晓华
张颖,张海峰,任青爱,谢晓华
螺内酯对截肢创伤后大鼠肾损伤的防护作用及其机制
张颖,张海峰,任青爱,谢晓华
目的探讨螺内酯对截肢后大鼠肾脏的保护作用及其可能机制。方法健康成年雄性Wistar大鼠42只,随机分为正常对照组,手术后6、24、48、72h组及螺内酯干预组,每组7只。测定血浆尿素氮(Ur)、肌酐(Cr)、髓过氧化物酶(MPO)、丙二醛(MDA)、白介素6(IL-6)、一氧化氮(NO)、血管紧张素Ⅱ(AngⅡ)、醛固酮(ALD)浓度及肾组织MPO、MDA、ALD含量和钙调神经磷酸酶(CaN)mRNA表达水平,光镜观察肾组织的形态学变化。结果截肢后6h大鼠肾组织出现损伤性变化;血浆Cr、AngⅡ、MDA、MPO、IL-6浓度及肾组织MDA、MPO含量升高,血浆及肾组织ALD水平在截肢后6h降低,随后升高;肾组织中CaN mRNA表达水平在截肢后明显升高。螺内酯干预后肾组织损伤有所减轻,血浆MPO、IL-6、AngⅡ浓度及肾组织MPO、ALD含量和CaN mRNA表达水平显著降低,血浆NO浓度显著升高,但血浆Cr、Ur、MDA、ALD浓度及肾组织MDA含量无明显变化。结论螺内酯对截肢后大鼠肾损伤具有保护作用,其机制可能与抑制醛固酮分泌、降低CaN mRNA的表达及活化,从而减少炎症因子的释放有关。
截肢术;急性肾损伤;钙神经素;螺内酯
螺内酯(spirolactone)又名安体舒通(antisterone),为非特异性的醛固酮拮抗剂,作为保钾利尿剂已广泛应用于临床。螺内酯可阻断肾素-血管紧张素-醛固酮系统(renin-angiotensinaldosteronesystem,RAAS)的部分作用,在高血压的治疗中具有很好的作用,近年来又发现其对减轻组织器官纤维化、改善肾功能具有积极作用[1]。有研究显示,慢性肾脏疾病患者加用螺内酯治疗后,血压未发生明显变化,而尿蛋白排泄率明显下降(约54%)[2],对糖尿病肾病患者的研究也得到了类似结果[3-4]。但螺内酯对于创伤导致的急性肾损伤有无保护作用鲜见文献报道。本研究通过建立截肢大鼠模型,探讨螺内酯对创伤后急性肾损伤的保护作用及其可能机制。
1 材料与方法
1.1 实验动物及分组 健康成年雄性Wistar大鼠42只,体重260~300g,购自解放军总医院实验动物中心,室温条件下标准饲料喂养。本实验符合动物伦理学要求。将大鼠随机分为正常对照组,手术后6、24、48、72h组及螺内酯干预组,每组7只。正常对照组:麻醉后迅速处死;手术后6、24、48、72h组分别在肢截肢术后6h、24h、48h、72h处死;螺内酯干预组大鼠在截肢前行螺内酯20mg/kg灌胃,1次/d,持续1周,术后6h处死。截肢模型的建立:大鼠以3%异戊巴比妥钠(80mg/kg)腹腔注射麻醉后,仰卧位固定,于左侧腹股沟处切开皮肤,游离股动静脉,结扎腹壁浅动静脉及其他分支血管,膝关节上方1.2~1.4cm处完全切断除股静、动脉以外的所有结构,缝扎止血,最后剪断股静、动脉,建立大鼠左后肢截肢模型。各组大鼠于相应时间点断头处死后开腹分离肾脏,取左肾组织约500mg,置冰冷生理盐水中清洗残存血液后待用。处死动物后,立即留取下腔静脉血,4℃下3000r/min离心6min,分离血浆待用。
1.2 主要仪器与实验材料 SYNERGY HT多功能酶标仪购自Bio-Tek公司,PCR仪购自Eppendorf公司,JY200电泳仪购自北京六一仪器厂,髓过氧化物酶(myeloperoxidase,MPO)、丙二醛(malondialdehyde,MDA)试剂盒购自南京建成生物工程研究所,PCR试剂盒购自天根生物科技公司。
1.3 方法
1.3.1 肾组织病理组织学检查 取大鼠左肾组织,以4%甲醛溶液固定后石蜡包理,连续5μm切片、烤片后二甲苯脱脂,梯度乙醇脱水,HE染色,常规脱水、透明、中性树脂封固,光学显微镜下观察并拍照。
1.3.2 血浆及肾脏MPO、MDA含量的测定 MPO含量测定采用比色法,MDA含量测定采用硫代巴比妥酸法,所用试剂盒购自南京建成生物工程研究所,具体操作按说明书进行。
1.3.3 血浆尿素氮(Ur)、肌酐(Cr)、白介素6(IL-6)、一氧化氮(NO)、血管紧张素Ⅱ(AngⅡ)、醛固酮(ALD)浓度及肾脏ALD含量的测定 血浆Ur、Cr浓度采用日立7600全自动生化分析仪进行测定,IL-6、NO、AngⅡ、ALD浓度采用放免法测定(委托解放军总医院东亚放免所完成)。
1.3.4 肾脏钙调神经磷酸酶(calcineurin,CaN)mRNA表达水平的检测 采用RT-PCR法测定肾脏CnAα mRNA的含量。首先提取肾组织mRNA,然后进行RNA鉴定,反转录合成cDNA,使用软件Primer 5.0设计CnAα(CnAα为CaN催化亚单位的一种主要同工酶,仅分布于肾小管)特异性引物,序列如下:CnAα正义5'-GAAGGCAGGCTGGAAGAAAGTGTC-3',反义5'-GAAGGCAGTCGAAGGCATCCATA-3',扩增产物大小400bp;内参照β-actin正义5'-CTATCGGCAATGAGC GGTTC-3',反义5'-CTTAGGAGTTGGGGGTGGCT-3',扩增产物大小762bp。
1.4 统计学处理 采用SPSS 12.0软件进行统计分析,计量资料以表示,多组间比较采用方差分析,进一步两两比较采用LSD-t检验,P<0.05为差异有统计学意义。

图1 截肢后大鼠肾脏的病理变化(HE×200)Fig. 1 Pathological changes of kidney tissue in rats after amputation (HE×200)A. Normal control group; B. 6h after amputation group; C. Spirolactone intervention group
2 结 果
2.1 截肢后大鼠肾脏结构的变化 光镜观察显示,截肢后大鼠出现不同程度的肾组织损伤,主要包括肾小球、肾间质充血,肾小球、肾小管上皮细胞肿胀,肾间质伴有少量炎性细胞浸润,螺内酯干预后肾组织损伤略有减轻(图1)。
2.2 截肢后大鼠血浆各检测指标的变化及螺内酯的影响 与正常对照组比较,大鼠血浆Cr在截肢后24h明显升高,72h达峰值,而Ur在截肢后各时间点无明显变化;AngⅡ在截肢后6h明显升高(P<0.05),此后开始下降,72h降至基本正常;ALD在截肢后6h明显降低(P<0.05),截肢后24h开始显著升高(P<0.05),到72h呈持续性升高(P<0.05);MPO在截肢后6h明显升高(P<0.01),此后逐渐降低,至72h恢复至正常对照组水平;MDA在截肢后6h明显升高(P<0.01),此后逐渐降低,至72h仍高于正常对照组(P<0.05);IL-6在截肢后6h明显升高(P<0.01),此后逐渐下降,至72h降至正常对照组水平;NO在截肢后6h明显降低(P<0.05),截肢后24h恢复至正常对照组水平(P>0.05)。与截肢后6h后比较,螺内酯干预后血浆Cr、Ur、ALD、MDA无明显变化,而AngⅡ、MPO、IL-6明显降低(P<0.05,P<0.01),NO明显升高(P<0.01,表1)。
表1 截肢后大鼠血浆各检测指标的变化(±s,n=7)Tab. 1 Changes of plasma indexes in rats after amputation (±s,n=7)
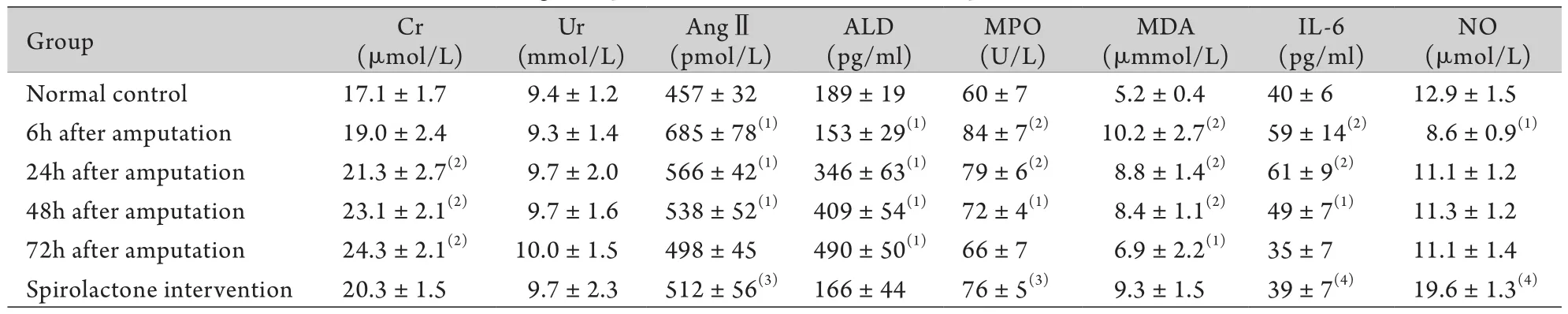
表1 截肢后大鼠血浆各检测指标的变化(±s,n=7)Tab. 1 Changes of plasma indexes in rats after amputation (±s,n=7)
(1)P<0.05, (2)P<0.01 compared with normal control; (3)P<0.05, (4)P<0.01 compared with 6h after amputation group
Group Cr (μmol/L) Ur (mmol/L) AngⅡ(pmol/L) ALD (pg/ml) MPO (U/L) MDA (μmmol/L) IL-6 (pg/ml) NO (μmol/L) Normal control 17.1±1.7 9.4±1.2 457±32 189±19 60±7 5.2±0.4 40±6 12.9±1.5 6h after amputation 19.0±2.4 9.3±1.4 685±78(1) 153±29(1) 84±7(2) 10.2±2.7(2) 59±14(2) 8.6±0.9(1)24h after amputation 21.3±2.7(2) 9.7±2.0 566±42(1) 346±63(1) 79±6(2) 8.8±1.4(2) 61±9(2) 11.1±1.2 48h after amputation 23.1±2.1(2) 9.7±1.6 538±52(1) 409±54(1) 72±4(1) 8.4±1.1(2) 49±7(1) 11.3±1.2 72h after amputation 24.3±2.1(2) 10.0±1.5 498±45 490±50(1) 66±7 6.9±2.2(1) 35±7 11.1±1.4 Spirolactone intervention 20.3±1.5 9.7±2.3 512±56(3) 166±44 76±5(3) 9.3±1.5 39±7(4) 19.6±1.3(4)
2.3 截肢后大鼠肾组织MPO、MDA、ALD含量和CaN mRNA表达水平的变化及螺内酯的影响 与正常对照组比较,肾组织MPO在截肢后6h明显升高(P<0.01),此后逐渐降低,至72h恢复至正常对照组水平;MDA在截肢后6h明显升高(P<0.01),此后逐渐降低,至72h已降至正常对照组水平(P>0.05);ALD在截肢后6h明显降低(P<0.05),截肢后24h开始显著升高(P<0.05),到72h呈持续性升高(P<0.05);肾组织CnAα mRNA表达水平在截肢后6h明显升高(P<0.01),此后逐渐下降,至72h降至正常对照组水平(P>0.05)。与截肢后6h后比较,螺内酯干预后肾组织MDA含量无明显变化,MPO含量及CaN mRNA表达水平明显降低(P<0.05,P<0.01),ALD含量明显升高(P<0.01,表2)。
表2 截肢后大鼠肾组织MPO、MDA、ALD含量和CaN mRNA表达水平的变化(±s,n=7)Tab. 2 Changes of MPO,MDA, ALD contents and CaN mRNA levels in rats after amputation (±s,n=7)
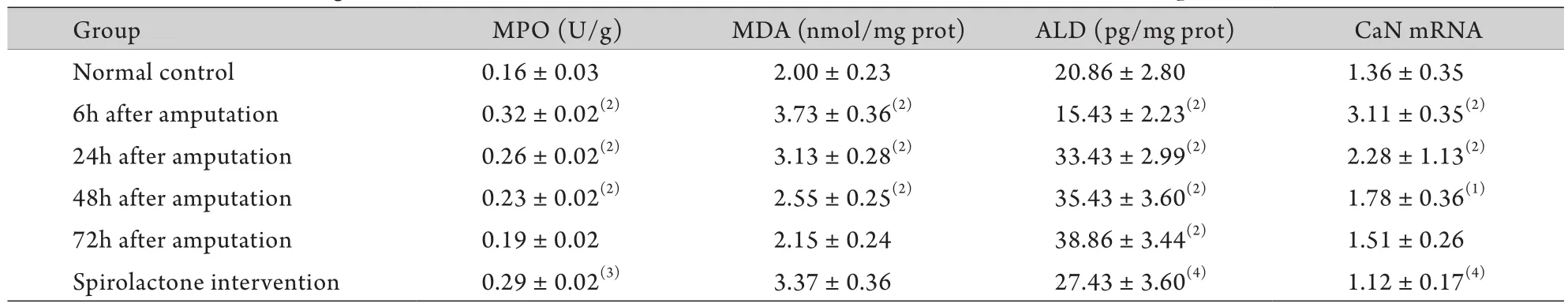
表2 截肢后大鼠肾组织MPO、MDA、ALD含量和CaN mRNA表达水平的变化(±s,n=7)Tab. 2 Changes of MPO,MDA, ALD contents and CaN mRNA levels in rats after amputation (±s,n=7)
(1)P<0.05, (2)P<0.01 compared with normal control; (3)P<0.05, (4)P<0.01 compared with 6h after amputation group
Group MPO (U/g) MDA (nmol/mg prot) ALD (pg/mg prot) CaN mRNA Normal control 0.16±0.03 2.00±0.23 20.86±2.80 1.36±0.35 6h after amputation 0.32±0.02(2) 3.73±0.36(2) 15.43±2.23(2) 3.11±0.35(2)24h after amputation 0.26±0.02(2) 3.13±0.28(2) 33.43±2.99(2) 2.28±1.13(2)48h after amputation 0.23±0.02(2) 2.55±0.25(2) 35.43±3.60(2) 1.78±0.36(1)72h after amputation 0.19±0.02 2.15±0.24 38.86±3.44(2) 1.51±0.26 Spirolactone intervention 0.29±0.02(3) 3.37±0.36 27.43±3.60(4) 1.12±0.17(4)
3 讨 论
研究证实,在创伤、烧伤、手术等应激条件下体内可发生炎症反应,释放大量炎性介质,如IL-1、IL-6、NO、肿瘤坏死因子(TNF-α)、急性期反应蛋白(ARP)等,导致各类炎症细胞聚集、增多,最终可使促炎介质和抗炎介质失去平衡,引起一系列连锁反应或瀑布效应即全身炎症反应综合征(systemic inflammatory response syndrome,SIRS),从而导致多个脏器功能受损甚至多器官衰竭[5-6]。高容量血液滤过(HVHF)可清除炎症介质,改善单核细胞及内皮细胞功能[7-8],阻断心脏手术后急性肾损伤(AKI)合并多器官功能衰竭(multiple organ failure,MOF)患者由SIRS向MOF方向发展,降低患者死亡率,尤其是早期应用该治疗者效果明显[9-10]。本研究发现截肢后大鼠血浆及肾组织IL-6、MDA、MPO明显升高,推测炎症反应在截肢创伤导致肾损伤的病理生理过程中起着重要作用,此外还发现血浆ALD浓度虽然在截肢后出现短暂降低,但很快升高,因此考虑RASS系统激活同样是导致急性肾损伤的机制之一。已有研究证实ALD可通过导致肾小球纤维化、体内活性氧簇(reactive oxygen species,ROS)增多、促发炎症因子释放等引起肾脏损伤,而醛固酮受体拮抗剂螺内酯具有抗炎、降低氧化应激水平的作用[11-14]。本研究结果显示螺内酯干预组IL-6、MPO水平显著降低,但Cr、MDA并无明显改变,可能与使用剂量较小、时间较短及肾脏损伤较轻有关。
本研究发现截肢后大鼠肾脏CnAα mRNA表达明显增强,提示该信号通路可能也参与了截肢导致的肾脏损伤机制。CaN属丝/苏氨酸蛋白磷酸酶(又称蛋白磷酸酶2B,PP2B)家族,是迄今发现的唯一受Ca2+/钙调素(CaM)调节的丝/苏氨酸蛋白磷酸酶。人体内的CaN由一个催化亚单位(CnA)和一个调节亚单位(CnB)组成,CnA有三种主要的同工酶:CnAα、CnAβ、CnAγ。CnAα和CnAβ呈特征性分布,前者仅分布于肾小管,而后者分布于肾小球。目前认为CaN是一种广泛分布的、参与多种细胞功能调节的多功能信号酶,在T细胞活化中起着调节枢纽的作用[15],可调节IL-2、IL-4及CD40L等基因的表达。此外有研究发现CaN的活化可调节β趋化因子(regulated upon on activation on normal T cell expressed and secreted,RANTES)的表达,而RANTES可激活T淋巴细胞,导致炎症因子的释放,进而加重肾脏损伤[16],还有学者发现IL-4及CD40-CD40L共刺激信号可通过活化肾小管上皮细胞CaN,调控RANTES的基因表达、分泌及合成,因此考虑CaN的活化可能参与了肾小管上皮细胞的炎症过程[17]。本研究发现螺内酯干预可下调CnAα基因的表达,提示螺内酯抑制CaN的活化可能是其减轻肾脏损伤的机制之一。
综上所述,本研究结果表明,截肢创伤可引起全身应激反应,激活RAAS系统、活化CaN、释放大量炎症因子而导致肾脏损伤,螺内酯可明显抑制RAAS系统、CaN的活化并减少炎症因子的释放,RAAS系统与CaN可能存在某种关联机制。既往有研究发现内源性醛固酮可通过激活CaN信号传导通路而参与肾性高血压大鼠靶器官的损伤[18],螺内酯可通过抑制CaN的活性,减轻肾性高血压大鼠的心肌肥大[19]。因此推测螺内酯可能通过抑制ALD,下调CaN基因的表达与活化,减少炎症因子释放,进而对肾脏起保护作用,但其具体机制仍有待进一步深入研究。
[1]Trachtman H, Weiser AC, Valderrama E,et al. Prevention of renal fibrosis by spironolactone in mice with complete unilateral ureteral obstruction[J]. J Urol, 2004, 172:1590-1594.
[2]Chrysostomou A, Becher G, Spironolactone in addition to ACE inhibition to reduce proteinuria in patients with chronic renal disease[J]. N Engl J Med, 2001, 345(12):925-926.
[3]Sato A, Hayashi K, Saruta T. Antiproteinuric effects of mineralocorticoid receptor blockade in patients with chronic renal disease[J]. Am J Hypertens, 2005, 18(1):44-49.
[4]Van den Meiracker AH, Baggen RG, Pauli S,et al. Spironolactone in type 2 diabetic nephropathy:effects on proteinuria, blood pressure and renal function[J]. J Hypertens, 2006, 24(11):2285-2292.
[5]Papanicolaon DA, Wilder RL, Manolagas SC,et al. The pathophysiologic roles of interlenkin-6 in humans[J]. Ann Intern Med, 1998, 128(2):127-137.
[6]Xu Y, Li J, Cao BP,et al. Analysis on prognosis of systemic inflammatory response syndrome in patients with early treatment of β-blocker[J]. Chin J Pract Intern Med, 2014, 34(3):292-294.[徐钰, 李佳, 曹宝平, 等. 早期使用β受体阻滞剂治疗肺部感染全身炎症反应综合征预后分析[J]. 中国实用内科杂志, 2014, 34(3):292-294.]
[7]Chen ZH, Liu ZH, Yu C,et al. Endothelial dysfunction in patientswith severe acute pancreatitis:Improved by continuous blood purification therapy[J]. Int J Artif Organs, 2007, 30(5):393-400.
[8]Liu ZH. State-of-the-art technocology in blood purification at present[J]. Med J Chin PLA, 2011, 36(2):99-103. [刘志红. 血液净化技术新进展与发展设想[J]. 解放军医学杂志, 2011, 36(2):99-103.]
[9]Lugones F, Chiotti G, CarrierM,et al. Continuous renal replacement therapy after cardiac surgery[J]. Blood Purif, 2004, 22(3):249-251.
[10]Tao J, Ji DX, Gong DH,et al. Effects of high volume hemofiltration on acute kidney injury in patients with cardiotomy[J]. J Nephrol Dialy Transplant, 2007, 16(3):245-250.[陶静, 季大玺, 龚德华, 等. 高容量血液滤过治疗心脏手术后急性肾损伤的疗效观察[J]. 肾脏病与透析肾移植杂志, 2007, 16(3):245-250.]
[11]Yuan J, Jia R, Bao Y. Aldosterone up-regulates production of plasminogen activator inhibitor-1 by renal mesangial cell[J]. J Biochem Mol Biol, 2007, 40(2):180-188.
[12]Renke M, Tylicki L, Knap N,et al. Spironolactone attenuates oxidative stress in patients with chronic kidney disease [J]. Hypertension, 2008, 52(5):e132-e133.
[13]Yuan J, Jia RH, Bao Y,et al. Spironolactone ameliorates glomerular injury in streptozocin-induced diabetic[J]. Chin J Nephrol, 2007, 23(8):524-528.[袁军, 贾汝汉, 包艳, 等. 螺内酯对糖尿病大鼠肾小球保护作用的机制探讨[J]. 中华肾脏病杂志, 2007, 23(8):524-528.]
[14]Takebayashi K, Matsumoto S, Aso Y,et al. Aldosterone blockade attenuates urinary monocyte chemoattractant protein-1 and oxidative stress in patients with type 2 diabetes complicated by diabetic nephropathy [J]. J Clin Endocrinol Metab, 2006, 91(6):2214-2217.
[15]Klee CB, Ren H, Wang X. Regulation of the calmodulin stimulated protein phosphatase, calcineurin[J]. J Biol Chem, 1998, 273(22):13367-13370.
[16]Dechers JG, Van Der Woude FJ, Ven Der Kooij SW,et al. Synergistic effect of IL-1, IFN-γ and TNF-α on RANTES production by human renal tubular epithelial cellsin vitro[J]. J Am Soc Nephrol, 1998, 9(2):194-202.
[17]Liang M, Yang X, Xu YW,et al. Relationship between the activation of CaN and the synthesis of RANTES in murine tubular epithelial cell stimulated by IL-4 and CD40mAb[J]. Chin J Nephrol, 2004, 20(4):277-281.[梁鸣, 阳晓, 许元文, 等. 白介素4及CD40抗体作用下肾小管上皮细胞钙调磷酸酶活性及其与RANTES分泌的关系[J]. 中华肾脏病杂志, 2004, 20(4):277-281.]
[18]Chen W, Xie XH, Chang LQ,et al. Alteration of tissue calcineurin activity mediated by aldosterone in target organs of renal hypertensive rats[J]. Chin J Mod Med, 2004, 14(17):58-61.[陈雯, 谢晓华, 常连庆, 等. 醛固酮介导的肾性高血压相关靶器官组织钙调神经磷酸酶活性的变化[J]. 中国现代医学杂志, 2004, 14(17):58-61.]
[19]Chang LQ, Xie XH, Chen WZ,et al. The study of spironolactone against calcineurin- dependent cardiac hypertrophy in renal hypertension rats[J]. Chin J Cardiol, 2004, 32(Suppl):81-84.[常连庆, 谢晓华, 陈雯主, 等. 螺内酯抗CaN依赖的肾性高血压大鼠心肌肥大的研究[J]. 中华心血管病杂志, 2004, 32(Suppl):81-84.]
Protective effect of spirolactone on kidney damage in rats after amputation and its mechanism
ZHANG Ying, ZHANG Hai-feng, REN Qing-ai, XIE Xiao-hua*
Surgery Department of South Building, General Hospital of PLA, Beijing 100853, China
*< class="emphasis_italic">Corresponding author, E-mail: n4xxh@126.com
, E-mail: n4xxh@126.com
This work was supported by the “Twelfth Five-Year Plan” Key Scientific Research Foundation of PLA (BWS12J051)
ObjectiveTo explore the protective effect and its possible mechanism of spirolactone against kidney injury in rats after amputation.MethodsForty-two male Wistar rats were randomly divided into 6 groups:normal control, 6 hours, 24 hours, 48 hours, 72 hours after the operation and spirolactone intervention groups (n=7, each). Plasma angiotensin Ⅱ (Ang Ⅱ), aldosterone (ALD), myeloperoxidase (MPO), malondialdehyde (MDA), interleukin-6 (IL-6), nitric oxide (NO), urea nitrogen (Ur), creatinine (Cr) concentration and renal tissue ALD, MPO, MDA and calcineurin (CaN) mRNA levels were determined. Renal pathological changes were observed by light microscopy.ResultsAt 6h after amputation, traumatic changes in rat kidney tissue were seen, and the levels of Cr, AngⅡ, MDA, MPO, IL-6 and CaN-mRNA were significantly elevated, while NO concentration was significantly lowered. Spirolactone intervention reduced the damage of kidney tissue, and the levels of MPO, IL-6, Ang Ⅱ in plasman, contents of MPO and ALD and expression level of CaN mRNA in kidney tissue were significantly lowered, but the levels of Cr, Ur, MDA and ALD in plasma and content of MDA in kidney tissue showed no significant change.ConclusionSpirolactone can provide protective effect against renal damage in rats after amputation, and it may be related to the mechanism that spirolactone inhibits secretion of ALD and lowers the expression and activation of CaN mRNA, thus reducing the release of pro-inflammatory factors.
amputation; acute kidney injury; calcineurin; spirolactone
R687.5
A
0577-7402(2015)07-0564-04
10.11855/j.issn.0577-7402.2015.07.10
2015-01-17;
2015-06-22)
(责任编辑:胡全兵)
军队“十二五”重点科研课题(BWS12J051)
张颖,主治医师,硕士研究生。主要从事围术期器官损伤与防护方面的研究
100853 北京 解放军总医院南楼综合外科(张颖、张海峰、任青爱、谢晓华)
谢晓华,E-mail:n4xxh@126.com
