高相对分子质量多环芳烃的生物共代谢降解
2015-06-28顾贵洲赵朝成赵东风
李 政, 顾贵洲, 赵朝成, 赵东风, 杨 磊
(1. 辽宁石油化工大学 化学化工与环境学部, 辽宁 抚顺 113001; 2. 中国石油大学 化学工程学院, 山东 青岛 266555)
高相对分子质量多环芳烃的生物共代谢降解
李 政1, 顾贵洲1, 赵朝成2, 赵东风2, 杨 磊1
(1. 辽宁石油化工大学 化学化工与环境学部, 辽宁 抚顺 113001; 2. 中国石油大学 化学工程学院, 山东 青岛 266555)
为了研究高相对分子质量多环芳烃(PAHs)芘的生物共代谢降解,考察了低相对分子质量PAHs芴和菲的加入对芘产生的影响,并采用GC-MS测定了生物降解后代谢产物的组成。结果表明,单一PAHs的生物降解中,芴在培养的第5 d已被完全降解,生成5种代谢产物,菲在第7 d降解率达到98.93%,生成10种代谢产物,芘在第9 d时降解率仅为65.73%,生成较多代谢产物,其中6种可基本定性; 3种PAHs混合降解时,芴、菲和芘分别在第3 d、5 d和8 d完全被除去,共产生8种代谢产物,其中芘在第8 d时只产生了3种代谢产物。芴和菲的存在不仅促进了芘的完全快速降解,而且能够促进芘代谢产物的去除,芘的存在也促进了芴和菲的降解和代谢产物的去除。
多环芳烃;共代谢;生物降解
多环芳烃(Polycyclic aromatic hydrocarbons,PAHs)是由2个或2个以上芳香环稠合在一起的一类化合物[1],主要来源于石油污染、油轮泄漏、汽车尾气,以及煤、石油等天然燃料的不完全燃烧等。由于部分PAHs对生物具有“三致”作用,美国环境保护署将其中16种确定为优先控制的有机污染物[2]。PAHs在环境中的去除途径包括挥发、光氧化、化学氧化、生物积累、土壤吸附、浸滤作用、微生物降解等,其中,微生物降解占有重要地位[3]。PAHs的微生物降解有2种方式[4]。一是4个苯环以下的低相对分子质量PAHs被作为唯一的碳源和能源而完全矿化;二是4个苯环及以上高相对分子质量PAHs被微生物以共代谢的方式降解[5]。所谓的共代谢作用,就是在外加碳源情况下,难生物降解污染物有可能被微生物转化,甚至完全降解[6]。共代谢作用由微生物细胞分泌的关键酶决定,与被降解底物的结构有着密切关系[7]。为了提高目标污染物降解性能,投加它的类似物,利用类似物诱导细胞酶的产生,提高酶活性,促进目标污染物的降解[8]。近年来,为了有效提高PAHs的降解,共代谢被广泛应用在PAHs污染的生物修复中,共代谢机理的研究逐渐成为目前PAHs降解研究的热点之一。但由于共代谢过程涉及到许多因素以及因素间的相互作用[6],其相关研究并不深入,有些解释还是假设性质的,有待于进一步探索。笔者通过考察低相对分子质量PAHs芴和菲的加入对高相对分子质量PAHs芘产生的影响,运用GC-MS测定单一PAHs生物降解和混合PAHs降解的降解速率和代谢产物组成的变化,来研究高相对分子质量PAHs的生物共代谢降解过程,为共代谢机理的研究提供参考。
1 实验部分
1.1 材料和试剂
1.1.1 试剂
芴、菲、芘(质量分数98.7%),美国Supelco公司产品;磷酸氢二钠(Na2HPO4)、磷酸二氢钾(KH2PO4)、硝酸钠(NaNO3)、硫酸镁(MgSO4)、氯化钙(CaCl2)、硫酸亚铁(FeSO4)、无水硫酸钠、丙酮、环己烷,均为分析纯,国药集团化学试剂有限公司产品;酵母粉,国药集团化学试剂有限公司产品。
1.1.2 无机盐培养基(MSM)
分别将0.6 g Na2HPO4、0.2 g KH2PO4、4.0 g NaNO3、0.3 g MgSO4、0.01 g CaCl2、0.01 g FeSO4和0.5 g 酵母粉按顺序逐一溶解,用蒸馏水定容至1000 mL。
1.1.3 菌源
从新疆克拉玛依油田黑油山公园的油泥中分离得到一组石油降解菌群。该菌群包含12株可分离培养的单菌,来自假单胞菌属(Pseudomonassp.)、动杆菌属(Acinetobactersp.)、节杆菌属(Arthrobactersp.)、红球菌属(Rhodococcussp.)、芽孢杆菌属(Bacillussp.)和苍白杆菌属(Ochrobactrumsp.)6个不同的菌属。在无菌条件下制备石油降解菌群的菌悬液,最终使液体中菌含量为1.0×108CFU/mL。
1.2 单一PAHs的降解
取10 mg芴完全溶解于丙酮中,加入100 mL已灭菌的MSM,最终使芴质量浓度为100 mg/L。置于摇床中过夜使丙酮挥发完全,接种1%(体积分数)菌悬液,然后于30℃、转速160 r/min的摇床中避光振荡培养,在第3、5、7、9 d分别取样测定。试验设3个平行样品,同时设不接种菌悬液的对照样品。菲和芘的降解方法同上。
1.3 混合PAHs的降解
分别取10 mg芴、菲、芘完全溶解于丙酮中,加入100 mL已灭菌的MSM,最终使混合PAHs中每种PAHs质量浓度为100 mg/L,具体降解方法同1.2节。
1.4 降解菌降解多环芳烃的紫外光度分析
待测样品经10000 r/min转速离心除去菌体,用环己烷萃取上清液中的多环芳烃。萃取3遍,合并萃取液,并用无水硫酸钠脱水,定容至10 mL。用紫外分光光度计测其吸光度。从标准曲线得到降解后芴、菲、芘的质量浓度。
1.5 降解菌降解PAHs的中间代谢产物分析
采用Agilent5975气相色谱-质谱联用仪分析PAHs降解中间产物。色谱仪进样口温度290℃;接口温度290℃;色谱柱DB-5(30 m×0.25 mm×0.25 μm); 60℃保持2 min,以6℃/min升到270℃,保持20 min;氦气作载气,流速1.10 mL/min,压力65.2 kPa;不分流进样。质谱仪离子源温度为200℃,溶剂延迟时间6 min,检测器电压1 kV,电子轰击源(EI),电离电压70 eV。
2 结果与讨论
2.1 单一多环芳烃的生物降解率和降解产物
2.1.1 单一多环芳烃的生物降解率
对降解菌分别降解质量浓度为100 mg/L的芴、菲和芘进行了紫外光度法分析,其降解率随培养时间的变化示于图1。由图1可以看出,降解菌对芴的降解效果最好,降解率也最高,在培养的第5 d,芴已经被完全降解(降解率为100%);对菲的降解效果也很好,在第7 d降解率达到98.93%;对芘的降解效果最差,第9 d时降解率仅为65.73%。由此可见,随着PAHs苯环数的增加,降解菌对其降解效率逐渐下降,这主要是因为高相对分子质量PAHs分子结构复杂,稳定性高,疏水性强,水溶性低,生物可利用性低,对微生物的毒性大,难以被微生物利用。
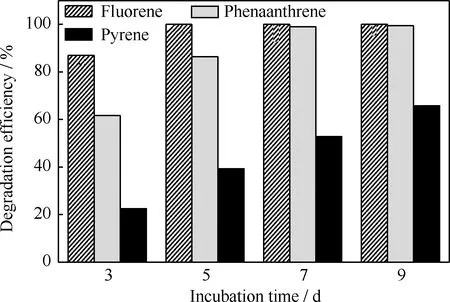
图1 微生物降解单一多环芳烃的降解率随培养时间的变化
2.1.2 芴的微生物降解产物
芴降解中间产物的GC-MS总离子流色谱如图2所示。经质谱数据系统检索并结合人工谱图解析,对相对丰度较高并且能够基本定性的色谱峰进行了鉴定。由图2可知,芴降解后产生5种可基本确定的代谢物。峰2为9-芴酮(9-Fluorenone),峰3、4和5的保留时间不同,但是具有相同的质谱离子(质荷比为254、239、165、73),说明是羟基取代位置不同的单羟基芴[9],分别为9-羟基芴(9- Hydroxy fluorene)、1-羟基芴(1- Hydroxy fluorene)和3-羟基芴(3- Hydroxy fluorene)。峰6是4-羟基-9-芴酮(4- Hydroxy-9- fluorenone)。
2.1.3 菲的微生物降解产物
菲降解中间产物的GC-MS总离子流色谱如图3所示。由图3可知,菲降解后产生10种可基本确定的代谢物,有峰1的水杨酸(Salicylic acid)、峰2的邻苯二甲酸(Phthalic acid)、峰3的二羟基萘(Dihydroxynaphthalene)、峰5的1-羟基-2-萘酸(1- Hydroxy-2- naphthalene)、峰6的7, 8-苯并香豆素(7, 8- Benzo coumarin)。此外,峰7、8分别鉴定为3-羟基菲(3-Hydroxyphenanthrene)和1-羟基菲(1-Hydroxyphenanthrene),峰9(Dihydroxyphenanthrene)、峰10(DihydroxyphenanthreneⅡ)和峰11(Dihydroxyphenanthrene Ⅲ)是羟基取代位置不同的二羟基菲(保留时间不同,但是有相同的质荷比354、339、266、236、73)[10]。
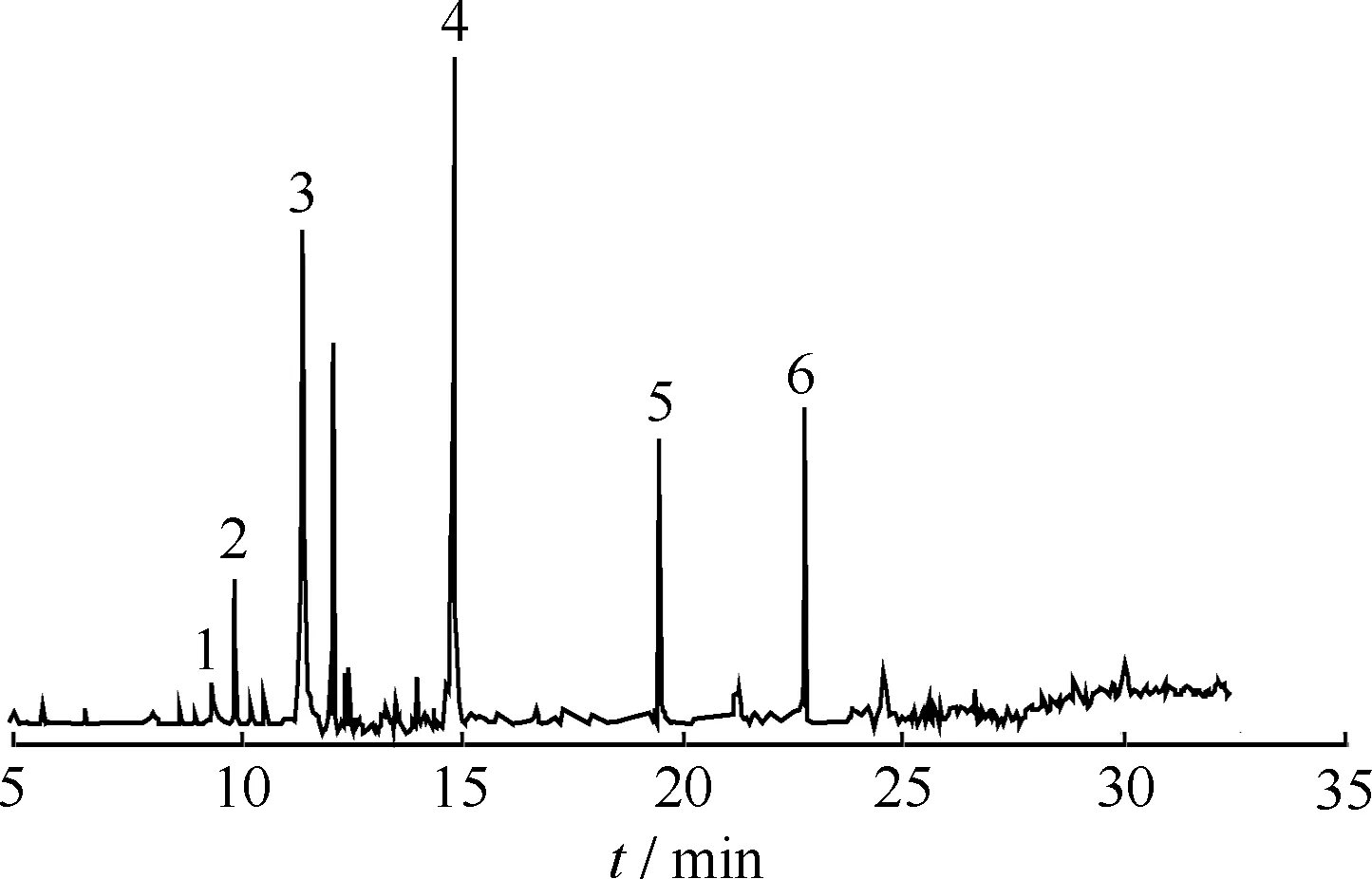
图2 芴降解中间产物GC-MS总离子流色谱图

图3 菲降解中间产物GC-MS总离子流色谱图
2.1.4 芘的微生物降解产物分析及其代谢途径的推导
芘降解中间产物的GC-MS总离子流色谱图如图4所示。由图4可知,芘降解后产生较多代谢物,有6种可基本定性。峰2和峰3分别确定为4-羟基菲(4-Hydroxyphenanthrene)和4-菲羧酸(4- Phenanthrene carboxylic acid),峰4为1-羟基芘(1-Hydroxypyrene),峰5为3, 4-二羟基菲(DihydroxyphenanthreneⅠ)。此外,存在2种羟基取代位置不同的二羟基芘(保留时间不同,但质荷比相同378、290、260、73)[11-13],即峰6(DihydroxypyreneⅠ)和峰7(DihydroxypyreneⅡ)。

图4 芘降解中间产物GC-MS总离子流色谱图
2.2 混合多环芳烃的共代谢降解
混合PAHs中每种组分的降解效果如图5所示。由图5可知,经过8 d的培养,3种PAHs均得到完全的降解,其中芴在第3 d时就已经完全去除,菲在第5 d时得到全部降解,较单一芴和单一菲为底物时降解效果更优(见图1)。同时,芴和菲的存在促进了芘的降解,在培养的第8 d已经得到完全去除,而单一芘为底物时在培养的第9 d降解率仅为65.73%(见图1)。可见,容易被微生物利用的芴和菲促进了难降解芘的共代谢降解,增强了降解菌降解芘的能力,同时芴和菲的降解也没有因为芘的存在受到负面影响。
混合PAHs降解中间产物的GC-MS总离子流色谱图如图6所示。由图6可知,混合PAHs降解后产生8种可基本确定的代谢物。其中峰5的4-羟基-9-芴酮(4- Hydroxy -9- fluorenone)为芴的代谢产物,峰1的水杨酸(Salicylic acid)、峰2的邻苯二甲酸(Phthalic acid)、峰3的1-羟基-2-萘酸(1- Hydroxy -2- naphthalene acid)和峰7的二羟基菲Ⅱ(DihydroxyphenanthreneⅡ)在单一菲的降解产物中存在,峰6的二羟基菲Ⅰ(DihydroxyphenanthreneⅠ)在单一菲和单一芘的代谢产物中均出现过,峰4的4-羟基菲(4-Hydroxyphenanthrene)和峰8的二羟基芘(DihydroxypyreneⅡ)在单一芘的降解产物中存在。而当芴、菲和芘单独降解时,分别产生5种、10种和6种代谢物,可见,3种PAHs混合降解有利于代谢产物的去除。
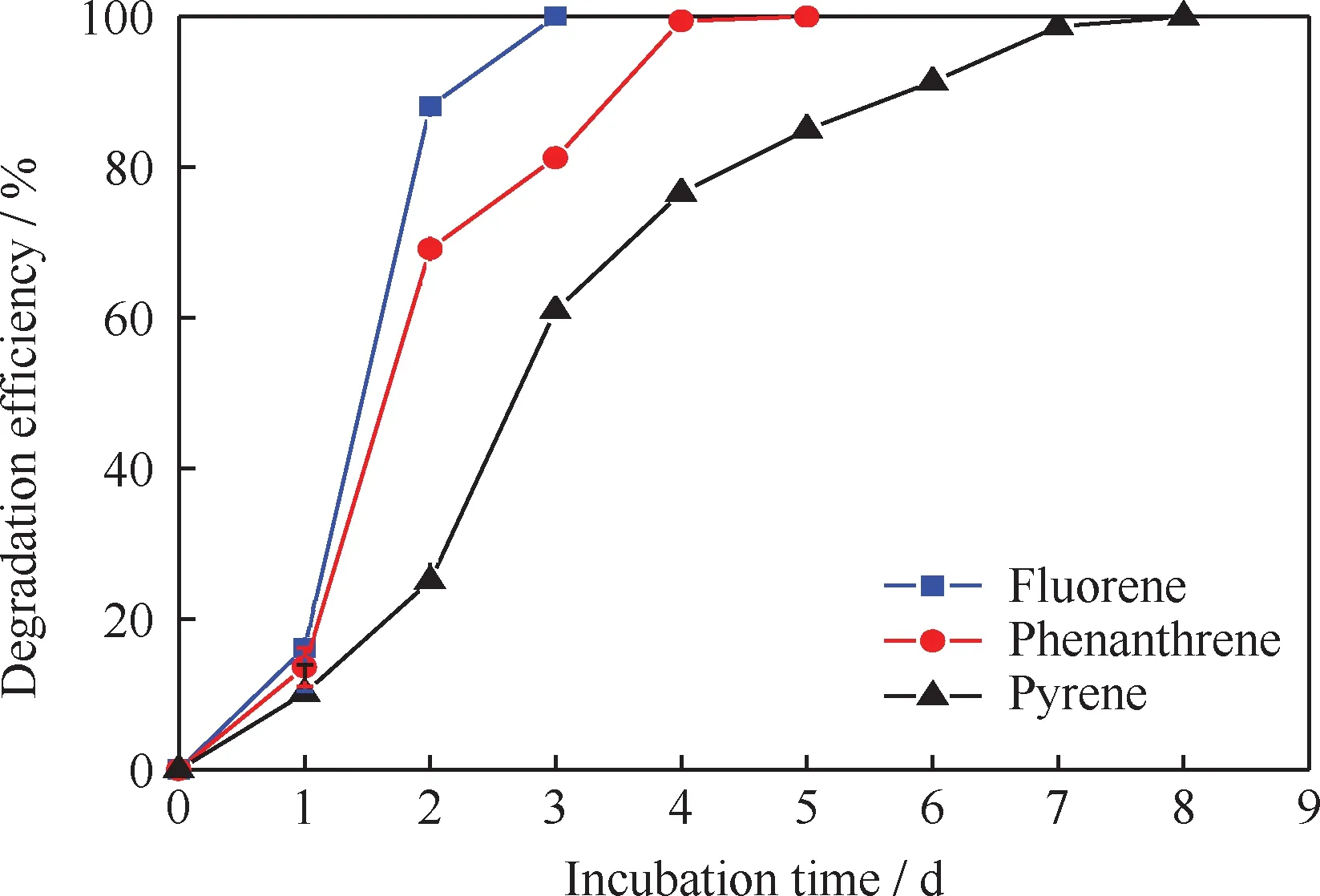
图5 混合PAHs中每种PAHs的降解率随培养时间的变化
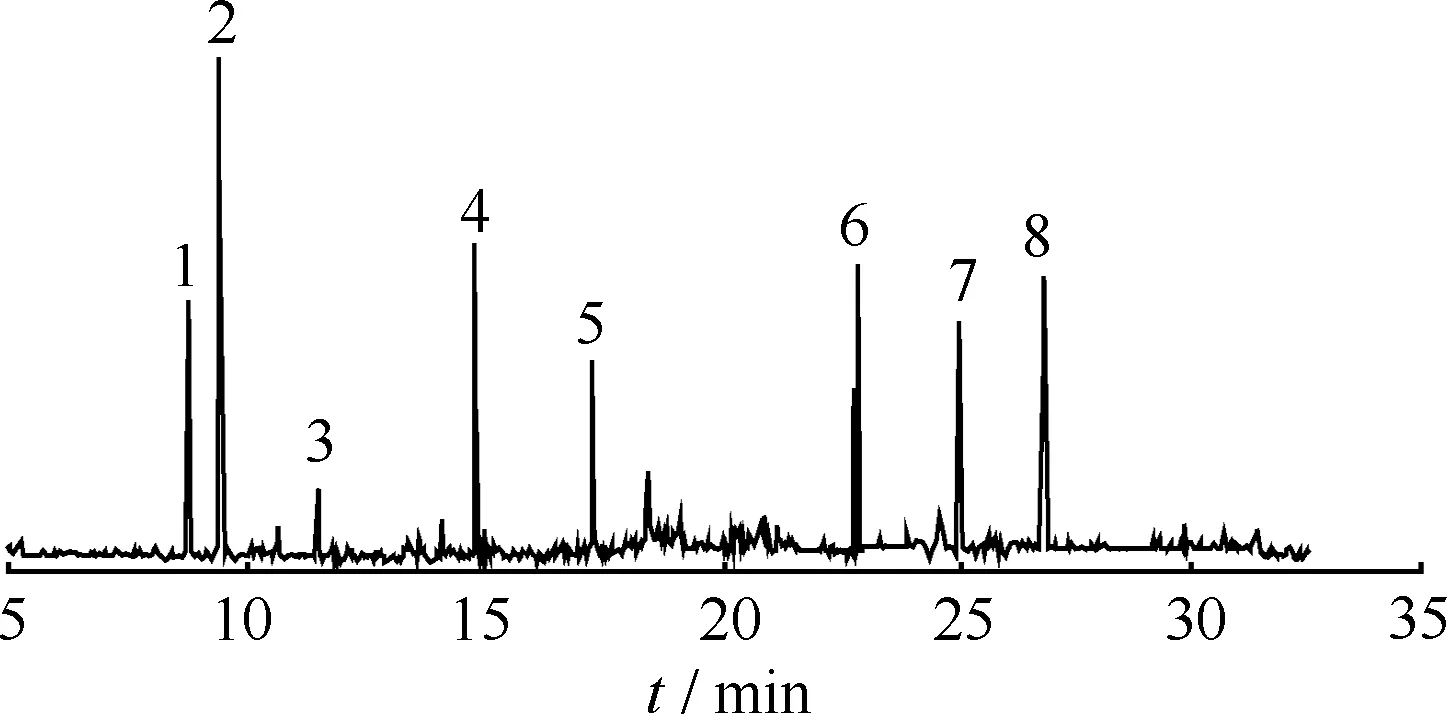
图6 混合多环芳烃降解中间产物的GC-MS总离子流色谱图
为进一步考察芴和菲的存在对芘降解产生的影响,将芘单独降解的代谢产物与混合降解时产生的代谢产物峰面积进行对比,结果示于图7。由图7可知,当芘单独降解时,经过9 d的培养检测到6种代谢产物,包括初始氧化产物(二羟基芘Ⅰ、二羟基芘Ⅱ和1-羟基芘)和环裂解产物(4-菲羧酸和4-羟基菲),其中初始氧化产物含量较大;而当芴和菲存在时,芘在第8 d时只产生了3种代谢产物,初始氧化产物二羟基芘Ⅰ和1-羟基芘已经检测不到,二羟基芘Ⅱ峰面积减少,环裂解产物4-羟基芘峰面积有所增加。微生物利用不同的碳源作为生长基质共代谢芘时会诱导出不同的酶系[14],因此,芴和菲的加入有可能诱导出新的降解芘及其代谢产物的酶系。此外,芴和菲较容易被微生物利用,能支持降解菌的快速增殖,从而分泌更多的降解酶来促进芘和芘的代谢产物的降解,通过增大生物量来促进难降解物的转化[15]。总之,芴和菲的存在不仅促进了芘的完全快速降解,而且能够促进芘代谢产物的去除,并且芘的存在也促进了芴和菲的降解和代谢产物的去除。

图7 芘单独降解9 d与混合降解8 d时降解中间产物峰面积对比
3 结 论
(1) 单一多环芳烃的生物降解中,芴的降解效果最好,降解率也最高,在培养的第5 d,芴已经被完全降解,有5种代谢产物生成;菲的降解效果也很好,在第7 d降解率达到98.93%,生成10种代谢产物;芘的降解效果最差,第9 d时降解率仅为65.73%,代谢产物较多,其中6种可基本定性。由此可见,随着苯环数的增加,多环芳烃的降解效果逐渐下降,代谢产物逐渐增多。
(2) 3种多环芳烃混合降解时,芴、菲和芘分别在第3 d、5 d和8 d得到完全的去除,共产生8种代谢产物,其中芘在第8 d时只产生了3种代谢产物。可见,芴和菲的存在不仅促进了芘的完全快速降解,而且能够促进芘代谢产物的去除,并且芘的存在也促进了芴和菲的降解,以及代谢产物的去除。
[1] BAMFORTH S M, SINGLETON I. Bioremediation of polycyclic aromatic hydrocarbons: Current knowledge and future directions[J]. Journal Chemical Technology Biotechnology, 2005, 80(7): 723-736.
[2] KEITH L H, TELLIARD W A. Priority pollutants I—A perspective view[J]. Environmental Science and Technology, 1979, 13: 416-423.
[3] 张金丽, 郑天凌. 多环芳烃污染环境的控制与生物修复研究进展[J]. 福建环境, 2002, 19(2): 26-29. (ZHANG Jinli, ZHENG Tianling. The pollution control of polycyclic aromatic hydrocarbons and the research prospect of bioremediation[J]. Fujian Environment, 2002, 19(2): 26-29.)
[4] 于秀艳, 丁永生. 多环芳烃的环境分布及其生物修复研究进展[J]. 大连海事大学学报, 2004, 30(4): 55-59. (YU Xiuyan, DING Yongsheng. Advances of studies on the environmental distribution of polycyclic aromatic hydrocarbons and its bioremediation[J]. Journal of Dalian Maritime University, 2004, 30(4): 55-59.)
[5] JUHASZ A, NAIDU R. Bioremediation of high molecular weight polycyclic aromatic hydrocarbons: A review of the microbial degradation of benzo[a]pyrene[J]. International Biodeterioration & Biodegradation, 2000, 45: 57-88.
[6] 罗玮. 难降解污染物微生物共代谢作用研究进展[J]. 土壤通报, 2012, 43(6): 1515-1521. (LUO Wei. Progress on co-metabolism of biorefractory pollutants[J]. Chinese Journal of Soil Science, 2012, 43(6): 1515-1521.)
[7] 钱忠宁, 张腾江, 杨赓. 难降解废水生物处理中的共代谢作用[J]. 福建环境, 2003, 20(5): 37-39. (QIAN Zhongning, ZHANG Tengjiang, YANG Geng. Cometabolism on biodegradation of refractory wastewater[J]. Fujian Environment, 2003, 20(5): 37-39.)
[8] MCNALLY D L, MIHELCIC J R, LUEKING D R. Biodegradation of mixtures of polycyclic aromatic hydrocarbons under aerobic and nitrate-reducing conditions[J]. Chemosphere, 1999, 38(6): 1313-1321.
[9] LUAN T G, FANG S H, ZHONG Y, et al. Determination of hydroxy metabolites of polycyclic aromatic hydrocarbons by fully automated solid-phase microextraction[J]. Journal of Chromatography A, 2007, 1173: 37-43.
[10] CAJTHAMLA T, ERBANOVA P,AEK V, et al. Breakdown products on metabolic pathway of degradation of benz[a]anthracene by a ligninolytic fungus[J]. Chemosphere, 2006, 64(4): 560-564.
[11] HRITKAMP M A, FREEMAN J P, MILLER D W, et al. Pyrene degradation by aMycobacteriumsp.: Identification of ring oxidation and ring fission products[J]. Applied and Environmental Microbiology, 1988, 54(10): 2556-2565.
[13] REHMANN K, NOLL H P, STEINBERG C E W, et al. Pyrene degradation byMycobacteriumsp. strain KR2[J]. Chemosphere, 1998, 36(14): 2977-2992.
[14] KRIVOBOK S, KUONY S, MEYER C, et al. Identification of pyrene-induced proteins inMycobacteriumsp. strain 6PY1: Evidence for two ring-hydroxylating dioxygenases[J]. Journal of Bacteriology, 2003, 185(13): 3828-3841.
[15] GUHA S, PETERS C A, JAFFÉ P R. Multisubstrate biodegradation kinetics of naphthalene, phenanthrene, and pyrene mixtures[J]. Biotechnology and Bioengineering, 1999, 65(5): 491-499.
Co-Metabolism Biodegradation of Polycyclic Aromatic Hydrocarbons With High Relative Molecular Mass
LI Zheng1, GU Guizhou1, ZHAO Chaocheng2, ZHAO Dongfeng2, YANG Lei1
(1.CollegeofChemistry,ChemicalEngineeringandEnvironmentalEngineering,LiaoningShihuaUniversity,Fushun113001,China;2.CollegeofChemicalEngineering,ChinaUniversityofPetroleum,Qingdao266555,China)
In order to study the co-metabolism biodegradation of the polycyclic aromatic hydrocarbons (PAHs) with high relative molecular mass, an influence of the addition of fluorene and phenanthrene, the PAHs with low relative molecular mass, on pyrene biodegradation was investigated and the composition of the biodegradation metabolites was determined by GC-MS. The results showed that in the biodegradation of single PAHs, fluorene was completely degraded throughout 5 d incubation to generate five metabolites, the degradation rate of phenanthrene reached 98.93% to generate ten metainbolites after 7 d incubation and only 65.73% of pyrene was degraded throughout 9 d incubation to generate more metabolites, six of which could be qualitative. In the degradation of mixture of fluorene, phenanthrene and pyrene, they were completely removed after 3 d, 5 d and 8 d incubation, respectively, and a total of eight metabolites were produced, and only three metabolites were produced from pyrene after 8 d incubation. Therefore, fluorene and phenanthrene not only promoted the degradation of pyrene rapidly and completely, but also promoted the removal of the metabolites of pyrene, meanwhile, the presence of pyrene also contributed to the degradation of fluorene and phenanthrene and the removal of their metabolites.
polycyclic aromatic hydrocarbons; co-metabolism; biodegradation
2014-02-18
辽宁省教育厅科学研究项目(L2014148)资助
李政,女,讲师,博士,从事石油污染土壤生物修复方面的研究;Tel: 024-53847679;E-mail: lizheng.zz@163.com
1001-8719(2015)03-0720-06
X172
A
10.3969/j.issn.1001-8719.2015.03.016
