早开堇菜组织培养及植株再生体系的建立
2015-06-26李俊强林利华万雪琴赵景龙
李俊强,林利华,张 帆,万雪琴,刘 敏,赵景龙
(1.四川农业大学,四川成都611130;2.宜宾职业技术学院,四川宜宾644000)
早开堇菜组织培养及植株再生体系的建立
李俊强1,2,林利华2,张 帆1*,万雪琴1,刘 敏1,赵景龙1
(1.四川农业大学,四川成都611130;2.宜宾职业技术学院,四川宜宾644000)
以野生早开堇菜为材料,研究了不同外植体类型(子叶节、叶片、叶柄)和不同激素配比对其不定芽诱导、愈伤组织诱导和分化的影响,成功建立了早开堇菜组织培养植株再生体系。结果表明,1)诱导子叶节和叶柄不定芽诱导的最适培养基为MS+2.0 mg/L 6-BA+0.1 mg/L NAA,叶片不适合作为直接诱导不定芽的外植体。2)3种外植体均能诱导愈伤组织,子叶节愈伤组织诱导的时间最短,其次为叶柄,叶片最晚。子叶节和叶柄愈伤组织诱导的最适培养基为MS+1.0 mg/L 6-BA+0.5 mg/L 2,4-D,诱导率分别为98.3%和96.7%;叶片愈伤组织诱导的最适培养基为MS+1.0 mg/L 6-BA+0.5 mg/L 2,4-D+0.05 mg/L NAA,诱导率可达88.3%。3)最适愈伤组织分化培养基为:MS+1.5 mg/L 6-BA+0.1 mg/L NAA,分化率为100%。4)不定芽增殖的最佳培养基为:MS+1.5 mg/L 6-BA+0.075 mg/L NAA,增殖率为4.68。5)再生苗移植到添加1.0 mg/L 6-BA的1/2 MS培养基上,生根率92.3%。6)组培苗移栽到珍珠岩∶河沙∶腐殖质(1∶2∶2)的混合基质时,100%成活,且植株长势好。
早开堇菜;组织培养;植株再生
早开堇菜(Viola prionantha)又名早花地丁,属堇菜科堇菜属多年生草本植物,分布于我国东北、华北、陕西、甘肃、湖北、四川、云南以及朝鲜和西伯利亚等地[1]。早开堇菜植株低矮、花期长、花色艳丽、花型美观、株型雅致,具有较高的观赏价值,可用于地被绿化、花境绿化、缀花草坪绿化之中;其次早开堇菜具有适应性广、生长迅速、抗逆性强、竞争力强等特点使其具有广阔的园林开发应用前景[2-3]。张金政等[3]在推荐具有良好的景观效果和适应当地环境的优良花卉资源时,就重点推荐了早开堇菜。此外,早开堇菜具有较高的药用价值,能清热解毒,有强的抗菌活性,其抗菌作用比同属的紫花地丁(V.philippica)还要强[4-5]。已有学者对早开堇菜的药性成分进行过研究,研究结果表明早开堇菜挥发油中含44种化学成分;这些成分具有防霉、防腐、消炎杀菌、抗肿瘤、抗突变、增强免疫功能等多方面功能[6]。早开堇菜主要靠种子繁殖和根状茎繁殖,但上述两种繁殖方式的繁殖率都比较低,不能满足作为地被植物和药用植物用量大的需求。
近年来,科学家们对早开堇菜的资源概况[7]、生理特性[8]、药用特性[9-10]以及对重金属富集吸收特性[11-13]等方面进行了大量的研究,但对其再生体系的研究尚未见报道。早开堇菜作为早春开花的优良地被植物,目前还没有被广泛应用;野生资源是早开堇菜药用的主要来源,但由于过度采挖导致现阶段该物种资源逐年减少。早开堇菜组织培养技术的研究,益于该物种资源的有效保护、再生利用和持续发展;而且还能通过植物组织培养的快速繁殖满足城市园林绿化对地被植物需求量大的要求。因此,亟待建立早开堇菜组织培养植株再生体系。本研究以早开堇菜的子叶节、叶片和叶柄为外植体,成功建立了完整的早开堇菜组织培养植株再生体系,为这一野生资源的保护和进一步开发利用奠定基础。
1 材料与方法
1.1 植物材料
野生早开堇菜(图1A)成熟种子于2013年6月采自四川省雅安市(北纬30.3°,东经103.0°)。外植体为种子繁殖幼苗的子叶节、叶片和叶柄。
1.2 试验方法
1.2.1 外植体处理及消毒 1)子叶节处理:选取早开堇菜饱满的新鲜种子,放在培养皿中,置于25℃恒温箱中进行催芽。待胚根长出1 cm左右,子叶恰好脱离种皮时的幼苗为试材。流水冲洗1 h,然后在1 g/L的多菌灵溶液中浸泡20 min,冲洗干净后置于超净工作台上70%的酒精中浸泡15 s,无菌水冲洗2次,再放入0.1%的升汞中消毒5~6 min,无菌水冲洗5次,每次2 min以上,最后用无菌纱布吸干表面水分,备用。
2)叶片、叶柄处理:选择健壮、无病虫害的优良植株,剪取带叶柄的幼嫩叶片,于洗衣粉中浸泡20 min,用毛刷轻轻刷去叶片、叶柄上残留的脏物,再用流水冲洗2~3 h,然后放入1 g/L的多菌灵溶液中浸泡30 min,流水冲洗干净之后置于超净工作台上70%酒精中浸泡30 s,后用无菌水冲洗2次,再放入0.1%的升汞中消毒8 min,无菌水冲洗5次,无菌纱布吸干表面水分,备用。
1.2.2 子叶节、叶片和叶柄诱导不定芽 灭菌完成后,置于超净工作台上,用解剖刀切取整个子叶节,下胚轴留约0.3 cm[14];将叶柄剪成0.5~1.0 cm左右的节段,叶片剪成1.0 cm×1.0 cm大小,接种于培养基上。以MS+3.0%蔗糖+0.7%琼脂为基本培养基分别添加不同浓度的6-苄氨基嘌呤(6-BA:1.0,1.5,2.0 mg/L)、萘乙酸(NAA:0.05,0.10,0.50 mg/L)。采用3因素3水平正交试验设计,每个处理接种20个外植体,每处理重复3次。30 d后统计不定芽诱导率以及出芽指数[15]。
1.2.3 子叶节、叶片、叶柄愈伤组织的诱导 以MS+3.0%蔗糖+0.7%琼脂为基本培养基,分别添加不同浓度的6-BA(0.5,1.0,1.5 mg/L)、2,4-二氯苯氧乙酸(2,4-D:0.05,0.10,0.50 mg/L)、NAA(0.05,0.10,0.50 mg/L)为愈伤组织诱导培养基,然后将灭完菌的外植体接种于培养基上进行培养。该试验采用3因素3水平正交试验设计,每个处理接种20个外植体,每处理重复3次,30 d后统计愈伤组织生长情况以及出愈率。
1.2.4 愈伤组织不定芽的分化 将诱导形成的愈伤组织转接到分化培养基上,使愈伤组织分化成苗。分化培养基为:以MS+3.0%蔗糖+0.7%琼脂为基本培养基,分别添加不同浓度的6-BA(0,1.0,1.5,2.0 mg/L)、NAA(0,0.05,0.075,0.10 mg/L)。采用完全试验组合,每个处理20瓶,每瓶接种直径1.0 cm的愈伤组织,重复3次,30 d后统计愈伤组织分化率及平均不定芽数。
1.2.5 不定芽的增殖培养 将由愈伤组织分化而来的不定芽或者由外植体直接诱导产生的不定芽切割成单芽,在增殖培养基上进行继代培养,30 d继代一次,记录增殖芽数,计算增殖倍数,筛选出最佳增殖培养基。增殖培养基:1)MS+1.5 mg/L 6-BA+0.1 mg/L NAA;2)MS+1.5 mg/L 6-BA+0.075 mg/L NAA,每个处理20株苗,重复3次。30 d后统计芽的增殖情况。
1.2.6 有效苗培养和生根培养 于不添加激素的MS培养基中直接接种小苗,15 d后统计有效苗率(苗高>4 cm),并观察有效苗的生长情况。选择4 cm以上的健壮早开堇菜有效单苗进行生根诱导培养。分别以MS、1/2 MS、1/4 MS为基本培养基,添加不同浓度的6-BA(0,0.5,1.0 mg/L)、NAA(0,0.3,0.5 mg/L)为生根培养基。试验采用3因素3水平的正交试验设计,每个处理20瓶,每瓶1株单苗,各处理重复3次。40 d后统计生根率、平均生根数、平均根长。
1.2.7 培养条件 培养基p H 5.7~6.0,培养温度恒定保持(25±2)℃,光照强度为25~35μmol/(m2·s),光照时间16 h/d。
1.2.8 炼苗与移栽 待苗根长2 cm,苗高5~6 cm时,在封口膜上密刺小孔,于温室散射光下培养,第4天揭开1/4的封口膜,第7天揭开1/2封口膜,第10天将封口膜全部揭开,第13天将试管苗轻轻取出,洗净根部的残留培养基,移植到基质上。选用珍珠岩、河沙、腐殖质按一定比例(1∶1∶3,1∶2∶2,2∶2∶1)混合成混合基质。
炼苗前,使用0.1%的高锰酸钾对基质进行消毒处理。苗栽后浇透水一次,初期可加盖遮阳网,温度保持20~30℃,湿度保持80%以上。每种基质移栽20株,重复3次,期间观察幼苗生长情况,20 d后统计成活率(%)。
1.3 统计分析方法
采用EXCEL 2003和SPSS 17.0进行方差分析和显著性分析。
2 结果与分析
2.1 不定芽诱导
2.1.1 外植体的类型对诱导不定芽的影响 3种外植体直接诱导产生不定芽的难易程度不同(表1),子叶节最容易诱导产生不定芽,其诱导率最高可达96.7%、出芽指数为4.22,其次是叶柄,最高诱导率83.3%、出芽指数为3.02,最低为叶片,诱导率仅为35.0%、出芽指数1.38。并且由叶片分化的芽长势差,容易褐化、死亡。因此利用早开堇菜的子叶节和叶柄作为外植体直接诱导产生不定芽效果最好,不宜选用叶片诱导不定芽。
2.1.2 不同浓度激素配比对诱导芽的影响 由表1可以看出2,3,9号处理中,芽诱导率较高,分别为88.3%,96.7%,83.3%,不定芽生长健康,呈现出嫩绿色或绿色(图1B,C)。不同浓度的6-BA对出芽指数的影响是有显著差异的,当6-BA的浓度为2.0 mg/L时,诱导率和出芽指数最高,分别为71.6%,2.87。因此,促进外植体直接成芽的最佳6-BA浓度为2.0 mg/L。另一方面,当NAA的浓度为0.1 mg/L时,诱导率和出芽指数均达最大值,分别为58.9%,2.51。因此,从外植体上直接诱导芽的最佳的NAA浓度为0.1 mg/L。综合数据分析,最有利于诱导早开堇菜子叶节和叶柄产生不定芽的最适的培养基为:MS+2.0 mg/L 6-BA+0.1 mg/L NAA。
2.2 愈伤组织诱导
2.2.1 不同浓度激素配比对子叶节愈伤组织诱导的影响 将早开堇菜子叶节接种至不同浓度激素配比的培养基上,黑暗培养15 d后子叶节开始膨大,然后光照培养7 d后开始形成愈伤组织。由表2可以看出6号和3号处理中子叶节愈伤组织诱导率较高,分别为98.3%和88.3%,且愈伤组织生长健康,呈白色或乳白色紧密状(图1D)。6-BA、2,4-D、NAA对愈伤组织诱导呈显著差异。当培养基中6-BA浓度为0.5和1.0 mg/L时愈伤组织诱导率比较高,生长状态比较好,此后,随着6-BA浓度增加到1.5 mg/L时,诱导率急剧下降,愈伤组织呈现出黄
色、褐色松软状,说明高浓度的细胞分裂素不利于愈伤组织的诱导。愈伤组织诱导率在一定范围内随着2,4-D浓度的增加而升高,当培养基中2,4-D浓度为0.5 mg/L时,诱导的效果最佳。NAA的浓度对愈伤组织诱导影响不显著。因此根据植物生长调节剂浓度宜低不宜高的原则[16],诱导子叶节愈伤组织最适宜的培养基为:MS+1.0 mg/L 6-BA+0.5 mg/L 2,4-D。

表1 不同外植体类型和激素浓度配比对芽诱导的影响Table 1 Effects of different explants and various hormone rations on bud induction in V.prionantha

图1 早开堇菜组织培养植株再生体系Fig.1 Plant regeneration system via tissue in V.prionantha
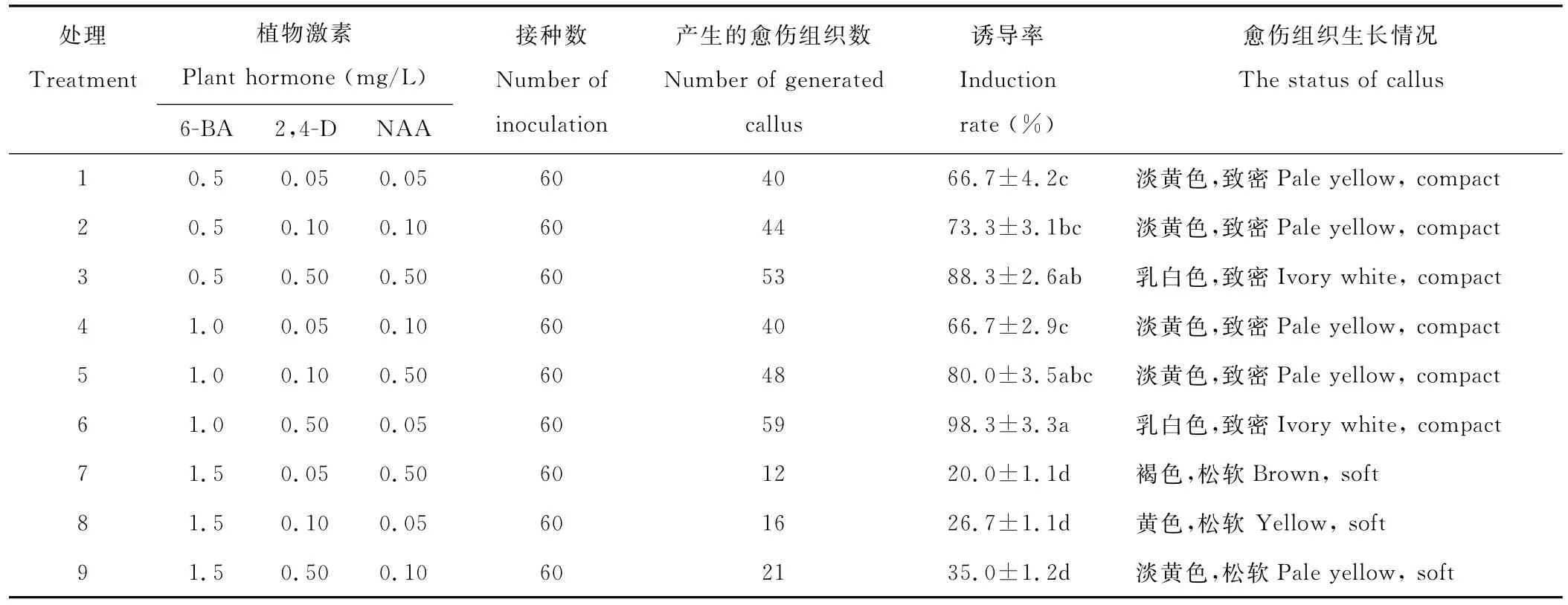
表2 不同浓度激素配比对子叶节愈伤组织诱导的影响Table 2 Effect of various hormone rations on callus induction of cotyledon node
2.2.2 不同浓度激素配比对叶片愈伤组织诱导的影响 将早开堇菜叶片接种至不同浓度激素配比的培养基上,黑暗培养15 d后叶片从切口处开始膨大,光照培养15 d后叶片四周开始形成愈伤组织,刚诱导出时生长缓慢,多次继代后生长旺盛。

表3 不同浓度激素配比对叶片愈伤组织诱导的影响Table 3 Effect of various hormone rations on callus induction of leaf blade
由表3可以看出在叶片愈伤组织诱导中,6-BA、2,4-D、NAA 3种植物生长调节剂对愈伤组织诱导率的影响呈显著差异。当培养基中6-BA浓度增加到1.5 mg/L时,愈伤组织诱导率急剧下降;而叶片愈伤组织诱导率随2,4-D浓度的增加而升高;不同浓度NAA对叶片愈伤组织诱导率的影响无显著差异。
6号和3号处理中叶片愈伤组织诱导率较高,两者的差异不显著,分别为88.3%和83.3%,愈伤组织生长健康,呈白色或乳白色紧密状(图1E)。当6-BA、2,4-D、NAA浓度分别为1.0,0.50和0.05 mg/L时,叶片愈伤组织诱导率最高,达88.3%。因此,诱导叶片愈伤组织最适宜的培养基为:MS+1.0 mg/L 6-BA+0.5 mg/L 2,4-D+0.05 mg/L NAA。
2.2.3 不同浓度激素配比对叶柄愈伤组织诱导的影响 将早开堇菜叶柄接种至不同浓度激素配比的培养基上,黑暗培养15 d后叶柄从切口处开始膨大,光照培养7 d后叶柄两端及表面形成大量愈伤组织。由表4可以看出6号处理和3号处理中叶柄愈伤组织诱导率较高,分别为96.7%和88.3%,愈伤组织生长健康,呈白色或乳白色紧密状(图1F)。
6-BA、2,4-D、NAA 3种植物生长调节剂对叶柄愈伤组织诱导呈显著差异。当6-BA的浓度为1.5 mg/L时,叶柄愈伤组织诱导率最低,并且愈伤组织呈松软状,说明高浓度的细胞分裂素不利于愈伤组织的诱导。此外不同浓度的NAA对叶柄愈伤组织诱导的影响差异不显著,根据植物生长调节剂浓度宜低不宜高的原则,诱导早开堇菜叶柄愈伤组织的最适NAA浓度为0 mg/L。因此,诱导早开堇菜叶柄愈伤组织最适培养基为:MS+1.0 mg/L 6-BA+0.5 mg/L 2,4-D。
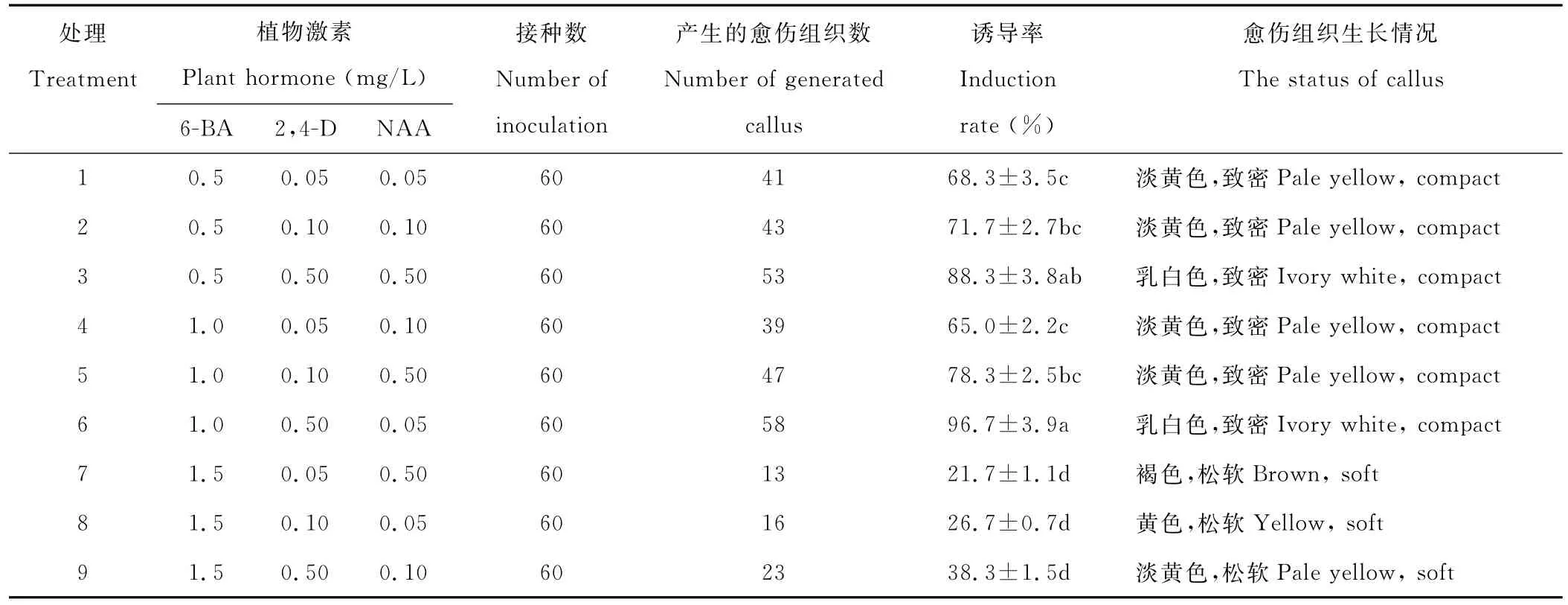
表4 不同浓度激素配比对叶柄愈伤组织诱导的影响Table 4 Effect of various hormone rations on callus induction of petiole
2.3 愈伤组织分化
将诱导产生的愈伤组织接种到分化培养基上,15 d后愈伤组织开始增殖,且逐渐由白色或乳白色转变为绿色,愈伤组织上陆续出现绿点。40 d后开始有芽的分化,50 d后芽开始大量分化(图1I)。
由表5可以看出,单独使用6-BA或NAA以及不添加任何植物生长调节剂时,愈伤组织不定芽分化率和平均不定芽数均为0,且愈伤组织逐渐褐化,变黄。当6-BA浓度为1.5 mg/L,NAA浓度为0.1 mg/L时愈伤组织不定芽分化率最高,达100%,每块愈伤组织的平均不定芽数达8.03。因此,诱导早开堇菜愈伤组织分化的最适培养基为:MS+1.5 mg/L 6-BA+0.1 mg/L NAA。
2.4 不定芽增殖
将产生的不定芽转移到增殖培养基上进行增殖,20 d后单芽基部相继出现新芽。表6可以看出2号培养基:MS+1.5 mg/L 6-BA+0.075 mg/L NAA的不定芽增殖效果最好,苗绿、健壮(图1G),增殖倍数达到6.72;其次为1号培养基:MS+1.5 mg/L 6-BA+0.1 mg/L NAA,增殖倍数达4.68。不定芽增殖培养中,适当降低NAA浓度有利于提高单芽的增殖倍数。将所有单芽转移到2号培养基上继代增殖,芽的生长状态极佳。因此,早开堇菜不定芽增殖的最适培养基为:MS+1.5 mg/L 6-BA+0.075 mg/L NAA。
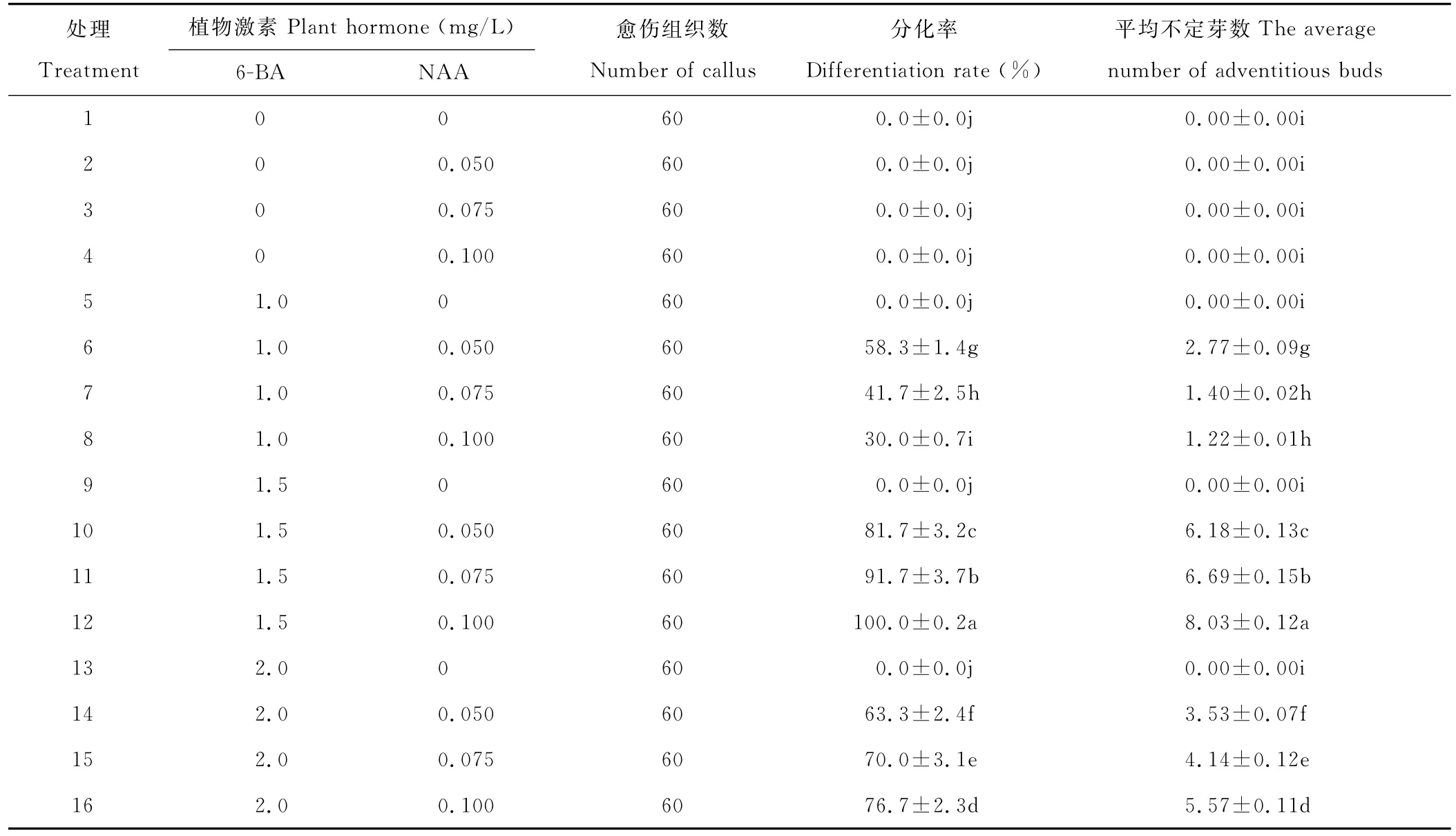
表5 不同浓度激素配比对愈伤组织分化的影响Table 5 Effect of various hormone rations on callus differentiation
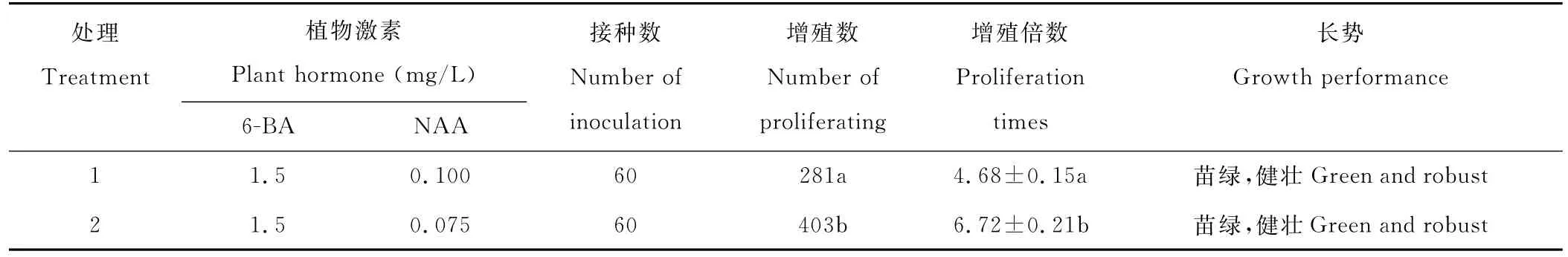
表6 不同浓度激素配比对不定芽增殖的影响Table 6 Effect of various hormone rations on adventitious bud proliferation
2.5 不同培养基和植物生长调节剂组合对组培苗生根的影响
直接将小苗转接于不添加任何激素的MS培养基中,15 d后有效苗率高达98.3%,有效苗植株生长健壮,叶色嫩绿。将有效单苗转入生根培养基中,接种25 d左右,多数处理中的幼苗开始生根,根系呈黄白色辐射状(图1J,K)。
由表7可以看出,6号处理的生根率最高、平均生根数最多、平均根长最长,分别为92.3%,5.4,4.8 cm。5号处理次之;而在没有添加任何植物激素的1号处理中无根的分化。培养基的类型对生根率、平均生根数、平均根长均有显著影响,1/2 MS培养基明显优于MS和1/4 MS培养基,因此早开堇菜生根最适宜的基本培养基为1/2 MS培养基。不同激素对生根影响不同。生根率、平均生根数、平均根长在一定的范围内随着6-BA浓度的增加而升高。当6-BA浓度为1.0 mg/L时,所有指标均达到最大值,植物生长良好,叶色嫩绿,叶片数多;NAA的浓度对试验结果影响不显著,根据植物生长调节剂浓度宜低不宜高的原则,NAA选择最低浓度0 mg/L。综合数据分析,最有利于早开堇菜幼苗生根的培养基组合为:1/2 MS+1.0 mg/L 6-BA。
2.6 不同基质对组培苗移栽的影响
待组培苗生长至10 cm左右时,开盖炼苗7 d后移植到1(珍珠岩)∶2(河沙)∶2(腐殖质)的混合基质上,植株成活率最高,生长良好(表8)(图1L)。
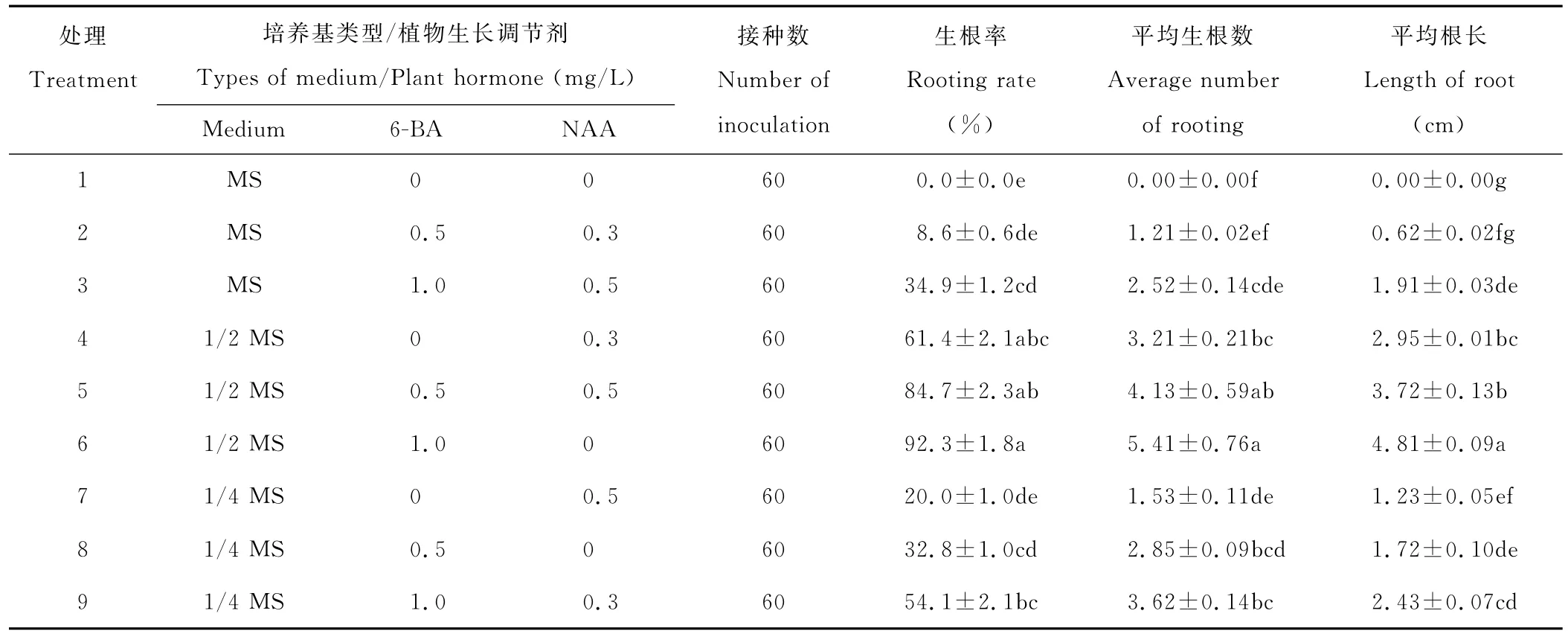
表7 不同培养基和植物生长调节剂组合对组培苗生根的影响Table 7 Effects of different culture medium and plant growth regulators combinations on rooting of the plants
3 讨论
3.1 外植体类型对早开堇菜植株再生的影响
在组织培养过程中,植物的种类、同一植物生理状态、生长季节、器官和部位的不同,其再生能力是有差异的[17-19]。有研究者发现:芽的再生能力>胚状体再生能力>愈伤组织再生能力>营养体组织再生能力[20]。邹永梅和黄雪芳[21]以带腋芽的万寿菊(Tagetes erecta)茎段为外植体在添加不同浓度的6-BA和NAA的MS培养基上诱导芽再生,其芽诱导率均超过90%,并建立了万寿菊茎段离体再生体系。齐广勋等[22]以白三叶(Trifolium repens)子叶节为外植体,诱导产生了优质的丛生芽。本研究以野生早开堇菜子叶节、叶片、叶柄为外植体诱导芽,诱导率从高到低分别为子叶节、叶柄和叶片。叶片的诱导率最低,不适合作为直接诱导早开堇菜产生不定芽的外植体,其原因可能与叶片的分化程度有关;而子叶节和叶柄是诱导早开堇菜产生不定芽的最佳选择。
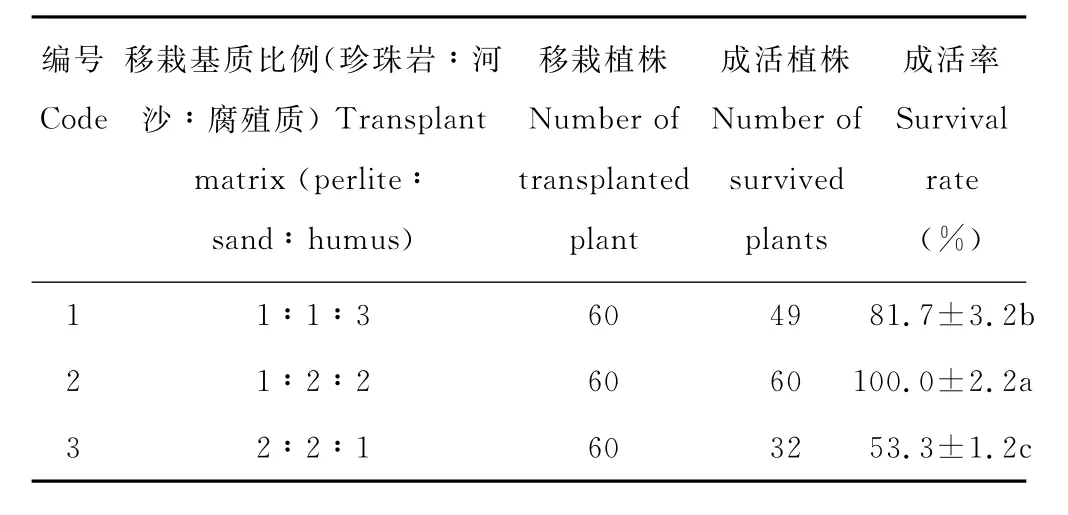
表8 不同移栽基质对组培苗成活率的影响Table 8 Effects of different transplanting substrates on seedling survival rate
3.2 基本培养基的类型对早开堇菜植株再生的影响
在植物组织培养的过程中,植物种类不同其对营养成分的要求也不同;甚至是同一植物不同培养阶段,其所需的营养成分也不尽相同。基本培养基是影响植物组织培养的重要因素,在选择基本培养基时除依据植物的遗传特性、生物及生态学特性以外,还应考虑基本培养基的无机盐浓度、营养元素的种类等。一般来讲,无机盐浓度高,有利于植株的茎叶生长,无机盐浓度低,有利于根的生长[23]。MS培养基中无机盐浓度高,且钾离子和铵离子含量丰富,元素比例适当,具有较强的缓冲性,能够满足快速增长的组织对营养元素的需求,是目前使用最广的培养基[24]。早开堇菜的组织培养表明:基本培养基是影响早开堇菜生根的主导因素。1/2 MS培养基中早开堇菜的生根率、平均生根数、平均根长明显优于MS和1/4 MS培养基,这可能是因为基本培养基中N元素的浓度不同影响生根。Maene和Debergh[25]报道离体培养植物生根时,培养基中的盐类浓度减少会促进植物的生根;López-Bucio等[26]在根系发育研究中提出,减少培养基中的N元素或增加P元素均可促进根系发育与生长。因此早开堇菜生根最适宜的基本培养基为1/2 MS培养基。此外本实验前期的预试验表明,早开堇菜的初代培养、继代增殖培养、愈伤组织分化培养以及壮苗培养最适宜的基本培养基为MS培养基。
3.3 不同激素配比对早开堇菜组织培养的影响
植物细胞分化和生长方向主要受激素调控,不同激素配比能够有效的控制植物形态建成的发展方向。细胞分裂素的主要作用是引起植物细胞分裂,诱导芽的形成和促进芽的生长;而生长素主要促进植物细胞伸长和根的分化。在一定浓度范围内,细胞分裂素与生长素的比值决定着芽和根的分化。通常情况下,细胞分裂素与生长素比值在1左右时,促进愈伤组织的诱导和分化;当两者的比值低时,促进根的生长;两者的比值高时,则促进芽的生长[27]。本研究结果表明合理的6-BA、NAA以及2,4-D配比能有效诱导早开堇菜子叶节、叶片、叶柄产生不定芽及愈伤组织。本研究中1.0 mg/L 6-BA+0.5 mg/L 2,4-D的激素配比是诱导早开堇菜子叶节和叶柄的愈伤组织的最适激素配比,其愈伤组织诱导率分别为98.3%,96.7%;而1.0 mg/L 6-BA+0.5 mg/L 2,4-D+0.05 mg/L NAA激素配比是诱导早开堇菜叶片愈伤组织的最适激素配比,其愈伤组织诱导率为88.3%;乔琦等[28]也在0.5 mg/L 2,4-D+0.5 mg/L 6-BA以及1.0 mg/L 2,4-D+0.2 mg/L 6-BA的培养基上诱导了紫花地丁的愈伤组织,本研究与其结果基本一致,说明同属植物之间其生长对激素的需求具有相似性。
NAA是植物组织培养中常用的生长素类激素之一,在诱导愈伤组织分化时使用较多,其使用的浓度范围是0.1~1.0 mg/L。本研究中发现当NAA浓度为0.1 mg/L时,早开堇菜愈伤组织分化率最高,达100%。生长素浓度低于细胞分裂素浓度时会促进植物芽的形成,且细胞分裂素起主导作用,6-BA是促进植物细胞分裂分化的激素,在愈伤组织分化中起主导作用,其浓度使用范围为1.0~3.0 mg/L,本研究中发现1.5 mg/L 6-BA+0.1 mg/L NAA的激素配比是诱导早开堇菜愈伤组织分化的最适激素配比,乔琦等[28]也在0.5 mg/L 2,4-D+1.0 mg/L 6-BA的分化培养基上诱导了紫花地丁的愈伤组织的分化,能有效再生成苗。本研究中早开堇菜不定芽增殖的最佳培养基为:MS+1.5 mg/L 6-BA+0.075 mg/L NAA。这与许多植物通过愈伤组织再生和外植体上直接发生芽的研究报道[29-31]基本一致,再次表明生长素浓度低于细胞分裂素浓度时会促进植物芽的形成,且细胞分裂素起主导作用。
许多植物组织培养的研究证实,无任何激素的1/2 MS培养基是组培苗生根的最适培养基,而且植物激素中生长素浓度高于细胞分裂素的浓度时才有利于根的分化,而本研究中却得到了相反的结果:在1/2 MS培养基基础上添加1.0 mg/L 6-BA最有利于早开堇菜生根,生根率为92.3%。
4 结论
以早开堇菜子叶节、叶柄为外植体,诱导其愈伤组织的最适培养基为:MS+1.0 mg/L 6-BA+0.5 mg/L 2,4-D;诱导不定芽的最适培养基为:MS+2.0 mg/L 6-BA+0.1 mg/L NAA;以叶片为外植体诱导愈伤组织的最适培养基为:MS+1.0 mg/L 6-BA+0.5 mg/L 2,4-D+0.05 mg/L NAA;愈伤组织分化的最适培养基为:MS+1.5 mg/L 6-BA+0.1 mg/L NAA;不定芽增殖的最适培养基为:MS+1.5 mg/L 6-BA+0.075 mg/L NAA;生根培养基为1/2 MS+1.0 mg/L 6-BA;把组培苗移栽到1(珍珠岩)∶2(河沙)∶2(腐殖质)的混合基质上,全部成活。
[1] Wang L N.The Life Cycle and Ecological Adaptation of Viola Prionantha Bunge[D].Hohhot:Inner Mongolia University,2009.
[2] Liu H C,Sun Z Y.Study on the introduction and application of three kinds of wild genus Viola.Chinese Landscape Architecture,2006,1(13):1-4.
[3] Zhang J Z,Sun G F,Liu X C.Available herbaceous flower resources in greening of environmental for the city of Beijing.Proceedings of Beijing Olympics and the City Landscape Construction[C].Beijing:Beijing Institute of Landscape Architecture,2002.
[4] Zhou C.The Textual Research and the Studies on the Chemical Constituents of Viola yedoensis[D].Beijing:Beijing University of Chinese Medicine,2008:13-15.
[5] Liu X X,Liu J H,Liu Z K,et al.Studies on effective composition analysis of Viola manshuricaw and its antibacterial effect.Journal of Traditional Chinese Veterinary Medicine,2004,23(3):16-18.
[6] Chen H Y.Determination of volatile components in Viola prionantha Bunge.Journal of Southwest University of Science and Technology,2010,25(3):22-24.
[7] Duan C Y,Hou X G,Zhang Z P,et al.Study on gardens utilizes of Viola in China.Chinese Agricultural Science Bulletin,2004,20(5):185-186.
[8] Cai D F,Gao Z S,Si F H.Isozyme analyse of two cover plants Viola philippica and Viola prionantha.Grassland of China,1998,4(1):48-49,53.
[9] Wang X H,Qin M J,Yu G D.Viola medicinal plant:general survey and perspectives of its natural resources for exploitation.Chinese Wild Plant Resources,2003,22(4):36-37.
[10] Ngan F,Chang R S,Tabba H D,et al.Isolation,purification and partial characterization of an active anti-HIV compound from the Chinese medical herb Viola yedoensis.Antiviral Research,1988,10(1-3):107-115.
[11] Hildebrandt U,Hoef-Emden K,Backhausen S,et al.The rare,endemic zinc violets of Central Europe originate from Viola lutea Huds.Plant Systematics and Evolution,2006,257(3-4):205-222.
[12] Noret N,Josens G,EscarréJ,et al.Development of Issoria lathonia(Lepidoptera:Nymphalidae)on zinc-accumulating and nonaccumulating Viola species(Violaceae).Environmental Toxicology and Chemistry,2007,26(3):565-571.
[13] Slomka A,Libik-Konieczny M,Kuta E,et al.Metalliferous and non-metalliferous populations of Viola tricolor represent similar mode of antioxidative response.Journal of Plant Physiology,2008,165(15):1610-1619.
[14] Vengadesan G,Ganapathi A,Prem Anand R,et al.In vitro propagation of Acacia sinuate(Lour.)Merr.via cotyledonary nodes.Agroforestry Systems,2002,55:9-15.
[15] Murashige T,Skoog F.Revised medium for rapid growth and bioassays with tobacco tissue cultures.Physiologia Plantarum,1962,15(3):473-497.
[16] Wang X F,Wang C M,Zhang J L,et al.Development of a plant regeneration system via tissue culture in Puccinellia tenuiflora.Acta Prataculturae Sinica,2014,23(6):355-360.
[17] Wang G,Du J,Li G Y,et al.Study on tissue cultural and clonal propagation of Lilium davidii var.Unicolor(Hoog)Cotton and Lilium brownie F.E.Brown ex Miellez.Journal of Northwest University(Natural Science),2002,38(1):69-71.
[18] Meng Y L,Hao Y P,Jia J F,et al.Tissue cultural in vitro and plant regeneration from callus as well as explant of red clover(Trifolium pratense L.).Acta Prataculturae Sinica,1994,3(2):51-54.
[19] Du X H,Sun X L,Hao G P,et al.Effects of different explants and exogenous hormones on callus induction and growth of Ginkgo biloba in vitro.Journal of Shandong Normal University(Natural Science),2008,23(1):129-133.
[20] Tan W C,Dai C G.Tissue Culture Technology of Ornamental[M].Beijing:China Forestry Publishing House,1991:91-99.
[21] Zou Y M,Huang X F.Rapid micro-propagation and inflorescence induction of Tagetes erecta L.Journal of Jiangsu Forestry Science&Technology,2005,32(6):17-19.
[22] Qi G X,Yang X D,Sui L,et al.Optimization of regeneration system of Trifolium repens L.Journal of Jilin Agricultural Sciences,2011,36(4):51-54.
[23] Wu L J.Application and limitations of the woody plant tissue culture technique in the forestry scientific research and production.Journal of Fujian Forestry Science and Technology,2003,30(1):67-70.
[24] Li C Y,Yin M H,Xu W H,et al.Effect of inorganic salt level and inositol concentration in MS medium and p H value on Phaseolus radiatus L.seed germination in test tube.Journal of Shangrao Normal College,2008,28(6):62-65.
[25] Maene L,Debergh P.Liquid medium additions to established tissue cultures to improve elongation and rooting in vitro.Plant Cell Tissue&Organ Culture,1984,5(1):23-33.
[26] López-Bucio J,Cruz-Ramírez A,Herrera-Estrella L.The role of nutrient availability in regulating root architecture.Current Opinion in Plant Biology,2003,6(3):280-287.
[27] Dhiman M,Shatma V,Moitra S.Somatic embryogenesis and plant regeneration in Ephedra foliates(Boiss.);a non coniferous gymnosperm.Plant Tissue Culture and Biotechnology,2010,20(2):133-143
[28] Qiao Q,Kong X S,Wu L,et al.Tissue culture and plant regeneration of Viola yedoensis.China Seed Industry,2007,6:38-39.
[29] Chen Y Q,Liu J F,Zhong X,et al.Tissue culture and regeneration system from leaves of Saintpaulia ionantha in vitro.Chinese Agricultural Science Bulletin,2010,26(10):212-216.
[30] Xu Q,Le Z B,Xu Y,et al.Study of leaf and petiole tissue culture induction and plant regeneration on sweet potato.Chinese Agricultural Science Bulletin,2011,27(15):102-105.
[31] Zou Y C,Qin D J,Shuai C Q,et al.Study on tissue culture technique for rapid propagation of Cyclamen persicum.Journal of Hubei University for Nationalities(Natural Science Edition),2011,29(1):23-27.
参考文献:
[1] 王丽娜.早开堇菜(Viola prionantha Bunge)生活史及其生态适应性的研究[D].呼和浩特:内蒙古大学,2009.
[2] 刘会超,孙振元.三种野生堇菜属植物引种及其园林应用.中国园林,2006,1(13):1-4.
[3] 张金政,孙国峰,刘雪川.北京城市大环境绿化中可利用的草本花卉资源.北京奥运和城市园林绿化建设论文集[C].北京:北京园林学会,2002.
[4] 周驰.紫花地丁的本草考证及化学成分研究[D].北京:北京中医药大学,2008:13-15.
[5] 刘湘新,刘进辉,刘自逵,等.紫花地丁的有效成分分析及抗菌作用研究.中兽医医药杂志,2004,23(3):16-18.
[6] 陈红英.早开堇菜的挥发性成分分析.西南科技大学学报,2010,25(3):22-24.
[7] 段春燕,侯小改,张赞平,等.堇菜属Viola植物资源的园林开发前景探讨.中国农学通报,2004,20(5):185-186.
[8] 蔡朵芬,高振声,石飞华.两种草坪地被植物紫花地丁与早开堇菜的同工酶研究.中国草地,1998,4(1):48-49,53.
[9] 王旭红,秦民坚,余国奠.堇菜属药用植物研究概况与其资源利用前景.中国野生植物资源,2003,22(4):36-37.
[16] 王雪芳,王春梅,张金林,等.小花碱茅组织培养植株再生体系的建立.草业学报,2014,23(6):355-360.
[17] 王刚,杜捷,李桂英,等.兰州百合和野百合组织培养及快速繁殖研究.西北师范大学学报(自然科学版),2002,38(1):69-71.
[18] 孟玉玲,皓云鹏,贾敬芬,等.红三叶组织培养及再生植株.草业学报,1994,3(2):51-54.
[19] 杜希华,孙秀玲,郝岗平.不同外植体和激素对银杏愈伤组织诱导和生长的影响.山东师范大学学报(自然科学版),2008,23(1):129-133.
[20] 谭文澄,戴策刚.观赏植物组织培养技术[M].北京:中国林业出版社,1991:91-99.
[21] 邹永梅,黄雪芳.万寿菊的组织培养和瓶苗开花研究.江苏林业科技,2005,32(6):17-19.
[22] 齐广勋,杨向东,隋丽,等.白三叶高频组织培养再生体系的研究.吉林农业科学,2011,36(4):51-54.
[23] 吴丽君.木本植物组织培养技术在林业科研生产中的应用与局限.福建林业科技,2003,30(1):67-70.
[24] 李粹钰,尹明华,徐卫红,等.MS培养基无机盐水平、肌醇浓度和p H值对绿豆试管内萌发的影响.上饶师范学院学报.2008,28(6):62-65.
[28] 乔琦,孔祥生,伍丽,等.紫花地丁的组织培养和植株再生.中国种业,2007,6:38-39.
[29] 程云清,刘剑锋,钟雪,等.非洲紫罗兰叶片外植体再生技术体系的建立.中国农学通报,2010,26(10):212-216.
[30] 徐茜,乐正碧,徐燕,等.甘薯叶片和叶柄组织诱导培养及植株再生研究.中国农学通报,2011,27(15):102-105.
[31] 邹迎春,覃大吉,帅超群,等.仙客来组织培养快繁技术研究.湖北民族学院学报(自然科学版),2011,29(1):23-27.
Tissue culture in vitro and plant regeneration of Viola prionantha
LI Jun-Qiang1,2,LIN Li-Hua2,ZHANG Fan1*,WAN Xue-Qin1,LIU Min1,ZHAO Jing-Long1
1.Sichuan Agricultural University,Chengdu 611130,China;2.Vocational and Technical College,Yibin 644000,China
The effects of various hormone ratios on adventitious buds,callus inductions and differentiation were investigated using the cotyledon node,leaf blade and petiole of Viola prionantha as explants.Finally,a plant regeneration system via tissue culture was established.The results showed that the optimal medium for adventitious bud induction from the cotyledon node and petiole was MS+2.0 mg/L 6-BA+0.1 mg/L NAA,but the leaf blade was not suitable as an explant.Three kinds of explants could induce callus formation.The optimal medium for callus induction from the cotyledon node and petiole was MS+1.0 mg/L 6-BA+0.5 mg/L 2,4-D with the highest callus induction rate being 98.3%and 96.7%,respectively.The optimal medium for callus induction from the leaf blade was MS+1.0 mg/L 6-BA+0.5 mg/L 2,4-D+0.05 mg/L NAA with the highest callus induction rate being 88.3%.The best medium for callus differentiation was MS+1.5 mg/L 6-BA+0.1 mg/L NAA with the highest callus differentiation rate being 100%.The optimal medium for the proliferation of adventitious buds was MS+1.5 mg/L 6-BA+0.075 mg/L NAA,the highest proliferation times being 4.68.The rooting rate of regenerated plants was up to 92.3%on half strength MS medium supplemented with 1.0 mg/L 6-BA.Rooted plantlets were grown on mixture with perlite:sand:humus(1:2:2);survival rate was upto 100%with good growth.
Viola prionantha;tissue cultural;plant regeneration
10.11686/cyxb2015160 http://cyxb.lzu.edu.cn
李俊强,林利华,张帆,万雪琴,刘敏,赵景龙.早开堇菜组织培养及植株再生体系的建立.草业学报,2015,24(11):163-173.
LI Jun-Qiang,LIN Li-Hua,ZHANG Fan,WAN Xue-Qin,LIU Min,ZHAO Jing-Long.Tissue culture in vitro and plant regeneration of Viola prionantha.Acta Prataculturae Sinica,2015,24(11):163-173.
2015-03-26;改回日期:2015-05-20
四川省“十二五”科技攻关项目林木新品种选育(2011YZGG)资助。
李俊强(1976-),男,四川宜宾人,副教授,博士。E-mail:379582780@qq.com
*通讯作者Corresponding author.E-mail:nolady@163.com
