生长期内三种结缕草对盐胁迫的响应
2015-06-26李静媛段艳欣董晓颖
赵 莹,李静媛,段艳欣,董晓颖
(青岛农业大学园艺学院,山东青岛266109)
生长期内三种结缕草对盐胁迫的响应
赵 莹,李静媛,段艳欣,董晓颖*
(青岛农业大学园艺学院,山东青岛266109)
试验以大穗结缕草、沟叶结缕草和日本结缕草为试材,研究了不同盐浓度(0,0.2%,0.4%,0.6%,0.8%)对生长期内3种结缕草叶片膜脂过氧化及生长的影响。结果表明,3种结缕草的生物量均随着盐浓度的增加逐渐减小;随着盐浓度的提高及处理时间的延长,3种结缕草的可溶性蛋白含量逐渐降低;相对电导率和丙二醛含量增加,在低盐浓度(0.2%~0.4%)下,两者增加幅度较小,当盐浓度为0.8%时,3种结缕草的相对电导率均达最大值,分别是38.71%,41.32%,40.97%,可溶性蛋白含量均达到最小值,分别为2.08,1.15和1.33 mg/g FW。Pro含量在处理后第10天达最大值,之后逐渐下降,后期变化比较平稳。在低盐浓度(0.2%~0.4%)下,CAT和SOD活性逐渐降低,而高盐浓度(0.6%~0.8%)下,两种酶活性呈上升-下降-上升的趋势。3种结缕草相比,大穗结缕草在高盐浓度胁迫下的相对电导率和丙二醛含量最低,而保护酶活性和可溶性蛋白含量最高。试验证明大穗结缕草抗盐能力最强,沟叶结缕草次之,日本结缕草较差。
结缕草;盐处理;耐盐性
我国滨海地区和北方干旱半干旱地区都有盐碱土地的分布,盐渍土壤总面积约1亿多hm2[1]。土壤盐渍化和次生盐渍化影响草坪草的生长,主要表现为春季发芽晚、秋季早衰、生长不良、出现泛斑等,影响草坪的美观,甚至导致草坪草死亡[2]。因此,研究草坪草的耐盐机理,选择适应盐渍环境的草坪草品种用于盐碱地区的绿化,对当前和未来城乡的绿化意义重大。植物耐盐机制国内外已有较多报道。耐盐植物对盐胁迫的反应主要表现在:1)将吸收的盐分通过盐腺排到茎叶表面,而后冲刷脱落排除过多的盐分以提高适应性[3];2)提高渗透调节物质含量来适应环境[4];3)提高保护酶活性[5],以有效地清除代谢过程中产生的活性氧。盐胁迫下,植物活性氧含量明显增加[6-7],体内的活性氧清除系统被激活,如超氧化物歧化酶(SOD)、过氧化氢酶(CAT)酶活性提高[8],维持了活性氧产生与清除的动态平衡[9]。随着高浓度盐胁迫时间的延长,保护酶系统逐渐被抑制,氧化酶活性降低,ROS(活性氧簇)大量积累,膜脂过氧化作用增强,丙二醛(MDA)含量明显上升[10],而MDA对植物造成二次伤害。植物在盐胁迫环境下生长,吸收的盐分在植物体内积累,破坏细胞膜透性,细胞内大量元素外流,电导率升高[11-12];同时,渗透调节物质如脯氨酸[13]含量也会升高,以提高渗透调节作用,减小伤害。国内外已对暖季型草坪草许多品种进行了抗盐性研究并取得了一些研究成果,但这些成果大部分是对草坪草形态特征和生物量变化的研究[12,14],且多数是盐胁迫时间较短,而对其耐盐生理机制的研究缺乏系统性。结缕草属草坪草是当前广泛使用的暖季型草坪草之一,其中大穗结缕草(Zoysia macrostachys)、沟叶结缕草(Zoysia matrella)和日本结缕草(Zoysia japonica)被认为是耐盐性较强的草坪草植物[15],但其耐盐机制尚不十分清楚。本试验以暖季型的大穗结缕草、沟叶结缕草和日本结缕草为试材,比较研究了生长期内3种结缕草在不同盐浓度处理下的生物量、相对电导率(RPP)、叶片丙二醛(MDA)、保护酶活性(SOD、CAT)、脯氨酸(Pro)及可溶性蛋白含量的变化,旨在探讨耐盐草坪草植物的耐盐相关机理和耐盐能力的强弱,以便为耐盐草坪草的选择使用及耐盐草坪草新品种的选育提供理论依据。本研究对滨海盐碱地区的绿化美化具有重要的参考价值。
1 材料与方法
1.1 材料
试验于2014年5月-2014年9月在青岛农业大学园艺学院试验站进行。供试材料为大穗结缕草、沟叶结缕草和日本结缕草。
1.2 方法
1.2.1 试材处理 2014年5月将3种结缕草栽植于高15 cm,直径为40 cm的塑料盆中,栽培基质为沙∶土=1∶1的混合土,每种草定植25盆,放至试验田,在防雨条件下生长。
7月19日分别用0.2%,0.4%,0.6%,0.8%的NaCl溶液进行处理,清水为对照,单盆为小区,各处理均设置5个重复。在进行盐处理时,每个盆下放置一个托盘,将流出的盐溶液补回到盆中,以保持盐处理浓度。定期称重,用蒸馏水补充散失的水分。处理后,每隔10 d分别取3种草各处理的叶片,用干净纱布拭去叶片表面的尘土,立即进行液氮速冻,放入超低温冰箱贮藏,备生理指标测定用,取样日期截止到9月19日。盐处理30 d后测定植株的生物量。
1.2.2 测定方法 取新鲜植株测定其生物量,将植株根茎叶在105℃下杀青15 min,然后在70℃下48 h测定根茎叶的干重。丙二醛含量的测定采用硫代巴比妥酸比色法[16];过氧化氢酶(CAT)活性测定采用紫外吸收法[17];超氧化物歧化酶(SOD)活性的测定采用氮蓝四唑法[17];可溶性蛋白含量的测定采用考马斯亮蓝比色法进行[16];电导率用Bante-901测定,称取绿色较小叶片0.5 g,将各处理叶片剪成小段分别放入不同的试管中,向每个试管加10 m L去离子水,室温条件下测定电导率EC1,将材料煮沸10 min冷却至室温后测定电导率EC2,电导率(%)=(EC1-EC0)/(EC2-EC0),EC0为去离子水电导率;脯氨酸含量的测定采用磺基水杨酸法[16],取0.3 g叶片加入5 m L磺基水杨酸后沸水浴10 min后过滤,吸取滤液2 m L,冰醋酸2 m L和酸性茚三酮3 m L,沸水浴40 min冷却后加5 m L甲苯,用漩涡混合器充分震荡静置分层,取上层甲苯溶液在520 nm下比色。脯氨酸含量(μg/g FW)=提取液中脯氨酸含量×提取液体积/测定时吸取的提取液体积/样品鲜重;以上所有测定均设置3次重复。
1.3 数据处理
采用SPSS 18.0进行数据分析,平均数的比较采用LSD多重比较法,Origin 8.0作图。
2 结果与分析
2.1 不同盐浓度处理对3种结缕草生物量的影响
3种结缕草根、茎、叶的生物量随着盐浓度的增加呈现逐渐下降的趋势。日本结缕草随着盐浓度的增加生物量下降比率最大,根系的下降幅度最为明显,各处理分别为对照的97.30%,90.54%,56.76%,35.13%。大穗结缕草根系干重在0.4%盐处理下才开始极显著降低,到高盐浓度处理时为对照的63.95%。沟叶结缕草根系干重下降比率介于日本结缕草和大穗结缕草之间。茎干重的变化,日本结缕草和沟叶结缕草在0.2%盐处理下显著下降,大穗结缕草在0.4%盐处理时开始降低。在0.8%盐处理时大穗结缕草、沟叶结缕草、日本结缕草茎的干重分别为对照的78.19%,46.34%,27.22%。3种结缕草的叶片干重随着盐浓度的增加逐渐降低,大穗结缕草的下降比率最小,沟叶结缕草次之,日本结缕草下降最快,最大。
2.2 不同盐浓度处理对3种结缕草叶片相对电导率的影响
如图1所示,3种结缕草叶片相对电导率随着处理时间的延长和盐浓度的增加均呈现逐渐升高的趋势。大穗结缕草各处理前30 d的相对电导率值增加缓慢,与对照相比差异不显著。0.2%处理的直到第50天后相对电导率才开始升高。0.4%和0.6%处理的相对电导率变化趋势基本一致,与对照相比,前期虽有所增加,但直到处理的第50天后才急剧增加。0.8%处理的相对电导率前30 d有所增加,为10.21%,到处理第30 d后急剧增大,到第60天达到最大值,为38.71%,相当于对照的451.56%,各处理在第60天时均达到最大值,差异极显著(P<0.01);沟叶结缕草在0.2%盐处理初期相对电导率缓慢增加,直到处理第50天急剧增加,各处理间电导率差异显著(P<0.05);0.4%和0.6%处理的相对电导率在处理初期上升较慢,后期增加较快。0.8%处理的相对电导率一直处于上升状态且数值较高;日本结缕草各处理的相对电导率变化趋势同沟叶结缕草相似。分析比较3种结缕草,在低盐(0.2%)浓度下,3者的相对电导率差别不大。在0.4%和0.6%中盐浓度下,大穗结缕草的相对电导率直到处理50 d后才迅速升高,而沟叶结缕草和日本结缕草的均在处理第40天就急剧增加。在0.8%高盐浓度处理下,大穗结缕草的相对电导率急剧增加的时期比沟叶结缕草和日本结缕草推迟了10 d。从变化幅度来看,大穗结缕草的相对电导率比最初增加了1.78倍,沟叶结缕草增加了2.51倍,日本结缕草增加了2.83倍,说明大穗结缕草的细胞膜受到盐处理的伤害出现的晚且较轻。
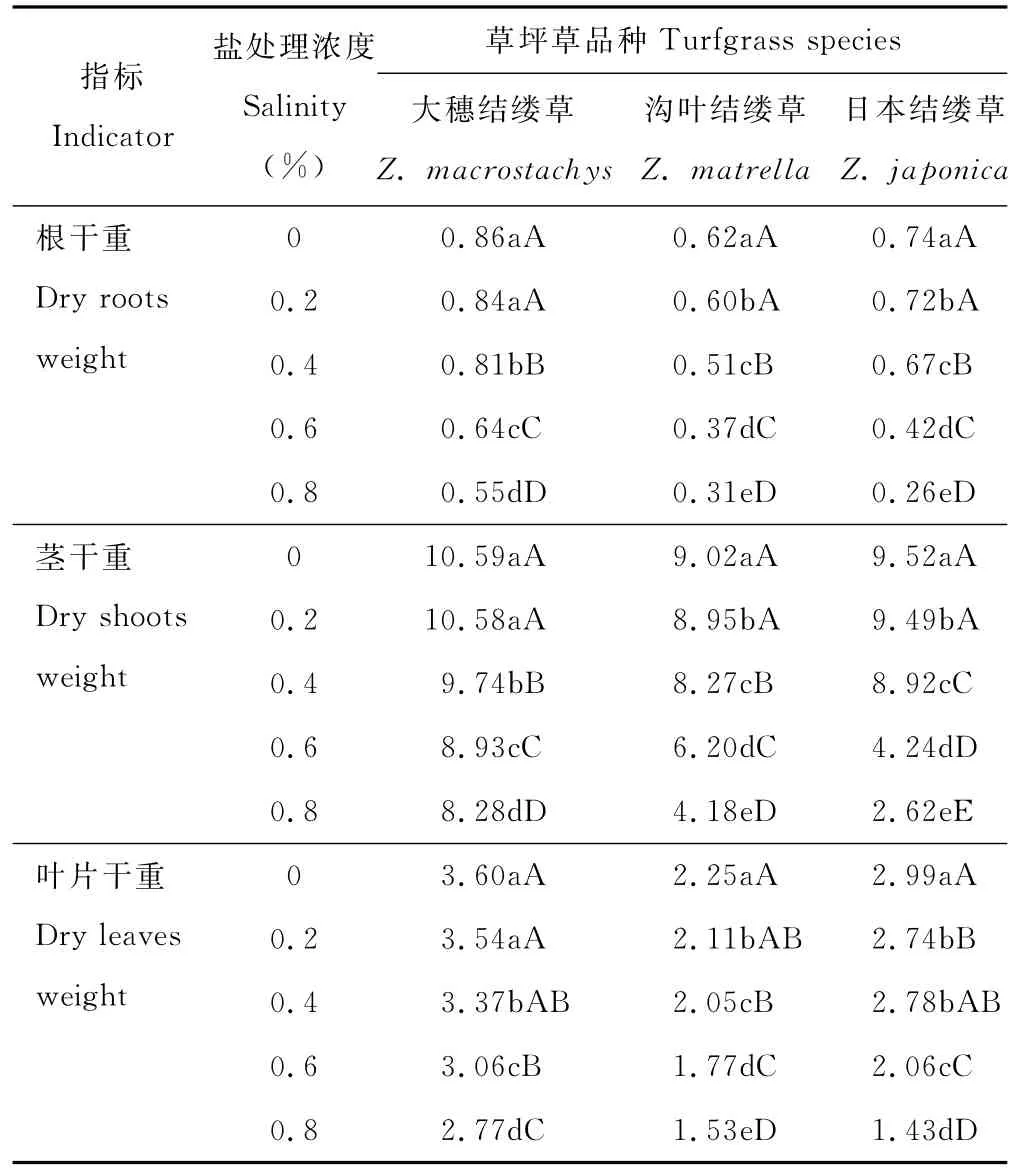
表1 不同盐处理浓度下对3种结缕草生物量的影响Table 1 Effect of the biomass under different salt treatment of three grasses g
2.3 不同盐浓度处理对3种结缕草叶片MDA的影响
由图2可以看出,大穗结缕草的MDA含量随着盐处理浓度的增加,除对照外各处理均呈现逐渐增加的趋势,但各处理间MDA含量差异不显著(P>0.05),且20 d后均明显高于对照的,在0.8%处理下达到最大值,为13.91μmol/g FW;沟叶结缕草的MDA含量变化与大穗结缕草相似,各处理MDA含量均高于对照,随着盐处理时间的延长,各处理的叶片MDA含量逐渐升高,0.8%处理第60天最高,达到16μmol/g FW;日本结缕草变化趋势与上述二者不同,盐处理的浓度越高,其含量越高,且均高于对照。在0.8%盐处理下随着时间的延长,MDA含量一直呈现升高的趋势,且处理最终时期达到17μmol/g FW以上。分析比较3种结缕草,随着盐浓度的增加和时间的延长,3种结缕草MDA含量均呈现逐渐上升的趋势。在0.4%以上的盐浓度处理下,大穗结缕草的MDA含量明显低于其他两种结缕草的,说明大穗结缕草的耐盐性强于沟叶结缕草和日本结缕草。
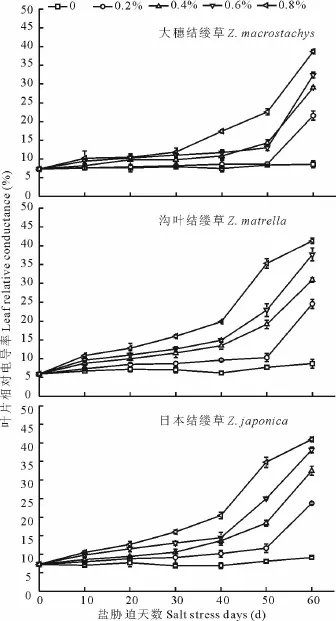
图1 不同盐浓度处理下3种结缕草叶片相对电导率变化Fig.1 Change of leaf relative conductance under different salt treatment of three grasses
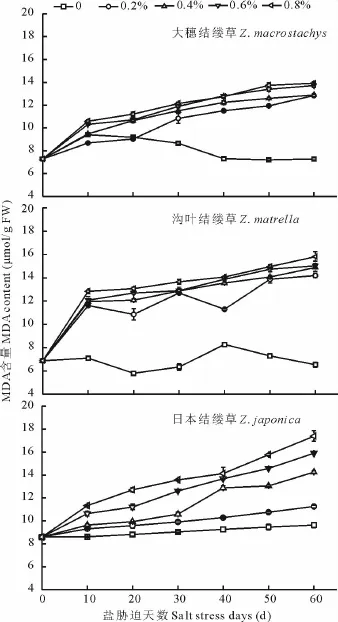
图2 不同盐浓度处理下3种结缕草叶片MDA变化Fig.2 Change of MDA content under different salt treatment of three grasses
2.4 不同盐浓度处理对3种结缕草叶片CAT活性的影响
如图3所示,大穗结缕草在低盐浓度处理(0.2%,0.4%)的CAT活性均与对照差别不大。0.6%和0.8%盐浓度处理的CAT活性均明显高于对照,且明显高于低盐处理的。浓度为0.8%的盐处理,第30天时酶活性达到峰值,为624.67[0.01Δ240nm/(g FW·min)],是对照的122.72%;沟叶结缕草CAT活性除0.2%处理的与对照无差异外,0.4%,0.6%和0.8%处理的均明显高于对照,但三者差异不显著。浓度为0.8%的盐处理,第30天时酶活性达到峰值,为544[0.01Δ240nm/(g FW·min)];日本结缕草各处理的CAT活性均高于对照,随着盐浓度的增加而增加。比较3种结缕草,在高盐浓度处理下,大穗结缕草的CAT活性值范围最高,沟叶结缕草的次之,日本结缕草的最低。从这一点亦可说明大穗结缕草的耐盐性高于沟叶结缕草和日本结缕草。
2.5 不同盐浓度处理对3种结缕草叶片SOD活性的影响
如图4所示,3种结缕草各处理的SOD活性变化规律有一定的差异,但各处理的SOD活性均高于对照的。大穗结缕草和沟叶结缕草变化趋势相似,表现为0.6%盐处理和0.4%盐处理的SOD活性达到峰值,分别为223.33和210.67 U/g FW,明显高于对照;0.4%~0.8%盐处理日本结缕草SOD活性均随着盐处理浓度的增加而增高。在中高盐浓度处理下,SOD活性差异显著(P<0.05)。从3种结缕草的SOD活性变化的总体情况来看,大穗结缕草和日本结缕草各处理的SOD活性从开始就高于沟叶结缕草的,变化规律性较小。
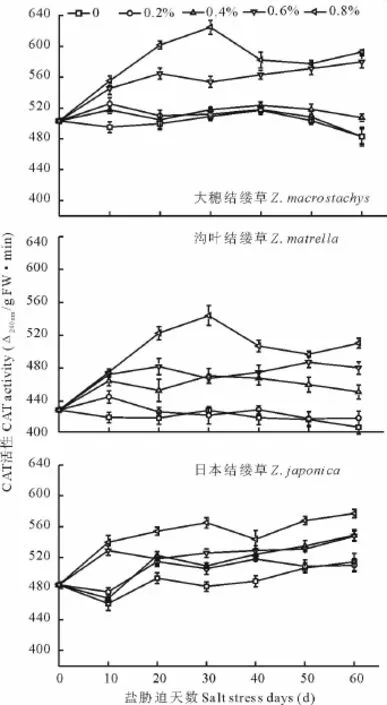
图3 不同盐浓度处理下3种结缕草叶片CAT活性变化Fig.3 Change of CAT activity under different salt treatment of three grasses
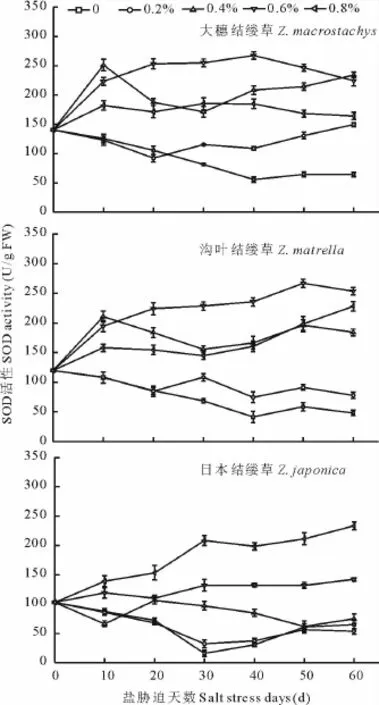
图4 不同盐浓度处理下3种结缕草叶片SOD活性变化Fig.4 Change of SOD activity under different salt treatment of three grasses
2.6 不同盐浓度处理对3种结缕草叶片Pro的影响
如图5所示,3种结缕草盐处理的Pro变化趋势基本相同,均在第10天达到峰值后下降。在低盐浓度下(0.2%和0.4%),3种结缕草的Pro含量变化与对照差异不显著(P>0.05)。0.6%处理的三者Pro含量峰值均在第10天出现,为20.34,24.53和30.64μg/g FW,分别为同期对照的241.28%,198.14%和191.26%。3种结缕草在0.6%盐处理下第10天时Pro含量与对照相比差异极显著(P<0.01),但大穗结缕草Pro含量低于沟叶结缕草和日本结缕草。在0.8%盐浓度处理下,3种结缕草的Pro含量均是大幅度上升之后又迅速回落,但大穗结缕草的仍明显的低于其他两者。在低盐浓度处理下3种结缕草叶片Pro含量和对照差异不大。
2.7 不同盐浓度处理对3种结缕草叶片可溶性蛋白的影响
如图6所示,在低盐浓度处理下大穗结缕草叶片可溶性蛋白含量呈现下降-升高-下降的变化趋势,与对照趋于吻合。在第20天后,各盐处理的可溶性蛋白含量开始上升,但均低于对照水平,各处理间差异不显著。0.6%和0.8%盐处理可溶性蛋白含量呈逐渐下降的趋势,到第60天达到最小值,分别是对照的81.82%和75.56%;沟叶结缕草和日本结缕草可溶性蛋白含量变化趋势相类似,随着盐处理浓度的升高和处理时间的延长,可溶性蛋白含量逐渐下降。在高盐浓度处理下可溶性蛋白含量显著降低,在第60天时,沟叶结缕草在高盐浓度处理下(0.6%,0.8%)可溶性蛋白含量为同期对照的59.01%和47.13%,日本结缕草可溶性蛋白含量为同期对照的74.80%和56.56%。3种结缕草可溶性蛋白含量随着盐浓度的增加和时间的延长均有所下降,大穗结缕草的下降值最小。

图5 不同盐浓度处理下3种结缕草叶片Pro变化Fig.5 Change of proline content under different salt treatment of three grasses

图6 不同盐浓度处理下3种结缕草叶片可溶性蛋白含量变化Fig.6 Change of soluble protein content under different salt treatment of three grasses
3 讨论
生物量变化是植物对盐胁迫环境的综合反映。本研究结果表明,随盐处理浓度的增加,各草种生物量逐渐下降,这与蒋乔峰等[18]和陈静波等[14]的研究结果一致。本研究中大穗结缕草根、茎、叶的生物量下降速度慢且下降最少。一般认为,耐盐性弱的植物生物量下降迅速,耐性强的植物下降的慢,因此,本研究结果表明大穗结缕草耐盐性最强。但也有研究表明,低浓度的盐胁迫会促进草坪草的生长[19],这与本研究结果不符,这是因为不同草坪草品种之间耐盐性差异不同,在同一盐处理下不同结缕草的表现也不相同。但随着盐胁迫时间的延长和盐浓度的增加,草坪草生物量逐渐下降。
一般情况下,植物体内活性氧的产生与清除处于动态平衡状态[7],盐胁迫环境下,植物体内活性氧含量上升,这种动态平衡状态被打破,因此盐胁迫下清除活性氧的能力与植物耐盐性密切相关。SOD主要催化植物体内的O2·-形成H2O2,而CAT催化H2O2生成H2O和O2。本试验中,低盐浓度处理初期,酶活性升高,这与周兴元和曹福亮[20]和樊瑞苹等[21]研究结果一致,高盐浓度处理下,3种结缕草的SOD、CAT活性增加,这与梁慧敏等[2]对盐胁迫对2种草坪草抗性生理生化指标的影响研究结果一致。但随着盐浓度的升高和时间的延长酶活性表现为先降低后升高,这一研究结果与樊瑞苹等[21]研究结果相反。植物短时间内接受高浓度盐处理,活性氧含量产生加快,植物的活性氧清除系统遭到破坏导致酶活性降低,而长时间高盐浓度胁迫后酶活性升高,可能是植物对高盐胁迫环境的一种适应。植物体内活性氧升高诱发膜脂过氧化作用,其过氧化产物MDA含量可代表膜脂受损伤的大小,可用来衡量表征膜脂过氧化的程度。Jiang和Huang[22]通过对多种植物的研究结果均表明植物在盐胁迫下,体内MDA含量均显著增大。本试验研究结果表明,3种结缕草叶片的MDA含量随盐浓度的增加呈现逐渐上升的趋势。
前人研究表明,细胞膜透性可作为衡量植物耐盐能力的指标之一[23]。Matsushita和Matoh[24]发现,盐胁迫下水稻(Oryza stativa)叶片细胞中Na+大量外流。丁顺华等[25]研究也表明,盐处理促进小麦(鲁麦15 Triticum aestivum cv.Lumai 15)叶片细胞质的相对电导率显著增大,胞内大量电解质外渗。本试验中,3种结缕草的相对电导率随盐处理浓度的增加都会增大,这一结果与周兴元和曹福亮[20]研究结果相似,但大穗结缕草电导率前后变化最小,可能是本身的盐腺比较发达,将植物吸收的盐分排除体外,这一问题将有待研究。土壤中高浓度的盐对植物会产生渗透胁迫,渗透胁迫时细胞质内会主动积累脯氨酸,使得细胞液浓度增加,渗透势降低,起到渗透调节的作用。脯氨酸还可以与蛋白结合,增强蛋白质的水合作用,增加蛋白质的可溶性和减少可溶性蛋白的沉淀,保护生物大分子结构和功能的稳定[26],还可以作为活性氧的清除剂[27]。本试验中,各处理均在第10天达到最大值,说明在高浓度盐胁迫下脯氨酸合成被明显促进,随后游离脯氨酸迅速下降的现象与周志红[10]的研究结果相反,说明脯氨酸起到很重要的渗透调节作用。可溶性蛋白的变化与植物的抗逆性有一定的关系[28-29]。盐胁迫诱导植物基因表达发生改变,表现出正常蛋白合成受阻[30]。在本试验中,3种结缕草叶片可溶性蛋白含量随着盐处理浓度的增加而降低,其中大穗结缕草始终保持较高水平且变化平稳。
本文选择细胞膜透性、MDA、CAT、SOD、Pro和可溶性蛋白6个生理指标对3种结缕草进行抗盐耐盐性分析,综合评价3种结缕草的抗盐耐盐性。综上所述,本研究认为耐盐性最高的是大穗结缕草。
[1] Wang B S,Zhao K F,Zou Q.Advances in mechanism of crop salt tolerance and strategies for raising crop salt tolerance.Chinese Bulletin of Botany,1997,14(Supplement):25-30.
[2] Lang H M,Xia Y,Du F,et al.Effects of NaCl stress on physiological index of two lawn grasses.Grassland of China,2001,25(3):27-30.
[3] He X P,Wang B D,Xie L P.Effects of Tamarix on ecological environment of saline-alkali soils.Marine Sciences,2014,38(1):96-101.
[4] Lu S Y,Guo Z F.Physiological responses of turfgrass to abiotic stresses.Acta Prataculturae Sinica,2003,12(4):7-13.
[5] Pei B,Zhang G G,Zhang S Y,et al.Effects of soil drought stress on photosynthetic characteristics and antioxidant enzyme activities in Hippophae rhamnoides Linn.seedings.Acta Ecologica Sinica,2013,33(5):1386-1396.
[6] Jiang M.Effect of abscisic acid on active oxygen species,antioxidative defence system and oxidative damage in leaves of maize seedlings.Plant Cell Physiology,2001,42(11):1265-1273.
[7] Lu Y,Lei J Q,Zeng F J,et al.Effects of NaCl treatment in growth and ecophysiological characteristics of Tamarix ramosis-
sima.Journal of Desert Research,2014,34(6):1509-1515.
[8] Tan H J,Li X R,Liu Y B,et al.Study on the antioxidative ability and salt tolerance of Reaumuria soongorica callus under salt stress.Journal of Desert Research,2013,33(2):549-553.
[9] Fen J Y,Pang M H,Liu Y C,et al.Effects and early mechanisms of complex salt and alkali conditions on seed germination and seeding growth of Flaveria bidentis.Acta Prataculturae Sinica,2010,19(5):77-86.
[10] Zhou Z H.Effects of nitric oxide on seed germination and seedling physiological response of Medicago varia under Pb stress.Grassland and Turf,2014,34(2):81-85.
[11] An M Y,Sun S S,Pu Y X H,et al.Effect of exogenous spermidine on salt tolerance in Kentucky bluegrass seedling under salinity stress.Acta Prataculturae Sinica,2014,23(6):207-216.
[12] Yu L,Liu Y H,Zhou L P,et al.A study on the change of ascorbic acid and related physiological indexes in different cultivars of Zoysia under drought stress.Acta Prataculturae Sinica,2013,22(4):106-115.
[13] Xue X D,Dong X Y,Duan Y X,et al.A comparison of salt resistance of three kinds of Zoysia at different salt concentration.Acta Prataculturae Sinica,2013,22(6):315-320.
[14] Chen J B,Yan J,Zhang T T,et al.Growth responses of four warm season turfgrasses to long-term salt stress.Acta Prataculturae Sinica,2008,17(5):30-36.
[15] Zhao K F,Li F Z.China Seedling Plants[M].Beijing:Beijing Science Press,1999:48-61,328-329.
[16] Hao Z B,Cang J,Xu Z.Plant Physiology Experiment Technology[M].Harbin:Harbin Institute of Technology Press,2004.
[17] Li H S.The Experiment Principle and Technique on Plant Physiology and Biochemistry[M].Beijing:Higher Education Press,2000.
[18] Jiang Q F,Chen J B,Zong J Q.Effects of different phosphorus concentrations on the growth and photosynthesis of Zoysia matrella under salt stress.Acta Agrestia Sinica,2013,21(3):526-533.
[19] Qian Y L,Engelke M C,Foster M J V.Salinity effects on Zoysiagrass cultivars and experimental lines.Crop Science,2000,40:488-492.
[20] Zhou X Y,Cao F L.Effects of soil salt stress on the activity of protective enzymes and peroxidation in three warm-season turfgrasses.Forest Research,2005,18(3):336-341.
[21] Fan R P,Zhou Q,Zhou B,et al.Effects of salinization stress on growth and the antioxidant system of tall fescue.Acta Prataculturae Sinica,2012,21(1):112-117.
[22] Jiang Y,Huang B.Drought and heat stress in jury to two cool-season turfgrasses in relation to antioxidant metabolism and lipid peroxidation.Crop Science,2001,41:442-463.
[23] Zhang D G.Study on the cell damage of five Poa turfgrass varieties at seedling stage under the salt stress.Journal of Gansu Agricultural University,1998,(1):38-41.
[24] Matsushita N,Matoh T.Characterization of Na+exclusion mechanism of salt tolerant reed plants in comparision with salt sensitive rice plants.Physiological Plantarum,1991,83:170-176.
[25] Ding S H,Li Y Y,Wang B S.Effect of exogenous trehalose on salt tolerance of wheat seedlings.Acta Botanica Boreal-Occidentalia Sinica,2005,25(3):513-518.
[26] Buchanan B B,Gruissem W,Jones R L.Biochemistry Molecular Biology of Plants[M].Rockville Maryland:The American Society of Plant Physiologists,2000.
[27] Ashraf M,Foolad M R.Roles of glycine betaine and proline in improving plant abiotic stress resistance.Environmental Experimental Botany,2007,59(2):206-216.
[28] Li Y B,Chen Y Y,Sun G R,et al.Preliminary study on nitrogenous metabolism of germinating Puccinellia tenuiflora seeds under alkaline salt stress.Bullentin of Botanical Research,1999,19(2):153-158.
[29] Luo Q X,Guan Q J,Jin S M,et al.Advances on application of molecular biology on plant salt tolerance research.Molecular Plant Breeding,2006,(S2):57-64.
[30] Asano T,Hakata M,Nakamura H,et al.Functional characterization of OsCPK21,a calcium-dependent protein kinase that
confers salt tolerance in rice.Plant Molecular Biology,2011,75(1-2):179-191.
参考文献:
[1] 王宝山,赵可夫,邹琦.作物耐盐机理研究进展及提高作物抗盐性的对策.植物学通报,1997,14(增刊):25-30.
[2] 梁慧敏,夏阳,杜峰,等.盐胁迫对两种草坪草抗性生理生化指标影响的研究.中国草地,2001,25(3):27-30.
[3] 何秀平,王保栋,谢琳萍.柽柳对盐碱地生态环境的影响.海洋科学,2014,(1):96-101.
[4] 卢少云,郭振飞.草坪草逆境生理研究进展.草业学报,2003,12(4):7-13.
[5] 裴斌,张淑勇,吴芹,等.土壤干旱胁迫对沙棘叶片光合作用和抗氧化酶活性的影响.生态学报,2013,33(5):1386-1396.
[7] 鲁艳,雷加强,曾凡江,等.NaCl处理对多枝柽柳(Tamarix ramosissima)生长及生理的影响.中国沙漠,2014,34(6):1509-1515.
[8] 谭会娟,李新荣,刘玉冰,等.盐胁迫下红砂愈伤组织的抗氧化能力与耐盐性研究.中国沙漠,2013,33(2):549-553.
[9] 冯建永,庞民好,刘颖超,等.复杂盐碱对黄顶菊种子萌发和幼苗生长的影响及机理初探.草业学报,2010,19(5):77-86.
[10] 周志红.3种冷季型草坪草对盐胁迫的生理响应.草原与草坪,2014,34(2):81-85.
[11] 安勐颍,孙珊珊,濮阳雪华,等.外源亚精胺调控草地早熟禾幼苗耐盐性的研究.草业学报,2014,23(6):207-216.
[12] 俞乐,刘拥海,周丽萍,等.干旱胁迫下结缕草叶片抗坏血酸与相关生理指标变化的品种差异研究.草业学报,2013,22(4):106-115.
[13] 薛秀栋,董晓颖,段艳欣,等.不同盐浓度下3种结缕草的耐盐性比较研究.草业学报,2013,22(6):315-320.
[14] 陈静波,阎君,张婷婷,等.四种暖季型草坪草对长期盐胁迫的生长反应.草业学报,2008,17(5):30-36.
[15] 赵可夫,李法曾.中国苗木植物[M].北京:北京科学出版社,1999:48-61,328-329.
[16] 郝再彬,苍晶,徐仲.植物生理实验技术[M].哈尔滨:哈尔滨工业大学出版社,2004.
[17] 李合生.植物生理生化试验原理与技术[M].北京:高等教育出版社,2000.
[18] 蒋乔峰,陈静波,宗俊勤,等.NaCl胁迫下不同磷浓度对沟叶结缕草生长及光合特性的影响.草地学报,2013,21(3):526-533.
[20] 周兴元,曹福亮.土壤盐分胁迫对三种暖季型草坪草保护酶活性及脂质过氧化作用的影响.林业科学研究,2005,18(3):336-341.
[21] 樊瑞苹,周琴,周波,等.盐胁迫对高羊茅生长及抗氧化系统的影响.草业学报,2012,21(1):112-117.
[23] 张德罡.盐胁迫对五个早熟禾草坪草品种苗期细胞膜伤害性的研究.甘肃农业大学学报,1998,(1):38-41.
[25] 丁顺华,李艳艳,王宝山.外源海藻糖对小麦幼苗耐盐性的影响.西北植物学报,2005,25(3):513-518.
[28] 李艳波,陈月艳,孙国荣,等.盐碱胁迫下星星草种子萌发过程中氮代谢的初步研究.植物研究,1999,19(2):153-158.
[29] 罗秋香,管清杰,金淑敏,等.植物耐盐性分子生物学研究进展.分子植物育种,2006,(S2):57-64.
Responses of three Zoysia grass species to salt stress
ZHAO Ying,LI Jing-Yuan,DUAN Yan-Xin,DONG Xiao-Ying*
College of Horticulture,Qingdao Agricultural University,Qingdao 266109,China
The effects of salt(NaCl)on the antioxidant system and soluble protein content during growth of Zoysia macrostachys,Z.matrella and Z.japonica was investigated.The biomass and the soluble protein contents of all three grasses reduced gradually with increasing salt concentration and duration of exposure,while leaf relative conductance and malondialdehyde(MDA)content increased.Under lower salt concentration(0.2%-0.4%),leaf relative conductance and MDA increased slightly,but both peaked at 0.8%salt.The proline content peaked 10 days after treatment application but subsequently declined.Under lower salt concentrations the activities of catalase and superoxide dismutase in all three grasses reduced gradually,while under 0.6%-0.8%salt,they initially increased,declined and then increased again.Z.macrostachys had the lowest leaf relative conductance and the lowest MDA,but the highest protective enzyme activity and soluble protein content.Consequently Z.macrostachys demonstrated greater salt resistance than Z.matrella and Z.japonica.
Zoysia grass;NaCl treatments;salt tolerance
10.11686/cyxb2015161 http://cyxb.lzu.edu.cn
赵莹,李静媛,段艳欣,董晓颖.生长期内三种结缕草对盐胁迫的响应.草业学报,2015,24(11):109-117.
ZHAO Ying,LI Jing-Yuan,DUAN Yan-Xin,DONG Xiao-Ying.Responses of three Zoysia grass species to salt stress.Acta Prataculturae Sinica,2015,24(11):109-117.
2015-03-27;改回日期:2015-05-29
青岛市公共领域科技支撑计划项目(12-1-3-50-nsh)资助。
赵莹(1989-),女,山东东营人,在读硕士。E-mail:xiaoshenglang0615@163.com
*通讯作者Corresponding author.E-mail:dxylph@163.com
