参附注射液对缺氧缺血性脑损伤新生大鼠脑保护机制研究
2015-06-24刘文强王军徐艳韩爱民杨倩倩
刘文强 王军 徐艳 韩爱民 杨倩倩
参附注射液对缺氧缺血性脑损伤新生大鼠脑保护机制研究
刘文强 王军 徐艳 韩爱民 杨倩倩
目的 探讨参附注射液对缺氧缺血性脑损伤(HIBD)新生大鼠皮质区钙离子相关蛋白钙网蛋白(CRT)的表达、细胞内游离Ca2+浓度以及神经元凋亡的影响,探讨其可能的脑保护机制。方法 将7日龄新生SD大鼠随机分为对照组、缺氧缺血组和参附干预组,各组进一步分为缺氧缺血后3、6、12、24、72 h 5个亚组,每组均10只。参照Rice等法制备HIBD模型。参附干预组于造模成功后立即腹腔注射参附注射液10 mL/(kg·d),连用3 d。缺氧缺血组和对照组注射等量生理盐水。HE染色观察大鼠病变侧脑组织病理变化;RT-PCR及Western-blot法检测各组CRT的表达变化;荧光显微镜法检测脑细胞中游离Ca2+浓度;流式细胞术检测神经元凋亡率。结果 缺氧缺血组和参附干预组各时间点CRT mRNA及蛋白表达量均较对照组升高(P<0.05),且参附干预组较缺氧缺血组升高(P<0.05);缺氧缺血组各时间点细胞内游离Ca2+浓度均较对照组明显升高(P<0.05),参附干预组细胞内游离Ca2+浓度较缺氧缺血组降低(P<0.05),但仍高于对照组(P<0.05);参附干预组各时间点的神经元凋亡率均明显低于缺氧缺血组(P<0.05),但较对照组仍升高(P<0.05)。结论 参附注射液可能通过上调CRT的表达,降低细胞内钙超载来减轻新生大鼠缺氧缺血性脑损伤。
参附注射液;缺氧缺血性脑损伤;钙网蛋白;凋亡
新生儿缺氧缺血性脑损伤(hypoxic-ischemic brain damage,HIBD)是由于各种围生期窒息引起的部分或者完全缺氧,脑血流减少或者暂停而导致胎儿或新生儿脑损伤性疾病,是引起新生儿急性死亡和慢性神经系统损伤的主要原因之一[1]。本病发病机制比较复杂,细胞内钙超载是目前比较认同的引起HIBD的机制之一,而钙网蛋白(calreticulin,CRT)作为内质网中的一种多功能分子伴侣,在维持细胞内Ca2+稳态中发挥重要作用。目前研究认为:坏死和凋亡是HIBD时神经元死亡的两种主要形式,脑缺氧缺血导致的迟发性神经元死亡主要与细胞凋亡有关[2]。
参附注射液的主要成分是人参皂甙和乌头类生物碱,其对心血管系统、缺血再灌注损伤、免疫系统以及抗肿瘤治疗等具有良好的保护作用[3]。近年来国内相关研究发现参附注射液对颅脑损伤也有很好的保护作用[4]。作者所在课题组在前期研究中已从线粒体凋亡、内质网应激等方面证实其在HIBD中具有良好的脑保护作用[5-6]。该研究在前期研究的基础上进一步探讨参附注射液对新生大鼠HIBD后内质网相关蛋白CRT表达、细胞内游离钙浓度以及神经元凋亡的影响。
1 材料和方法
1.1 材料
1.1.1 实验动物:7日龄新生SD大鼠150只,体质量12~16 g,雌雄不拘,由徐州医学院实验动物中心提供。将大鼠随机分为对照组、缺氧缺血组和参附干预组,各组进一步分为缺氧缺血后3、6、12、24、72 h 5个亚组,每组均10只,其中8只用于基因、蛋白、钙离子浓度及凋亡率的检测,另外2只用于苏木精-伊红(HE)染色。
1.1.2 主要试剂:Trizol Reagent试剂为Invitrogen公司产品,RT-PCR试剂盒购于北京天根生化科技有限公司,引物及内参均由上海生工生物技术服务有限公司提供;兔抗鼠CRT多克隆抗体购于美国CST公司,羊抗兔二抗以及β-actin 一抗、二抗均购于北京中杉金桥生物技术有限公司,Fura-2/AM由Sigma公司生产,参附注射液由雅安三九药业有限公司生产。
1.2 方法
1.2.1 模型制备:参照Rice等[7]法制作HIBD模型。对照组仅切开颈部皮肤,游离右侧颈总动脉后缝合切口,未进行缺血缺氧处理。参附干预组于造模成功后立即腹腔注射参附注射液10 mL/(kg·d),连用3 d。缺血缺氧组和对照组注射等量生理盐水。
1.2.2 HE染色:大鼠脑缺血缺氧后72 h分离右侧大脑半球标本,常规固定、脱水、石蜡包埋,统一取相当于耳间前线2 mm水平(即相当于大脑中后1/3部位)行冠状位脑组织切片,采用HE染色,光镜下观察大鼠皮层脑组织病理变化。
1.2.3 RT-PCR检测CRT mRNA:取新鲜大脑皮质标本,用Trizol试剂提取总RNA,计算相当量总RNA体积后,采用反转录试剂盒,按照说明书操作步骤进行反转录反应。CRT以β-actin作为参照物。CRT引物序列:上游5′-CAAGGATATCCGGTGTAAGGA-3′;下游5′-CATAGATATTCGCATCGGGG-3′,产物长度445 bp;β-actin引物序列:上游5′-CGTAAAGACCTCTATGCCAACA-3′;下游5′-CGGACTCATCGTACTCCTGCT-3′,产物长度229 bp。PCR体系:cDNA 3 μL,2×Taq PCR MasterMix 12.5 μL,上下游引物各1 μL,ddH2O 7.5 μL,总反应体系为25 μL;PCR扩增条件为:94℃预变性3 min,94℃变性30 s,退火30 s,72℃延伸1 min,30个循环,最后经过72℃延长7 min终止反应。CRT退火温度为55℃,β-actin退火温度为57℃。取5 μL PCR产物在1.5%(质量浓度)琼脂糖凝胶电泳后,用凝胶成像分析系统扫描、拍照,分析数据。
1.2.4 Western blot方法检测CRT蛋白含量:取新鲜右侧大脑皮质组织,用RIPA裂解液裂解蛋白,BCA法蛋白定量。上样后SDS-PAGE凝胶电泳,半干法转NC膜。一抗(1∶100)4℃孵育过夜后孵育二抗。DAB法显色后拍照,用Image J图像分析系统测条带灰度值,并做统计学分析处理。
1.2.5 脑细胞内游离Ca2+浓度测定:将大脑皮质标本制备成Hank′s悬浮液后用毛细吸管吸取一滴于洁净载玻片上,盖上盖玻片静置2 min,置荧光显微镜下观察脑细胞,采用荧光图像分析系统检测单个脑细胞荧光强度(F),激发波长340 nm和380 nm,发射波长505 nm,F340nm/F380nm比值测定胞质游离钙浓度。
1.2.6 流式细胞术检测各组大脑皮质神经元凋亡率:将新鲜大脑皮质组织在磷酸盐缓冲液(PBS)中轻柔剪碎,放离心管中用PBS稀释为4 mL,反复吹打20次,沉淀5 min,取上清,经200目尼龙网过滤2次,制成单细胞悬液,以70%(体积分数)乙醇4℃固定12 h,上机前再用PBS稀释,再次离心去上清,加入PI染液,4℃避光放置30 min,24 h内应用流式细胞仪检测。
1.3 统计学处理 采用SPSS 16.0统计软件进行统计学分析,计量资料以均数±标准差表示,多组间均数比较采用单因素方差分析(one-way analysis of variance, ANOVA),两两比较采用LSD法。以P<0.05认为差异有统计学意义。
2 结果
2.1 脑组织病理改变 光学显微镜下观察发现:对照组脑组织结构及细胞层次清晰,神经细胞排列整齐紧密,形态正常。缺氧缺血组病变区脑组织细胞间隙增大,细胞稀疏,水肿明显,表现为细胞体积增大,胞质疏松、淡染,部分细胞严重水肿,胞质透明如气球,呈气球样变;并伴有细胞坏死,表现为核固缩、核碎裂等。参附干预组细胞排列尚规则,体积稍大,呈轻度水肿改变。结果见图1。
2.2 各组大鼠CRT表达变化 结果见表1、2,图2、3。对照组各时间点CRT mRNA及蛋白表达均相对较弱,且组内各时间点间比较差异均无统计学意义(F=0.462,P>0.05;F=0.181,P>0.05)。缺氧缺血组及参附干预组各时间点CRT的表达量均较对照组升高(P<0.05),CRT mRNA表达高峰在造模后12 h,CRT蛋白表达高峰在造模后24 h;且与缺氧缺血组比较,参附干预组CRT 表达升高(P<0.05)。
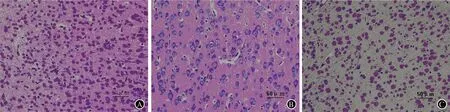
A:对照组;B:缺氧缺血组;C:参附干预组
图1 各组大鼠右侧大脑皮质区病理改变(HE)
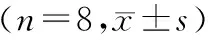
表 1 各组缺氧缺血后不同时间点CRT mRNA的相对表达量
注:CRT:钙网蛋白;与对照组比较,*P<0.05;与缺氧缺血组比较,#P<0.05;与同组其他时间点比较,△P<0.05。表2~4、图2~3同

表 2 各组缺氧缺血后不同时间点CRT蛋白的相对表达量±s)

图2 RT-PCR检测各组大鼠脑缺氧缺血后不同时间点脑组织CRT mRNA的表达(n=8)
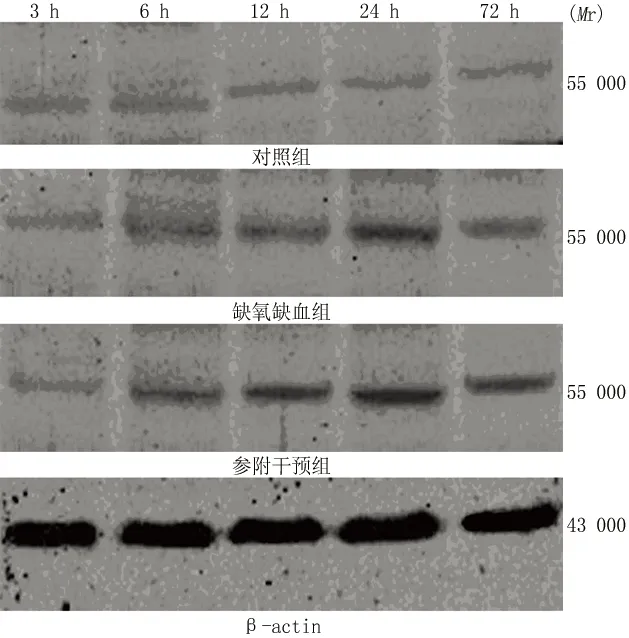
图3 Western blot方法检测各组大鼠脑缺氧缺血后不同时间点脑组织CRT蛋白的表达(n=8)

表 3 各组大鼠脑缺血缺氧后不同时间点右侧大脑皮质胞质内游离Ca2+浓度的变化±s)

表 4 各组大鼠脑缺血缺氧后不同时间点右侧皮质神经元凋亡率±s)
2.3 各组大鼠脑皮质细胞内游离Ca2+浓度变化 缺氧缺血组各时间点细胞内游离Ca2+浓度较对照组明显升高(P<0.05),并随时间推移,游离Ca2+水平升高逐渐明显;予参附注射液干预后,细胞内游离Ca2+浓度较缺氧缺血组明显下降(P<0.05),但仍高于对照组(P<0.05)。见表3。
2.4 各组大鼠大脑皮质神经元凋亡率 对照组各时间点脑皮质神经元凋亡率极低,而缺氧缺血组和参附干预组各时间点神经元凋亡率均较对照组明显升高(P<0.05),且参附干预组各时间点的神经元凋亡率与缺氧缺血组比较则明显降低(P<0.05)。见表4。
3 讨论
缺氧缺血导致的脑损伤一般分为原发性损伤(窒息后4~6 h)和更为剧烈持久的继发性损伤(窒息后6~72 h)两个阶段。因此该研究选择缺氧缺血后3 h、6 h、12 h、24 h以及72 h作为观察点。无论原发损伤还是继发损伤都会因能量衰竭造成Na+/K+-ATP失活,最终均导致大量钙离子内流,造成钙离子超载,从而介导细胞内一系列依赖钙离子的生化反应,诱导神经元凋亡。CRT是内质网中主要的Ca2+结合蛋白,通过调节内质网 Ca2+贮存而影响细胞胞质游离Ca2+水平,并作为内质网分子伴侣参与蛋白质折叠,具有调节Ca2+稳态、蛋白质折叠、细胞凋亡等多种生物学功能,在缺血再灌注损伤、缺氧缺血损伤中引起高度关注。CRT能与Ca2+-ATP酶(sarco endoplasmic reticulurn calcium ATPase,SERCA)糖基化的C-端末尾直接作用,当内质网中Ca2+耗竭时,两者解离,ATP酶活化,回收胞质内Ca2+;当内质网中Ca2+充足时,两者结合,抑制ATP酶活性,胞质内Ca2+向内质网转运停止,提示CRT可能通过SERCA来调节Ca2+稳态。目前文献中关于CRT在缺血(氧)、氧化应激等致细胞凋亡中的作用尚有争议。有报道认为CRT参与了应激细胞的保护:Liu等[8]研究发现,在创伤后应激障碍大鼠海马中,胞质内游离Ca2+浓度升高,Ca2+平衡失调,CRT表达升高,参与Ca2+超载与内质网应激的调节,减轻了细胞损伤。在微波辐射诱导的大鼠心肌微血管内皮细胞损伤模型中,外源性CRT可以通过减轻内质网应激反应发挥保护作用[9]。与上述研究相反,有报道认为CRT过表达增加细胞对凋亡刺激的敏感性:Prathyuman等[10]报道人类乳腺癌MCF-7细胞中过表达CRT可诱发凋亡的发生。Shi等[11]通过对先兆子痫患者胎盘的研究发现,CRT能促进肿瘤细胞的凋亡,抑制肿瘤细胞的增殖与侵犯。本研究发现,新生大鼠脑皮质中CRT的表达在缺氧缺血后3 h即已明显增加,其基因表达在缺氧缺血后 12 h达高峰,蛋白在24 h达到高峰,随后逐渐下降,72 h仍明显高于对照组。推测CRT相关信号转导通路在缺氧缺血性脑损伤新生大鼠大脑皮质中被激活。
参附注射液的主要成分为人参皂甙和乌头类生物碱。近年来研究发现参附注射液具有多种药理作用和神经保护作用,包括清除氧自由基,抑制脂质过氧化物的产生;抑制过量钙离子内流,减轻钙超载;降低炎性反应因子,减轻炎性反应;上调Bcl-2表达,抑制细胞凋亡等[3]。在脑保护中起主要作用的是人参皂甙。陈大庆等[12]研究发现,人参皂甙能降低颅脑损伤大鼠神经细胞的凋亡率;庄严等[13]研究表明,人参皂甙对大鼠脑损伤的保护作用可能与抑制细胞内的Ca2+超载、降低神经细胞凋亡有关。目前乌头类生物碱在心肌损伤、抗肿瘤等方面具有良好的作用[14-15],而其在脑保护方面的报道则较少。
李锋等[16]研究表明参附注射液在低(5 mL/kg)、中(10 mL/kg)、高(20 mL/kg)不同剂量经腹腔注射对SD大鼠颅脑损伤均有保护作用,且无剂量效应关系。本研究选择中等剂量的参附注射液(10 mL/kg),结果显示:与缺氧缺血组相比较,参附干预组脑组织病理损伤明显减轻,而且皮质区神经元的凋亡率显著下降,此外,参附干预组各时间点CRT表达量均高于缺氧缺血组,胞质游离钙浓度明显低于缺氧缺血组,提示参附注射液可能通过上调CRT的表达,降低钙超载来减少神经元凋亡,从而起到脑保护作用。这与陈大庆等[12]、庄严等[13]的研究结果基本一致。
综上所述,本实验结果显示缺氧缺血后新生大鼠脑皮质胞质内游离钙浓度上升,CRT表达增加,表明缺氧缺血造成了细胞内钙超载,并且激活了钙离子相关蛋白CRT。用参附注射液干预后CRT表达升高更加明显,同时胞质内游离钙浓度明显下降,而大脑皮质神经元凋亡率下降,脑组织病理损伤减轻,推测参附注射液可能通过上调CRT的表达、降低钙离子超载来发挥神经保护作用。当然,参附注射液是否还存在其他神经保护机制以及CRT是否通过SERCA来减轻钙超载尚需进一步研究。
[1]王卫平.儿科学[M].第8版.北京:人民卫生出版社,2013.107-108.
[2]Cao G, Xing J, Xiao X, et al. Critical role of calpain I in mitochondrial release of apoptosis-inducing factor in ischemic neuronal injury[J]. J Neurosci, 2007, 27(35): 9278-9293.
[3]徐军,楼洪刚,楼宜嘉,等.参附注射液药理作用的研究进展[J].上海中医药杂志,2008,42(10):87-88.
[4]史伟,张良登,宋玉明,等.参附注射液在脑血管疾病方面的临床应用与实验研究进展[J].中国中医药信息杂志,2009,16(1):109-111.
[5]王伟,王军,徐艳,等.缺血缺氧性新生大鼠皮质神经元胞浆Smac/Diablo、caspase-9的表达及参附注射液的干预作用[J].中华神经医学杂志,2011,10(3):228-231.
[6]潘红,王军,曹修丽,等.参附注射液对缺氧缺血性脑损伤新生大鼠eIF2а(p)、ATF4的影响[J].中国妇幼保健,2011,26(34):5429-5432.
[7]Rice JE, Vannucci RC, Brierley JB. The influence of immaturity on hypoxic-ischemic brain damage in the rat [J]. Ann Neurol, 1981, 9: 131-141.
[8]Liu H, Han F, Shi Y. Effect of calreticulin on Ca2+/CaM kinaseⅡalpha and endoplasmic reticulum stress in hippocampal in a rat model of post-traumatic stress disorder [J]. Neurochem Res, 2013, 38(7):1407-1414.
[9]Li WH, Li YZ, Song DD, et al. Calreticulin protects rat microvascular endothelial cells against microwave radiation-induced injury by attenuating endoplasmic reticulum stress [J]. Microcirculation, 2014, 21(6): 506-515.
[10]Prathyuman S, Sellappa S, Joseph S, et al. Enhanced calreticulin expression triggers apoptosis in the MCF-7 cell line [J]. Asian Pac J Cancer Prev, 2010, 11(4):1133-1136.
[11]Shi Z, Hou W, Hua X, et al. Overexpression of calreticulin in pre- eclamptic placentas: effect on apoptosis, cell invasion and severity of pre-eclampsia [J]. Cell Biochem Biophys, 2012, 63(2): 183-189.
[12]陈大庆,朱烈烈,李永领,等.人参皂甙Rg1对颅脑损伤模型大鼠神经细胞凋亡的影响[J].实用医学杂志,2010,26(1):30-31.
[13]庄严,时京,吕燕华,等.人参皂甙Rb1对香烟烟雾诱导的大鼠神经细胞凋亡和细胞内Ca2+浓度的影响[J].现代生物医学进展,2013,13(31):6019-6022.
[14]殷胜利,刘子由,张希,等.乌头类生物碱在体外循环心内直视手术中心肌保护作用及其机制[J].中华实验外科杂志,2005,22(10):1259-1261.
[15]饶朝龙,彭成.乌头类生物碱对ras基因表达影响及其抗肿瘤分子机制研究[J].现代预防医学,2010,37(6):1098-1100.
[16]李峰,钟宏,陈喜志,等.参附注射液对颅脑损伤的脑保护作用[J].中医药临床杂志,2006,18(5):455-456.
(本文编辑:时秋宽)
Neuroprotective effects of Shenfu injection on hypoxic-ischemic brain damage in neonatal rats
LIUWenqiang,WANGJun*,XUYan,HANAimin,YANGQianqian.
*DepartmentofNeonatology,theAffiliatedHospitalofXuzhouMedicalCollege,Xuzhou221002,China
WANG Jun, Email: snakewzh@sina.com
Objective To investigate the expression of calreticulin(CRT), the change of intracellular free calcium and neuronal apoptosis in cerebral cortex of neonatal rats with hypoxic-ischemic brain damage (HIBD), and the intervention effects of Shenfu injection. Methods Sprague-Dawley (SD) rats aged 7 days were randomly assigned to three groups: control group, hypoxic-ischemic group and Shenfu-treated group. Rat models of HIBD were established according to Rice’s method. Based on the observing time points, each group (n=50) was subdivided into 5 subgroups sacrificed at 3, 6, 12, 24 and 72 hrs. Rats in the control group were not performed ligation of the right common carotid artery and not underwent hypoxia but only performed the separation of right common carotid artery. Shenfu injection was administered by intraperitoneal injection right after H/I insult and then once daily at a dosage of 10 mL/kg for 3 days in the rats of Shenfu-treated group. Saline was also administered into the rats of hypoxic-ischemic group and control group by the same methods and the same dosage. The pathological changes of right cerebral cortex were observed under light microscope. The expression of CRT in the cerebral cortex was detected by RT-PCR and western blot. The cells of right cerebral cortex were isolated and incubated with Fura-2/AM and observed under fluorescent microscope. The free calcium concentrations were determined as the ratio of F340/F380via image analysis system. The apoptosis rate was measured by flow cytometry. Results Compared with the control group, the expressions of CRT in hypoxic-ischemic group and Shenfu-treated group were obviously up regulated (P<0.05), and the expressions of CRT in Shenfu-treated group were notably higher than those in hypoxic-ischemic group (P<0.05). The concentrations of intracellular free calcium in Shenfu-treated group were significantly decreased compared with hypoxic-ischemic group (P<0.05), but was also higher than those in control group (P<0.05). The apoptosis of neuron in cerebral cortex in Shenfu-treated group was significantly less than that in hypoxic-ischemic group (P<0.05), but was also more than that in control group (P<0.05). Conclusions Shenfu injection may be neuroprotective against HIBD by up-regulation of CRT expression and relief of calcium overload.
Shenfu injection; hypoxic-ischemic brain damage; calreticulin; apoptosis
10.3969/j.issn.1006-2963.2015.03.011
徐州市科技发展基金计划项目(XF10C066)
221002 徐州医学院附属医院新生儿科
王军,Email:snakewzh@sina.com
R743.3
A
1006-2963 (2015)03-0200-06
2014-07-31)
