缺氧对成牙骨质细胞增殖、凋亡及缺氧相关基因的影响
2015-06-23韩红娟任小华
吴 浩,韩红娟,任小华,梁 琳
(四川省医学科学院·四川省人民医院 a.口腔科,b.药学部,四川 成都 610072)
缺氧对成牙骨质细胞增殖、凋亡及缺氧相关基因的影响
吴 浩a,韩红娟a,任小华a,梁 琳b
(四川省医学科学院·四川省人民医院 a.口腔科,b.药学部,四川 成都 610072)
目的 探讨不同时间缺氧微环境对成牙骨质样细胞OCCM-30增殖、凋亡及缺氧相关基因的影响,了解缺氧在正畸导致的牙骨质吸收中所起的作用。方法 利用三气培养箱构建细胞缺氧模型,以常氧条件培养为对照组,利用MTT法测定细胞增殖率,流式细胞术检测细胞凋亡率,RT-PCR检测HIF-1α、VEGF mRNA等相关基因的表达变化。结果 缺氧可以抑制OCCM-30细胞的增殖,明显提高细胞的凋亡率,并能显著诱导HIF-1α和VEGF mRNA基因的表达,HIF-1αmRNA的表达水平在24 h达到顶峰后进入平台期;而VEGF mRNA的表达水平在36 h后开始逐步上调。结论 缺氧微环境能抑制OCCM-30细胞增殖,促进调亡及缺氧相关基因的表达。
缺氧;成牙骨质样细胞;OCCM-30;增殖;HIF-1α
正畸矫治过程中,施加于牙齿上的矫治力使牙周组织产生相应的组织改建,从而使牙齿移动。机械张/压应力和氧分压的下降是牙周系统在正畸矫治过程中受到的主要外界刺激,以前的研究大多关注机械张/压应力对其相关功能的调节。相关研究表明,缺氧微环境对成骨细胞和破骨细胞的功能均有很大的影响[1]。正畸能导致牙周血管变化,在牙周形成局部缺氧环境,正畸牙周改建中也起着同样重要的作用。本文拟对缺氧环境对成牙骨质细胞增殖、凋亡及缺氧相关基因的影响作初步的探讨,为正畸临床提供理论基础。
1 对象与方法
1.1 研究对象 本实验所使用的细胞为美国华盛顿大学Somerman教授实验室提供的成牙骨质样细胞株OCCM-30。相关研究表明,OCCM-30细胞的主要性能完全符合成牙骨质细胞功能特点,是成熟、稳定的成牙骨质细胞株体系,能作为研究成牙骨质细胞相关调控功能的模型[2]。
1.2 研究方法
1.2.1 细胞缺氧 采用德国Binder三气培养箱,通过控制N2的输入量,用传感器来实现对O2浓度的实时精确控制。将细胞按1×105个/毫升接种于中号培养瓶(50 ml)内,每瓶2 ml,镜下观察细胞大部分贴壁后(约12 h),将培养瓶转移至三气缺氧箱内,当氧气浓度降至预设浓度时(大约1~2小时),开始计时。缺氧组条件设置:2%O2、5%CO2、93%N2;对照组培养条件:20%O2、5%CO2、75%N2(细胞正常培养条件)。检测时间点:0、6、12、24、36、48、72 h。缺氧完成后按检测手段分别收集细胞。
1.2.2 MTT法测定细胞增殖率 按时间点收集细胞,调节细胞浓度为1×104个/毫升,于96孔板每孔加入200 μl,一段时间后每孔加入20 μl MTT溶液,继续孵育4小时后吸弃液体,每孔加入DMSO 200 μl,震荡15分钟,在酶联免疫检测仪上选择570 nm波长,设立不含任何细胞的空白对照孔调零,测定每孔的光密度值(OD值)。
1.2.3 流式细胞仪检测细胞凋亡 收集缺氧干预后的细胞,75%酒精调整细胞密度,在4 ℃环境下固定24小时。制作碘化吡啶(PI)溶液:将PI溶于中性PBS中,并调整终浓度为100 μg/ml,4 ℃冰箱中棕色瓶避光保存。将固定好的细胞离心5分钟后弃去液体,PBS重悬5分钟,400目滤网过滤1次除杂质,4 ℃冰箱中避光30分钟,流式细胞仪检测并进行分析。
1.2.4 RT-PCR检测HIF-1α、VEGF mRNA的表达
引物由宝生物公司代为合成及测试。HIF-1α 正向引物:5'-TGCTCATCAGTTGCCACTTCC-3',反向引物:5'-CGCTGTGTGTTTTGTTCTTTACCC-3'。VEGF 正向引物:5'-CGACAGAAGGGGAGCAGAAAG-3',反向引物:5'-GCAAGTACGTTCGTTTAACTC-3'。GAPDH正向引物:5'-GAGAGGAGAAGAAGCTTTACAC-3',反向引物:5'-CCAAGCAATTCCAATGAA-3'。逆转录条件:37 ℃ 15分钟,85 ℃ 5秒,逆转录得到模板cDNA。荧光定量PCR检测HIF-1α、VEGF mRNA基因的表达。PCR反应体系总体积20 μl,包括PCR正向、反向引物各0.8 μl,SYBR Premix Ex Taq 10 μl,ROX Reference Dye(50×) 0.4 μl,ddH2O 6 μl,DNA 模板 2 μl。设置好反应条件后,计算机系统自动控制反应并实时检测,绘制扩增曲线并分析。运用△Ct 法来评价实验结果,具体方法如下:①根据每个样本的各个基因的Ct值来计算其△Ct 值:△Ct = Ct 目的基因-Ct GAPDH;②根据步骤①计算所得△Ct 值计算相对于对照组的△△Ct值:△△Ct =△Ct 实验组-△Ct 对照组;③计算2-△△Ct 的数值,即为实验组样本的目的基因相对于对照组样本的目的基因变化的倍数。
1.3 统计学方法 数据分析采用Excel 2003 version软件进行。计量资料以均数±标准差表示。采用SNK法、单因素方差分析法(ANOVA)进行相关比较,P< 0.05为差异有统计学意义。
2 结果
2.1 OCCM-30细胞缺氧后增殖情况(图1) MTT分析法结果显示,其OD 570 nm值和对照组相比差异有统计学意义,提示缺氧可以抑制OCCM-30细胞的增殖,并且随着缺氧时间的延长,缺氧抑制OCCM-30细胞增殖的作用越明显。
2.2 OCCM-30细胞后凋亡情况(图2) 流式细胞术检测表明,缺氧可明显提高OCCM-30细胞的凋亡率,而且随缺氧时间的延长,OCCM-30细胞凋亡率逐渐增加。正常培养的各对照组中细胞的凋亡率均为(1.52±0.12)%。
2.3 OCCM-30细胞中HIF-1α mRNA的表达变化 随着缺氧的进行,HIF-1α mRNA的表达逐步上调,在24小时达到顶峰,进入平台期,从24小时起至72小时,HIF-1α mRNA的表达水平无明显差异(P> 0.05),见图3。
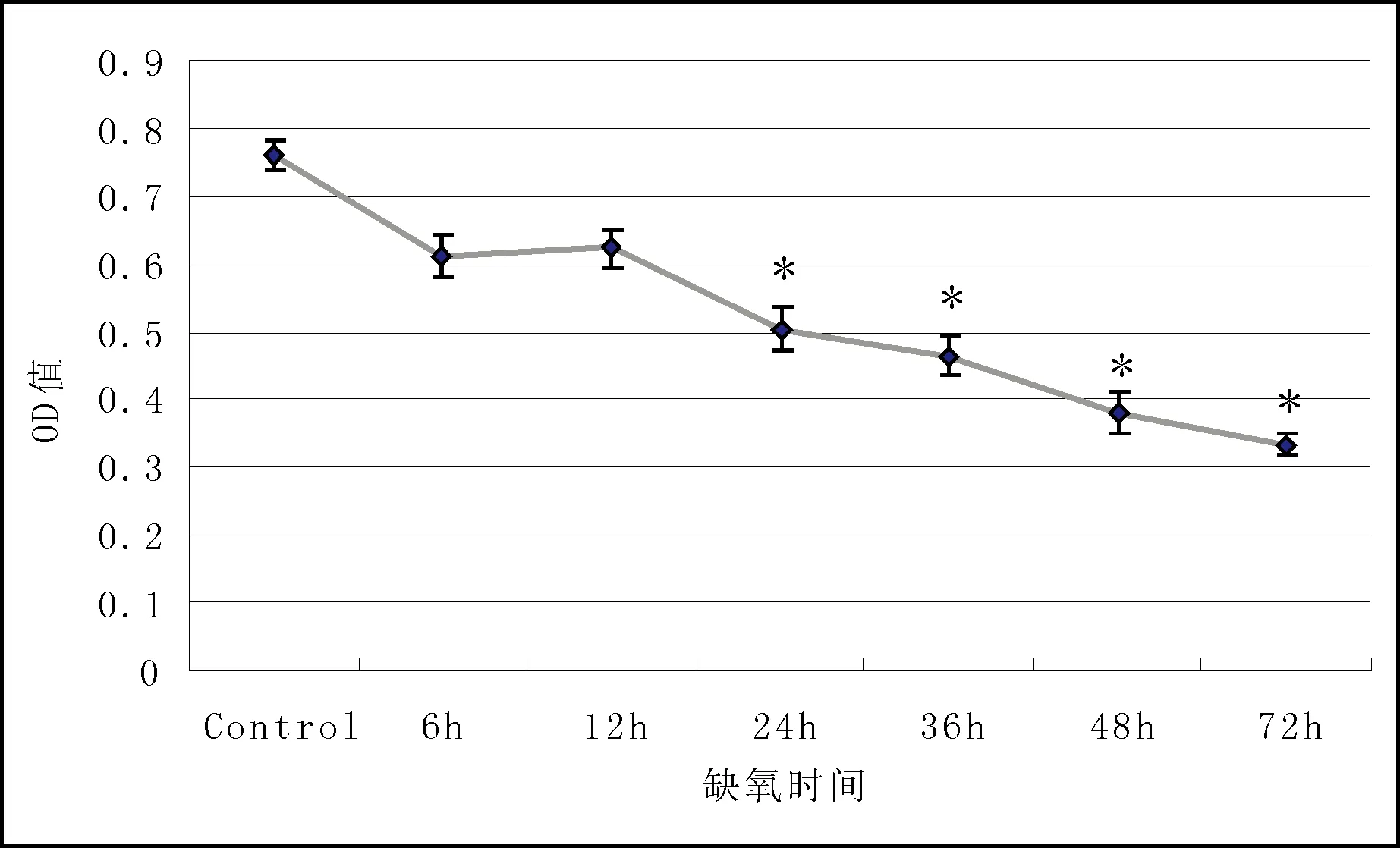
图1 OCCM-30细胞缺氧后增殖情况 与空白对照组比较:*P < 0.05,**P < 0.01
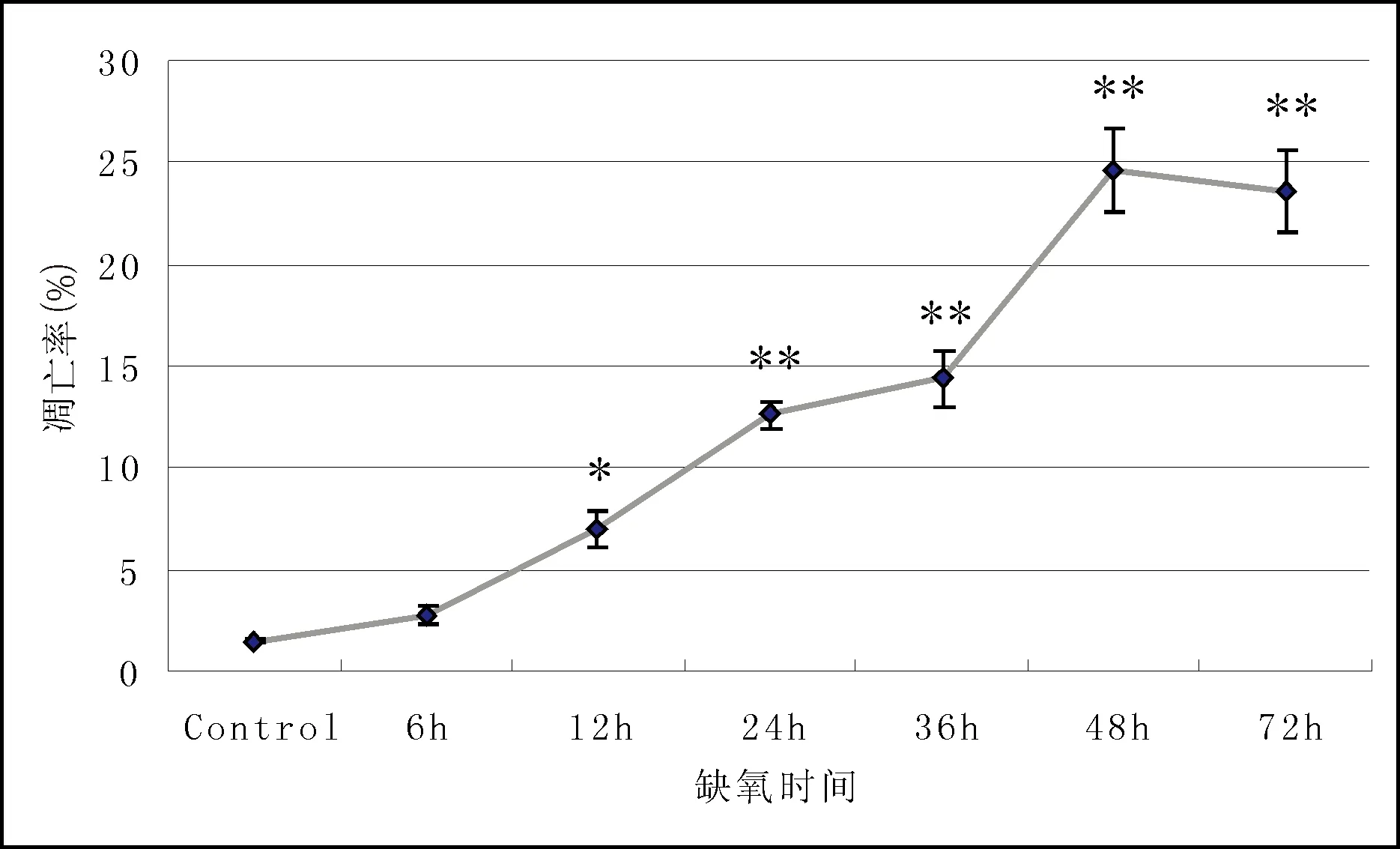
图2 OCCM-30细胞缺氧后凋亡情况 与对照组比较:*P < 0.05,**P < 0.01

图3 OCCM-30细胞缺氧后HIF-1α mRNA的表达变化 与对照组比较:*P < 0.05,**P < 0.01
2.4 OCCM-30细胞中VEGF mRNA的表达变化
细胞缺氧后6 h组、12 h组、24 h组VEGF mRNA的表达水平没有显著变化(P> 0.05),从36 h组开始,表达水平逐步上调,与对照组相比差异有统计学意义(P< 0.05),见图4。
3 讨论
Steinbrech等[3]研究表明,缺氧能显著抑制体外培养的成骨细胞的增殖活性。本实验结果显示,缺氧明显抑制OCCM-30细胞的增殖,并且具有明显的时间依赖性,随着缺氧时间的延长,这种抑制作用越明显,与大多数研究结果一致。但有研究学者也认为,缺氧既有促进细胞增殖的作用,也有抑制效应,Piret等[4]则认为缺氧的具体效应与细胞的种类、缺氧程度密切相关。缺氧微环境对细胞增殖的调控是通过细胞分裂周期、细胞代谢相关蛋白的调节来实现的,但具体机制仍待进一步研究。
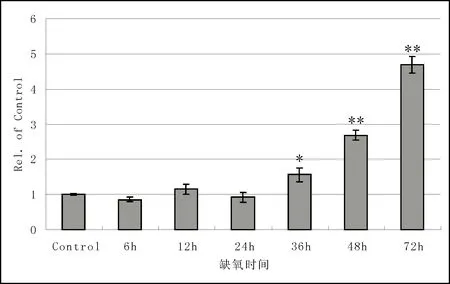
图4 OCCM-30细胞缺氧后VEGF mRNA的表达变化
本实验中对照组细胞的凋亡率为1.52%,与文献报道的体外培养细胞的正常凋亡率基本一致,反应细胞正常的更替。细胞缺氧后6 h,凋亡率高于对照组,但无明显差别,在12 h后,细胞凋亡率逐步上升,且差异均具有统计学意义,说明缺氧能显著提高OCCM-30细胞的凋亡率。在正畸矫治过程中,成牙骨质细胞受到了机械矫治力和缺氧微环境的共同作用,细胞凋亡程序启动,加速了细胞凋亡,影响到牙骨质受损后的修复。
Akeno等的研究表明[5],HIF-1α在细胞缺氧特异性应答的过程中发挥了调控作用,被认为是缺氧环境与细胞功能变化间的桥梁,是细胞缺氧后一系列变化的启动因子,接受HIF-1α调控的下游基因在其增强子或者启动子结构中具备一个或多个能与HIF-1α连接位点[6]。本实验研究显示,缺氧能显著诱导HIF-1α mRNA的表达,在缺氧6小时后,HIF-1α mRNA的表达量相比对照组即有明显的提高,并随着缺氧时间的延长表达逐步上调,在24小时达到顶峰,进入平台期,从24小时起至72小时,HIF-1α的表达水平无明显差异。可以看出,在感受到缺氧微环境后,作为细胞感受氧分压下降后的上游基因,HIF-1α在很短时间内调控即发生了变化。24小时后表达达到了高峰,可能是由于细胞内HIF-1α mRNA表达量的持续增加、累积,抑制了其继续转录,同时,细胞凋亡率上升,细胞活力开始下降,导致正常的转录水平下降。
在骨折/骨损伤修复中,成骨细胞分泌表达的VEGF诱导了新血管的生长,为新骨的形成及重塑提供必要的营养支持[7]。同时,VEGF还能通过影响骨细胞的分化进程、增殖效率来促进骨生成和重塑,在骨折重建过程中发挥重要作用[8]。本实验结果显示,缺氧微环境能显著诱导OCCM-30细胞VEGF mRNA的表达上调,但与成骨方面的研究相比在表达的时效性上存在差别,在缺氧后36小时表达量才逐步上升,可能是因为OCCM-30细胞具备成牙骨质细胞的特性,成牙骨质细胞与成骨细胞相比属于惰性细胞,大多数情况下处于未激活状态,因而在对缺氧应答上存在差异。本实验尚未观察到VEGF mRNA表达在上调后继而下降的现象,可能是因为实验设定观察时间较短,需要进一步研究。综上所述,缺氧能显著抑制成牙骨质细胞的活性,在正畸导致的牙骨质吸收过程中发挥着重要的作用。
[1] Amemiya K,Kaneko Y,Muramatsu T,et a1.Osteoblasts responses during hypoxia and reoxygenation in vitro[J].Eur J Oral Sci,2003,111(4):332-338.
[2] Arzate H,Olson SW.Isolation of human tumor cells that Produce cementum proteins in culture[J].Bone Miner,1992,18(l):15-30.
[3] Steinbrech DS,Mehrara BJ.Hypoxia regulates VEGF exPression and cellar proliferation by osteoblasts in vitro[J].Plast Reconstr Surg,1999,104(3):738.
[4] Piret JP,Mottet D.Is HIF-1 alpha a pro-or an anti-apoptotic protein?[J].Biochem phamarcol,2002,64(5):889-893
[5] Akeno N,Czyzyk-Krzeska MF,Gross TS,et al.Hypoxia induces vascular endothelial growth factor gene transcription in human osteoblast-like cells through the hypoxia-inducible factor-2α[J].Endocrinology,2001,142:959-962
[6] Douglas S,Steinbrech MD.Hyopxia regulates VEGF expression and celluar proliferation by osteoblasts in vitro[J].Plast Reconstr Surg,1999,104(3):738-747
[7] Holmes SB,Lioyd T.Distraction osteogenesis of the mandible in the previously irradiated patient[J].Oral Maxillofac Surg,2002,60:305-309
[8] Mayer Wohlfart U,Waltenberger J.Vascular endothelial growth factor stimulates chemotactic migration of primary human osteoblast[J].Bone,2002,30:472-477
Effect of hypoxia on proliferation,apoptosis and hypoxia-related gene of cementoblast-like cells
WUHaoa,HANHong-juana,RENXia-huaa,LIANGLinb
(a.DepartmentofStomatology,b.DepartmentofPharmacy,SichuanAcademyofMedicalSciences&SichuanProvincialPeople’sHospital,Chengdu610072,China)
Objective To investigate the influence of hypoxia on proliferation,apoptosis and hypoxia-related gene of cementoblast-like cells in order to understand the role of hypoxia in orthodontic-induced cementum absorption.Methods A cell hypoxic model was constructed by using a special incubator.At the same time,cell cultured under normal oxygenic pressure was used as control.MTT,FCM and RT-PCR were used to measure the proliferation ratio,apoptosis ratio and mRNA expressions of HIF-1α and VEGF.Results Hypoxia could depress the cell proliferation,increase apoptosis ratio and induce mRNA expressions of HIF-1α and VEGF of OCCM-30 cells.The expressions of HIF-1α mRNA reached the highest platform at 24 h after hypoxia while the expression of VEGF mRNA started to increase after 36 h of hypoxia.Conclusion Hypoxia could inhibit the cell proliferation and increase the cell apoptosis and hypoxia-relative gene expressions.
Hypoxia;Cementoblast-like cell;OCCM-30;Proliferation;HIF-1α
R780.2
A
1672-6170(2015)01-0043-03
2014-08-20;
2014-10-10)
