细胞牙骨质发育的组织形态学观察
2014-11-05于西佼杜言梅
于西佼,杜言梅,姜 欢,杜 毅
(济南市口腔医院牙体牙髓科,山东济南 250001)
赫特威尔氏上皮根鞘(Hertwig's epithelial root sheath,HERS)是牙根发育过程中上皮-间充质所发生的一系列交互信号诱导而得以实现的重要且唯一的上皮性结构[1]。本实验选择出生后不同时期BALB/c小鼠的下颌第一磨牙根尖1/3区细胞牙骨质,追踪观察其细胞牙骨质在发育过程中的组织形态和细胞活性改变,以探讨来源于上皮根鞘断裂的上皮性细胞是否参与细胞牙骨质的发育。为进一步研究牙骨质发育时的交互诱导信号,实现牙骨质的再生提供前期研究基础[2-3]。
1 材料和方法
1.1 主要试剂和仪器
In situ Cell Death Detection Kit(Roche,德国);Mouse monoclona to cytokeratin 14(Abcam,UK);PV免疫组化两部法试剂盒、AEC显色剂、ClearmountTM封片剂(北京中杉);蛋白酶 K(MERK,德国);Tris/HCI、多聚赖氨酸(Sigma,美国);RM2135切片机(LEICA,德国);OLYMPUS CX71显微镜及照相系统、JEM-1200EX透射电镜(Olympus,日本)。
1.2 标本制备
分别取出生后15、19、25 d的BALB/c小鼠各8只(山东大学动物实验中心提供),引颈处死后解剖分离其双侧含下颌第一磨牙的下颌骨段。其中一侧分别经40 g/L多聚甲醛固定、100 g/L EDTA脱钙1个月后,梯度乙醇脱水、石蜡包埋,制作近远中向5 μm连续切片;分别用于根尖1/3区牙骨质发育的常规组织学观察、免疫组化和细胞凋亡检测。另一侧置于25 mL/L戊二醛液中4℃下固定,用于透射电镜观察。
1.3 PV免疫组化染色法检测CK14的表达
上述石蜡切片常规脱蜡、水化至水,并用30 mL/L过氧化氢液室温孵育10 min,以灭活内源性过氧化物酶活性;然后分别滴加CK14单克隆抗体(1∶100稀释),37℃温箱孵育1 h;PBS洗2 min×3次,滴加羊抗鼠IgG抗体-HRP多聚体,37℃孵育20 min;PBS漂洗,AEC溶液显色;蒸馏水冲洗,苏木素复染30 s;常规脱水、透明、水溶性ClearmountTM封片。以PBS代替一抗作阴性对照,显微镜下观察CK14的表达情况(细胞质内有棕红色颗粒者为阳性表达,蓝色者为阴性)。
1.4 TUNEL法检测细胞凋亡
上述石蜡切片常规脱蜡、水化至水,并用30 mL/L过氧化氢液室温处理7 min,以灭活内源性过氧化物酶。分别经DDW(double distilled water)冲洗、0.1 mol/L PBS液(pH 7.4)洗2 min×3次后,滴加 16.2 μg/mL 蛋白酶 K(10 mmol/L Tris/HCI pH 7.4),37℃温箱孵育消化 10 min;DDW冲洗,PBS洗2 min×3次,每张切片滴加20 μL的TUNEL反应液(1号液与2号液按1∶9混合配制,1号液为末端脱氧核酸转移酶TdT,2号液为核苷酸混合液),置于湿盒中37℃ 温箱孵育90 min;DDW冲洗,PBS洗2 min ×3次,滴加正常山羊血清室温处理10 min,以减少非特异性结合;PBS洗2 min×3次,滴加酶标记的抗荧光素抗体转化剂-POD(3号液),湿盒内37℃温箱孵育30 min;DDW冲洗,PBS洗2 min ×3次,滴加DAB显色剂镜下显色;DDW终止显色反应后冲洗,苏木精复染30 s;自来水冲洗5 min,常规脱水、封片。以PBS液代替TUNEL反应液作阴性对照,显微镜下观察凋亡细胞的表达情况(细胞核呈棕黄色或褐色着色者为阳性表达)。
1.5 透射电镜观察
分别取25 mL/L戊二醛液4℃下初固定48 h后的各小鼠一侧下颌骨,初步修剪后置于100 g/L EDTA液中脱钙2周;0.1 mol/L PBS液(pH 7.4)冲洗后再置于10 g/L锇酸液中后固定2 h;梯度乙醇(300、500、700、850、950 mL/L 和无水乙醇 3 次)脱水后,换置环氧乙烷并逐步过渡到Spurr包埋剂中进行包埋;升温聚合后,修块切片,碱性品红-亚甲蓝染色1~2 min;水冲后显微镜下观察定位,并进一步修块、制作80 nm超薄切片;然后用醋酸双氧铀、柠檬酸铅进行双重染色,JEM-1200EX透射电镜观察并拍照。
2 结果
2.1 免疫组化和细胞凋亡检测结果
BALB/c小鼠出生后第15天,其下颌第一磨牙即有细胞牙骨质开始形成;出生后第19天,可见根尖1/3区被细胞牙骨质覆盖,细胞凋亡检测发现部分被埋入或正被埋入的胞核呈棕黄色,部分呈蓝色,提示细胞凋亡表达阳性 (图1)。免疫组化染色结果显示,CK14阳性表达位于细胞质呈棕红色,出生后第15~19天,处于细胞牙骨质形成阶段,成牙骨质细胞被新形成的牙骨质基质埋入从而成为牙骨质细胞;而在被埋入或即将埋入的细胞中可见部分细胞阳性表达CK14,提示其上皮性来源(图2)。
2.2 超微结构观察结果
上皮根鞘断裂后,在HERS细胞的外侧可见成牙骨质细胞的存在,BALB/C小鼠出生后第15天时,可见部分上皮性细胞在根面被成牙骨质细胞分泌的基质所包围(图3);出生后第19天,部分HERS断裂后的上皮性细胞转移到了牙周膜内形成上皮剩余,并出现异染色质比率增加、月型改变等细胞凋亡征象(图4)。伴随牙齿萌出,牙骨质形成较快,可见成牙骨质细胞正被牙骨质基质埋入(图5)或已经被埋入而成为牙骨质细胞(图6)。出生后第25天时,伴随成熟牙骨质的厚度增加,在细胞牙骨质陷窝内可见牙骨质细胞(图7~8)。
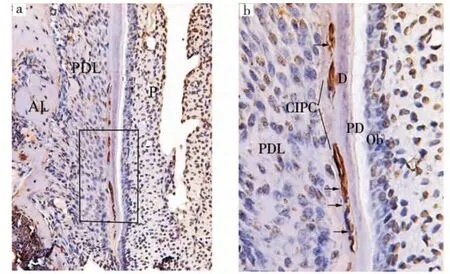
图1 小鼠根尖1/3区细胞凋亡阳性表达(箭头示)(TuNEL,a.×20;b.×40)
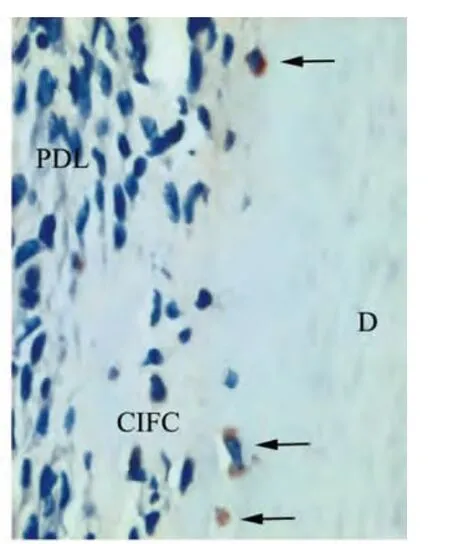
图2 CK14阳性表达的细胞埋入牙骨质基质中(箭头示)(PV,×40)
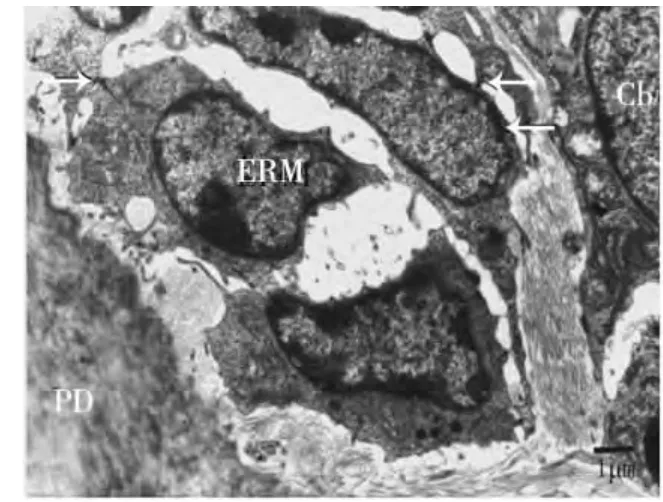
图3 成牙骨质细胞分泌的基质包围牙根表面的上皮性细胞团(箭头示桥粒连接)
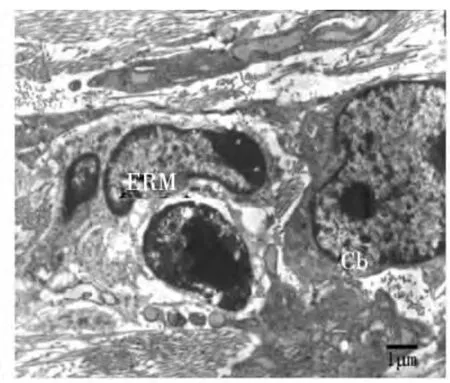
图4 成牙骨质细胞内大量粗面内质网,提示其分泌功能活跃;可见异染色质比率增加、出现月型改变的上皮剩余细胞团
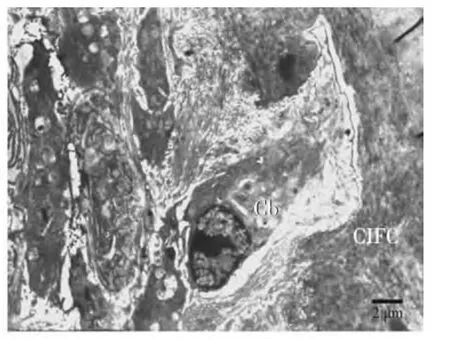
图5 成牙骨质细胞正被牙骨质基质埋入
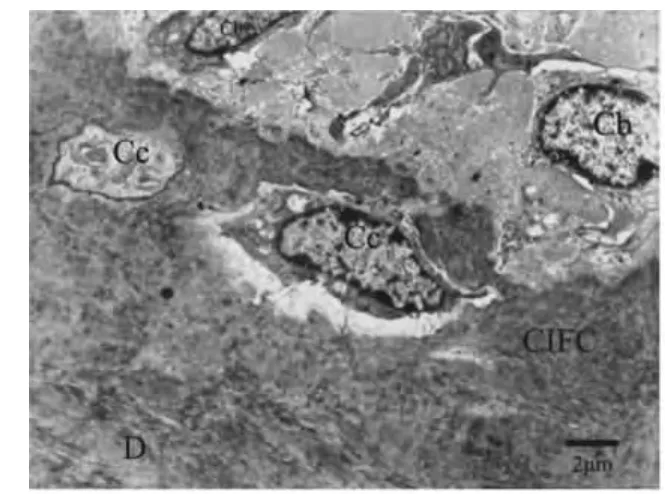
图6 成牙骨质细胞已被牙骨质基质埋入成为牙骨质细胞
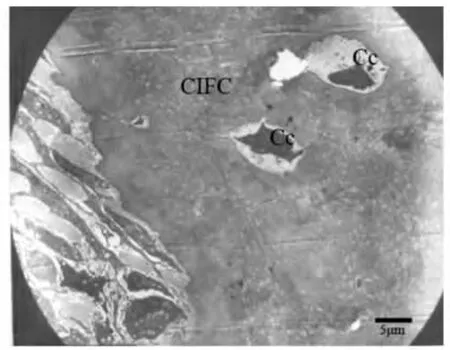
图7 细胞牙骨质
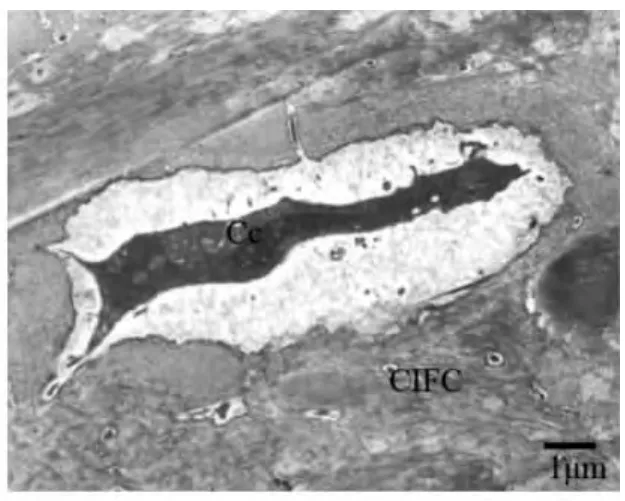
图8 牙骨质细胞位于陷窝内,并可见细胞突起
3 讨论
本实验通过观察出生后不同时期BALB/C小鼠根尖1/3区细胞牙骨质的发育情况,以探讨上皮根鞘断裂后的上皮性细胞是否参与细胞牙骨质的发育。结果显示,细胞角蛋白14能较特异的标记上皮根鞘细胞,从而可以追踪上皮根鞘断裂后的结局和转归[3-4];部分被埋入或即将埋入牙骨质基质的细胞呈CK14阳性表达,说明了这些细胞为上皮性来源;超微结构观察发现,根面的上皮性细胞被其外侧成牙骨质细胞分泌的基质包围,提示上皮根鞘细胞断裂后产生的上皮细胞可能通过成为牙骨质细胞而参与细胞牙骨质的形成。
根据牙骨质的细胞分布和纤维来源,可将牙骨质分为5种类型:无细胞无纤维牙骨质(AAC)、无细胞外源性纤维牙骨质(AEFC)、有细胞固有纤维牙骨质(CIFC)、无细胞固有纤维牙骨质(AIFC)、有细胞混合性分层牙骨质(CMSC)。无细胞外源性纤维牙骨质一般位于牙根近冠方的1/3,含有密集排列的胶原纤维,方向与牙根面垂直。CMSC为AEFC和CIFC不规则交替沉积而成,通常分布在根分歧区及根尖区;该类牙骨质既含有成牙骨质细胞产生的平行于根面排列的胶原纤维,也含有外源性穿通纤维,牙骨质细胞分布其中。最靠近牙本质区域为CIFC,其纤维与牙本质纤维呈交错混合排列,起附着作用;AEFC位于近牙周膜侧,含大量穿通纤维,这些纤维插入其深面的CIFC中[5]。牙骨质再生的最终目的是诱导AIFC和CMSC的形成,其中CIFC除参与构成CMSC外,还是修复性牙骨质的一种类型,由成牙骨质细胞形成,能对牙骨质吸收或缺陷区、根折区进行修复。
HERS是牙根发育中的决定性结构,是牙根发育过程中上皮-间充质所发生的一系列交互信号诱导而得以实现的重要且唯一的上皮性结构[6]。断裂后的HERS细胞部分转移到了牙周膜内形成上皮剩余(epithelial cell rests of Malassez,ERM),并终生存在于牙齿发育完成后的牙周组织中。有研究已证实,上皮剩余在牙周组织内环境的维系[7]、牙骨质修复[8]等方面均发挥重要作用[9]。但是,这些来源于断裂HERS的上皮细胞是否在细胞牙骨质形成中也存在上皮-间充质交互信号诱导,将会成为我们进一步研究的方向;并在此基础上深入研究不同类型牙骨质发育的机理,从而最终实现真正的牙骨质再生。
[1]Luan X,Ito Y,Diekwisch TG.Evolution and development of Hertwig's epithelial root sheath[J].Dev Dyn,2006,235(5):1167-1180.
[2]Yang Y,Ge Y,Chen G,et al.Hertwig's epithelial root sheath cells regulate osteogenic differentiation of dental follicle cells through the Wnt pathway[J].Bone,2014,63:158 -165.
[3]Wang Y,Lv L,Yu X,et al.The characteristics of epithelial cell rests of Malassez during tooth eruption of development mice[J].J Mol Histol,2014,45(1):1 -10.
[4]Xiong J,Gronthos S,Bartold PM.Role of the epithelial cell rests of Malassez in the development,maintenance and regeneration of periodontal ligament tissues[J].Periodontol,2000,2013,63(1):217-233.
[5]Bosshardt D,Nanci A.Structure of periodontal tissues in health and disease[J].Periodontol,2000,2006(40):11 -28.
[6]Lee JH,Lee DS,Nam H,et al.Dental follicle cells and cementoblasts induce apoptosis of ameloblast-lineage and Hertwig'sepithelial root sheath/epithelial rests of Malassez cells through the Fas-Fas ligand pathway[J].Eur J Oral Sci,2012,120(1):29-37.
[7]Fujiyama K,Yamashiro T,Fukunaga T,et al.Denervation resulting in dento-alveolar ankylosis associated with decreased Malassez epithelium[J].J Dent Res,2004,83(8):625 -629.
[8]Rincon JC,Xiao Y,Young WG,et al.Production of osteopontin by cultured porcine epithelial cell rests of Malassez[J].J Periodontal Res,2005,40(5):417 -426.
[9]Nam H,Kim J,Park J,et al.Expression profile of the stem cell markers in human Hertwig's epithelial root sheath/Epithelialrests of Malassez cells[J].Mol Cells,2011,31(4):355-360.
