兔骨骼肌卫星细胞的分离、培养及成肌特性
2015-06-12柯棠山刘坤祥
柯棠山,董 进,廖 娟,刘坤祥
(遵义医学院 医学与生物学研究中心,贵州 遵义 563099)
基础医学研究
兔骨骼肌卫星细胞的分离、培养及成肌特性
柯棠山,董 进,廖 娟,刘坤祥
(遵义医学院 医学与生物学研究中心,贵州 遵义 563099)
目的 建立高纯度、高丰度的兔骨骼肌卫星细胞的分离、培养方法,并对培养的肌卫星细胞体外增殖和成肌特性进行观察。方法 采用改良I型胶原酶和胰蛋白酶混合消化法结合差速贴壁培养以分离、纯化1周龄幼兔小腿三头肌来源的骨骼肌卫星细胞。镜下观察肌卫星细胞生长形态,结蛋白(Desmin)免疫组化染色鉴定体外培养的肌卫星细胞,MTT法绘制细胞生长曲线,并对分离培养的肌卫星细胞成肌特性进行诱导培养观察。结果 差速贴壁后的悬浮肌卫星细胞折光性强,呈透亮球形,数量较多,贴壁生长后逐渐变为长梭形;免疫组化染色检测分离培养的细胞高表达Desmin,证明为肌卫星细胞,纯度高达95%;传代培养的肌卫星细胞24 h后开始增殖,第3~7天处于对数生长期,第8天后进入平台期;不经诱导分化培养基培养的肌卫星细胞也可融合形成肌管,但形成肌管速度不及诱导分化培养组快速。结论 成功建立了具有操作简便、不易污染和纯度高的兔骨骼肌卫星细胞分离、培养方法,为采用肌卫星细胞为种子细胞的再生医学研究奠定实验基础。
肌卫星细胞;细胞培养;兔
骨骼肌卫星细胞(skeletal muscle satellite cells,SC)是一种位于肌纤维肌膜与基底膜之间的多潜能干细胞,由Mauro首次发现。肌卫星细胞通常处于有丝分裂静止期,当骨骼肌受到外伤和负重锻炼等应激刺激时,肌卫星细胞即被激活而迅速增殖,补充死亡的肌纤维、修复损伤的骨骼肌。骨骼肌卫星细胞池内干细胞数量和质量的稳定,对维持体内肌纤维的数量与生长及损伤后骨骼肌的修复和再生具有重要意义[1]。高纯度的肌卫星细胞分离、培养方法,是研究肌卫星细胞生物学特性的重要工具[2]。目前虽有一些文献报道体外肌卫星细胞培养的方法,但对兔卫星细胞的研究较少,且操作步骤粗略,可重复性低。本实验拟建立可获取高纯度、较多数量兔骨骼肌卫星细胞的分离及培养方法,为后续的肌卫星细胞移植治疗失神经肌萎缩研究奠定了基础。
1 材料与方法
1.1 实验动物 选用1周龄健康新西兰大白兔,雌雄不限,由遵义医学院实验动物中心提供。
1.2 主要试剂 HG-DMEM培养基、DMEM/F12培养基由Hyclone公司提供,Ⅰ型胶原酶购于Sigma公司,胎牛血清(fetal bovine serum,FBS)和马血清(horse serum,HS)购自Gibco公司,青霉素、链霉素、胰蛋白酶、多聚赖氨酸由Solarbio公司生产,小鼠IgG免疫组化试剂盒(SABC即用型)、Desmin 蛋白抗体及DAB显色试剂盒均购于武汉博士德公司。
1.3 实验方法
1.3.1 动物消毒与取材 37 ℃蒸馏水清洗幼兔2次,2%戊巴比妥钠腹腔注射麻醉,颈椎脱臼处死,75%酒精浸泡消毒5~10 min,无菌条件取出幼兔后肢小腿三头肌并去除肌表面的筋膜,放入冰浴的含有双抗PBS的15 mL离心管,置于超净台。
1.3.2 兔骨骼肌卫星细胞的分离、纯化和培养 参照黄郁凯等[3]混合酶消化法进一步优化胶原酶和胰蛋白酶比例及浓度,缩短消化时间。用含双抗的PBS冲洗肌块2次后转移到无菌培养皿,用眼科镊、眼科剪尽可能去除筋膜、神经、血管和脂肪组织,除去杂质的肌块转入新的无菌培养皿,充分剪碎肌组织,约1 mm3大小。PBS冲洗,吹打,静置,弃去漂浮物,重复2~3次。将剪碎的肌肉组织块转入无菌锥形瓶,加入不含血清的DMEM培养基、0.2 %胶原酶、0.2 %胰蛋白酶各5 mL,37 ℃水浴消化40 min(期间轻摇动锥形瓶,缓速圆周运动,使肌组织与酶充分接触);加含胎牛血清的培养基终止消化,收集消化的细胞悬液和未消化完全的组织块经200目、400目细胞筛过滤。收集滤液,1000 r/min离心5 min,弃除上清液,在沉淀中加入适量的生长培养基重悬,台盼蓝染色,计数活细胞,种植密度不低于105个细胞/mL。培养条件: HG-DMEM(20%FBS,青霉素100 U/mL,链霉素100 (g/mL),37 ℃、5%CO2及饱和湿度。差速贴壁3 h,重复2次。收集上清液,转入多聚赖氨酸包被的培养瓶,培养3 d后第1次换液,以后每隔48小时换液1次,倒置相差显微镜观察细胞形态和生长情况。
1.3.3 SC的传代培养 待6 d左右细胞汇集达60%~70%,用0.25%胰蛋白酶充分消化4~6 min,以1∶2比例传代培养,每隔2天换液1次,倒置显微镜下观察。
1.3.4 MTT法检测体外培养骨骼肌卫星细胞的生长特性 取生长状态良好的第3代增殖期细胞,以8×103/孔接种到96孔板中,每孔培养体系为200μL,置于37 ℃、5%CO2孵箱中进行培养,每24小时随机选取1组培养板6个培养孔内加入MTT试剂,测定每个孔的吸光度值(A)。计算每天每组6孔的吸光度平均值,绘制肌卫星细胞生长曲线 。
1.3.5 兔骨骼肌卫星细胞成肌特性观察 选取第2代肌卫星细胞,胰蛋白酶消化后以1×105/孔接种于2块6孔培养板内,加入含20%FBS的HG-DMEM 培养基进行培养。待培养细胞增殖至70%~80%汇合时,其中一板在生长培养基下继续培养,另一板改用分化培养基(含2%马血清的DMEM/F12培养基)培养,镜下观察比较两板细胞的排列状态、细胞间的融合及肌管形成的差异。
1.3.6 兔骨骼肌卫星细胞的鉴定 选原代培养细胞爬片,4%多聚甲醛室温固定30 min,蒸馏水冲洗;0.5% Triton-X100 4℃孵育4 h,蒸馏水冲洗;30%H2O21份+纯甲醇50份混合,室温30 min,蒸馏水冲洗;消化酶处理10 min,蒸馏水冲洗;5%BSA 封闭液37 ℃30 min,甩去多余液体;滴加稀释的抗Desmin蛋白抗体(一抗),PBS 代替一抗作为阴性对照,4 ℃过夜,PBS冲洗;滴加相应的二抗, 37 ℃30 min,PBS冲洗;滴加SABC,37 ℃ 30 min,PBS冲洗;滴加DAB显色液显色,镜下控制反应时间;苏木素轻度复染;脱水,透明,封片;显微镜观察,以细胞浆内出现棕黄色颗粒为阳性染色。
2 结果
2.1 兔肌卫星细胞的分离和培养 经2次差速贴壁后悬浮的细胞数量较多,在倒置相差显微镜下观察细胞球形透亮,折光性强(见图1A),视为肌卫星细胞,培养12~14h后细胞开始贴壁,培养3 d后完全贴壁,细胞逐渐延伸成纺锤形或长梭形(见图1B)。随着培养时间的延长,细胞迅速增殖且排列呈现方向性。培养第7天,细胞开始以长轴平行汇合(见图1C),至第14天见整个视野长梭形细胞高度汇合(见图1D)。在生长培养基中继续培养,则高度汇合的细胞开始出现融合,形成多核肌管细胞,肌管呈长条形,光滑透亮。
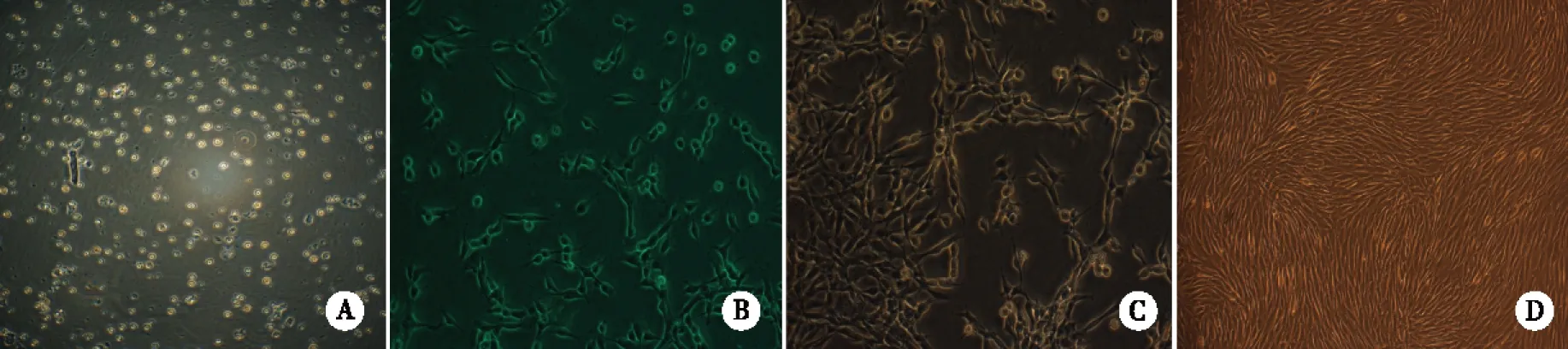
A:为2次差速贴壁后的SC细胞 ×100;B:为原代培养第3天的SC细胞 ×200;C:为原代培养第7天的SC细胞 ×200;D:为原代培养第14天的SC细胞×100。
2.2 体外培养骨骼肌卫星细胞的生长特性 传代培养的肌卫星细胞系24 h后开始增殖,第3~7天处于对数生长期,第8天后增殖速度明显减慢,处于平台期,此时细胞生长汇合度在80%以上(见图2)。
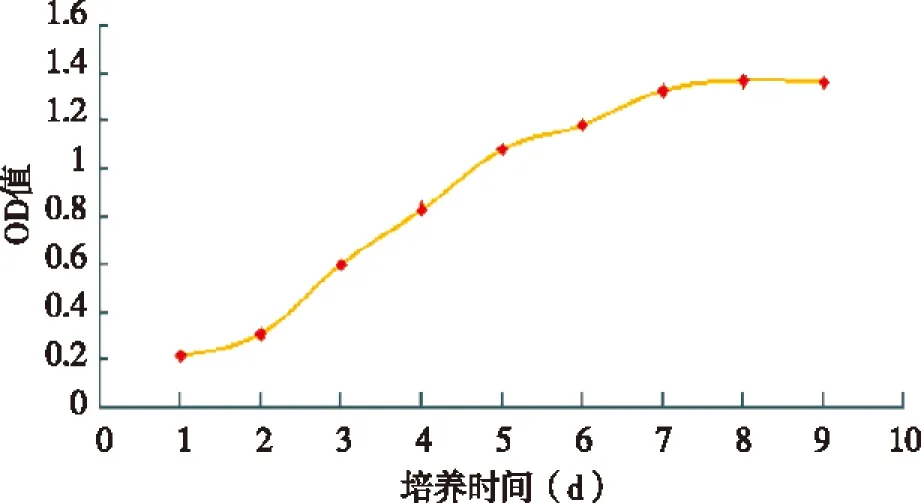
图2 SC细胞生长曲线(MTT法)
2.3 兔骨骼肌卫星细胞的成肌特性 在生长培养基培养下,肌卫星细胞贴壁培养1周左右,细胞汇集达60%~70%,开始有散在细胞相互融合,形成长索形肌卫星细胞链(见图3 A),随着培养时间的延长,细胞密集,细胞间的融合更为广泛,3周左右开始形成粗大透亮的肌管,培养至第30天,肉眼可见培养瓶底部形成膜状结构(见图3B)。当细胞增殖至70%~80%汇集时,改用分化培养基培养,肌卫星细胞增殖速度明显下降,24 h后开始有少量细胞相互融合,1周可见散在的肌管形成(见图4A、4B)。
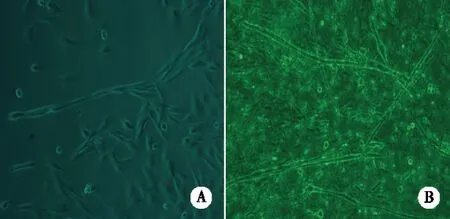
A:生长培养基传代培养第7天,SC沿长轴相互连接,呈融合趋势,形成细胞链 ×200;B:生长培养基传代培养第30天,可见多条长条状透亮的肌管×100。
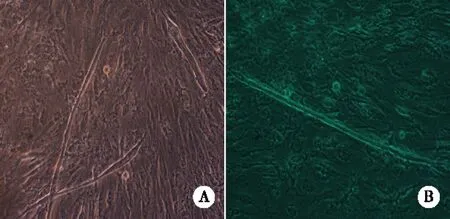
A、B:诱导培养7 d的SC细胞,可见到光滑透亮的肌管 ×200。
2.4 兔骨骼肌卫星细胞的鉴定 细胞 Desmin蛋白免疫组化染色显示兔骨骼肌卫星细胞为强阳性表达(见图5),以PBS代替Desmin抗体作为一抗的免疫组化染色SC显示为阴性。

A:示胞浆深棕色阳性染色 ×100;B:示苏木素复染细胞核呈蓝色 ×200。
3 讨论
骨骼肌卫星细胞由Mauro于1961年首先发现,电镜下观察到其位于基膜和肌细胞膜之间,紧贴肌细胞表面而命名为肌卫星细胞。以后进一步证实肌卫星细胞参与了骨骼肌的生长和修复,具有自我增殖和多向分化的能力,维持着体内肌肉干细胞池的稳定,在骨骼肌的生长和再生中起着重要作用[4]。然而,随着机体衰老肌卫星细胞池发生改变,卫星细胞的数量减少,导致了肌肉再生能力下降。一些肌源性疾病如假性肥大型肌营养不良症(Duchenne muscular dystrophy,DMD)患者,由于肌卫星细胞数减少、丧失再生能力,不能满足机体对肌卫星细胞持续需求,导致进行性肌肉无力与慢性退化。因此,对DMD患者不断补充肌卫星细胞视为目前的重要治疗手段之一[5]。最近的研究还显示肌卫星细胞在心肌等疾病的修复中亦有良好的应用前景[6-7]。然而,干细胞治疗的先决条件是获得稳定、可靠和数量较多的干细胞。
已经报道有多种分离纯化骨骼肌卫星细胞的方法,包括肌组织块酶消化、直接分离单根肌纤维培养和根据细胞表面分子标志的流式细胞和免疫磁珠分选等,但效果并不理想。由于肌卫星细胞所处的位置,细胞连接紧密,单纯用胶原酶消化并不能有效将肌束上的卫星细胞分离且耗时;单根肌纤维培养获得的肌卫星细胞数量有限;而培养条件不同,细胞表面分子标志发生变化,将影响流式细胞和免疫磁珠分选的结果,也给后续的扩增和应用带来不利影响。不同年龄、不同骨骼肌类型中肌卫星细胞的数目不同,年幼个体的卫星细胞含量较丰富,慢肌比快肌卫星细胞含量多,所以实验取材对象和部位的选择十分重要[2]。
在肌卫星细胞纯化方面,有文献报道采用Percoll 液梯度离心法[8],但存在程序繁琐、细胞损失大、易污染等缺点。黄郁凯等[3]采用悬浮培养法培养获得大鼠骨骼肌干细胞团,批量扩增骨骼肌干细胞,模拟了组织的三维结构,但也存在细胞成团慢、杂质细胞多等不足。本实验从兔后肢的慢肌小腿三头肌取材,使用胶原酶和胰蛋白酶联合消化分离方法,可以发挥叠加作用,使肌肉组织充分消化释放出肌卫星细胞,并减少消化的总体时间,降低消化酶对细胞的损伤,同时消化期间改用轻轻摇动锥形瓶做缓速圆周运动,去除了既往SC提取方法中消化期间需反复吹打的繁琐步骤,减少操作污染的几率。采用传统的2次差速贴壁就可以获得较高纯度的卫星细胞。鉴于卫星细胞贴壁慢,采用多聚赖氨酸包被的培养瓶培养,取得了良好的贴壁效果。Desmin是一种分子量为56ku的中间丝蛋白,在维持骨骼肌细胞的完整性以及肌小节之间的信息传递中发挥作用,是肌组织的特异性标记[9]。本实验对分离培养的目的细胞经抗结蛋白( Desmin) 抗体免疫组化染色结果呈阳性,纯度高达95%,进一步证实为肌卫星细胞。我们的结果表明,在未使用诱导分化培养基培养时,肌卫星细胞仍可融合形成肌管,需要20 d,使用诱导分化培养基马血清后,却只要7d就可见肌管形成,这提示使用诱导分化培养基可为SC分化培养赢得时间。
近年来随着干细胞的研究和探索,进一步的发展,干细胞的应用逐渐广泛,但仍然存在多方面的不足,如来源有限,获取困难等,不能很好的解决应用于临床问题[10]。肌卫星细胞作为骨骼来源的干细胞,在组织工程应用如骨骼肌、心肌、骨、软骨等的修复重建等具有广阔的前景和实用价值。我们采用胶原酶与胰蛋白酶联合消化和差速贴壁离心相结合的分离纯化方法,得到的骨骼肌卫星细胞数量较多且效果较好,可为上述应用前景提供基础。
[1] Kuang S, Kuroda K, Le Grand F, et al. Asymmetric self-renewal and commitment of satellite stem cells in muscle[J]. Cell, 2007, 129(5): 999-1010.
[2] Danoviz M E, Yablonka-Reuveni Z. Skeletal muscle satellite cells: background and methods for isolation and analysis in a primary culture system[J].Methods mol Biol,2012,798:21-52.
[3] 黄郁凯, 李晓红, 潘宇,等. 成年大鼠骨骼肌干细胞的制备与新型培养方法[J]. 中国病理生理杂志, 2013, 29(1): 183-187.
[4] Bareja A, Holt J A, Luo G, et al. Human and Mouse Skeletal Muscle Stem Cells: Convergent and Divergent Mechanisms of Myogenesis[J].Plos One,2014,9(2):e90398.
[5] Motohashi N, Asakura A. Muscle Satellite Cell Heterogeneity and self-Renewal[J].Front Cell Dey Biol, 2014, 2: 1.
[6] Tedesco F S, Dellavalle A, Diaz-Manera J, et al. Repairing skeletal muscle: regenerative potential of skeletal muscle stem cells[J]. J Clin Invest, 2010, 120(1): 11-19.
[7] Sambasivan R, Tajbakhsh S. Skeletal muscle stem cell birth and properties[J].Semin Cell Dev Biol,2007, 18(6): 870-882.
[8] 张玉石, 李汉忠, 张锐强, 等. 应用 Percoll 分离纯化组织工程用肌卫星细胞[J]. 中国医学科学院学报, 2006, 28(2): 182-185.
[9] Cornelison D D, Wold B J. Single-cell analysis of regulatory gene expression in quiescent and activated mouse skeletal muscle satellite cells[J].Dev Biol, 1997, 191(2): 270-283.
[10] 郭常敏, 王达利, 魏在荣,等. 人脂肪间充质干细胞体外培养鉴定与诱导分化的初步研究[J]. 遵义医学院学报, 2013, 36(1):32-36.
[收稿2014-12-15;修回2015-03-07]
(编辑:谭秀荣)
Separation and culture of rabbit skeletal muscle satellite cells and evaluation of their myotube formation capability in vitro
KeTangshan,DongJin,LiaoJuan,LiuKunxiang
(Research Center for Medicine & Biology, Zunyi Medical University, Zunyi Guizhou 563099, China)
Objective To establish the methods for the separation and culture of rabbit skeletal muscle satellite cells and evaluate their myotube formation capability. Methods Skeletal muscle satellite cells from 1-week-old rabbit triceps surae were isolated and pured by improved collagenase-Ⅰ and trypsin digestion using different adhesion method. The morphology of satellite cells was observed under microscope. Desmin immunohistochemical staining was used for the identification of satellite cells. MTT assay was used for drawing the cell growth curve. The induction culture and characteristics of myotube formationin vitro was observed. Results After twice differential adherence, the number of suspended cells with strong refraction was increased rapidly, and cells gradually became long-shuttle in shape. The strong positive expression was detected by desmin immunohistochemical staining. The purity was up to 95%. The satellite cells began to proliferate after 24 h. It was in logarithmic growth and platform phase after subcultured for 3rd-7th day and 8th day, respectively. Without the induced differentiation culture medium, the satellite cells could still fuse to form myotubes. However, the speed of myotube formation was slower than that with induced differentiation culture medium. Conclusion This experiment has successfully established methods for separation and culture of rabbit skeletal muscle satellite cells with easy operation, little pollution and high purity, which provide the basis for the experimental foundation of regeneration medicine research.
skeletal muscle satellite cell; cell culture; rabbit
遵义市科技局基金资助项目(NO:E-072)
刘坤祥,男,博士,教授,硕士生导师,研究方向:骨骼肌神经生物医学工程,E-mail:liukunxiang01@163.com。
R322-32
A
1000-2715(2015)02-0150-04
