丰富生存环境对肿瘤的抑制作用及其相关基因通路分析
2015-06-12李国华吴育峰蔡小锦
甘 愉,李国华,吴育峰,蔡小锦,姚 明,屠 红
(上海交通大学医学院附属仁济医院,上海市肿瘤研究所,癌基因及相关基因国家重点实验室,上海 200032)
专家论坛
丰富生存环境对肿瘤的抑制作用及其相关基因通路分析

(屠红研究员)
甘 愉,李国华,吴育峰,蔡小锦,姚 明,屠 红
(上海交通大学医学院附属仁济医院,上海市肿瘤研究所,癌基因及相关基因国家重点实验室,上海 200032)
目的 探讨丰富生存环境(EE)对肿瘤抑制作用及可能机制。方法 EE饲养环境为12只以上小鼠置大空间笼饲养,笼内设有用于小鼠探索、学习和运动的玩具。小鼠置EE环境饲养3周后,皮下接种B16F10恶性黑色素瘤细胞或Panc02胰腺癌细胞,置原环境继续饲养,比较EE组和常规环境(SE)饲养组小鼠的成瘤率和瘤重。APCMin/+基因突变小鼠3周龄起分别置EE和SE环境饲养,20周龄时处死小鼠,比较两组小鼠小肠腺瘤数量。实验还采用Agilent小鼠全基因组44K表达谱芯片对Panc02胰腺癌细胞移植瘤组织进行基因表达差异分析。结果 与SE饲养比较,EE饲养对B16F10恶性黑色素瘤和Panc02胰腺癌皮下瘤的生长均有显著的抑制作用,抑瘤率分别为43.0%(P<0.05)和58.2%(P<0.01);EE对APCMin/+小鼠肠道腺瘤的生成也具有明显的抑制作用(P<0.05)。Panc02胰腺癌细胞移植瘤表达谱芯片结果的KEGG分析显示,有2倍以上表达差异的基因通路富集于细胞粘附和线粒体功能,并与神经退行性疾病和心脏疾病相关基因有交集。结论 EE对肿瘤的发生发展具有广泛的抑制作用,其对肿瘤细胞内线粒体功能的影响及其生物学意义值得深入研究。
恶性肿瘤;丰富生存环境;基因表达谱
癌症是表现为局部组织细胞异常增生的系统性疾病[1],机体的神经、免疫和内分泌对其发生发展都起着重要的调控作用。有关精神因素与恶性肿瘤关系的研究目前多集中在肿瘤发生之后患者抑郁情绪程度的产生和变化,而精神行为对肿瘤发生的影响,尤其是“良性”精神行为对肿瘤的作用,国内外研究较少。
丰富生存环境(enriched environment,EE)是指空间、物体和成员比标准实验动物饲养更为丰富的环境,即饲养空间增大;笼内设有用于探索、学习、运动和居住的玩具如隧道、跑轮、玩具、房屋等;动物成员较多,一般每笼12只以上[2]。在神经学研究领域已证实这种丰富环境的刺激能提高动物的学习、记忆能力,减少焦虑性情绪,并具有改善老年痴呆、帕金森氏病等神经退行性病变的作用[3-5],也有助于缺血/再灌注后的神经损伤修复[6]。近年,国外开始将EE模型引入肿瘤研究领域[2, 7]。我们观察了EE对多种小鼠肿瘤发生发展的影响,并从小鼠胰腺癌皮下移植瘤中基因表达谱差异分析入手,探讨EE抑制肿瘤生长的可能机制。
1 材料与方法
1.1 细胞与细胞培养 小鼠胰腺癌细胞Panc02由美国Frederick National Laboratory for Cancer Research引进。小鼠恶性黑色素瘤细胞B16F10购自美国ATCC细胞库。细胞培养于含10%胎牛血清(美国Life Technologies公司)的DMEM培养基。
1.2 动物与动物饲养 C57BL/6小鼠购自上海实验动物资源中心。APCMin/+基因突变小鼠购自南京大学模式动物研究所。EE饲养条件为:在60 cm×40 cm×20 cm 的透明大鼠笼内,铺覆垫料,设置小屋、斜梯、隧道、塑料跑轮、躲避处、棉花、各种形状及颜色的玩具和木制积木,在小鼠浴室撒放鼠沙。每笼安置12只小鼠,每3天清洁并更换笼具及玩具。环境温度保持21~23 ℃,维持12 h照明、12 h黑暗的光照周期(见图1A)。对照组小鼠饲养于30 cm×18 cm×25 cm小鼠笼内,每笼4只小鼠(见图1B)。

A:小鼠丰富饲养环境;B:小鼠标准饲养环境。
1.3 C57BL/6小鼠皮下移植瘤模型的EE实验 3周龄C57BL/6雄性小鼠置EE环境和常规环境(standard environment, SE)饲养3周,右侧皮下注射Panc02或B16F10,每只小鼠剂量为5×105细胞,放回原有环境中继续饲养。肿瘤细胞接种后第5天起隔日进行肿瘤瘤体积检测,按公式V=长径a×短径b2÷2计算肿瘤体积并记录,绘制肿瘤生长曲线。胰腺癌在接种后第35天、恶性黑色素瘤在第17天时处死小鼠,取瘤体称重,标本至液氮速冻后转移至-80 ℃保存。
1.4 APCMin/+基因突变小鼠肠道自发腺瘤模型的EE实验 APCMin/+小鼠自行繁育后经基因型鉴定为杂合子的雄性APCMin/+小鼠24只,随机分为两组,分别置EE和非EE条件下饲养。小鼠20周龄时处死,留取肠道标本,亚甲兰瞬时染色后20倍镜下观察肠道腺瘤形态和计数腺瘤数量,根据公式V=长径a×短径b2÷2估算腺瘤体积。腺瘤的统计范围为自十二指肠至回盲部的全部小肠。
1.5 小鼠胰腺癌皮下瘤总RNA抽提 每50 mg Panc02胰腺癌组织中加入1 mL TRIzol(美国Life Technologies公司),组织破碎仪破碎1 min,3 000 rpm离心3 min后吸取上清,加入0.2 mL的氯仿振荡混均30 s,室温静置5 min。12 000 rpm、4°C下离心15 min,取上层水相转移至新的离心管中,加入等量异丙醇混均30 s,室温下静置10 min。12 000 rpm、4°C离心10 min,弃上清,1 mL 预冷的75%乙醇洗RNA沉淀1次,加入40 μL RNase-free的水溶解沉淀,电泳鉴定RNA抽提质量。
1.6 基因表达谱检测 基因表达谱芯片实验由上海伯豪生物技术有限公司提供技术服务,所用芯片为Agilent小鼠全基因组44K表达谱芯片。简要过程:对样品中的mRNA进行放大和标记(Agilent公司配套试剂盒),用RNeasy mini kit(QIAGEN公司)纯化标记好的cRNA。按Agilent表达谱芯片配套提供的杂交标准流程和配套试剂盒,1.65 μg cRNA在65°C、10 rpm滚动杂交炉中与芯片杂交17 h。洗片,用Agilent Microarray Scanner对芯片上的荧光信号进行扫描。Feature Extraction software 10.7读取数据,最后采用Gene Spring Software 11.5进行归一化处理,所用的算法为Quantile。
1.7 统计学处理 数据采用SPSS 13.0软件包进行统计学分析。小鼠瘤重、体积和数量采用独立非配对t检验或非参数秩和检验,P<0.05时差异有统计学意义。
2 结果
2.1 EE对C57BL/6小鼠皮下瘤的抑制作用
2.1.1 恶性黑色素瘤 C57BL/6雄性3周龄小鼠25只随机分为EE组12只及对照SE组13只,各自环境中饲养3周后小鼠皮下接种B16F10黑色素瘤细胞,继续同样环境饲养。第17天处死小鼠时,EE组及SE组的肿瘤状况见图2,SE组100%成瘤,而EE组中有3只小鼠未成瘤。EE饲养能延缓皮下移植肿瘤的形成(见图3A),且EE组平均瘤重(2.01±0.61g)显著低于对照组瘤重(3.53±0.62g,P<0.05,见图3B),与对照组相比,EE抑瘤率为43.0%。

SE:常规饲养;EE:丰富生存环境饲养。
2.1.2 胰腺癌 C57BL/6雄性3周龄小鼠在EE环境(12只)和SE环境(12只)中饲养3周,接种Panc02胰腺癌细胞,继续原环境饲养。两组小鼠Panc02胰腺癌成瘤状况(见图3C)。第35天实验结束时,EE组肿瘤的平均瘤重(0.23±0.03g)显著小于对照组小鼠的平均瘤重(0.55±0.04g,P<0.01,见图3D)。与对照组相比,EE抑瘤率达到58.2%。
2.2 EE对APCMin/+小鼠自发瘤的抑制作用 3周龄雄性APCMin/+小鼠随机分为2组,每组12只,置EE或SE环境中饲养20周,处死小鼠,留取肠道标本观察腺瘤形成状况(见图4A)。HE染色后可见肠上皮细胞具有腺瘤特征(见图4B)。亚甲蓝染色后统计EE组小鼠肠道内腺瘤数量为18.08±1.75个/鼠,显著少于SE组24.17±1.19个/鼠(P<0.01,见图4C);对腺瘤体积进行分析,EE组小鼠为86.70±10.32 mm3/鼠,显著少于SE组的139.07 ± 13.57 mm3/鼠(P<0.01见图4D)。EE对APCMin/+小鼠的肠道自发腺瘤具有较好的抑制作用。

A: B16F10细胞接种后不同时间点EE和SE组成瘤率比较;B:EE组合和SE组B16F10恶性黑色素瘤平均瘤重比较;C:小鼠胰腺癌PNAC02接种后不同时间点EE和SE组成瘤率比较;D: EE组和SE组PNAC02胰腺癌平均瘤重比较;SE:常规饲养;EE:丰富生存环境饲养;*P<0.05;**P<0.01。
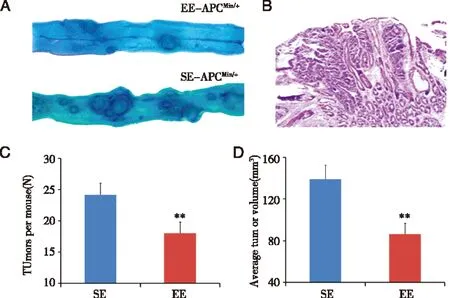
A:亚甲蓝染色后,SE和EE饲养小鼠肠道内腺瘤数目比较;B: 小鼠肠腺瘤HE染色,×20放大;C: ApcMin/+小鼠在EE下肠道腺瘤数目明显小于常规饲养组;D: EE条件下肠道腺瘤体积显著小于常规饲养组;SE:常规饲养;EE:丰富生存环境饲养;**P<0.01。
2.3 胰腺癌组织基因表达谱的通路分析 为了探索EE抑制肿瘤的分子途径,我们对EE组和SE组的Panc02胰腺癌皮下瘤进行了小鼠全基因组表达谱芯片检测。结果显示,在41265基因检测点中,差异1.5倍以上的基因点11653个,其中下调6191个(53.1%);差异3倍以上基因点共3022个,其中下调2118个(70.1%);差异5倍以上的基因点1459个,其中下调1162个(79.6%)。随着差异倍数的增大,差异基因倾向于以下调为主(见图5)。

A:1.5倍以上差异基因;B:2倍以上差异基因;C:2.5倍以上差异基因;D:3倍以上差异基因;E:5倍以上差异基因;SE:常规饲养;EE:丰富生存环境饲养。
对2倍以上差异基因进行KEGG通路分析后获得的P<0.001的通路见表1。上调基因主要富集在细胞粘附相关的通路,包括紧密连接(Tight junction)和粘附连接(Adherence junction),同时还有肿瘤信号通路(Pathways in cancer)等。下调基因富集的通路主要涉及线粒体功能(三羧酸循环Citrate cycle、氧化磷酸化 Oxidative phosphorylation、糖酵解/糖合成Glycolysis/Gluconeogenesis)和免疫系统功能(基本免疫缺陷Primary immunodeficiency、血液细胞系Hematopoietic cell lineage、细胞因子-细胞因子受体交互作用Cytokine-cytokine receptor interaction、IgA相关肠道免疫网络Intestinal immune network for IgA production),同时还包括钙离子信号通路(Calcium signaling pathway)。下调基因富集的疾病通路有神经退行性疾病(帕金森病Parkinson's disease和阿尔茨海默病Alzheimer's disease)和心脏疾病(扩张性心肌病Dilated cardiomyopathy、肥厚性心肌病 Hypertrophic cardiomyopathy、心肌收缩Cardiac muscle contraction、致心律失常性右室心肌病 Arrhythmogenic right ventricular cardiomyopathy、病毒性心肌炎Viral myocarditis)。
表1 Panc02瘤体2倍以上差异基因的KEGG通路分析
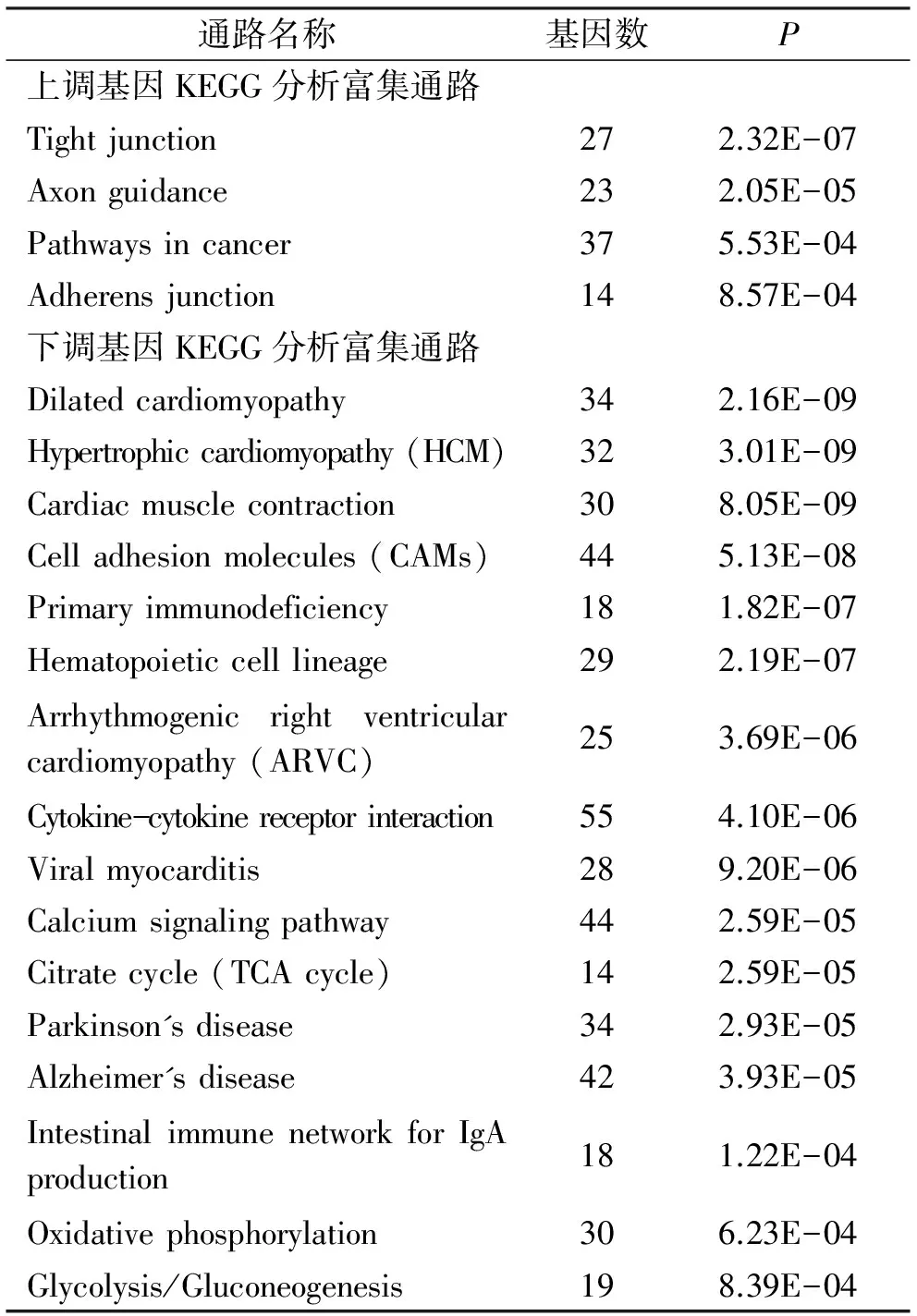
通路名称基因数P上调基因KEGG分析富集通路Tightjunction272.32E-07Axonguidance232.05E-05Pathwaysincancer375.53E-04Adherensjunction148.57E-04下调基因KEGG分析富集通路Dilatedcardiomyopathy342.16E-09Hypertrophiccardiomyopathy(HCM)323.01E-09Cardiacmusclecontraction308.05E-09Celladhesionmolecules(CAMs)445.13E-08Primaryimmunodeficiency181.82E-07Hematopoieticcelllineage292.19E-07Arrhythmogenicrightventricularcardiomyopathy(ARVC)253.69E-06Cytokine-cytokinereceptorinteraction554.10E-06Viralmyocarditis289.20E-06Calciumsignalingpathway442.59E-05Citratecycle(TCAcycle)142.59E-05Parkinson'sdisease342.93E-05Alzheimer'sdisease423.93E-05IntestinalimmunenetworkforIgAproduction181.22E-04Oxidativephosphorylation306.23E-04Glycolysis/Gluconeogenesis198.39E-04
3 讨论
EE作为一种调控神经可塑性的良性心理应激手段被广泛应用于衰老[8]、学习记忆[9-10]、脑损伤[6, 11]、神经退行性病变[5]等领域,取得了令人振奋的结果。EE对肿瘤发生发展影响的研究,直到近年才刚刚起步[2, 7]。Cao等[2]在2010年首先报道了EE对小鼠恶性黑色素瘤和结肠癌移植瘤具有显著的抑瘤作用。在乳腺癌小鼠移植瘤模型中,Nachat-Kappes等[7]也发现EE对肿瘤的发生发展具有抑制作用。本研究中,我们不仅证实了EE对恶性黑色素瘤具有抑制性,而且还证实其对小鼠胰腺癌也具有显著的抑制作用,且抑瘤率高达58.2%,略低于胰腺癌治疗的主要化疗药物吉西他滨和5-氟尿嘧啶(抑瘤率为70%~85%)在本小鼠胰腺癌模型中的抑瘤效果(结果未呈现)。结合EE对APCMin/+突变小鼠肠道自发瘤的抑制现象,我们认为良性精神行为对肿瘤的发生发展具有普遍的抑制作用。本研究结果从新的角度支持了医学模式由生物转向生物-心理-社会医学模式的必要性,也为肿瘤的综合质量提供了新的措施,具有较大的临床转化价值。
有关EE抑瘤的作用机理,迄今研究较少。EE可显著提高小鼠中枢神经系统的BDNF水平[2],在我们的研究中也得到证实[12]。虽然有研究显示,中枢BDNF表达增加,可通过下丘脑-交感神经轴,使脂肪细胞因子瘦素的分泌下调和脂联素的分泌上调,最终抑制肿瘤的生长[2]。在小鼠Panc02胰腺癌模型中, 我们也观察到EE能下调荷瘤小鼠中瘦素的水平(结果未呈现),提示了外周脂肪细胞因子水平的改变可能直接作用于肿瘤并参与EE对肿瘤生长的抑制作用。但脂肪细胞因子或其他受EE调控的中枢/外周因子在肿瘤细胞内如何发挥调控作用的分子机制,目前尚不清楚。探讨EE小鼠肿瘤细胞内的分子和通路改变,有助于阐明EE整体调控肿瘤的可能途径。
通过表达谱芯片我们发现,在丰富生存条件下,Panc02移植瘤内基因表达谱发生了一系列显著改变。对表达谱芯片提示有2倍以上表达差异的基因,我们进行了实时荧光定量PCR验证,结果证实所有定量PCR检测基因均有与芯片检测上调或下调方向一致的表达改变,其中83.3%(10/12)的基因定量PCR差异达统计学意义[12],提示我们的表达谱芯片分析结果具有较好的可靠性。肿瘤的发生发展与细胞内众多信号通路的激活或失活有关,EE对肿瘤细胞产生的基因表达下调作用,一部分很可能与其肿瘤抑制作用有关。对瘤体2倍以上差异的上调和下调基因分别进行Kegg Pathway分析后,获得P<0.01的通路20条,其中下调基因涉及的通路为16条,占全部富集通路的80%,提示了EE对肿瘤的作用更集中于对信号通路的负向调控。在这些富集的通路中,有些与肿瘤的发生、发展密切相关,如细胞粘附功能和免疫系统功能相关通路,提示EE可能通过增强肿瘤细胞之间的粘附和减弱肿瘤对免疫的抑制作用发挥其抑瘤作用。更为值得关注的是,EE能引起肿瘤细胞内线粒体相关基因的表达改变,具体表现为普遍下调了从丙酮酸脱羧、三羧酸循环至氧化磷酸化反应中的各个重要的催化酶基因的表达,如柠檬酸合成酶(CS)、苹果酸脱氢酶2(MDH2)、乌头酸酶2(ACO2)、琥珀酸脱氢酶(SDH)、泛醌-细胞色素C还原酶核心蛋白(UQCRC)等提示EE可能会抑制肿瘤细胞线粒体功能。虽然胰腺癌和其他肿瘤一样存在Warburg效应,即肿瘤细胞主要通过糖酵解来提供能量,但最近有研究显示线粒体的三羧酸循环和氧化磷酸化相关的功能对胰腺癌的发生、发展同样具有重要的作用,抑制这些功能能导致胰腺癌生长缓慢[13-14]。今后如能进一步证实EE调控线粒体的呼吸功能,将为研究EE抑制肿瘤的分子机制提供一条重要的线索。有趣的是,EE下调基因的KEGG分析还富集到了神经退行性疾病(帕金森病和阿尔茨海默病)和心脏疾病的通路。神经元线粒体氧化磷酸化功能紊乱是导致神经退行性疾病的重要机制之一[15],EE与神经退行性疾病的关联在于两者在线粒体相关基因的改变上有共性。在对EE与心脏疾病通路相关的具体基因进行分析后发现,他们中的一些与钙离子信号有关,如心肌肌钙蛋白C(TNNC1)、腺苷酸环化酶(ADCY)、骨骼肌钙通道α1(CACNA1S)等,这一信号系统在EE抗肿瘤中的作用,也值得深入探讨。
总之,本研究证实了EE对肿瘤的生长具有普遍的抑制作用,提示了将良性心理应激在肿瘤辅助治疗中的运用前景。表达谱分析结果则为进一步探讨EE的抗肿瘤机制提供了线索。
[1] 顾键人,杨胜利. 要用系统性疾病的观念重新认识癌症 [J]. 中华医学杂志,2005,85(8):505-507.
[2] Cao L,Liu X,Lin E J,et al. Environmental and genetic activation of a brain-adipocyte BDNF/leptin axis causes cancer remission and inhibition [J]. Cell,2010,142(1):52-64.
[3] Baldini S,Restani L,Baroncelli L,et al. Enriched early life experiences reduce adult anxiety-like behavior in rats: a role for insulin-like growth factor 1 [J]. J Neurosci,2013,33(28):11715-11723.
[4] Sale A,Berardi N,Maffei L. Environment and brain plasticity: towards an endogenous pharmacotherapy [J]. Physiol Rev,2014,94(1):189-234.
[5] Laviola G,Hannan A J,Macri S,et al. Effects of enriched environment on animal models of neurodegenerative diseases and psychiatric disorders [J]. Neurobiol Dis,2008,31(2):159-168.
[6] Yu K,Wu Y,Zhang Q,et al. Enriched environment induces angiogenesis and improves neural function outcomes in rat stroke model [J]. J Neurol Sci,2014,347 (1-2):275-280.
[7] Nachat-Kappes R,Pinel A,Combe K,et al. Effects of enriched environment on COX-2, leptin and eicosanoids in a mouse model of breast cancer [J]. PLos One,2012,7(12):e51525.
[8] Yang S,Lu W,Zhou D S,et al. Four-month enriched environment prevents myelinated fiber loss in the white matter during normal aging of male rats [J]. Brain Struct Funct,2014 Feb 20 [Epub ahead of print].
[9] Lima A P,Silva K,Padovan C M,et al. Memory, learning, and participation of the cholinergic system in young rats exposed to environmental enrichment [J]. Behav Brain Res,2014,259:247-252.
[10] Monteiro B M,Moreira F A,Massensini A R,et al. Enriched environment increases neurogenesis and improves social memory persistence in socially isolated adult mice [J]. Hippocampus,2014,24(2):239-248.
[11] Kovesdi E,Gyorgy A B,Kwon S K,et al. The effect of enriched environment on the outcome of traumatic brain injury; a behavioral, proteomics, and histological study [J]. Front Neurosci,2011,5:42.
[12] Li G,Gan Y,Fan Y,et al. Enriched environment inhibits mouse pancreatic cancer growth and down-regulates the expression of mitochondria-related genes in cancer cells [J]. Sci Rep,2015,5:7856.
[13] Son J,Lyssiotis C A,Ying H,et al. Glutamine supports pancreatic cancer growth through a KRAS-regulated metabolic pathway [J]. Nature,2013,496(7443):101-105.
[14] Viale A,Pettazzoni P,Lyssiotis C A,et al. Oncogene ablation-resistant pancreatic cancer cells depend on mitochondrial function [J]. Nature,2014,514(7524):628-632.
[15] de Moura M B,dos Santos L S,Van Houten B. Mitochondrial dysfunction in neurodegenerative diseases and cancer [J]. Environ Mol Mutagen,2010,51(5):391-405.
[收稿2015-02-26;修回2015-03-20]
(编辑:谭秀荣)
Study on the inhibitory effects of enriched environment on tumor growth and the potential mechanisms
GanYu,LiGuohua,WuYufeng,CaiXiaojin,YaoMing,TuHong
(State Key Laboratory of Oncogene and Related Genes, Shanghai Cancer Institute, Shanghai Jiao-Tong University School of Medicine, Renji Hospital,Shanghai 200032, China)
Objective To investigate the effects of enriched environment (EE) housing condition on tumor growth and explore the potential mechanisms responsible for such inhibition.Methods After exposed to EE condition (a group of 12 mice raised in an enlarged cage containing various toys for exploration, learning and physical exercise) or standard environment (SE) for 3 weeks, mice were subcutaneously implanted with B16F10 melanoma cells or Panc02 pancreatic cancer cells and returned to their respective housing conditions. The tumor weights were compared between EE and SE groups. Three-week-old APCMin/+mice were randomized to be raised in EE or SE housing conditions for 20 weeks. The number of intestinal adenomas was counted in each EE and SE mice. Gene expression profiles of Panc02 zynografts from EE and SE mice were measured by Agilent 44K Whole Mouse Genome Oligo Microarray.Results Compared with SE group, EE housing significantly inhibited the growth of both B16F10 melanoma and Panc02 pancreatic tumors with the inhibitory rates of 43.0 % (P<0.05) and 58.2% (P<0.01), respectively. EE could also significantly reduce the formation of intestinal adenomas in APCMin/+mice. KEGG pathway enrichment analysis with the gene expression profiles of tumor samples showed that the differentially expressed genes were overrepresented in pathways linking to cell adhesion and mitochondria-related functions, and were overlapped with genes related to neurodegenerative disorders and cardiac diseases.Conclusion EE exposure yields robust inhibitory effects on the development and progression of tumors. The results also suggest an involvement of mitochondria-related genes in regulating tumor growth by EE.
malignant tumor; enriched environment; gene expression profile
国家自然科学基金青年项目(NO:81201823);癌基因和相关基因国家重点实验室自主项目(NO:91-11-02,91-13-06)。
屠红,女,医学博士,研究员,上海交通大学博士生导师。本科毕业于上海医科大学临床医学专业。上海医科大学和美国南加州大学联合培养博士,法国巴斯德研究所博士后。2008年起任上海市肿瘤研究所“癌基因及相关基因国家重点实验室”课题组长,2005至2010年兼任美国路易斯安娜州立大学PBRC研究所Research Instructor。主要从事肝炎病毒和肝癌的分子生物学研究,以及神经精神因素对恶性肿瘤的系统调控研究。先后负责国家自然科学基金面上项目、上海市科委重大项目、“十二五”/“十三五”国家科技重大专项等科研任务,研究成果获国家教委科技进步一等奖、上海中西医结合科学技术三等奖、中法科技协会生物技术奖等奖项。发表论文90余篇,其中SCI收录45篇,参编中、英文论著4部,获国家发明专利3项。现任上海市抗癌协会传统医学专业委员会委员,国家及多省市基金项目和成果评审专家库成员,上海市肿瘤研究所学术委员会委员。担任WorldJournalofGastroenterology,《肿瘤》等杂志编委,以及ScientificReports、CancerPreventionResearch等杂志审稿人。
R446.62
A
1000-2715(2015)02-0111-06
