足细胞内陷性肾小球病
2015-06-09朱小东曾彩虹
徐 峰 朱小东 曾彩虹
·肾活检·
足细胞内陷性肾小球病
徐 峰 朱小东 曾彩虹
57岁女性患者,临床诊断系统性红斑狼疮(SLE),抗核抗体、SSA、SSB阳性,无口干和眼干症状,少量蛋白尿是肾脏损害的临床表现,其肾功能正常。肾活检光镜组织学病变轻,仅见肾小球节段轻度系膜增生,但毛细血管袢略僵硬,免疫荧光检查阴性,超微结构观察肾小球基膜内见质膜样结构,个别足细胞胞质突入肾小球基膜,肾小球系膜区、毛细血管袢基膜内皮下及上皮侧均未见电子致密物沉积。诊断符合足细胞内陷性肾小球病。
足细胞内陷性肾小球病 系统性红斑狼疮 足细胞 电镜 肾活检
病例摘要
病史 57岁女性患者,因“面部红斑3年,自身抗体阳性伴尿检异常1月余”,于2012-09-12入院。2009年9月患者无明显诱因出现面部蝶形红斑,外用抗过敏药物治疗后可消退,但红斑反复出现,未予重视。2012-08-06我院门诊查尿蛋白定量0.59 g/24h,尿沉渣红细胞计数正常,自身抗体ANA 1∶ 256、抗SSA++、抗SSB++,补体C3 0.464 g/L,C4 0.061 g/L,血常规白细胞计数(WBC) 3.1×109/L,血红蛋白(Hb) 103 g/L,诊断为“系统性红斑狼疮(SLE)、狼疮性肾炎(LN)”,予泼尼松20 mg/d治疗;2012-09-05复查尿蛋白定量0.99 g/24h,WBC正常,免疫学指标无改善,为进一步诊治收住入院。
既往史 有双膝及双肩关节疼痛病史20余年,未就诊;2012年3月体检时尿检正常。
体格检查 体温36.7℃,脉搏60次/min,呼吸18次/min,血压116/74 mmHg,体质量指数(BMI) 17.6 kg/m2。面部可见褐色色素沉积,眼睑无水肿,甲状腺不肿大,未触及结节。双肺呼吸音清晰,未闻及干湿啰音和胸膜摩擦音。心率60次/min,心律齐,各瓣膜区未闻及心脏杂音。腹软,无压痛、反跳痛及肌紧张,未触及包块,肝脾肋下未触及,无移动性浊音。四肢关节无畸形,双下肢无水肿。
实验室检查
尿液检查 尿蛋白定量0.85 g/24h,尿沉渣红细胞1.0万/ml;NAG 10.9 U/(g·Cr),视黄醇结合蛋白0.2 mg/L,溶菌酶<0.5 mg/L,禁饮13h尿渗量1 231 mOsm/(kg·H2O)。
血常规 Hb 101 g/L,WBC 3.9×109/L,血小板151×109/L,C反应蛋白0.1 mg/L。
血生化 白蛋白37.4 g/L,球蛋白27.2 g/L,谷丙转氨酶11 U/L,谷草转氨酶18 U/L,乳酸脱氢酶131 U/L;尿素氮6.3 mmol/L,肌酐57.5 μmol/L,尿酸229 μmol/L,胱抑素C 1.1 mg/L;总胆固醇4.97 mmol/L,三酰甘油1.42 mmol/L,高密度脂蛋白1.03 mmol/L,低密度脂蛋白3.03 mmol/L;钾4.18 mmol/L,钠140.4 mmol/L,氯102.9 mmol/L,总二氧化碳26.8 mmol/L,钙2.08 mmol/L,磷 1.18 mmol/L;空腹血糖 4.73 mol/L。
免疫学检验 免疫球蛋白IgG 17.5 g/L,IgA2.1 g/L,IgM 1.18 g/L,抗链球菌溶血素“O” 34.9 IU/ml,类风湿因子<20 IU/ml;补体C3 0.5 g/L,C4 0.05 g/L;自身抗体ANA 1∶256,A-dsDNA阴性。ENA多肽谱:抗SSA ++,SSB +。心磷脂抗体谱阴性。
传染病四项阴性 乙肝二对半阴性。
甲状腺功能 FT3 3.63 pmol/L,T3 1.27 nmol/L,FT4 10.8 pmol/L,T4 111.02 nmol/L,促甲状腺激素6.15 mIU/L。
眼底检查未发现明显异常。泪膜破裂时间:左右均20s;滤纸试验:左右均5 mm。
心脏彩超 左室舒张功能减低。
肾活检病理
光镜 29个肾小球中6个球性废弃,余正切肾小球体积增大,节段系膜区轻度增宽,系膜基质略增多,毛细血管袢开放好、略僵硬(图1A),少数袢内皮细胞成对,节段囊壁增厚、分层。PASM-Masson:阴性。肾小管间质慢性病变轻度,散在及小灶性肾小管萎缩、基膜增厚,见蛋白管型,部分非萎缩小管基膜亦增厚,间质小灶性纤维化,少量单个核细胞浸润。偶见动脉弹力层分层。
免疫荧光 IgG、IgA、IgM、C3、C1q均阴性。磷脂酶A2受体(PLA2R)染色阴性。
电镜 观察1个肾小球。肾小球节段系膜区轻度增宽,系膜细胞1~2个,基膜样物质增多,系膜区未见电子致密物沉积。肾小球毛细血管袢开放好,基膜增厚,约760~1 350 nm,基膜内见较多膜样结构,直径约50~70 nm,个别直径达100~160 nm,少数足细胞胞质突入基膜(图1B、C),基膜内皮下及上皮侧未见电子致密物沉积。肾小球足细胞足突融合50%~60%,胞质少量微绒毛化。
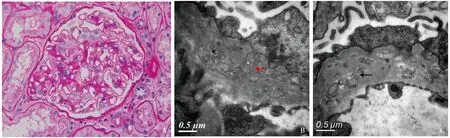
图1 图A:肾小球节段系膜区轻度增宽,毛细血管袢开放好、略僵硬(PAS,×400);B、C:肾小球基膜内较多膜样结构(↑),偶见足细胞胞质陷入基膜内(↑)(EM)
病理诊断 足细胞内陷性肾小球病(PIG)。予泼尼松20 mg/d治疗。患者一般情况较好,无肉眼血尿,无腰痛、腹痛。出院后予雷公藤多苷(60 mg/d)和泼尼松(20 mg/d)维持治疗,尿蛋白波动于0.65~0.82 g/24h,肾功能正常,2013-05-29(肾活检术后8月)复查尿蛋白定量0.73 g/24h,ANA 1∶128,肌酐69.0 μmol/L。
讨 论
中年女性患者,有多系统损害和自身抗体阳性,临床符合SLE,患者SSA、SSB阳性,但无口干、眼干症状,泪膜破裂时间及滤纸试验均正常,故不考虑合并干燥综合征。肾脏损害轻,蛋白尿定量<1 g/24h,无血尿,肾功能正常。肾活检组织学病变轻,肾小球节段轻度系膜增生,毛细血管袢稍僵硬,肾小管间质轻度慢性病变; PASM-Masson染色肾小球基膜未见钉突和空泡化,Masson三色染色肾小球系膜区、内皮下和上皮侧均未见嗜复红物沉积。免疫荧光免疫球蛋白和补体染色均为阴性,PLA2R染色阴性,超微结构肾小球基膜(GBM)内有质膜样结构,个别足细胞胞质陷入GBM内。因此诊断考虑PIG,这是国内首次报道这一病理改变。
足细胞内陷性肾小球病 PIG,又称足细胞陷入丝球体病,是一类少见的特殊的肾小球形态学改变,表现为足细胞胞质陷入GBM或GBM内具有质膜结构,日本报道较多。1992年,Sato等[1]报道了5 例病例,肾活检标本经电镜观察发现GBM中有足细胞胞质陷入以及微球体或微导管结构,2008年,日本学者进行了一系列个案报道[2-7],并提出这是一种新的肾小球疾病。
PIG的基础疾病及临床表现 Joh等[8]总结25例日本PIG患者,年龄20~69岁,女性19例,男性6例,提示女性更多见。25例患者有不同程度的蛋白尿(6例尿蛋白定量<1.0 g/24h;13例1.0~2.9 g/24h;6例>3.0 g/24h),其中15例患者12个月内蛋白尿缓解,而5例患者随访期间蛋白尿仍>1.0 g/24h。3例患者见镜下血尿,7例患者存在高血压,21例患者肾功能正常,4例肾功能不全且均伴有高血压。22例患者明确存在基础疾病,主要是自身免疫性疾病,其中SLE 12例(3例合并肾盂积水、1例合并大动脉炎),干燥综合征1例,SLE合并干燥综合征2例,干燥综合征合并类风湿性关节炎1例,混合性结缔组织病(MCTD)1例,3例未明确说明存在的基础疾病。由此可见,PIG常见于自身免疫性疾病,以SLE较为常见。除自身免疫性疾病外,还可见于甲状腺炎、乙肝病毒感染、成熟畸胎瘤、肿瘤溶解综合征、膀胱输尿管反流相关双侧肾盂积水合并巴塞多病。此外,也有合并多发性骨髓瘤的病例报道[9]。报道的PIG病例临床症状轻重不一,而与PIG合并存在的疾病亦多种多样,和自身免疫性疾病合并存在的报道较多,但是与上述疾病之间的具体关系尚未可知。本例为中年女性,合并SLE,但临床表现轻,仅少量蛋白尿,无血尿,肾功能正常。
PIG的病理改变 Joh等[8]对25例患者光镜组织学进行了观察,发现肾小球膜性病变4例,局灶节段性肾小球硬化伴有GBM内空泡4例,LN-Ⅰ型1例,LN-Ⅱ型4例,LN-Ⅴ型7例,其他组织学改变还有肾小球轻微病变、膜增生性肾炎Ⅲ型。免疫荧光染色7例患者为全阴性,其中包括5例自身免疫性疾病,6例仅IgG肾小球沉积,1例仅IgM肾小球沉积,11例有多种免疫球蛋白和补体沉积。自身免疫性疾病和非自身免疫性疾病免疫病理改变无明显差别,GBM内的微球体或微管结构免疫球蛋白既可阳性,也可阴性。电镜下观察病变有两类,1类为原发性足细胞胞浆内陷,另1类为GBM内的超微结构,包括微球体和微管,25例患者中4例有原发性足细胞胞质内陷,24例GBM内见微球体,14例GBM内见微管,24例患者可见GBM特别是致密层增厚。因此PIG多数有基础病变,但也有部分仅表现轻微病变,光镜下常无特异性的改变,即使观察GBM空泡,也很难与膜性病变进行区分,电镜是确诊该病的唯一手段。本例患者肾活检组织学病变轻,免疫荧光阴性,电镜观察发现GBM内有质膜结构,个别足细胞胞陷入GBM内,系膜区、内皮下、上皮侧及基膜内均未见电子致密物沉积。
PIG膜结构来源 根据电镜观察把PIG超微结构改变分为两类,一类是原发性足细胞胞浆内陷,另一类是GBM内超微结构,包括微球体和微管样结构,类似足细胞微绒毛化的胞质突入到GBM内,前者在光镜下可观察到钉突样结构,后者则对应表现为GBM内空泡样结构。因此有人把足细胞内陷性肾小球分为3种亚型,A型为单纯足细胞胞质内陷,B型为足细胞胞质内陷合并GBM内超微结构,C型为单纯GBM内超微结构[8]。但实际上有时很难区分。按此分析,本例为B型,即足细胞胞质内陷合并GBM内超微结构。
GBM内还存在一类细胞外球状微粒,需要和PIG的超微结构进行鉴别。1973年,Burkholder等[10]在1 400多例肾活检标本中发现有55例GBM中存在细胞外球状微粒(SMPs),直径约50~58 nm,呈紧密聚集,通常局限性分布于疏松的GBM外疏松层,而PIG的超微结构分布更加弥漫,排列较为疏松,形态多样,膜样结构直径较大,约60~90 nm。
PIG发病机制 目前,PIG的发病机制还不清楚,Nakajima等[11]用免疫电镜对各种肾小球疾病的细胞外结构包括微球体和纤维状结构进行分析,发现细胞外结构的膜上分布的是一些补体或补体片段如C1s、C3d和 C9。Higlais等[12]运用免疫组织化学的方法发现GBM内的圆形颗粒和条纹状膜样结构表达膜攻击复合物C5b9,因此推测PIG与足细胞上特殊的补体活化有关。
由于PIG通常与其他疾病合并存在,是否为一种独立的肾小球疾病尚有待商榷,与自身免疫性疾病存在何种关系,以及有无特殊的病理生理机制,目前仍不清楚,或许在以前的电镜观察中遗漏了对该类病变的观察,因此在今后的病理观察中需要注意收集此类病变,以供进一步的研究。
1 Sato H,Saito T,Yoshinaga K.Intramembranous fine depositdisease associated with collagen disorder:a new morphologicalentity? Virchows Arch A Pathol Anat Histopathol,1992,420(5):447-451.
2 Fujigaki Y,Muranaka Y,Sakakima M,et al.Analysis of intra-GBM microstructures in a SLE case with glomerulopathy associated with podocytic infolding.Clin Exp Nephrol,2008,12(6):432-439.
3 Koike K,Utsunomiya Y,Ito Y,et al.A case of glomerulopathy showing podocytigin asc infoldinsociation with Sjo¨gren’s syndrome and primary biliarycirrhosis.Clin Exp Nephrol,2008,12(6):489-493.
4 Kitazawa K,Joh K,Akizawa T.A case of lupus nephritis coexisting with podocytic infolding associated with Takayasu’s arteritis.Clin Exp Nephrol,2008,12(6):462-466.
5 Yoshimura K,Joh K,Kitamura H,et al.A case report of glomerulopathy-associated podocytic infolding in a patient with tumor lysis syndrome.Clin Exp Nephrol,2008,12(6):522-526.
6 Masuda Y,Mii A,Shimizu A,et al.Invagination and infolding of podocytes in glomerular basementmembrane in the cases of primary membranous nephropathy.Clin Exp Nephrol,2008,12(6):440-449.
7 Nomura S,Inoue-Kiyohara M,Oosugi K,et al.Unusual glomerulopathy with aggregated subepithelial microspheric particles resembling membranous nephropathy:a variant of glomerulopathy associated with podocytic infolding? Clin Exp Nephrol,2008,12(6):513-517.
8 Joh K,Taguchi T,Shigematsu H,et al.Proposal of podocytic infolding glomerulopathy as a new diseaseentity:a review of 25 cases from nationwide research in Japan.Clin Exp Nephrol,2008,12(6):421-431.
9 Harada M,Kamijo Y,Ehara T,et al.A case of podocytic infolding glomerulopathy with multiple myeloma.BMC Nephrol,2014,15:32.
10 Burkholder PM,Hyman LR,Barber TA.Extracellular cluster of spherical microparticle in glomeruli in human renal glomerular disease.Lab Invest,1973,28(4):415-425.
11 Nakajima M,Hewitson TD,Mathews DC,et al.Localization of complement components in association with glomerular extracellular particles in various renal diseases.Virchows Arch A Pathol Anat Histopathol,1991,419(4):267-272.
12 Hinglais N,Kazatchkine MD,Bhakdi S,et al.Immunohistochemical study of the C5b-9 complex of complement in human kidneys.Kidney Int,1986,30(3):399-410.
(本文编辑 莫 非 凡 心)
Podocyte invagination glomerular disease
XUFeng,ZHUXiaodong,ZENGCaihong
NationalClinicalResearchCenterofKidneydiseases,Jinlinghospital,NanjingUniversitySchoolofMedcine,Nanjing210016,China
A 57-year-old woman with systemic lupus erythematosus (SLE) presented a mild proteinuria. A renal biopsy showed mild proliferative lesion, and electron microscopy revealed that microtubular structures or microspheres which derived from podocytes was present in the GBM. The final diagnosis was podocytic infolding glomerulopathy.
Podocytic infolding glomerulopathy systemic lupus erythematosus podocyte electron microscopy renal biopsy
南京军区南京总医院肾脏科 国家肾脏疾病临床医学研究中心 全军肾脏病研究所(南京,210016)
2015-06-06
