抗中性粒细胞胞质抗体相关血管炎合并感染患者的临床特征
2015-06-09谢红浪刘正钊陈樱花成水芹章海涛刘志红胡伟新
杨 柳 谢红浪 刘正钊 陈樱花 成水芹 章海涛 刘志红 胡伟新
抗中性粒细胞胞质抗体相关血管炎合并感染患者的临床特征
杨 柳 谢红浪 刘正钊 陈樱花 成水芹 章海涛 刘志红 胡伟新
目的:回顾性分析抗中性粒细胞胞质抗体(ANCA)相关血管炎(AAV)治疗过程中合并感染患者的流行病学特点、临床特点、危险因素及预后。 方法:1996年1月至2013年12月确诊AAV伴肾脏损害的患者255例,其中男性103例,女性152例,年龄14~78岁(中位年龄55岁)。诱导治疗方案包括单用激素、激素联合间断环磷酰胺静脉冲击疗法(IV-CTX)或吗替麦考酚酯(MMF)、多靶点疗法或雷公藤多苷(TW)。感染诊断依据临床症状、实验室和微生物检查,收集治疗过程中出现的多种中度以上感染患者,分析感染发生的时间、部位、发生率及危险因素。 结果:在中位随访15月(1~155月)期间,共86例(33.7%)发生103次感染。单用激素(n=65)、MMF(n=77)、IV-CTX(n=66)和TW(n=40)诱导治疗期内感染发生率分别为38.5%、39.0%、33.3%和22.5%。76次(73.8%)感染发生在治疗6个月内,其中3个月内66次(64.1%)。感染最常见部位为肺(n=74),其次为皮肤、消化道和泌尿道,6例发展为脓毒症;感染病原体以细菌最常见(78.6%),其次为真菌(12.6%)和病毒(8.7%)。COX回归模型显示前驱感染(RR=4.105,95%CI=2.557~6.592)、血清肌酐≥530.4 μmol/L(RR=1.179,95%CI=1.090~1.276)和使用CTX治疗(RR=1.889,95%CI=1.020~3.500)是感染发生的独立危险因素。肺部影像学征象表现以大叶性肺炎(51.4%)最为多见,依次为弥漫间质性肺炎(28.4%)或多发结节样病灶(17.6%)。12例(11.7%)患者均死于肺部感染。 结论:AAV治疗过程中并发感染的发生率高且好发于治疗前3个月内,病变部位以肺最为常见,病原体以细菌感染比例最高。前驱感染、严重肾功能不全和使用CTX治疗是感染发生的独立危险因素。
抗中性粒细胞胞质抗体相关血管炎 感染 发生率 危险因素
抗中性粒细胞胞质抗体(ANCA)相关血管炎(AAV)是一类病因不明、组织学病变以小血管炎症、坏死为主要病变的系统性疾病,主要包括微型多发性血管炎(MPA)、肉芽肿性血管炎(GPA),嗜酸性肉芽肿性血管炎(EGPA),和局限于肾脏的血管炎(RLV)。激素、环磷酰胺(CTX)、吗替麦考酚酯(MMF)等细胞毒药物使AAV患者的缓解率和人肾存活率提高,但免疫抑制治疗后并发感染率高,导致部分AAV患者治疗失败甚至死亡,影响远期预后。如何有效降低AAV患者并发感染的发生率已成临床难题,为此本研究回顾性分析AAV治疗并发感染的发生规律、临床特征、危险因素及预后。
对象和方法
病例资料 收集1996年1月至2013年12月在南京军区南京总医院国家肾脏科确诊的活动性AAV伴肾脏损害的患者资料。AAV的诊断符合Chaphill诊断标准[1],血清ANCA均阳性,存在肾脏AAV活动性病变,或伴其他脏器(如肺、皮肤、关节等)病变,并排除继发性血管炎如过敏性紫癜、药物过敏、自身免疫性疾病(如狼疮性血管炎、类风湿性血管炎)、肿瘤、冷球蛋白血症、感染等疾病。194例患者经肾活检病理明确诊断。排除已进入ESRD或确诊时因合并感染未行诱导治疗者。
临床指标 包括年龄(首次出现AAV症状的年龄)、性别、吸烟史、病程、实验室检查结果、肺部病变特点。实验室检查包括血白细胞、血红蛋白、白蛋白、球蛋白、血清肌酐、T淋巴细胞亚群(流式细胞仪测定)。间接免疫荧光检测p-ANCA、c-ANCA和抗内皮细胞抗体,ELISA法检测抗髓过氧化酶抗体(MPO-ANCA)和抗蛋白酶3抗体(PR3-ANCA)[2]。
治疗方案 激素:口服泼尼松0.6~0.8 (mg/kg·d),4周后开始每周减5 mg,至10 mg/d维持。病情活动强者先予甲泼尼龙(MP)0.5g静脉滴注,1次/d,连续3天。免疫抑制剂包括吗替麦考酚酯(MMF,1~1.5 g/d口服)、间断环磷酰胺静脉冲击治疗(IV-CTX,0.5~1.0 g/m2BSA)、多靶点疗法(激素+MMF+他克莫司)[3]和雷公藤多苷(TW)。部分患者因合并肺出血、严重肾功能不全联合免疫吸附、血浆置换或双重滤过血浆置换治疗。维持期治疗方案包括激素联合MMF、硫唑嘌呤(Aza)或TW。接受IV-CTX、MMF、多靶点或血浆置换治疗的患者称为强化治疗组,仅口服激素(10~30 mg/d)或激素联合TW称为非强化治疗组。80例接受肾脏替代治疗。外周血CD4+T淋巴细胞计数<200个/μl者口服复方磺胺甲恶唑预防感染。
感染诊断 参照2009年美国卫生及公共服务部、国家卫生研究院和国家癌症研究所共同颁布的常见不良反应评价标准(CTCAE)40版,依据临床症状、体征、实验室和微生物学检查综合判断且与治疗相关。本研究仅收集中度以上感染(需抗生素治疗)。病原体判断:(1)依据临床表现(如单纯疱疹、带状疱疹);(2)体液培养:血液、尿液(包括中段尿、膀胱穿刺尿)、咽拭子、痰、粪、脑脊液、胸腔积液、腹水、皮肤及外阴分泌物等细菌与真菌的镜检和培养;(3)辅助检查:相关部位的X线、B超及CT等;(4)特殊检查:如结核菌纯蛋白衍生物(PPD)皮肤试验和抗结核治疗的反应,巨细胞病毒(CMV)DNA的PCR检查等。深部真菌感染诊断标准:患者有发热、咳嗽、尿频、尿急、尿痛、腹泻等症状,且痰培养、尿培养、粪培养或活组织中发现真菌,可确诊为深部真菌感染,如胸部X线片或CT提示间质性肺炎或伴偏心性空洞,高度怀疑肺部真菌感染。CMV肺炎:患者出现发热伴干咳(少痰或无痰),呼吸困难及低氧血症进行性加重,胸片见肺纹理增粗或间质性肺炎表现(弥漫性及边缘不清的结节性病灶,严重者呈“棉花团”样改变),实验室检查CMV-IgM阳性和(或)CMV-DNA含量≥6.0×102copies/ml,排除其他原因后可确诊。
感染的治疗 随访期间AAV患者并发感染后即停用免疫抑制剂,同时进行抗感染治疗,并根据病原体及药敏结果调整抗生素治疗方案。加强营养支持治疗,肾功能急性减退或合并急性呼吸窘迫综合征者行连续性血液净化治疗。
定义 随访基线资料为入院指标。随访终点包括死亡、终末期肾病(需要维持性肾脏替代治疗持续3个月以上)。前驱感染指确诊AAV之前3月内(包括起病时、使用免疫抑制剂治疗之前)发生的各种感染。即时透析指入院时即需要肾脏替代治疗。
统计学方法 采用SPSS 20.0软件进行统计分析。以单样本Kolmogorov-Smirnow Z检验对数据进行正态检验,正态分布的计量资料以均数±标准差表示,两组之间均数比较采用t检验;非正态分布计量资料以中位数(四分位数)表示,组间比较采用Kruskal-Wallis检验。计数资料以率(百分比)表示,组间比较采用Pearsonχ2检验或Fisher精确检验。采用多因素COX回归模型分析AAV并发感染的危险因素,所有统计学检验均为双侧检验,P<0.05为差异有统计学意义,P<0.01为统计学差异显著。将年龄、性别、吸烟、糖尿病、前驱感染、肺部受累、血红蛋白、白蛋白、血清肌酐、CD4+T细胞、免疫球蛋白G、Birmingham血管炎活动性评分(BVAS)、甲泼尼龙冲击及血浆置换纳入COX回归模型,不同诱导治疗方案以激素为参照,同时校正临床和实验室指标进行COX回归分析。
结 果
临床资料 255例AAV患者中男性103例,女性152例,年龄14~78岁(中位年龄55岁)。75例(29.4%)有肺部受累,30例(11.8%)合并肺出血。54例(21.2%)鼻窦受累。临床类型包括MPA(221例),RLV(16例),GPA(10例)和EGPA(8例)。234例MPO-ANCA阳性,21例PR3-ANCA阳性。诱导治疗方案单用激素65例,MMF共77例,CTX共66例,多靶点7例,TW40例(表1)。
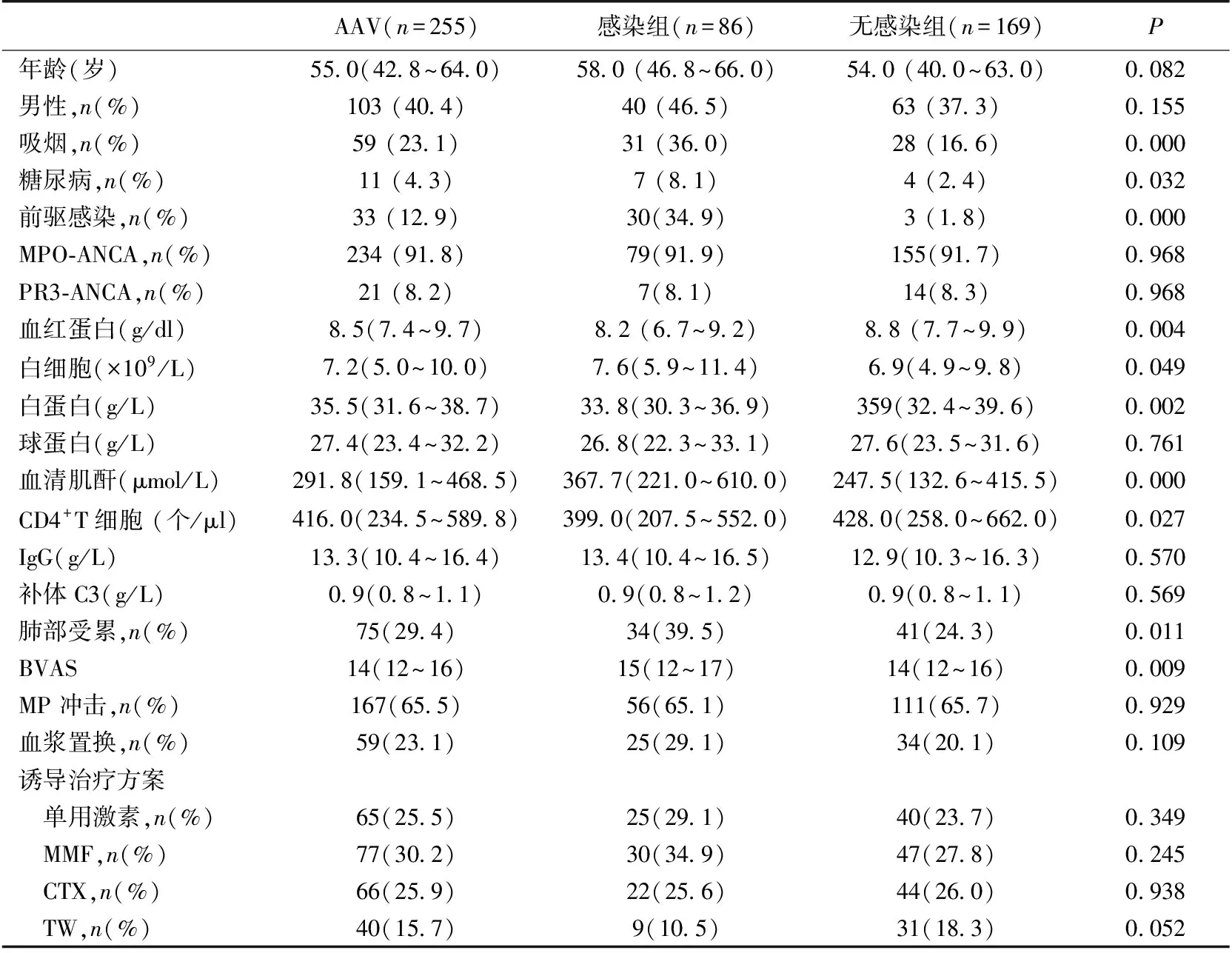
表1 本组患者的临床资料
IgG:免疫球蛋白G; BVAS:Birmingham血管炎活动性评分;MP:甲泼尼龙;MMF:吗替麦考酚酯;CTX:环磷酰胺;TW:雷 公藤多苷;AAV:抗中性粒细胞胞质抗体相关血管炎;MPO-ANCA:抗髓过氧化酶抗体;PR3-ANCA:抗蛋白酶3抗体
感染发生率、发生时间及部位 在随访1~155月(中位15月)期间,86例共发生103次感染(15例感染2次,1例感染3次),感染发生率为33.7%。
103次感染中,76次(73.8%)在治疗6月内发生,中位发生时间为1.5月,其中66次(64.1%)发生于治疗3月内(中位时间1月)。 6月后共发生27次(26.2%),中位发生时间18月,6次感染发生于24月后。
感染最常见部位为肺(n=74),共82例次,占感染总数的79.6%,其他包括皮肤(n=7)、消化道(n=3)、泌尿道(n=2)和中枢神经系统(n=1)感染,其中6例发展为脓毒症。
病原体 103次感染中50次确定了病原学,其中28次(56%)为细菌感染,以金黄色葡萄球菌最多,其次为铜绿假单胞菌、大肠埃希菌及肺炎克雷伯菌。13次(26%)为深部真菌感染,以白假丝酵母菌常见(8次,16%),9次(18%)为病毒感染,包括带状疱疹病毒、巨细胞病毒感染。混合感染包括:细菌二重感染(4例),细菌、真菌混合感染(5例)、细菌、CMV混合感染(1例)。其余53次感染病原体依据临床表现、实验室及影像学检查等综合判断,临床判断以细菌最多见(共81例次,占78.6%)。治疗3月内合并感染者常见病原体为金黄色葡萄球菌、大肠埃希菌、鲍曼不动杆菌、白假丝酵母菌和CMV,3~6月内常见白假丝酵母菌和带状疱疹病毒感染,6月后常见结核菌及铜绿假单胞菌感染。
感染危险因素分析 单用激素(n=65)、MMF(n=77)、IV-CTX(n=66)和TW(n=40)诱导治疗期内感染发生率分别为38.5%、39.0%、33.3%和22.5%。与无感染组(n=169)相比,感染组吸烟率(36.0%vs16.6%,P=0.000)及患糖尿病比例(8.1%vs2.4%,P=0.032)明显增高(表1)。多因素回归模型显示前驱感染、血清肌酐高(≥530.4 μmol/L)和使用CTX治疗是感染发生的独立危险因素(表2)。

表2 AAV并发感染患者的基线资料和诱导治疗方案的COX回归分析
BVAS:Birmingham血管炎活动评分;MMF:吗替麦考酚酯;CTX:环磷酰胺;TW:雷公藤多苷
肺部感染特点 82例次肺部感染者中44例明确病原体,以细菌感染最常见(27例,占61.4%),其中5例(18.5%)金黄色葡萄球菌及3例(11.1%)铜绿假单胞菌;13例真菌感染,主要为白假丝酵母菌(8例,占61.5%)感染;4例病毒感染,均为巨细胞病毒肺炎。肺部影像学征象表现以大叶性肺炎(38例,51.4%)为主,其他为弥漫间质性肺炎(21例,28.4%)或多发结节样病灶(13例,17.6%)。其中细菌感染以大叶性肺炎、结节或网格状阴影为主,可见不规则线条影、网格样、网状结节影等表现,CMV肺炎以两肺磨玻璃影为主,合并弥漫分布网格或纤维索条影。肺部真菌感染表现为斑片、网格或索条影。13例并发急性呼吸窘迫综合征(ARDS),其中10例合并多器官功能障碍综合征,9例需呼吸机辅助呼吸(5例双水平气道正压通气,4例气管插管机械通气)。
治疗和预后 103例次感染依据感染类型、病原学检查及药敏试验结果均静脉使用抗生素治疗,86例感染患者中12例(11.7%)死亡,均为重症肺部感染。74例感染治愈,共34例进入终末期肾病。12例死亡患者包括:CMV肺炎1例;肺金黄色葡萄球菌、鲍曼复合不动杆菌伴嗜麦芽假单胞菌感染1例;慢性阻塞性肺疾病(COPD)伴白假丝酵母菌感染1例;肺曲霉菌感染1例;肺革兰阴性杆菌感染2例;感染病原体不明确6例。
讨 论
AAV患者感染发生率达26%~31%,感染是AAV的重要死亡原因,约占25%[4-6],与基础疾病、营养不良、免疫抑制治疗等因素有关。本文回顾性分析单中心255例AAV治疗并发感染的流行病学及感染特征。
本研究255例AAV患者随访1~155月(中位15月),感染总体发生率33.7%,治疗各时期均可并发感染,但前3月内为感染高发期,表明AAV患者在治疗初期应特别注意感染的预防和监测。诱导初期高龄、有糖尿病史或吸烟史、低蛋白血症、贫血等因素均增加感染风险。文献报道89%的AAV患者的感染与激素有关,激素剂量减小后感染率随之下降[4,7]。本文发现诱导期单用激素治疗患者并发感染的发生率高达38.5%,由于单用激素诱导者多有严重肾损害、肺部受累、淋巴细胞减低、免疫力低下,感染风险高,即使仅用激素治疗,仍需警惕合并感染。
AAV并发感染的主要类型包括肺部感染、皮肤软组织炎症及脓毒症,病原体以细菌最多见,其次为真菌和病毒[4]。既往研究[4,7]报道AAV患者的肺部感染率为36%~57.1%,本组病例也以肺部感染最常见,这可能与以下因素有关:(1)目前推荐强化免疫治疗过程中预防性使用复方磺胺甲恶唑(SMZ-CO)以预防卡氏肺孢子虫(PCP)感染[8]。本中心主要对CD4+T淋巴细胞<200个/μl者进行预防用药,覆盖人数有限,在肺部感染但未明确病原体的患者中,根据临床表现不排除PCP;(2)AAV患者普遍存在肾功能不全,而肾功能不全与并发感染密切相关[9-10],呼吸道是感染高发部位;(3)伴肺部受累、肺出血者肺部保护屏障受损后更易发生感染。本研究显示发生感染者的肺部受累率显著高于无感染组(39.5 %vs24.3%,P=0.011)。此外,皮肤、消化道、泌尿道及中枢神经系统均可并发感染。
文献报道AAV患者感染病原体主要为肺炎链球菌、流感嗜血杆菌、铜绿假单胞菌和金黄色葡萄球菌[11-12],本研究发现最常见的感染病原体为细菌和真菌。感染的细菌种类与文献有所不同,主要为金黄色葡萄球菌、铜绿假单胞菌和大肠埃希菌。同时,与文献相比,本组病例真菌感染比例较高,病毒感染(包括CMV肺炎和带状疱疹病毒)比例相对偏低[13],可能与病毒感染多具自限性和病毒检测相对困难有关。AAV疾病自身特点(如全身炎症状态、肾功能不全、肺部受累、营养不良等)及免疫抑制治疗导致淋巴细胞减少、细胞免疫功能障碍和低免疫球蛋白血症均增加感染、尤其机会致病微生物(如真菌)感染的风险[14]。本组病例中4例CMV肺炎、13例肺真菌病发生于诱导期,且全部静脉冲击MP并使用细胞毒药物治疗,表明诱导期需警惕机会致病菌感染,可适当预防感染治疗。临床研究指出接种肺炎链球菌和流感病毒疫苗安全有效且无致疾病复发风险[15-17],有待进一步验证。
肺部感染的影像学改变多为双肺受累,部分呈浸润性和(或)弥漫性病变,磨玻璃影、网格或纤维索条影等间质性肺改变基础上可合并斑片状、云絮状、边缘不规则的炎性渗出改变。不同病原体肺部感染的影像学改变有所差异,细菌感染以肺部实变、结节或网格影为主,而真菌感染多表现为斑片或结节状病变,部分可见晕征、空洞。病毒感染则以磨玻璃影为主要特点。确定肺部感染病原体的金标准仍是分泌物的培养或分子生物学检查,但肺部影像学特征和临床表现有助于判断病原体并可作为临床选择抗生素的基础。
多项研究探讨AAV患者并发感染的危险因素,但结果不一,部分研究认为高龄、糖尿病、肾功能损害、白细胞减低、免疫抑制剂是感染的危险因素[9-10,18],但亦有报道未发现上述因素与感染显著相关[1]。本研究结果显示AAV感染组吸烟率、糖尿病发病率≥无感染组,与文献报道一致[10,12]。单因素分析发现年龄、吸烟、前驱感染、肺部受累、血红蛋白、白蛋白、血清肌酐、CD4+T细胞、Birmingham血管炎活动性评分(BVAS)和诱导治疗等与感染相关。校正年龄、性别等因素后发现前驱感染、血清肌酐高于530.4 μmol/L和使用CTX治疗是AAV并发感染的独立危险因素,表明AAV患者合并感染主要与前驱感染史、肾损害严重及使用CTX强化免疫抑制治疗有关。肺部受累的AAV患者更容易合并感染,本文肺出血患者全部行血浆置换,其中仅1例未并发感染。
本研究感染相关死亡率为11.7%,低于以往报道[19]。强化免疫抑制治疗阶段感染风险及感染相关死亡率均较高,需强调在控制疾病进展同时避免过度免疫抑制。此外,死亡的重症感染患者主要为肺部混合病原体感染和抗细菌治疗无效者,提示抗感染过程中应兼顾真菌、卡氏肺孢子虫等不典型病原体。
综上所述,血管炎并发感染发生规律如下:(1)AAV各阶段均可感染,部位以肺部、皮肤多见;(2)病原体以细菌为主,机会致病菌以念珠菌属、巨细胞病毒、单纯疱疹病毒常见;(3)前驱感染、严重肾功能不全和CTX治疗是感染发生的独立危险因素。了解AAV并发感染的临床特点和规律有助于降低感染发生率。本研究仅回顾性分析,上述结果尚需前瞻性、大样本研究进一步验证。
1 Jennette JC,Falk RJ,Andrassy K,et al.Nomenclaure of systemic vasculitides:The proposal of an international consensus conference.Arthritis Rheum,1994,37(12):187-192.
2 梅洁卉,胡伟新,刘春蓓,等.抗中性粒细胞胞浆抗体相关血管炎肾损害的临床病理分析.肾脏病与透析肾移植杂志,2007,16(2):127-133.
3 胡伟新,陈樱花,刘正钊,等.激素联合赛可平和他克莫司治疗狼疮性肾炎的前瞻性临床研究.肾脏病与透析肾移植杂志,2011,20(4):301-306.
4 Charlier C,Henegar C,Launay O,et al.Risk factors for major infections in Wegener granulomatosis:analysis of 113 patients.Ann Rheum Dis,2009,68(5):658-663.
5 Reinhold-Keller E,Beuge N,Latza U,et al.An interdisciplinary approach to the care of patients with Wegener’s granulomatosis-long-term outcome in 155 patients.Arthritis Rheum,2000,(43)5:1021-1032.
6 Gayraud M,Guillevin L,le Toumelin P,et al.Long-term followup of polyarteritis nodosa,microscopic polyangiitis,and Churg-Strauss syndrome:Analysis of four prospective trials including 278 patients.Arthritis Rheum,2001,44(3):666-675.
7 Hoffman GS,Kerr GS,Leavitt RY,et al.Wegener Granulomatosis:An Analysis of 158 Patients.Ann Intern Med,1992,116(6):488-498.
8 Mukhtyar C,Guillevin L,Cid MC,et al.EULAR recommendations for the management of primary small and medium vessel vasculitis.Ann Rheum Dis,2009(68):310-317.
9 Harper L,Savage CO.ANCA-associated renal vasculitis at the end of the twentieth century-a disease of older patients.Rheumatology (Oxford),2005(44):495-501.
10 Booth AD,Almond MK,Burns A,et al.Outcome of ANCA-associated renal vasculitis:A 5-year retrospective study.Am J Kidney Dis,2003,41(4):776-784.
11 Bonaci-Nikolic B,Andrejevic S,Pavlovic M,et al.Prolonged infections associated with antineutrophil cytoplasmic antibodies specific to proteinase 3 and myeloperoxidase:diagnostic and therapeutic challenge.Clin Rheumatol,2010,29(8):893-904.
12 Koselj-Kajtna M,Koselj M,Rott T,et al.Infectious complications of immunosuppressive treatment for anti-neutrophil cytoplasm antibody-related vasculitis.Transplant Proc,2002,34(7):3001-3002.
13 Moosig F,Holle JU,Gross WL.Value of anti-infective chemoprophylaxis in primary systemic vasculitis:what is the evidence? Arthritis Res Ther,2009,11(5):253.
14 Sowden E,Carmichael AJ.Autoimmune inflammatory disorders,systemic corticosteroids and pneumocystis pneumonia:a strategy for prevention.BMC Infect Dis,2004,4:42.
15 Stassen PM,Sanders JS,Kallenberg CG,et al.Influenza vaccination dose not result in an increase in relapses in patients with ANCA-associated vasculitis.Nephrol Dial Transplant,2008,23(2):654-658.
16 Holvast A,Stegeman CA,Benne CA,et al.Wegener’s granulomatosis patients show an adequate antibody response to influenza vaccination.Ann Rheum Dis,2009,68(6):873-878.
17 van Assen S,Agmon-Levin N,Elkayam O,et al.EULAR recommendations for vaccination in adult patients with autoimmune inflammatory rheumatic diseases.Ann Rheum Dis,2011,70 (3):414-422.
18 Ozaki S,Atsumi T,Hayashi T,et al.Severity-based treatment for Japanese patients with MPO-ANCA-associated vasculitis:the JMAAV study.Mod Rheumatol,2012,22(3):394-404.
19 Flossmann O,Berden A,de Groot K,et al.Long-term patient survival in ANCA-associated vasculitis.Ann Rheum Dis,2001,70(3):488-494.
(本文编辑 律 舟 莫 非 凡 心)
Infectious complications in patients with ANCA associated vasculitis
YANGLiu,XIEHonglang,LIUZhengzhao,CHENYinhua,CHENGShuiqin,ZHANGHaitao,LIUZhihong,HUWeixin
NationalClinicalResearchCenterofKidneyDisease,JinlingHospital,NanjingUniversitySchoolofMedicine,Nnajing210016,ChinaCorrespondingauthor:HUWeixin(E-mail:huwx@vip.163.com)
Objective:To investigate the incidence, epidemiologic and clinical characteristics and risk factors of infection in patients with antineutrophil cytoplasmic antibody (ANCA)-associated vasculitis (AAV). Methodology:Two hundred fifty five patients (male 103 and female 152, age 14~78 years) with AAV from January 1996 to December 2013 were included into this retrospective study. The patients
induction therapy with corticosteroids with or without intravenous cyclophosphamide (IV-CYC), mycophenolate mofetil (MMF) or multi-target therapy. Infection was defined as major infection and diagnosed by the clinical and radiological manifestation and microbiological evidences. The time, site, incidence and risk factors of severe infection were analyzed. Results:103 infection episodes were found in 86 patients (28.0%) during follow-up for median 15 months (1~155 months). The infection rate of induction therapy with corticosteroids (n=65),MMF (n=77),IV-CTX (n=66) and Tripterygium wilfordii (n=40) were 38.5%,39.0%,33.3% and 22.5% respectively. 73.8% (76/103) of the infection episodes occurred within 6 months of the induction treatment, 66 of them (64.1%) occurred within 3 months. The most common infection site was lung (n=74).The others included skin, digestive tract and urinary tract, and six cases developed sepsis. The most common pathogen was bacteria (78.6%), followed by fungus (12.6%) and virus (8.7%). COX model manifested that beforehand infection prior to the onset of AAV (RR=4.105, 95%CI=2.557-6.592), serum creatinine≥6 mg/dl (RR=1.179, 95%CI=1.090-1.276), and cyclophosphamide (RR=1.889, 95%CI=1.020-3.500) were independent risk factors for the development of infection. The main thoracic manifestations include consolidation (51.4%), diffused interstitial pneumonia(28.4%)and multiple nodules (17.6%). 34 cases reached end stage of renal disease during follow-up. 12 of 86 patients (11.7%) died and all were due to severe pulmonary infection. Conclusion:Infection rate was high in patients with AAV, especially during the first 3 months of induction treatment. Pulmonary bacteria infection was the most common type of infection. Beforehand infection, severe renal dysfunction and cyclophosphamide were high risk factors for developing infection.
antineutrophil cytoplasmic antibody vasculitis infection incidence risk factors
国家科技支撑计划课题(2013BAI09B04,2015BAI12B05),江苏省临床医学中心项目(BL2012007)
南京军区南京总医院肾脏科 国家肾脏疾病临床医学研究中心 全军肾脏病研究所(南京,210016)
胡伟新(E-mail:huwx@vip.163.com)
2014-11-22
ⓒ 2015年版权归《肾脏病与透析肾移植杂志》编辑部所有
