肾病综合征患者合并无菌性股骨头坏死
2015-06-09焦晨峰许书添涂远茂刘志红李世军
焦晨峰 许书添 涂远茂 刘志红 李世军
肾病综合征患者合并无菌性股骨头坏死
焦晨峰 许书添 涂远茂 刘志红 李世军
目的:分析原发性肾小球疾病(局灶节段性肾小球硬化、IgM肾病、微小病变肾病)肾病综合征患者合并无菌性股骨头坏死的临床特点及危险因素。 方法:回顾性分析2009年1月至2013年12月原发性肾小球疾病肾病综合征患者激素治疗后合并股骨头坏死的临床资料。 结果:3 796例原发性肾小球疾病肾病综合征门诊随访患者中92例(2.4%)并发股骨头坏死。股骨头坏死组在激素治疗3年内发生股骨头坏死比例为80.4%。多因素Logistic回归分析结果显示低白蛋白血症是原发性肾小球疾病肾病综合征患者并发股骨头坏死的危险因素(P<0.05)。股骨头坏死组对激素治疗反应、肾病复发次数及糖皮质激素累积用量与非股骨头坏死组无明显差异(P>0.05)。股骨头坏死组血清白蛋白降低、纤维蛋白原升高及血钙水平降低的患者与非股骨头坏死组有统计学差异(P<0.05)。预防使用维生素D制剂及钙剂不能降低股骨头坏死发生率。股骨头坏死组与非股骨头坏死组之间年龄、性别、24h尿蛋白定量、血红蛋白、血小板、尿酸、三酰甘油、总胆固醇、低密度脂蛋白胆固醇、低密度脂蛋白胆固醇与高密度脂蛋白胆固醇比值、血磷无统计学差异(P>0.05)。 结论:原发性肾小球疾病肾病综合征并发股骨头坏死在激素治疗3年内高发,部分症状不典型,低白蛋白血症是并发股骨头坏死的高危因素。高危患者应在激素治疗5个月开始定期行影像学检查,以早期诊断骨股头坏死。
原发性肾小球疾病 肾病综合征 股骨头坏死 糖皮质激素
无菌性股骨头缺血性坏死简称股骨头坏死,是各种原因导致局部缺血,从而引起股骨头结构破坏及股骨头塌陷的一种病变。原发性肾小球疾病肾病综合征患者常需激素治疗,而激素是导致股骨头坏死的重要诱因,晚期可导致全髋关节病变,出现髋关节疼痛、功能障碍,是严重的致残性疾病[1-3]。
迄今为止,已经有关于无菌性股骨头坏死的研究,包括系统性红斑狼疮(SLE)、饮酒、吸烟及肾移植受者[4-6]。但目前尚无针对原发性肾小球疾病肾病综合征患者并发无菌性股骨头发生规律及危险因素的报道。本研究回顾分析原发性肾小球疾病肾病综合征患者随访期间并发股骨头坏死的临床资料,探讨股骨头坏死发病率及相关临床特点,以提高对原发性肾小球疾病肾病综合征合并无菌性股骨头坏死的认识,为其防治提供依据。
对象和方法
研究对象 从2009年1月至2013年12月在南京军区南京总医院肾脏科门诊规律随访的原发性肾小球疾病肾病综合征[包括局灶节段性肾小球硬化(FSGS)、IgM肾病、微小病变肾病]患者3 796例,均行肾活检明确诊断。
纳入标准:(1)X线、CT 、MRI任一影像学检查证实,伴或不伴临床症状;(2)门诊规律随访≥2年;(3)激素用量明确,持续时间≥3个月;
排除标准:(1)年龄<12岁;(2)门诊随访不规律,激素用量不明确;(3)外伤骨折、长期酗酒、肿瘤、SLE、抗心磷脂抗体综合征(APS)、膜性肾病(MN)等其他因素所致股骨头坏死。
从2009年1月至2013年12月间符合下述条件[(1)排除无菌性股骨头坏死;(2)门诊随访规律,随访时间≥2年;(3)激素用量明确,持续时间≥3个月;(4)年龄≥12岁]的原发性肾小球疾病肾病综合征患者,随机抽取92例为对照组。
研究方法 比较两组的临床特点、肾病复发及激素用量情况;包括患者的性别、年龄、原发性肾小球疾病肾病综合征对激素的反应、肾病复发次数、激素累积用量、是否使用维生素D制剂及钙剂;实验室检查指标包括24h尿蛋白定量、血红蛋白(Hb)、血小板、纤维蛋白原、血钙、血磷、尿酸、三酰甘油、总胆固醇、低密度脂蛋白胆固醇(LDL-C)、LDL-C与高密度脂蛋白胆固醇(HDL-C)比值。
肾组织学检查 所有患者均在B超引导下行经皮肾活检术,标本行光镜、免疫荧光及电镜检查。光镜检查常规行HE、PAS、PASM-Masson、Masson三色染色。免疫荧光采用冰冻切片免疫荧光直接法观察肾组织IgG、IgA、IgM、C3及C1q的沉积情况。肾组织以3.75%的冷戊二醛固定,1% 四氧化锇后固定,超薄切片厚70~80 nm,醋酸铀、柠檬酸铅双染色,置于Hitachi7500投射电子显微镜下观察超微结构。
相关指标定义 激素敏感型肾病综合征(SSNS):足量激素治疗[泼尼松 1 mg/(kg·d) 或相应剂量的其他类型的糖皮质激素]治疗≤8周,尿蛋白完全转阴;若病理类型为 FSGS,患者足量激素治疗时间可延长至 12周;糖皮质激素抵抗型肾病综合征(SRNS):使用糖皮质激素治疗[泼尼松 1 mg/(kg·d) 或相应剂量的其他类型的糖皮质激素]8 周无效;若病理类型为FSGS,患者足量激素治疗 12 周无效时定义为激素抵抗。糖皮质激素依赖型肾病综合征(SDNS):糖皮质激素治疗取得完全缓解后,于减量或停药后 2 周内复发,连续 2 次以上。复发:经治疗好转或缓解的患者重新出现尿蛋白定量≥3.5 g/24h。
统计学处理 使用SPSS 19.0软件。计量资料以均数±标准差或中位数表示,组间比较采用t检验,计数资料以百分比表示,组间比较采用卡方检验。相关分析采用采用pearson相关系数。多因素Logistics回归分析法分析原发性肾小球疾病肾病综合征合并股骨头坏死的相关危险因素。P<0.05为差异有统计学意义。
结 果
一般资料 3 796例患者中FSGS 1 178例,IgM肾病70例,微小病变肾病2 548例。并发股骨头坏死共92例,男 68例,女 24例;其中FSGS 24例,IgM肾病8例,微小病变肾病60例。年龄范围 13~60岁,平均(27.9±11.6)岁。累及双侧股骨头坏死47例,单侧45例(左侧 23例,右侧22例)。非股骨头坏死组92例,其中男 65例,女27例,年龄范围12~63岁,平均(26.4±13.5)岁。两组在性别、年龄无统计学意义(P>0.05)。股骨头坏死组在初次发病时尿蛋白定量、尿酸、Hb、血小板、三酰甘油、总胆固醇、LDL-C及LDL-C/HDL-C比值方面无统计学差异,但在血清白蛋白、纤维蛋白原、血钙水平方面有统计学意义(P<0.05)(表1)。
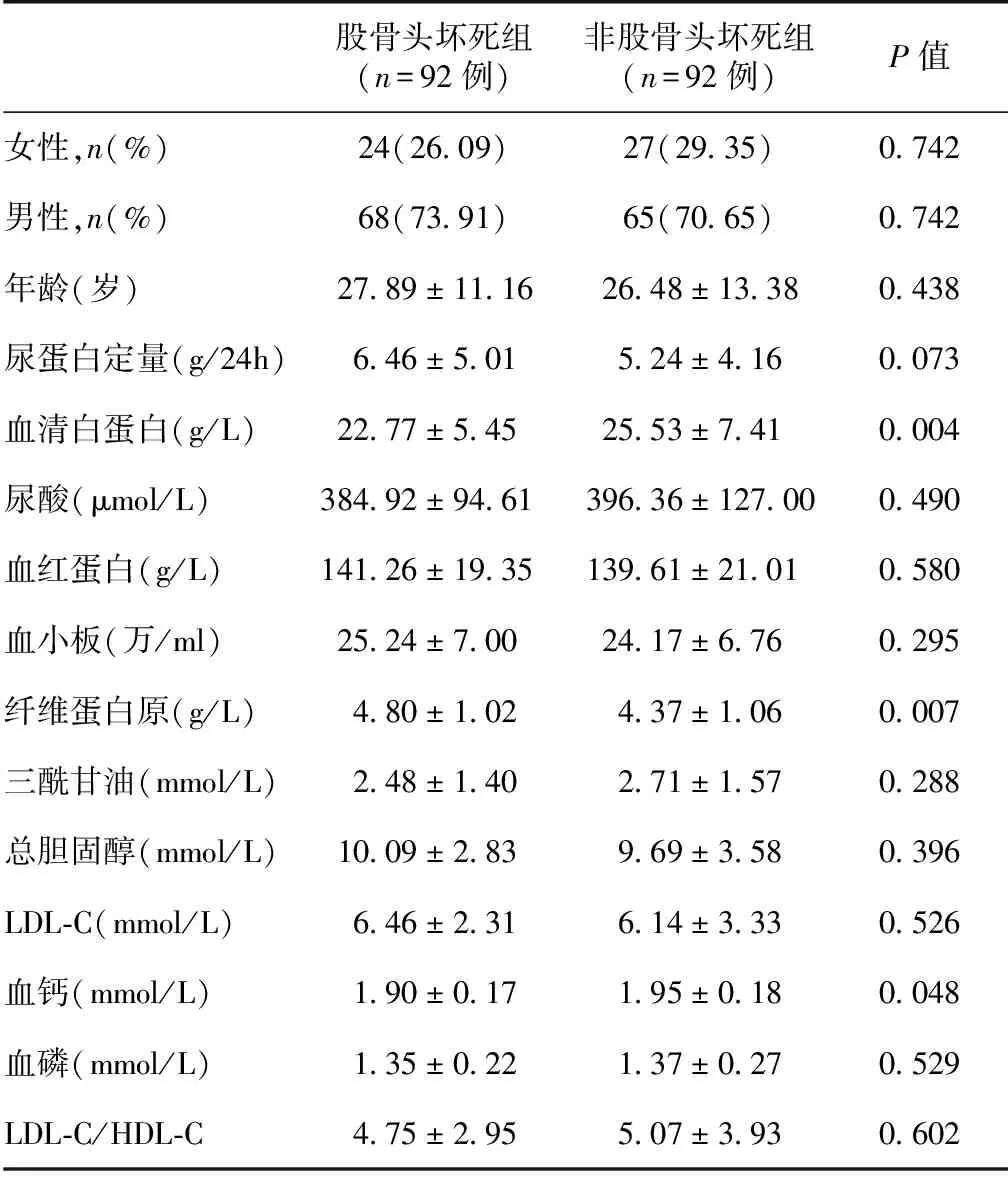
表1 两组患者基线临床资料
LDL-C:低密度脂蛋白胆固醇;HDL-C:高密度脂蛋白胆固醇FSGS、IgM肾病及微小病变肾病并发股骨头坏死发生率比较 FSGS、IgM肾病及微小病变肾病中并发股骨头坏死的发生率分别为2.04%、11.43%、2.35%。FSGS与微小病变肾病股骨头坏死发生率无统计学意义(P>0.05),但IgM肾病与FSGS及微小病变肾病股骨头坏死发生率有统计学意义(P<0.05)。
股骨头坏死影像学表现 股骨头坏死早期,患者通常无临床症状。随着股骨头坏死程度逐渐加重,患者可逐渐出现髋关节疼痛、髋关节僵硬、活动受限及跛行。 图1示典型股骨头坏死MRI影像学改变。

图1 典型股骨头坏死MRI影像学改变
股骨头坏死发生时间 92例患者在激素开始治疗5~115月(中位时间28月)确诊为股骨头坏死。其中1年以内、1~2年、2~3年、3~4年及4年以上股骨头坏死所占比例分别为15.2%、35.9%、29.3%、10.9%、8.7%。80.4%股骨头坏死发生在激素治疗3年内,3年后发生率逐渐降低,最长1例患者随访9年时发现股骨头坏死(图2)。
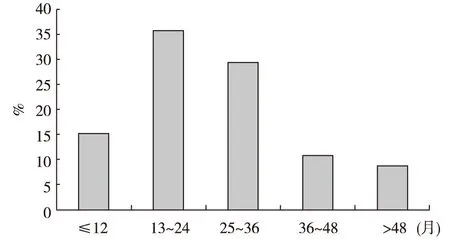
图2 肾病综合征患者发生股骨头坏死的时间分布
对激素治疗的反应 股骨头坏死组与非股骨头坏死组SSNS、SDNS、SRNS分布比较无统计学差别(P>0.05)(表2)。
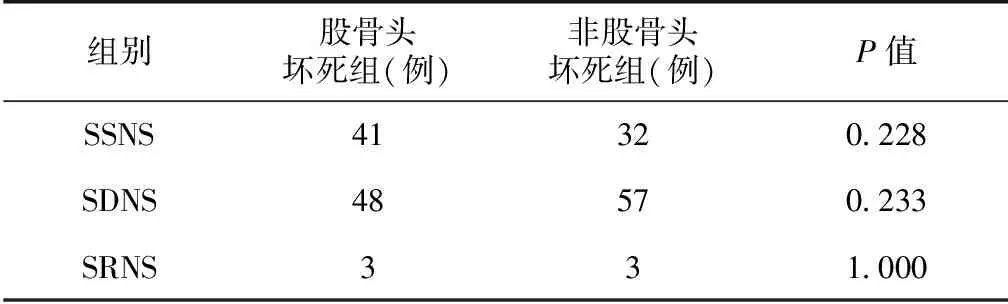
表2 原发性肾小球疾病肾病综合征对激素治疗的反应比较
SSNS:激素敏感型肾病综合征;SDNS:糖皮质激素依赖型肾病综合征;SRNS:糖皮质激素抵抗型肾病综合征
相关分析 采用pearson相关系数分析发现血白蛋白水平与血钙水平具有相关性(R=0.717,P<0.05)。
多因素Logistic回归分析 以是否并发股骨头坏死为因变量,以Hb、血小板、血清白蛋白、纤维蛋白原、LDL-C、血钙、血磷、总胆固醇、三酰甘油为自变量建立Logistic回归模型,结果显示两组之间血清白蛋白比较有统计学差异(P<0.05),低白蛋白血症是股骨头坏死的危险因素。
肾病复发次数及糖皮质激素累积用量比较 原发性肾小球疾病肾病综合征合并股骨头坏死发病高峰在激素使用3年以内,3年内发生股骨头坏死者74例,将3年内股骨头坏死组与非股骨头坏死组激素使用时间做1∶ 1配比,比较在股骨头坏死组与非股骨头坏死组肾病复发次数及糖皮质激素累积用量比较。肾病复发次数及糖皮质激素累积用量在股骨头坏死组及非股骨头坏死组中无统计学差异(P>0.05)(表3)。
表3 激素治疗3年内肾病复发次数及糖皮质激素累积用量比较
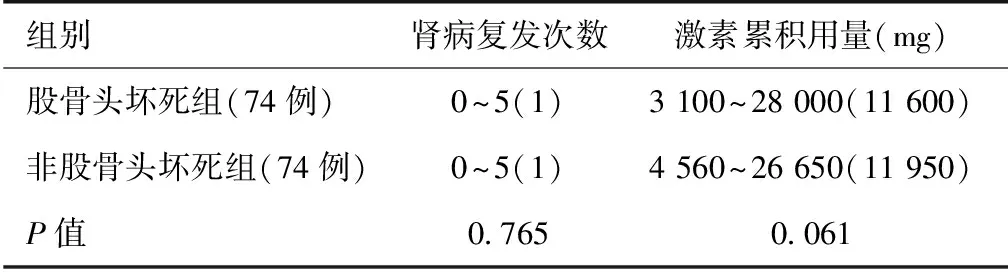
组别肾病复发次数激素累积用量(mg)股骨头坏死组(74例)0~5(1)3100~28000(11600)非股骨头坏死组(74例)0~5(1)4560~26650(11950)P值0 7650 061
预防使用维生素D制剂及钙剂比较 股骨头坏死组在激素开始治疗时有68例患者使用维生素D制剂及钙剂,而非股骨头坏死组有64例。两组比较无统计学差异(P>0.05)。
讨 论
原发性肾小球疾病肾病综合征是一类临床表现为大量蛋白尿,低白蛋白血症、未明确病因的一组临床综合征。随着疾病诊断水平提高,激素的广泛使用,原发性肾小球疾病肾病综合征的预后较以往有了明显的改善。激素作为治疗原发性肾小球疾病肾病综合征的基础用药,一般认为激素与骨坏死的发生密切相关[7]。在美国,约有3千万的患者需要糖皮质激素的治疗,其中约50% 的患者会出现骨质丢失导致骨折,40%的患者会出现不同程度的股骨头坏死。而糖皮质激素是非创伤性无菌性股骨头坏死的最重要的原因[8-10]。股骨头坏死具有预后差,致残率高等临床特点,给患者带来了巨大的精神及经济压力,严重影响患者的生活质量。本研究结果显示,原发性肾小球疾病肾病综合征合并股骨头坏死的发生率为2.4 %。其中IgM肾病合并股骨头坏死的比例高,本组患者IgM肾病病例数较少,其确切股骨头坏死有待进一步观察。
1978年,Felson 和Anderson[11]对糖皮质和骨坏死进行了荟萃分析,结果显示糖皮质激素累积量、糖皮质激素用药时间及平均每日糖皮质激素剂量与骨坏死密切相关。Koo等[9]研究显示,导致Ⅰ期无菌性股骨头坏死糖皮质激素平均用量5 928 mg,平均时间5.3月。本研究显示,原发性肾小球疾病肾病综合征合并股骨头坏死糖皮质激素最低剂量为3 100 mg。原发性肾小球疾病肾病综合征患者在平均随访28月(5~115月)发生股骨头坏死。本实验组糖皮质激素累积剂量大及用药时间长,与本研究患者并非股骨头坏死早期,而是出现严重的临床症状才行影像学检查明确有关。
既往研究证实,糖皮质激素导致股骨头坏死主要有以下原因:(1)糖皮质激素促使成骨细胞凋亡、抑制骨母细胞存活及分化,延长破骨细胞生命周期。骨细胞凋亡破坏股骨头机械感应网络,骨重塑障碍,导致股骨头塌陷坏死[7,8,11]。(2)糖皮质激素可损伤血管内皮细胞,导致微血管数量减少[12-13];且糖皮质激素使血液处于高凝及低纤溶状态[14],局部血栓形成,使股骨头发生缺血坏死。(3)糖皮质激素损伤血管内皮,使NO生成减少,外周血管舒缩平衡障碍,外周循环灌注不足,降低股骨头血流灌注[15]。糖皮质激素能诱导骨髓基质细胞向脂肪细胞分化,减少向成骨细胞分化;脂肪细胞大量增生,脂肪细胞肥大,髓内压力增高,静脉回流受阻;同时骨细胞内脂质沉积,骨细胞脂肪变性,最终骨细胞坏死[16-18]。
但Colwell等[19]在跟踪随访1 420例因患风湿性关节炎及哮喘而需要服用糖皮质激素的患者10年后,并未发现激素用量和无菌性股骨头坏死的发生有必然的相关性。所以,并不是所有的患者在接受高剂量的糖皮质激素后一定发生股骨头坏死。本研究结果亦证实,原发性肾小球疾病肾病综合征合并无菌性股骨头坏死组激素累积用量与未合并股骨头坏死组激素累积用量无统计学差异,同时分析原发性肾小球疾病肾病综合征对激素治疗反应及肾病复发次数,亦无统计学差异。本研究我们未能发现激素累积用量与股骨头坏死无明显相关,但是其危险因素。Asano等[20-21]提出股骨头坏死的易感性与个体基因差异导致糖皮质激素在体内代谢相关,该研究发现转运P糖蛋白(P-gp)活性与股骨头坏死易感性呈负相关。P-gp在糖皮质激素的吸收及分布方面起重要作用。编码P-gp基因类型表达C3435TT的P-gp有更高的活性,股骨头坏死发生率显著降低。He等[22]研究表明,P-gp基因类型为ABCB1可上调糖皮质激素的摄取,与股骨头坏死发生相关。对于长期使用糖皮质激素的患者,ABCB1基因G2677T/A多态性更容易发生股骨头坏死。因此,糖皮质激素治疗是股骨头坏死危险因素,股骨头坏死的发生是遗传易感性及后天因素相互作用的结果。
原发性肾小球疾病肾病综合征合并股骨头坏死患者80.4%发生在激素治疗3年以内,治疗3年以后股骨头坏死发生率明显减低,表明在治疗3年以内尤其要注意防范股骨头坏死。本研究患者均在出现明显临床症状才行影像学检查并确诊,因此均非股骨头坏死早期。本组股骨头坏死患者的症状除典型的髋部疼痛和髋关节活动障碍外,少数患者以膝关节疼痛或下肢疼痛为首发症状。因此,原发性肾小球疾病肾病综合征患者在治疗过程中出现下肢或髋关节疼痛或障碍时均应行髋关节影像学检查。但在股骨头坏死早期,患者通常无临床症状,常规X线片、CT检查均无异常,因此早期股骨头坏死较难发现,MRI检查的敏感度和特异度高,为早期诊断最可靠的方法[3]。本研究结果显示,激素治疗最短5个月即可发生股骨头坏死。因此,对于原发性肾小球疾病肾病综合征激素治疗5个月的高危患者尚无临床症状的常规行MRI检查并定期复查,以便尽早发现股骨头坏死。
本研究结果显示,原发性肾小球疾病肾病综合征合并股骨头坏死组的血清白蛋白、纤维蛋白原及血钙水平与未合并股骨头坏死组有统计学差异,血清白蛋白水平与血钙水平两者之间具有相关性,考虑低血钙水平继发于肾病综合征血清白蛋白水平降低。但尿蛋白定量、Hb、血小板、血尿酸、血磷、三酰甘油、总胆固醇、LDL-C及LDL-C/HDL-C比值无统计学差异。但是本研究发现预防使用维生素D制剂及钙剂在两组之间无统计学差异。多因素Logistic分析提示白蛋白水平降低是股骨头坏死发生危险因素。提示除糖皮质激素以外,肾病综合征本身也对股骨头坏死发生起一定作用。笔者认为,肾病综合征本身低蛋白血症导致有效血容量减少,进而导致股骨头灌注不足。高凝倾向及高纤维蛋白原血症促进股骨头原位血栓形成;继发性低钙血症导致骨质疏松化。以上因素共同促进股骨头坏死发生。但是具体发生机制尚不明确。
在临床实践中,临床医师要注重对股骨头坏死的认识。对于长期服用糖皮质激素的高危患者,要警惕股骨头坏死的发生,仔细询问有无髋关节疼痛不适,加强对髋关节病变体征的检查(有无叩击痛,Thomas征、4字试验有无阳性),必要时髋关节影像学检查,若X线片阴性,完善MRI检查。若明确股骨头坏死,则随访以X线片和CT为主,无需再行MRI。
本研究中尚存在不足,首先本文为回顾性研究,且并非所有患者均行MRI检查,部分早期股骨头坏死的患者可能被漏诊,因此,原发性肾小球疾病肾病综合征合并股骨头坏死的发生有待进一步前瞻性研究。
综上所述,本研究发现原发性肾小球疾病肾病综合征合并股骨头坏死的发生率为2.4%,在糖皮质激素治疗3年内发生率最高,低白蛋白血症是股骨头坏死发生危险因素。发生股骨头坏死与原发性肾小球疾病肾病综合征对激素治疗反应、肾病复发次数及糖皮质激素累积用量无明显相关。起病时血清白蛋白、纤维蛋白原及低血钙水平与股骨头坏死发生相关。预防使用维生素D制剂及钙剂不能减低股骨头坏死发生。对长期服用糖皮质激素患者,临床医生应定期行影像学检查,早期发现股骨头坏死。
1 Lavernia CJ,Sierra RJ,Grieco FR.Osteonecrosis of the femoral head.J Am Acad Orthop Surg,1999,7(4):250-261.
2 Aldridge JM 3rd,Urbaniak JR.Avascular necrosis of the femoral head:etiology,pathophysiology,classication,and current treatment guidelines.Am J Orthop (Belle Mead NJ),2004,33(7):327-332.
3 李子荣.股骨头坏死诊断与治疗的专家建议.中华骨科杂志,2007,27(2):146-148.
4 Inoue S,Horii M,Asano T,et al.Risk factors for nontraumatic osteonecrosis of the femoral head after renal transplantation.J Orthop Sci,2003,8(6):751-756.
5 Hirota Y,Hirohata T,Fukuda K,et al.Association of alcohol intake,cigarette smoking,and occupational status with the risk of idiopathic osteonecrosis of the femoral head.Am J Epidemiol,1993,137(5):530-538.
6 Gladman DD,Urowitz MB,Chaudhry-Ahluwalia V,et al.Predictive factors for symptomatic osteonecrosis in patients with systemic lupus erythematosus.J Rheumatol,2001,28(4):761-765.
7 Spreafico A,Frediani B,Francucci CM,et al.Role of apoptosis in osteoporosis induced by glucocorticoids.J Endocrinol Invest,2008,31(7 Suppl):22-27.
8 Weinstein RS, Manolagas SC.Apoptosis in glucocorticoid-induced bone disease.Curr Opin Endocrinol Diabetes Obes,2015,12(3):219-223.
9 Koo KH,Kim R,Kim YS,et al.Risk period for developing osteonecrosis of the femoral head in patients on steroid treatment.Clin Rheumatol,2002,21 (4):299-303.
10 Assouline-Dayan Y,Chang C,Greenspan A,et al.Pathogenesis and natural history of osteonecrosis.Semin Arthritis Rheum,2002,32(2):94-124.
11 Felson DT,Anderson JJ.Across-study evaluation of association between steroid dose and bolus steroids and avascular necrosis ofbone.Lancet,1987,1(8538):902-906.
12 Kerachian MA,Harvey EJ,Cournoyer D,et al.Avascular necrosis of the femoral head:vascular hypotheses.Endothelium,2006,13 (4):237-244.
13 Vogt CJ,Schmid-Schönbein GW.Microvascular endothelial cell death and rarefaction in the glucocorticoid-induced hypertensive rat.Microcirculation,2001,8 (2) 129-139.
14 Jones LC,Mont MA,Le TB,et al.Procoagulants and osteonecrosis.J Rheumatol,2003,30 (4):783-791.
15 Akaike M,Matsumoto T.Glucocorticoid-induced reduction in NO bioavailability and vascular endothelial dysfunction.Clin Calcium,2007,17 (6):864-870.
16 Kawai K,Tamaki A,Hirohata K.Steroid-induced accumulation of lipid in the osteocytes of the rabbit femoral head.A histochemical and electron microscopic study.J Bone Joint Surg Am,1985,67 (5):755-763.
17 Yin L,Li YB,Wang YS.Dexamethasone-induced adipogenesis in primary marrow stromal cell cultures:mechanism of steroid-induced osteonecrosis.Chin Med J (Engl),2006,119 (7):581-588.
18 Kitajima M,Shigematsu M,Ogawa K,et al.Effects of glucocorticoid on adipocyte size in human bone marrow.Med Mol Morphol,2007,40 (3):150-156.
19 Colwell CW Jr,Robinson CA,Stevenson DD,et al.Osteonecrosis of the femoral head in patients with inflammatory arthritis or asthma receiving corticosteroid therapy .Orthopedics,1996,19(11):941-946.
20 Asano T,Takahashi KA,Fujioka M,et al.ABCB1 C3435T and G2677T/A polymorphism decreased the risk for steroid-induced osteonecrosis of the femoral head after kidney transplantation.Pharmacogenetics,2003,13(11):675-682.
21 Asano T,Takahashi KA,Fujioka M,et al.Genetic analysisof steroid-induced osteonecrosis of the femoral head.J Orthop Sci,2003,8(3):329-333.
22 He W,Li K.Incidence of genetic polymorphisms involved in lipid metabolism among Chinese patients with osteonecrosis of the femoral head.Acta Orthop,2009,80(3):325-329.
(本文编辑 凡 心)
Avascular bone necrosis in patients with primary nephrotic syndrome
JIAOChenfeng,XUShutian,TUYuanmao,LIUZhihong,LIShijun
NationalClinicalResearchCenterofKidneyDisease,JinlingHospital,NanjingUniversitySchoolofMedicine,Nanjing210016,ChinaCorrespondingauthor:LIShijun(E-maillisj8855@163.com)
Objective:To investigate the clinical features of osteonecrosis of the femoral head (ONFH) in patients with primary nephrotic syndrome. Methodology:The clinical data of 3 796 cases with primary nephrotic syndrome including FSGS,IgM nephropathy and minimal change nephropathy were retrospectively analyzed in outpatients from January 2009 to December 2013. According to whether or not with ONFH they were divided into two groups; ONFH group and non-ONFH group. Results:A total of 92 cases was diagnozed as ONFH,and incidence of ONFH in idiopathic nephrotic syndrome patients was 2.4%. 80.4% of the ONFH occurred within the first 3 years of corticosteroid therapy. Multiple factor logistic regression analysis revealed that hypoproteinemia was the risk factor of ONFH (P<0.05). ONFH was no correlation with the glucocorticoid therapy response, recurrence frequency of nephropathy and accumulative dosage of glucocorticoid (P>0.05). Preventive use of vitamin D and calcium can not reduce the occurrence of ONFH. There was no difference in sex, age, 24-hour urine albumin excretion, hemoglobin, blood platelet, uric acid, triglyceride, total cholesterol, LDL-C, the ratio LDL-C to HDL-C, blood phosphorus between the two groups (P>0.05). Conclusion:The incidence of ONFH in patients with idiopathic primary glomerulopathy nephrotic syndrome was high within 3 years glucocorticoid therapy. Some patients were delayed to diagnose of ONFH for its atypical symptoms. Hypoproteinemia is the risk factor with ONFH. They should do MRI test of the hip joint routinely when the time of glucocorticoid treatment for 5 months.
primary glomerulopathy nephritic syndrome osteonecrosis of the femoral head glucocorticoid
国家科技支撑计划课题(2013BAI09B04,2015BAI12B05),江苏省临床医学中心项目(BL2012007)
南京大学医学院附属金陵医院(南京军区南京总医院)肾脏科 硕士研究生(焦晨峰),国家肾脏疾病临床医院研究中心 全军肾脏病研究所(南京,210016)
李世军(E-mail:lisj8855@163.com)
2015-02-12
ⓒ 2015年版权归《肾脏病与透析肾移植杂志》编辑部所有
