系统性红斑狼疮患者合并假性肠梗阻
2015-06-09许书添胡伟新刘正钊李世军刘志红章海涛
王 霞 许书添 胡伟新 刘正钊 李世军 刘志红 章海涛
系统性红斑狼疮患者合并假性肠梗阻
王 霞 许书添 胡伟新 刘正钊 李世军 刘志红 章海涛
目的:观察分析系统性红斑狼疮(SLE)患者合并假性肠梗阻(IPO)的临床特点及预后。 方法:2004年1月至2014年4月南京军区南京总医院肾脏科住院确诊为SLE合并IPO患者30例,回顾性分析其临床表现、实验室检查结果、影像学特点、治疗及预后。 结果:30例SLE合并IPO患者中,女性26例,男性4例,发生IPO时平均年龄(26.1±11.2)岁,SLE中位病程为27.5月,狼疮活动性指数(SLE-DAI)评分(11.2±7.4)分。6例有明确诱因(5例不洁饮食、1例上呼吸道感染)。IPO临床症状依次为恶心呕吐(76.6%)、腹痛(66.7%)、腹泻(56.7%)和腹胀(30%)。腹部平片及腹部CT可辅助诊断肠梗阻,阳性率>75%,7例患者同时合并肾盂、输尿管积水。96.7%患者存在贫血,9例患者血小板减少,8例患者白细胞减少,4例直接Coombs试验阳性。96.7%的患者补体C3降低,ANA阳性率89.7%,抗ds-NDA抗体阳性率51.7%,抗心磷脂抗体阳性率30.4%,狼疮抗凝物阳性率43.8%,抗C1q抗体阳性率47.4%。29例患者接受激素为主[泼尼松0.6~1 mg/(kg·d)]的免疫抑制剂治疗(其中10例甲泼尼龙冲击治疗,11例丙种免疫球蛋白治疗),病情均好转出院,IPO好转中位数时间12d。24例患者长期随访(1~60月),2例死亡,4例行腹膜透析,5例反复发生IPO,至随访终点,肾脏完全缓解率25%,部分缓解率41.7%。 结论:SLE累及消化道导致IPO临床相对罕见,但症状较重,容易误诊,早期识别,并及时给予免疫抑制剂治疗。
系统性红斑狼疮 假性肠梗阻 治疗 预后
系统性红斑狼疮(SLE)是多器官受累的自身免疫性疾病,临床表现多样,可累及一个或多个系统。约50%的SLE患者可出现消化道症状,仅2%~30%胃肠道症状由SLE引起[1-2],表现为恶心、呕吐,腹痛、腹泻,胃食管反流,吞咽困难,便秘,腹泻,大便失禁,假性肠梗阻(IPO),穿孔和出血。IPO主要是由肠壁平滑肌肠肌神经丛病变引起,有肠梗阻的症状和体征,但无机械性梗阻证据的综合征。IPO分为原发性和继发性,继发性IPO可见于多种基础疾病,如结缔组织病淀粉样变性等。SLE合并IPO病情危重复杂[3],极易误诊、延误治疗。本文通过对30例SLE患者出现IPO的临床表现、实验室检查和治疗预后分析,以提高对此类疾病的认识。
对象和方法
研究对象 2004年1月至2014年4月南京军区南京总医院肾脏科住院确诊为SLE合并IPO的患者30例。所有的病例均符合以下诊断标准:(1)美国风湿病学会(ACR)1982年修订的SLE分类标准[4];(2)有典型的肠梗阻症状、影像学表现并排除机械性肠梗阻;(3)排除类风湿性关节炎等其他结缔组织疾病,完整的病史、实验室检查、治疗及预后记录。
研究方法 收集患者的基本资料包括SLE起病年龄、SLE病程、肾病病程、肾活检病理分型、狼疮活动性指数(SLE-DAI),IPO的病程、诱因、临床表现,血常规,血生化,自身抗体(包括ANA、抗ds-DNA、抗心磷脂抗体、狼疮抗凝物、抗C1q抗体),补体、抗中心粒细胞胞质抗体(ANCA)等。同时收集腹部平片、腹部CT、肾脏超声、胃镜、肠镜。治疗措施:一般治疗包括禁食、胃肠减压、抑酸、促进胃肠动力、抗菌药物等;免疫抑制剂治疗包括泼尼松0.6~1 mg/(kg·d)及其他免疫抑制剂;外科手术治疗、IPO转归及远期预后等。
肾活检组织按常规方法行光镜、免疫荧光和电镜检查,病理类型,参照2003年ISN/RPS有关LN病理分型标准。
相关定义
肾病综合征定义 24h尿蛋白定量>3.5 g/24h,血清白蛋白(Alb)<30 g/L;低补体血症: C3<0.8 g/L或C4<0.1 g/L;白细胞减少:白细胞<4×109/L;血小板减少:血小板计数<100×109/L。
自身免疫性溶血(AIHA)的诊断标准[5]近4月内无输血或可疑药物服用史,血红蛋白<110 g/L,直接抗人球蛋白试验(Coombs’试验)阳性,血清间接胆红素升高,网织红细胞高于5%,血清乳酸脱氢酶升高。
疗效定义
IPO好转的定义 肠梗阻的症状消失和(或)影像学检查未见梗阻表现。
狼疮性肾炎(LN)完全缓解:蛋白尿定量≤0.4 g/24h,无活动性红细胞尿(尿沉渣RBC<10万/ml),Alb>35 g/L,血清肌酐(SCr)正常。部分缓解:尿蛋白定量降至基础值50%以下且<3 g/24h,Alb>30 g/L,SCr正常或不超过基础值的15%。无效:未达到完全缓解或部分缓解标准。
终末期肾病(ESRD)定义 CKD-EPI公式估算的肾小球滤过率(eGFR)<15 ml/(min·1.73m2)或接受肾脏替代治疗(血液透析、腹膜透析或肾脏移植)。
统计学方法 正态分布计量资料以均数±标准差表示;非正态分布计量资料中位数(四分位数)表示。计数资料采用百分比表示。组间比较采用t检验,P<0.05为差异有统计学意义,P<0.01为统计学差异显著。
结 果
一般资料 30例SLE合并IPO中女性26例,男性4例,其中3例以IPO为首发症状,发生IPO时平均年龄(26.1±11.2)岁(11~50岁),SLE中位数病程为27.5月 (6.3月,81月)。IPO有明确诱因6例。发生IPO时SLE-DAI评分(11.2±7.4)分。
IPO的临床表现 发生IPO到就诊的中位时间为5d(12d,15d),IPO的临床表现为恶心、呕吐(23例,76.6%),其次为腹痛(20例,66.7%),腹泻(17例,56.7%),发热(15例,50%),腹胀(9例,30%),肠鸣音减弱(5例,16.7%),排气减少无排便(4例,13.3%),无排便、排气(3例,10%),鲜血便(3例,10%),有排便无排气(6例,20%),肠鸣音消失(3例,10%),黑便(2例,6.7%)。
IPO的影像学检查结果
腹部X平片检查 19例患者行腹部X平片检查,其中16例提示不同程度的肠管扩张、积气,部分可见异常液气平面(图1A)。
腹部CT检查 26例患者行腹部CT检查,其中20例有不同程度的小肠壁、结肠局部肠管积气、扩张、水肿,轴位呈为较典型的“靶形”样改变(图1B)。
B超检查 20例患者在发生IPO时行肾脏B超检查,其中5例提示不同程度肾盂、肾盏扩张,输尿管上段积水(图1C)。
内窥镜检查 5例行胃镜检查、3例行结肠镜检查,均未发现器质性病变。
病理学检查 例12、20和29因误诊行肠管切除,例12和例20病理检查均提示血管炎性改变;例29结肠组织病理检查示:炎性细胞浸润,肉芽肿性结节及多形核白细胞。
肾脏损害 26例患者累及肾脏,其中20例行肾活检,病理分型为Ⅴ型5例,Ⅳ+Ⅴ型3例,Ⅳ型4例,Ⅲ+Ⅴ型3例,Ⅱ 型4例,间质性肾炎1例。发生IPO时肾脏损害表现为急进性肾炎综合征3例,慢性肾功能不全6例,急性肾损伤2例,肾病综合征2例,尿检异常17例。尿蛋白定量(2.2±2.1) g/24h; SCr (143.2±155.6) μmol/L,尿素氮(10.0±7.2) mmol/L。6例血钾偏低[(3.27±0.19) mmol/L]。其中8例患者发生IPO 1个月内行肾活检,7例免疫荧光见多种免疫复合物在肾小球系膜区及血管袢沉积,其中2例间质血管见补体沉积,1例小管基膜见补体沉积。
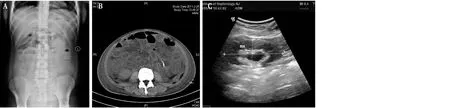
图1 系统性红斑狼疮合并假性肠梗阻患者腹部影像学改变A:肠管内见多个液气平面,呈阶梯状改变;B:肠管扩张积气呈“靶心”改变;C:右肾肾盂肾盏扩张,输尿管上段扩张
其他系统损害 29例贫血,平均血红蛋白(95.6±20.6) g/L,自身免疫性溶血4例。平均血小板计数为(107±108)×109/L,其中9例患者血小板减少,白细胞减少8例;肾、输尿管积水7例;中枢神经系统受累1例;心包积液6例;胸腔积液8例;肺动脉高压1例。病程中合并关节炎9例,皮肤脉管炎11例。平均补体C3下降(0.46±0.30) g/L,C4(0.09±0.07) g/L,ANA阳性率89.7%,抗ds-NDA阳性率51.7%,抗磷脂抗体阳性率30.4%(7/23),狼疮抗凝物阳性43.8%(7/16),抗C1q抗体阳性率47.4%(9/19),直接Coombs阳性22.2%(4/18)。SSA阳性率61.5%(16/26)。7例行MPO/PR3-ANCA检测均阴性。
IPO治疗及转归
一般治疗 一般治疗包括禁食(100%)、胃肠减压(25例,83.3%),留置胃管(25例,83.3%),抗菌药物治疗(18例,60%);接受质子泵抑制剂治疗(27例,90%),生长抑素治疗(17例,56.7%);肠外营养治疗(23例,76.7%)。其他对症治疗还包括纠正电解质紊乱、促进胃肠动力、纠正贫血、输注血小板及凝血因子、低分子肝素抗凝治疗等。
免疫抑制剂治疗 除例9外,其余患者均接受以糖皮质激素为主的免疫抑制剂治疗。在泼尼松[0.6~1 mg/(kg·d)]治疗的基础上,10例给予甲泼尼龙冲击(0.75~3g),11例给予丙种免疫球蛋白治疗(15~100g),2例患者给予环磷酰胺冲击治疗,1例加用他克莫司治疗(表1)。
外科治疗 共3例患者行外科手术:例9行剖腹探查,例12行左半结肠及左侧卵巢切除术;例20行结肠及部分小肠切除术。

表1 30例SLE合并IPO患者的实验室检查、治疗及长期预后
SLE:系统性红斑狼疮;IPO:假性肠梗阻;LN:狼疮性肾炎;MP:甲泼尼龙;IVIG:丙种免疫球蛋白;TW:雷公藤多苷;HCQ:羟氯喹;Pred:泼尼松;MMF:吗替麦考酚酯;FK506:他克莫司;CsA:环孢素A;CTX:环磷酰胺;LEF:来氟米特;PR:部分缓解;CR:完全缓解;CIN:慢性间质性肾炎;ND:未做;NA:不适用;*:甲泼尼龙冲击治疗IPO转归 经治疗,29例患者IPO好转,中位缓解时间为12d(8d,19.8d)。例9因剖腹探查并发感染放弃治疗。
随访结局 30例患者6例失访,24例随访4~60月。其中2例死亡(例2因右侧枕叶出血合并脑疝死亡;例10因狼疮累及中枢神经系统导致死亡);4例患者进入ESRD(例3、4和16在IPO缓解后1~2月接受腹膜透析治疗,例13随访中进展至ESRD行腹膜透析治疗);6例患者肾脏完全缓解,10例部分缓解(表1)。
维持期采用小剂量糖皮质激素联合其他免疫抑制剂治疗,其中5例患者出现IPO复发(1~3次)。IPO复发组患者的年龄[(17±4.7)岁vs(27±11.5)岁,P=0.004)、补体C4水平更低[(0.053±0.019)g/Lvs(0.101±0.07) g/L,P=0.007]均低于未复发组,而SLE-DAI两组无差异。另3例未发生IPO,但肾脏超声检查提示不同程度的肾盂、输尿管积水,经免疫抑制剂治疗后肾积水消失。
讨 论
IPO是一种排他性诊断,分为原发性和继发性,继发性原因较多,如SLE、硬皮病和系统性淀粉样变性[6-7]。文献报道[1,2,8]约50%的SLE患者可出现胃肠道症状,但仅2%~30%由SLE直接引起,其余可能为药物的不良反应或并发胃肠道疾病。SLE累及胃肠道包括肠系膜血管炎、胰腺炎、浆膜炎、蛋白丢失性肠病及IPO[9]。IPO可为SLE的首发表现[10],少数的病例报道通常表现为SLE的合并症[3,11-12]。SLE合并IPO的发病率不详。本中心2004年1月至2014年4月新诊断的SLE共3 174例,SLE合并IPO的发病率为9.7‰。
本研究观察的30例患者均符合SLE及IPO的诊断,IPO可发生在SLE的任何阶段,常见的临床症状依次为恶心、呕吐、腹痛、腹泻、腹胀。而以IPO为SLE为首发症状表现时,因临床表现急,病程短,消化道症状重,其他系统受累症状不典型,易误诊而接受不必要的手术治疗。本文例12和20接受了部分肠管切除,术后症状不缓解,病理提示血管炎性改变,其中例20患者在行结肠切除后3个月再次发生肠梗阻。腹部平片阳性率为84.2%,腹部CT的阳性率76.9%,故腹部平片可作为常规检查,结合CT检查可发现肠管扩张、局限性或弥漫性肠壁增厚、肠系膜水肿、腹水,且CT检查可发现肾盂、输尿管积水,本研究发现IPO同时合并肾盂、输尿管积水者7例。故临床上有典型的肠梗阻症状,如腹痛、腹胀、腹泻,而影像学检查提示肠管明显扩张、肠壁水肿高度考虑IPO但无肠梗阻的高危因素者,尤其是育龄期女性,合并尿检异常、血液系统损害者更要注意,需排除自身免疫性疾病,完善自身抗体检查避免漏诊、误诊。对于未发生IPO而出现肾盂肾盏扩张,输尿管积水的SLE患者应高度警惕发生IPO的可能。
IPO的发生与狼疮活动有一定相关性,本文观察的30例患者,IPO发生时SLE-DAI平均为(11.2±7.4)分,其中14例SLE-DAI评分≥12分。5例患者出现IPO反复复发,其中2例IPO复发时狼疮处于活动状态,SLE-DAI评分为16分和17分,余3例分别为2分、6分及6分。这与文献报道相符,IPO在SLE活动状态易发生[13-15],但也有SLE不活动状态下发生IPO[16]。
SLE合并IPO的机制目前尚不清楚,目前认为可能的机制:(1)免疫复合物介导:SLE引起免疫复合物在小血管壁的沉积导致炎细胞浸润、坏死、慢性缺血,引起肠道平滑肌纤维化和萎缩,伴黏膜下浆膜血管增生[15,17-18]。本研究中所有患者均存在低补体血症、对糖皮质激素治疗快速反应,提示是免疫复合物介导。2例患者肾间质血管见补体成分沉积。本研究观察到一个有趣的现象,反复复发IPO患者在发生前均存在不同程度补体下降,提示补体活化参与肠道病变发生。(2)浆膜腔炎是导致麻痹性肠梗阻的原因之一,本研究浆膜炎的发生率为36.7%(11/30),较文献报道的44.4%稍低,但SLE患者中浆膜炎也可能是SLE疾病活动的表现。(3)血管炎:文献报道有2例SLE合并ANCA阳性的患者发生IPO,而在本研究中未发现ANCA阳性,2例行肠管切除术后病理均提示血管炎性改变。(4)特异性抗体:目前尚未发现IPO特异性抗体,Park等[19]对SLE合并IPO、肾盂输尿管积水及巨胆总管的研究显示,抗平滑肌抗体可能参与IPO的发生,通过肠全层活检示环行肌层、T淋巴细胞性肌炎更显著,平滑肌细胞数量降低或完全消失,推测肠平滑肌细胞可能如抗原提呈细胞将T细胞激活后参加了炎性反应,最终引发自身的破坏。本研究合并肾盂输尿管积水发生率为23.3%,也说明了IPO与平滑肌功能障碍有关。Truedsson等[20]研究发现C1q的缺陷可能会导致细胞因子产生受损而引起持久的病毒感染,这可能是SLE的一个触发因素。
SLE合并IPO的治疗,首先应针对肠梗阻采用对症支持治疗[9]。在支持治疗的同时还应积极给予激素及免疫抑制剂治疗,包括(环磷酰胺、硫唑嘌呤、环孢素A等免疫抑制剂)。研究证实大剂量激素能有效治疗IPO[15],本研究中29例患者接受了足量或大剂量激素冲击治疗,部分缓解接受丙种免疫球蛋白治疗,多数患者在治疗后数天至数周病情缓解,恢复进食,治疗有效率达90%,同时SLE活动也明显改善。IPO常伴体重减轻、营养不良等并发症,误诊及治疗不及时是导致其发生率低和高死亡率的主要原因。本文观察的24例患者,长期随访过程中继续免疫抑制剂治疗(如雷公藤多苷、他克莫司、吗替麦考酚酯、硫唑嘌呤等),所有患者LN病情均稳定,但是仍有IPO复发及出现肾盂、输尿管积水,因此,关于SLE合并IPO的发病机制及远期预后仍需深入研究。
小结:IPO为SLE的罕见而严重的并发症,SLE伴IPO影像学检查不典型,临床容易误诊、漏诊。对于肠梗阻患者要排除SLE,免疫抑制剂治疗有效,而非手术。
1 Hallegua DS,Wallace DJ.Gastrointestinal manifestations of systemic lupus erythematosus.Curr Opin Rheumatol,2000,12(5):379-385.
2 Sultan SM,Ioannou Y,Isenberg DA.A review of gastrointestinal manifestations of systemic lupus erythematosus.Rheumatology (Oxford),1999,38(10):917-932.
3 Mok MY,Wong RW,Lau CS.Intestinal pseudo-obstruction in systemic lupus erythematosus:an uncommon but important clinical manifestation.Lupus,2000,9(1):11-18.
4 Tan EM,Cohen AS,Fries JF,et al.The 1982 revised criteria for the classification of systemic lupus erythematosus.Arthritis Rheum,1982,25(11):1271-1277.
5 Giannouli S,Voulgarelis M,Ziakas PD,et al.Anaemia in systemic lupus erythematosus:from pathophysiology to clinical assessment.Ann Rheum Dis,2006,65(2):144-148.
6 Mann SD,Debinski HS,Kamm MA.Clinical characteristics of chronic idiopathic intestinal pseudo-obstruction in adults.Gut,1997,41(5):675-681.
7 Antonucci A,Fronzoni L,Cogliandro L,et al.Chronic intestinal pseudo-obstruction.World J Gastroenterol,2008,14(19):2953-2961.
8 Kwok SK,Seo SH,Ju JH,et al.Lupus enteritis:clinical characteristics,risk factor for relapse and association with anti-endothelial cell antibody.Lupus,2007,16(10):803-809.
9 Klippel JH.Systemic lupus erythematosus:demographics,prognosis,and outcome.J Rheumatol Suppl,1997,48:67-71.
10 Kim J,Kim N.Intestinal pseudo-obstruction:initial manifestation of systemic lupus erythematosus.J Neurogastroenterol Motil,2011,17(4):423-424.
11 Ceccato F,Salas A,Góngora V,et al.Chronic intestinal pseudo-obstruction in patients with systemic lupus erythematosus:report of four cases.Clin Rheumatol,2008,27(3):399-402.
12 Hill PA,Dwyer KM,Power DA.Chronic intestinal pseudo-obstruction in systemic lupus erythematosus due to intestinal smooth muscle myopathy.Lupus,2000,9(6):458-463.
13 Ebert EC,Hagspiel KD.Gastrointestinal and hepatic manifestations of systemic lupus erythematosus.J Clin Gastroenterol,2011,45(5):436-441.
14 Chng HH,Tan BE,Teh CL,et al.Major gastrointestinal manifestations in lupus patients in Asia:lupus enteritis,intestinal pseudo-obstruction,and protein-losing gastroenteropathy.Lupus,2010,19(12):1404-1413.
15 Tian XP,Zhang X.Gastrointestinal involvement in systemic lupus erythematosus:insight into pathogenesis,diagnosis and treatment.World J Gastroenterol,2010,16(24):2971-2977.
16 Nguyen H,Khanna N.Intestinal pseudo-obstruction as a presenting manifestation of systemic lupus erythematosus:case report and review of the literature.South Med J,2004,97(2):186-189.
17 Alexopoulou A,Andrianakos A,Dourakis SP.Intestinal pseudo-obstruction and ureterohydronephrosis as the presenting manifestations of relapse in a lupus patient.Lupus,2004,13(12):954-956.
18 Perlemuter G,Chaussade S,Wechsler B,et al.Chronic intestinal pseudo-obstruction in systemic lupus erythematosus.Gut,1998,43(1):117-122.
19 Park FD,Lee JK,Madduri GD,et al.Generalized megaviscera of lupus:refractory intestinal pseudo-obstruction,ureterohydronephrosis and megacholedochus.World J Gastroenterol,2009,15(28):3555-3559.
20 Truedsson L,Bengtsson AA,Sturfelt G.Complement deficiencies and systemic lupus erythematosus.Autoimmunity,2007,40(8):560-566.
(本文编辑 凡 心)
Intestinal pseudo-obstruction in patients with systemic lupus erythematosus
WANGXia,XUShutian,HUWeixin,LIUZhengzhao,LIShijun,LIUZhihong,ZHANGHaitao
NationalClinicalResearchCenterofKidneyDiseases,JinlingHosptial,NanjingUniversitySchoolofMedicine,Nanjing210016,ChinaCorrespondingauthor:ZHANGHaitao(E-mail:htzhang163@163.com)
Objective:To observe and analyze the clinical manifestations and prognosis of systemic lupus erythematosus (SLE) patients complicated with intestinal pseudo-obstruction (IPO). Methodology:From January 2004 to April 2014, thirty SLE patients complicated with IPO were enrolled into this retrospective study. Their clinical manifestations, laboratory tests, imaging characteristics, treatment and prognosis were investigated. Results:They were 26 females and 4 males, with mean age 26.1±11.2 years old. The median history of SLE was 27.5 months. The SLE-DAI score was 11.2±7.4 when IPO occurred. 6 patients had identified the precipitating factor (5 cases had unclean food, one case had respiratory tract infection). The most common manifestions of IPO were nausea and vomiting (76.6%), abdominal pain (66.7%), diarrhea (56.7%), and bloating (30%). More than 75% patients showed intestinal obstruction in KUB and abdominal CT. 7 patients with hydronephrosis and hydroureters concomitantly. Most cases had anemia (96.7%). 6 patients had thrombocytopenia and 8 patients had leukopenia. The direct coomb’s tests were positive in 4 cases. All patients had hypocomplementemia, with positive autoantidodies of ds_NDA (51.7%), anticardiolipin antibody (30.4%), lupus anticoagulant (43.8%) and anti-C1q antibody (47.4%). 29 patients were treated with intensive immunosuppressive therapy, 10 patients
methylprednisolone plus (0.75~3 g), 11 patients received gamma immunoglobulin therapy (15~100 g). All of them were improved after therapy. The median remission time of IPO was 12d (8~19 d). There was 24 patients follow-up one to 60 months,2 died of complications,5 patients had relapse of IPO,4 cases entered ESRD. Patients had stable condition of lupus. Conclusion:SLE complicated with IPO is relatively rare in clinical. The manifestation is diversity and easily missed diagnose or misdiagnosis. Eearly diagnosis and timely immunosuppressive therapy could improve the prognosis.
systemic lupus erythematosus intestinal pseudo-obstruction immunosuppressive therapy prognosis
“十二五”国家科技支撑计划课题(2013BAI09B04,2015BAI12B05),江苏省临床医学科技专项(BL2012007)
南京军区南京总医院肾脏科 国家肾脏疾病临床医学研究中心 全军肾脏病研究所(南京,210016)
章海涛(E-mail:htzhang163@163.com)
2015-01-19
ⓒ 2015年版权归《肾脏病与透析肾移植杂志》编辑部所有
