脂肪酸结合蛋白3对足细胞脂肪代谢的影响
2015-06-09郭汉城刘俊兰关天俊
高 清 徐 波 郭汉城 刘俊兰 关天俊
脂肪酸结合蛋白3对足细胞脂肪代谢的影响
高 清 徐 波 郭汉城 刘俊兰 关天俊
目的:观察脂肪酸结合蛋白3(FABP3)过度增加对足细胞脂肪代谢的影响。 方法:慢病毒载体转染小鼠永生化足细胞系(HSMPs)以构建稳定过表达FABP3的细胞系。将FABP3-siRNA转染至HSMPs中沉默FABP3,筛选干扰效率最大的FABP3-siRNA片段进行后续干扰实验。实验分组:(1)正常足细胞组;(2)NC-siRNA足细胞组;(3)FABP3-siRNA足细胞组;(4)NC足细胞组;(5)FABP3过表达足细胞组;(6)正常足细胞+棕榈酸(PA)组;(7)NC-siRNA足细胞+PA组;(8)FABP3-siRNA足细胞+PA组;(9)NC足细胞+PA组;(10)FABP3过表达足细胞+PA组。比色法测定细胞内 TG和游离脂肪酸的含量。定量PCR法检测各组细胞中过氧化物酶增殖激活受体α(PPARα)、酰基辅酶A氧化酶3(ACOX3)mRNA的表达。Western Blot法检测PPARα、ACOX3蛋白表达水平。 结果:与正常足细胞组相比,FABP3过表达足细胞组细胞内三酰甘油(TG)和游离脂肪酸水平增加(P<0.05),而FABP3-siRNA足细胞组TG和游离脂肪酸水平下降(P<0.05)。不论在正常环境还是PA环境下,与正常足细胞组相比,FABP3过表达足细胞组PPARα mRNA和蛋白表达均下调(P<0.05),而ACOX3 mRNA和蛋白表达均上调(P<0.05); FABP3-siRNA足细胞组PPARα mRNA和蛋白表达均上调(P<0.05),而ACOX3 mRNA和蛋白表达均下调(P<0.05)。与FABP3过表达足细胞组相比,FABP3-siRNA足细胞组PPARα mRNA和蛋白表达上调(P<0.05),ACOX3 mRNA和蛋白表达下调(P<0.05);加入PA后,FABP3过表达足细胞+PA组和FABP3-siRNA 足细胞+PA组之间PPARα mRNA和蛋白表达、ACOX3 mRNA和蛋白表达统计学差异显著(P<0.01)。 结论:FABP3过度增加可导致足细胞脂肪代谢紊乱,抑制FABP3过度增加可纠正足细胞脂肪代谢紊乱状态。该研究结果提示抑制FABP3表达可能对代谢因素如糖尿病、肥胖、高脂血症所致的足细胞损伤有一定防御和治疗作用。
脂肪酸结合蛋白3 过氧化物酶增殖激活受体α 酰基辅酶A氧化酶3 足细胞
足细胞是肾小球滤过屏障的重要组成部分,除参与维持毛细血管袢正常结构、肾小球基膜的更新和修复外,在肾小球固有细胞功能调节及机体免疫应答中,足细胞也起着重要作用。既往大量研究认为,足细胞损伤是肾小球损伤的中心环节,多种损伤因素(如代谢、免疫、炎症、毒物、感染、环境、遗传背景等)都能直接或间接影响足细胞,导致足细胞损伤、蛋白尿形成、肾小球硬化或间质纤维化等。脂毒性-足突细胞中心观点认为 podocin 和 nephrin附着于足突细胞间裂孔隔膜的类固醇(脂质阀)上,促进了podocin-nephrin 和 podocin 转运受体与阳离子通道6(TRPC-6)的交互作用,进而维持了足突细胞的功能。如果脂肪酸氧化出现异常,可能影响podocin蛋白的棕榈化作用、膜的嵌入及脂质阀的脂质构成,从而促进肾小球高滤过而产生白蛋白尿。仇丽茹等[1]的实验结果表明,脂肪酸可导致足细胞内脂滴增加,Caspase3/7明显增高,诱导足细胞凋亡。因此提出脂肪是维持肾脏细胞功能的必要物质,但也可导致肾脏炎性反应、纤维化作用甚至坏死[2-3]。
脂肪酸结合蛋白3(FABP3)是FABP超家族成员之一,其又称为心型FABP,既往认为它主要分布于心肌和骨骼肌。近期Chen等[4]研究发现肾小球足细胞中也存在FABP3,并且在肥胖相关性肾病患者肾组织足细胞中表达异常增高,与蛋白尿水平呈正相关。但FABP3对足细胞脂肪代谢的影响极其机制尚不清楚。
RNA干扰技术是一种新兴的基因治疗技术,是发生于mRNA水平的转录后基因沉默技术。可在哺乳动物细胞组织内起基因封闭作用,其结构稳定,无须像反义寡核苷酸那样进行广泛的化学修饰才能提高其半衰期,而且干扰RNA(siRNA)能在低于反义寡核苷酸几个数量级的浓度下,使靶基因降至低水平甚至完全“敲除”,从而产生缺失突变型[5-6]。因此,我们采用小鼠永生化足细胞系(HSMPs细胞),利用LV5(含EGF和puro)质粒为骨架,将FABP3构建进质粒,感染HSMPs细胞建立稳定表达FABP3的HSMPs细胞系。将siRNA转染至HSMPs细胞系中干扰FABP3,筛选最佳FABP3-siRNA序列并利用最佳的siRNA沉默FABP3。重点观察稳定表达FABP3的HSMPs细胞系和沉默FABP3的HSMPs细胞系脂质代谢与正常HSMPs细胞系之间的不同。探讨FABP3在足细胞中的作用,为治疗各种可能导致足细胞脂质代谢紊乱的慢性肾脏病提供新的可能性思路。
材料和方法
药品和试剂 棕榈酸(sigma公司),Fugene Xtreme transfection reagent(Roche公司),逆转录试剂盒(日本takara公司),FABP3、PPARα抗体(美国abcam公司),ACOX3抗体(美国pierce公司)、FABP3 siRNA(上海吉玛生物公司)、三酰甘油(TG)测定试剂盒(浙江伊利康生物技术有限公司)、游离脂肪酸和考马斯亮蓝蛋白测定试剂盒(南京建成生物工程研究所)。
稳定表达FABP3的HSMPs细胞系 过表达FABP3慢病毒订购自上海吉玛生物公司,绿色荧光蛋白(GFP)标记。种1×105个HSMPs细胞(由美国Shankland教授授权,南京军区南京总医院肾脏科刘志红院士馈赠)于六孔板中,加入MOI=1×107滴度的病毒培养,观察绿色荧光表达情况。加入 1 μg/ml的嘌呤霉素筛选细胞,2周后通过实时定量PCR(RT-PCR)及Western Blot法检测FABP3表达情况。
FABP3-siRNA瞬时转染 将8%FABP3-siRNA转染液加入种有1×105个HSMPs细胞的六孔板中,24h后取出细胞,用RT-PCR、Western Blot法检测FABP3表达情况。
细胞分组处理 根据每组需求,六孔板每个孔种2×105个所需细胞,转染siRNA和(或)者加入30 μmol/L棕榈酸(PA)即不饱和脂肪酸,由此将细胞分组为:(1)正常足细胞组;(2)NC-siRNA足细胞组;(3)FABP3-siRNA足细胞组;(4)NC足细胞组;(5)FABP3过表达足细胞组;(6)正常足细胞+PA组;(7)NC-siRNA足细胞+PA组;(8)FABP3-siRNA足细胞+PA组;(9)NC足细胞+PA组;(10)FABP3过表达足细胞+PA组。其中NC为转染一个错配序列的阴性对照(negative control)。处理48h后,收集细胞提取RNA和蛋白。
比色法检测细胞内TG和游离脂肪酸含量 收获细胞后,用PBS重复洗 3 次,加入PBS 500 μl后放入-70℃冰箱反复冻融3次,然后按照试剂盒说明书上提供的比色法测定细胞内TG和游离脂肪酸的含量。
RT-PCR法检测mRNA表达水平 提取各组细胞RNA,检测浓度后按照逆转录试剂盒说明书进行逆转录反应(表1)。采用RT-PCR仪以20μl反应体系进行PCR扩增。PCR热循环参数:37℃ 15 min→85℃ 5 s→95.0 ℃10 min→(95.0 ℃5 s→60.0 ℃1 min)×40。样本扩增结果用GADPH浓度校正。
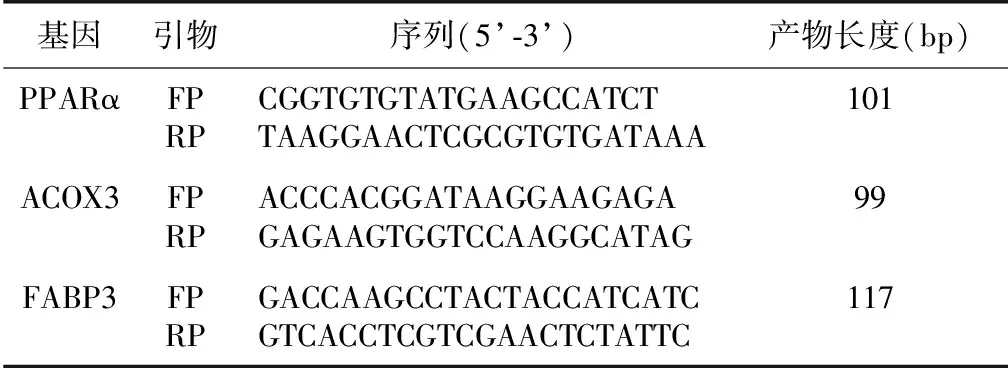
表1 实时荧光定量PCR引物分析
PPARα:过氧化物酶增殖激活受体α;ACOX3:酰基辅酶A氧化酶3;FABP3:脂肪酸结合蛋白3Western Blot法检测蛋白表达水平 收集细胞后加入蛋白裂解液获取总蛋白,用BCA法测蛋白浓度。每孔30 μg蛋白上样,经聚丙烯酰胺凝胶(SDS-PAGE)电泳分离后转至聚偏氟乙烯(PVDF)膜上,5%脱脂牛奶,室温下封闭1h,洗涤后加入兔抗小鼠PPARα多克隆抗体(1∶ 1 000)、兔抗小鼠ACOX3多克隆抗体(1∶ 1 000)4℃孵育过夜,洗涤后加入HRP偶联羊抗兔IgG(1∶ 5 000)室温孵育1h,洗涤后加入millipore ECL显色液曝光。Chremi DOC XRS凝胶成像仪照相,以Quantity One图像分析软件测定条带的吸光度值,以目的蛋白条带与β-actin条带吸光度的比值作为目的蛋白的相对表达量。
结 果
最佳FABP3-siRNA序列的筛选 我们设计了两组FABP3的siRNA片段,片段信息如下:Fabp3-Mus-298 GCAGGAGACAACACUAACUTT;Fabp3-Mus-369 GTGAGCACTCGGACTTAT。转染至目的细胞后24h RT-PCR检测FABP3的表达变化,筛选出干扰效果更强的为Fabp3-Mus-298片段用于下游实验。
FABP3 siRNA以及过表达mRNA水平和蛋白水平检测 mRNA水平和蛋白水平检测结果显示,过表达FABP3慢病毒感染足细胞后,足细胞稳定过表达FABP3,与对照组比较,FABP3在足细胞中mRNA表达水平和蛋白表达水平均明显升高(P<0.01);经FABP3-siRNA瞬时转染感染的足细胞,与对照组比较,足细胞FABP3表达明显受到抑制,FABP3的mRNA表达水平和蛋白表达水平均明显降低(P<0.01)(图1)。

图1 FABP3 siRNA及过表达FABP3 mRNA水平和蛋白水平检测A:FABP3 siRNA以及过表达mRNA水平检测;B:FABP3 siRNA以及过表达蛋白水平检测;ctrl:正常足细胞组;NC:阴性对照,将足细胞转染一个错配序列;FABP3:脂肪酸结合蛋白3;**:与ctrl组比较,P<0.01
不同FABP3表达水平对足细胞内TG和游离脂肪酸的影响 比色法结果显示,在PA作用下足细胞TG和游离脂肪酸水平增加(P<0.05)。过表达FABP3慢病毒感染足细胞后,足细胞内TG和游离脂肪酸水平增加(P<0.05);经FABP3-siRNA瞬时转染感染的足细胞,与正常对照组比较,TG和游离脂肪酸水平降低(P<0.05)。FABP3过表达足细胞在PA作用下TG和游离脂肪酸水平增加更加明显(P<0.01);FABP3-siRNA足细胞在PA作用下,TG和游离脂肪酸水平增加不明显(P>0.05)(表2)。
表2 FABP3 siRNA以及FABP3过表达足细胞在PA干预下细胞内TG和游离脂肪酸水平变化

实验组TG(mg/gprotein)游离脂肪酸(μmol/gprotein)正常足细胞组156±18332±24NC⁃siRNA足细胞组148±20350±39FABP3⁃siRNA足细胞组81±12∗196±16∗NC足细胞组164±35328±23FABP3过表达足细胞组225±37∗458±45∗正常足细胞+PA组239±46∗567±58∗NC⁃siRNA足细胞+PA组245±39∗579±72∗FABP3⁃siRNA足细胞+PA组136±27303±42NC足细胞+PA组230±40∗572±53∗FABP3过表达足细胞+PA组332±23∗∗798±54∗∗
FABP3:脂肪酸结合蛋白3;NC:阴性对照;TG:三酰甘油;PA:棕榈酸;*:与正常对照组比较,P<0.05;**:与正常对照组比较,P<0.01
不饱和脂肪酸干预状态下足细胞不同FABP3表达水平对PPARα和ACOX3 mRNA及蛋白表达的影响 定量PCR和Western Blot检测结果显示,过表达FABP3慢病毒感染足细胞后,足细胞PPARα mRNA和蛋白表达水平均下降(P<0.05),ACOX3 mRNA和蛋白表达水平均上升(P<0.05)。经FABP3-siRNA瞬时转染感染的足细胞,与正常对照组比较,PPARα mRNA和蛋白表达水平均上升(P<0.05),ACOX3 mRNA和蛋白表达水平均下降(P<0.05)。正常足细胞经PA干预后,PPARα mRNA和蛋白表达水平均下降(P<0.05),ACOX3 mRNA和蛋白表达水平均上升(P<0.05)。过表达FABP3慢病毒感染足细胞在PA干预下,PPARα mRNA和蛋白表达水平下降更加明显(P<0.05),ACOX3 mRNA和蛋白表达水平上升更加明显(P<0.05)。在PA干预下,经FABP3-siRNA瞬时转染感染的足细胞较正常足细胞PPARα mRNA和蛋白表达水平高(P<0.05),ACOX3 mRNA和蛋白表达水平低(P<0.05)(图2、3)。
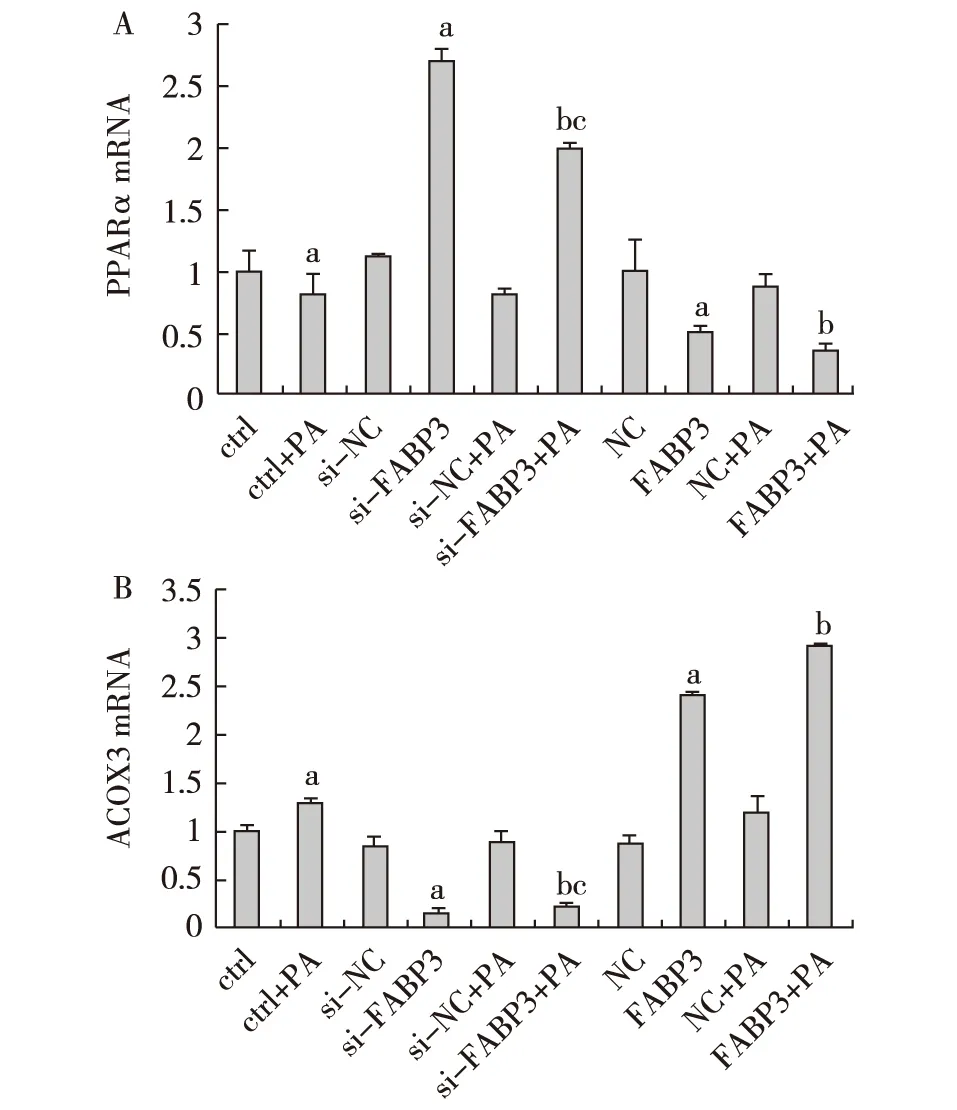
图2 FABP3 siRNA以及FABP3过表达足细胞在PA干预下PPARα、ACOX3 mRNA水平变化A:PPARα mRNA表达水平;B:ACOX3 mRNA水平;PPARα:过氧化物酶增殖激活受体α;ACOX3:酰基辅酶A氧化酶3;FABP3:脂肪酸结合蛋白3;PA:棕榈酸;ctrl:正常足细胞组;NC:阴性对照;a:与ctrl组比较,P<0.05;b:与ctrl+PA对照组比较,P<0.05;c:与FABP3+PA组比较,P<0.01

图3 FABP3 siRNA及FABP3过表达足细胞在PA干预下PPARα、ACOX3 蛋白水平变化A:PPARα、ACOX3 蛋白表达水平;B:PPARα蛋白表达水平半定量测定;C:ACOX3蛋白表达水平半定量测定;PPARα:过氧化物酶增殖激活受体α;ACOX3:酰基辅酶A氧化酶3;FABP3:脂肪酸结合蛋白3;PA:棕榈酸;ctrl:正常足细胞组;NC:阴性对照;a:与ctrl组比较,P<0.05;b:与ctrl+PA对照组比较,P<0.05;c:与FABP3+PA组比较,P<0.01
讨 论
足细胞在肾脏中具有重要作用,除参与构成肾小球滤过屏障、维持毛细血管袢正常结构、辅助肾小球基膜的更新和修复外,在肾小球固有细胞功能调节以及机体免疫应答中,足细胞也起着重要作用。既往研究认为足细胞损伤是肾小球损伤的中心环节,可导致蛋白尿形成、肾小球硬化或间质纤维化等。脂毒性-足细胞中心观点认为脂肪酸氧化异常可能影响podocin蛋白的棕榈化作用、膜的嵌入及脂质阀的脂质构成,可导致足细胞凋亡,从而促进肾小球高滤过而产生白蛋白尿[1-3]。此外,足细胞还可能分泌脂肪细胞因子如内脂素参与机体代谢紊乱[7-8]。因此提出脂肪过度增加可影响足细胞功能。
FABP是一组分子量约为14~15 kD的低分子胞质蛋白,分为FABP1、FABP2、FABP3、FABP4等亚型,参与细胞内的脂肪酸运输,在细胞内与脂肪酸结合,调节细胞内外脂肪酸的浓度,并将脂肪酸从细胞膜运送到脂肪酸氧化、TG和磷脂的合成部位,调控细胞内的多种生化反应过程。FABP广泛分布于多种组织细胞中,不同型的FABP以及同型FABP在不同细胞及组织内有其特殊性[9]。肾脏主要分布着三种FABP。Kamijo-Ikemori等[10]报道FABP3集中分布于肾小球和远端肾小管上皮。Guan等[11]发现肾小球系膜细胞上分布有FABP4。Oyama[12]的研究证实肾小管上皮细胞中存在FABP1。近期Chen等[4]研究发现肾小球足细胞中也存在FABP3,并且在肥胖相关性肾病患者肾组织足细胞中表达异常增高,与蛋白尿水平呈正相关。但FABP3对足细胞脂肪代谢的影响极其机制尚不清楚。因此,本文试图通过体外实验,重点观察足细胞FABP3过度表达和抑制状态下足细胞内脂肪代谢的情况及反映脂肪代谢的两个指标PPARα、ACOX3 mRNA和蛋白表达水平的改变。结果发现FABP3过度增加可导致足细胞内脂肪代谢紊乱,PPARα mRNA和蛋白表达水平下降,ACOX3 mRNA和蛋白表达水平升高;抑制FABP3表达可降低足细胞内TG及游离脂肪酸浓度,上调足细胞PPARα mRNA和蛋白表达水平,下调ACOX3 mRNA和蛋白表达水平。
PPARα可调节与脂肪酸氧化相关的酶的基因,可通过其他核转录因子而参与转录调控靶基因。PPARα的功能改变与肥胖的发病机制有密切关系。PPARα可能作为一种重要的脂质调节因子,参与细胞脂质代谢失衡的过程。足细胞中部分蛋白基因编码区有特异的启动因子,PPARα可直接调节足细胞。激活PPARα后对糖尿病受累足细胞有保护作用,可抑制核因子(NF-κB)和转化生长因子β1(TGF-β1)/Smad3 信号通路[13]。研究发现,阿霉素诱导的小鼠肾病综合征模型中PPARα表达下降,PPARα激动剂可通过稳定nephrin表达并抑制足细胞凋亡改善这一疾病模型[14]。在体外培养的足细胞中,也发现PPARα可通过降低caspase-3表达、增加Bcl-2表达而改善阿霉素诱导的足细胞损伤[15]。在多种损伤模型中发现PPARα可通过保护Bcl-2、Bax和nephrin表达而防治足细胞损伤[16]。本研究结果提示FABP3过度增加可能通过降低PPARα表达而导致足细胞更易受外界因素损伤,包括代谢、免疫、炎症、毒物、感染、环境等;抑制FABP3可能通过增加PPARα表达而起到保护足细胞的作用。本研究选取PA作为外界干扰因素,发现抑制FABP3过度增加仍可防止PA作用下足细胞PPARα表达降低,从而可能起到保护足细胞的作用。
ACOX3是过氧化物酶体脂肪酸β氧化过程中的重要氧化酶之一,过氧化物酶体是脂肪酸氧化的重要场所。在哺乳动物中,过氧化物酶体主要氧化分解长链、超长链和支链脂肪酸,过氧化物酶体的功能障碍会造成很多脂肪酸的过度沉积,引起代谢疾病。组织表达规律研究表明,ACOX3在小鼠白色脂肪组织中的表达量最高。高脂系个体ACOX3基因的表达量是低脂系的两倍多,ACOX3对脂肪的沉积有重要影响[17-18]。本研究结果提示FABP3过度增加可能通过ACOX3表达增加而导致脂肪在组织中过度沉积,在代谢因素所致足细胞损伤中可能起重要作用;抑制FABP3过度增加可能通过降低ACOX3 mRNA和蛋白表达而保护足细胞。
从研究结果看,我们认为FABP3过度增加可导致足细胞脂肪代谢紊乱,细胞内TG和游离脂肪酸水平增加,抑制FABP3表达可纠正足细胞脂肪代谢紊乱状态,细胞内TG和游离脂肪酸水平下降。FABP3过度增加可导致足细胞PPARα mRNA和蛋白表达水平下降,ACOX3 mRNA和蛋白表达水平升高;抑制FABP3可上调足细胞PPARα mRNA和蛋白表达水平,下调ACOX3 mRNA和蛋白表达水平。尤其在外界因素PA干预下两者差异更加显著。由此提示抑制FABP3表达可能通过改善足细胞脂肪代谢,调控PPARα、ACOX3 mRNA和蛋白表达水平起到保护足细胞、防止足细胞受外界因素损伤的作用。
小结:本研究为治疗足细胞损伤相关肾脏病提供了一种新的可行性方案,不足之处是目前对FABP3如何影响PPARα和ACOX3表达的机制尚未明确,我们将在今后的研究中进一步探索相关机制,并进一步观察FABP3在足细胞中的其他作用。
1 仇丽茹,唐锦辉,周建华.脂肪酸通过固醇调节元件结合蛋白1诱导足细胞的损伤.中国医院药学杂志,2013,33(18):1472-1476.
2 唐俊婷,宋滇平.乙酰辅酶 A羧化酶B与糖尿病及糖尿病肾病.中华临床医师杂志,2014,8(20):3665-3668.
3 Kampe K,Sieber J,Orellana JM,et al.Susceptibility of podocytes to palmitic acid is regulated by fatty acid oxidation and inversely depends on acetyl-CoA carboxylases 1 and 2.Am J Physiol Renal Physiol,2014,306(4):F401-F409.
4 Chen HM,Zheng CX,Gao Q,et al.Heart-type fatty acid binding protein is associated with proteinuria in obesity.PLoS One,2012,7(9):e45691.
5 马雯,徐玉音,仇芝,等.前列腺素E2受体1亚型在转化生长因子β诱导小鼠系膜细胞损伤中的作用机制.肾脏病与透析肾移植杂志,2015,24(1):44-49.
6 Karlsson C,Rak J,Larsson J.RNA interference screening to detect targetable molecules in hematopoietic stem cells.Curr Opin Hematol,2014,21(4):283-288.
7 冷蕾,张承巍,袁志刚,等.血清内脂素、Vaspin 与糖尿病肾病的相关性.实用临床医药杂志,2014,18(21):31-34.
8 江彤,吴爱兵.关于血浆内脏脂肪素与2型糖尿病肾病的探讨.中国医疗前沿,2008,3(14):3-4.
9 Binas B,Danneberg H,McWhir J,et al.Requirement for the heart-type fatty acid binding protein in cardiac fatty acid utilization.FASEB J,1999,13(8):805-812.
10 Kamijo-Ikemori A,Sugaya T,Matsui K,et al.Roles of human liver type fatty acid binding protein in kidney disease clarified using hL-FABP chromosomal transgenic mice.Nephrology (Carlton),2011,16(6):539-544.
11 Guan Y,Zhang Y,Schneider A,et al.Peroxisome proliferator-activated receptor-gamma activity is associated with renal microvasculature.Am J Physiol Renal Physiol,2001,281(6):F1036-F1046.
12 Oyama Y,Takeda T,Hama H,et al.Evidence for megalin-mediated proximal tubular uptake of L-FABP,a carrier of potentially nephrotoxic.Lab Invest,2005,85(4):522-531.
13 Bénardeau A,Verry P,Atzpodien EA,et al.Effects of the dual PPAR-α/γ agonist aleglitazar on glycaemic control and organ protection in the Zucker diabetic fatty rat.Diabetes Obes Metab,2013,15(2):164-174.
14 Mori K,Mukoyama M,Nakao K.PPAR-α transcriptional activity is required to combat doxorubicin-induced podocyte injury in mice.Kidney Int,2011,79(12):1274-1276.
15 Zhou Y,Kong X,Zhao P,et al.Peroxisome proliferator-activated receptor-α is renoprotective in doxorubicin-induced glomerular injury.Kidney Int,2011,79(12):1302-1311.
16 Miglio G,Rosa AC,Rattazzi L,et al.The subtypes of peroxisome proliferator-activated receptors expressed by human podocytes and their role in decreasing podocyte injury.Br J Pharmacol,2011,162(1):111-125.
17 李辉,赵士初,黄学涛,等.ACOX3基因多态性对鸡体脂沉积的影响.东北农业大学学报,2014,45(10):42-48.
18 Pivovarova O,Jürchott K,Rudovich N,et al.Changes of Dietary Fat and Carbohydrate Content Alter Central and Peripheral Clock in Humans.J Clin Endocrinol Metab,2015,100(6):2291-2302.
(本文编辑 春 江)
Effects of fatty acid binding protein 3 on the fat metabolism of podocyte
GAOQing,XUBo,GUOHancheng,LIUJunlan,GUANTianjun
DepartmentofNephrology,ZhongshanHospital,XiamenUniversity,Xiamen361004,ChinaCorrespondingauthor:GUANTianjun(E-mail:guantianjun@aliyun.com)
Objective:To investigate the effect and mechanisms of fatty acid binding protein 3 (FABP3) on the fat metabolism of podocyte. Methodology:We transfect the lentivirus vector to heat-sensitive mouse podocytes(HSMPs) to construct the cell line which express FABP3 stabile and excessively. Two siRNAs were designed and synthesized. One of them that was capable of silencing FABP3 more effectively in HSMPs was chosen to do the next interference study. They were divided into ten cell groups: (1) normal control group; (2) NC-siRNA group; (3) FABP3-siRNA group; (4) NC group; (5) excessive express FABP3 group; (6)normal control+palmic acid (PA) group; (7) NC-siRNA+PA group; (8) FABP3-siRNA+PA group; (9) NC+PA group; (10) excessive express FABP3+PA group. Triglycerides (TG) and free fatty acid contents in podocytes were determined by colorimetric method. The mRNA expression of peroxisome proliferator activated receptors α (PPARα) and ACOX3 of each group was determined by using Real-Time PCR. The proteins of PPARα and ACOX3 were examined by using Western blot. Results:Compared with normal control group,the levels of TG and free fatty acid were up-regulated in group5 (FABP3 group),while down-regulated in group3 (FABP3-siRNA group) (P<0.05). Compared with normal control group,mRNA and protein expressions of PPARα were down-regulated in FABP3 group (P<0.05),while mRNA and protein expressions of ACOX3 were up-regulated in FABP3 group (P<0.05) with or without PA. Compared with normal control group,mRNA and protein expressions of PPARα were up-regulated in FABP3-siRNA group (P<0.05),while mRNA and protein expressions of ACOX3 were down-regulated in FABP3-siRNA group with or without PA (P<0.05). Compared with FABP3 group,mRNA and protein expressions of PPARα were up-regulated in FABP3-siRNA group (P<0.05),while mRNA and protein expressions of ACOX3 were down-regulated in FABP3-siRNA group (P<0.05). There was more conspicuous statistical difference between FABP3+PA group and FABP3-siRNA+PA group in the expression of mRNA and proteins of PPARα and ACOX3 (P<0.01). Conclusion:The excessive expression of FABP3 may induce fatty metabolic disturbance in podocytes. Inhibiting the expression of FABP3 may improve the fatty metabolic disturbance in podocytes. These results prompted that inhibiting the expression of FABP3 may ameliorate the metabolic disorder induced podocyte injury,such as diabetes mellitus, obesity and dyslipidemia.
Fatty acid binding protein 3 peroxisome proliferator activated receptors α Acyl-Coenzyme A oxidase 3 podocyte
福建省自然科学基金青年创新项目(2012D054)
福建省厦门大学附属中山医院肾内科(厦门,361004)
关天俊(E-mail:guantianjun@aliyun.com)
2015-05-12
ⓒ 2015年版权归《肾脏病与透析肾移植杂志》编辑部所有
