糖皮质激素引发骨质疏松或骨坏死等不良反应研究进展
2015-06-09周晓孙伟隋晓杰综述王向波审校
周晓,孙伟,隋晓杰综述 王向波审校
综 述
糖皮质激素引发骨质疏松或骨坏死等不良反应研究进展
周晓,孙伟,隋晓杰综述 王向波审校
激素;不良反应;骨质疏松;骨坏死
众所周知,糖皮质激素(glucocorticoid, GC)因为其抑制免疫反应和抗感染等功能而被广泛应用,用来治疗很多疾病,尤其是感染性、过敏性和自身免疫性疾病,例如哮喘、风湿性关节炎、系统性红斑狼疮、风湿性多肌痛、炎性肠病、慢性阻塞性肺疾病、皮肤病、器官移植和其他系统性疾病[1,2],而在实际临床应用中,糖皮质激素也可被用于某些疑难杂病的试验性治疗及危重症疾病如休克或重症肌无力等患者的抢救,往往是不可替代的治疗方案,但是糖皮质激素导致的不良反应较为广泛,尤其是骨质疏松、股骨头坏死甚至骨折等严重后果,且发生率相对较高,使其应用受到限制。现对其引发的不良反应作以下综述。
1 糖皮质激素作用机制及不良反应概述
1.1 糖皮质激素的主要作用机制 糖皮质激素在体内有活性和非活性2种存在形式, 而这2种形式通过羟化(有活性的氢化可的松)或脱氢(无活性的可的松)相互转化,如可的松在细胞内可通过1型11β羟基类固醇脱氢酶(11β-HSD1)作用转化为氢化可的松,而11β-HSD2则使氢化可的松转化为可的松[3]。 该激素通过转录依赖性和非依赖性2种通路发挥作用,其中转录依赖性是作用的主要方式。糖皮质激素穿透细胞膜与胞浆激素受体(cytosolic GC receptors,cGCRs)结合,然后激素—受体复合物转运到细胞核,招募特定的转录因子来激活(JAB1/LPS)或抑制(激活蛋白,AP1/核因子κB,NF-κB)特定基因转录,分别称为激活和反式阻抑;尽管糖皮质激素大部分通过激活效应起治疗作用,但是对某些下游靶基因的反式阻抑可以导致激素治疗中对新陈代谢的不良反应。目前对糖皮质激素的抗炎作用机制研究较多:转录依赖型通路即细胞浆激素受体(主要是GR-α)介导的基因转录调控机制,转录非依赖型通路包括细胞浆或细胞膜介导的非基因转录调控机制、与细胞膜的非特异作用和其他作用机制发挥抗炎效果;其中,前者是主要的作用方式,糖皮质激素与其受体的复合物以同源二聚体形式与DNA上的糖皮质激素反应元件(GREs)结合,招募一些特异的转录因子(如具有组蛋白乙酰转移酶活性的共激活因子和IγB)结合到抗炎DNA的启动子上,促进抗炎蛋白的表达(如亮氨酸拉链蛋白);转录非依赖型通路可以产生很迅速的效果,可以分为3种不同的机制:首先,糖皮质激素作用方式被胞浆受体(如甾体激素共激活因子)调控,激素与胞浆激素受体的结合促进了某些信号分子(如脂皮质素-1)的释放抑制花生四烯酸产生,产生快速的反应;其次,最新发现激素有细胞膜受体调控作用,激素和细胞膜上激素受体的结合可以刺激单核细胞提高β38MAPK的活性,在几分钟内引起细胞内的级联反应,导致细胞凋亡;再次,由于糖皮质激素的亲脂特性,如果激素应用过多,糖皮质激素与膜结构的物理化学反应可以导致非特异性作用,如影响细胞浆中的离子转运(如干扰Na+-K+-ATP酶及Ca2+-ATP酶),并且该激素与线粒体细胞膜的直接接触可以导致质子的排出;最后,其他作用机制(抑制p38MAPK)也可以抑制炎性介质表达[4~8]。糖皮质激素对固有免疫细胞的作用是多方面的,其对中性粒细胞、巨噬细胞、NK细胞和树突状细胞等免疫细胞有强大的免疫抑制作用,但是GC无法诱导NEU凋亡,可以促进具有拮抗其功能的MIF的表达,甚至在不同浓度下,其作用可能是完全相反的[9]。
1.2 糖皮质激素的不良反应 糖皮质激素的不良反应最重要的是导致骨质疏松(glucocorticoid-induced osteoporosis, GIOP),此外,还有许多其他不良反应,例如,胃肠道不耐受症状、易感染倾向、切口愈合延迟、高血糖、水钠潴留、情绪改变、失眠症、闭经、痤疮等。如果长时间使用激素,会出现更多的问题,如生长迟滞、肌病、胰岛素抵抗、糖尿病、高血压、下丘脑—垂体—肾上腺轴(HPA axis)的抑制、肾上腺危象、白内障、青光眼、胃炎、消化道溃疡、胰腺炎、肠穿孔、向心性肥胖、高脂血症、低钾血症、低钙血症、皮肤变薄、多毛症、营养不良、色素沉着、情绪和性格改变、精神错乱、假性脑瘤及撤退反应等[7]。许多不良反应不仅有剂量依赖性,还有时间依赖性,所以即使是低剂量(≤7.5 mg/d)长时间应用也不像想象的那样安全。激素的累积效应也与严重的激素不良反应相关[10]。
2 糖皮质激素导致的骨质疏松(GIOP)和骨折
2.1 骨质疏松和骨折 60年前首先由Cushing发现内源性糖皮质激素过多的患者伴随着骨质疏松并有骨折的倾向[11]。骨质疏松是一个系统性的骨骼疾病,以低骨密度和骨组织微结构退化为特点,致使骨的脆性增加,更容易发生骨折,甚至导致病死率的增加。除了绝经后骨质疏松,长时间使用糖皮质激素是导致继发性骨质疏松(GIOP)的最常见原因[12,13]。因为应用糖皮质激素治疗各种疾病的广泛性和该激素导致骨质疏松的高发生率,GIOP严重影响人类健康[14]。例如,糖皮质激素治疗风湿免疫性感染性疾病导致骨吸收的增加和骨形成的减少[15]。糖皮质激素导致的骨丢失(骨质疏松)会增加骨折(包括椎骨和非椎骨骨折)风险,非椎骨骨折比椎骨骨折更常见,在激素应用的前3个月,患者的髋骨和椎骨体开始出现骨折,尤其是第1个月的时候最显著,然后在1年之后逐渐减少,并且在停止激素应用之后,骨折风险(首先是椎骨,其次是髋骨)向基线水平降低,这个趋势在停止激素之后的第1年非常明显;口服泼尼松龙治疗量超过5 mg/d连续3~6个月即可导致骨密度(BMD)的减少和骨折风险的快速增加,并且日剂量和累积剂量都与骨折风险的增加密切相关[16,17]。有研究表明日剂量与骨折相关性更大[10,17],但是另外一些研究表明持续时间与骨折相关性更大[7]。最常见的BMD减少部位是骨小梁而非骨皮质,在使用大剂量的激素治疗仅仅2个月之后也会有腰椎、股骨颈和全身骨骼BMD的明显降低,腰椎骨小梁降低得最明显[18]。骨质疏松的发病率已是世界各种常见病的第7位,中国是世界上拥有骨质疏松症患者最多的国家,截至2008年,约有患者9 000万[19]。目前还没有关于GIOP的大规模流行病学调查,上海和浙江地区的相关研究指出,在605例风湿病患者中,GIOP患病率达到39.0%,骨量减少达41.7%[20],可见在国内外其发生率均较高。
2.2 糖皮质激素对骨代谢的影响 激素对骨细胞的影响导致骨质疏松和骨折示意图见图1[12]。
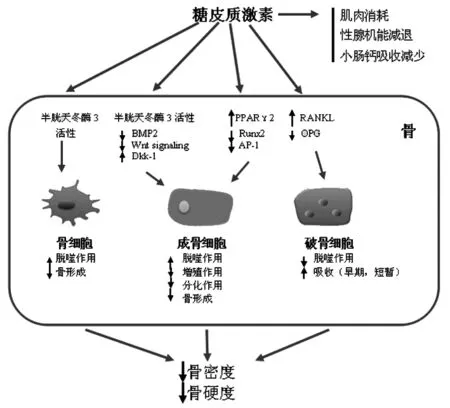
图1 糖皮质激素激素对骨代谢的作用
注:Dkk-1.dickkopf1;OPG.骨保护素;RANKL.核因子κB受体配体激动剂;BMP.骨形态形成;GSK3β.糖原合酶激酶3β;PPAR.过氧化物酶体增殖物激活受体;Runx2.Runt相关蛋白2;AP-1.激活蛋白-1
大量外源性GC抑制成骨细胞和骨细胞的功能。RANKL表达上调而OPG表达下降(OPG/RANKL/RANK途径)使骨吸收增加,同时成骨细胞和骨细胞凋亡增加;另外,大量GC通过调高Wnt拮抗因子DKK1及SFRPs的表达水平抑制成熟骨细胞Wnt/β-catenin信号通路活性,使间充质干细胞向脂肪细胞分化,并通过弱化成骨活性因子(Cbfal、IGF-1)的表达和增强成骨负性因子(SOS、TPPARγ2)的活性,从而抑制骨形成[21,22]。
2.3 GIOP的形成机制 GIOP形成的主要原因是糖皮质激素导致的骨细胞和成骨细胞的凋亡[23]。尽管糖皮质激素对BMD的降低和骨折风险的增加都有很显著的影响,骨折风险的增加并不能完全由BMD的改变来解释,其还会受到骨质量减低的影响。剂量相关的骨钙素水平的降低也会在应用激素治疗的前24 h内出现[24]。在激素治疗的早期,骨形成被抑制而骨吸收增加,在慢性阶段,骨形成和骨吸收联合作用,而骨保护素及可溶性核因子-κB受体激活剂配体等因素增强破骨细胞作用,从而导致骨质疏松[25,26]。停止应用激素1年以内骨折风险减低是因为骨质中的微结构的改变[15]。糖皮质激素导致骨小梁的可逆性变薄,却没有导致骨小梁穿孔等骨微结构不可逆的损伤,这可以解释完全翻转的情况[27]。组织形态测定术的研究结果也表明,激素治疗导致骨丢失的主要原因是骨小梁变薄,而并不是在常见的在特发性骨质疏松中出现的非骨小梁的穿孔或者接触不良[28,29],这说明除非使用很高的激素累积剂量(通常是相当于>10 g泼尼松龙的激素),糖皮质激素治疗可能没有破坏骨小梁微结构[16,30]。
糖皮质激素可以减低腔隙—微管的液体流动,并且通过骨细胞凋亡影响骨强度。骨细胞凋亡的累积效应导致不可修复的损伤,特异性损伤骨细胞—腔隙—小管系统的机械感觉功能,从而开始不可避免地导致股骨头瓦解的一系列事件,甚至发生无骨质疏松的骨坏死[31]。糖皮质激素也可以导致缺氧性骨坏死,French等[32]经单变量和多变量分析(校正性别、年龄、治疗方案之后)显示AI-1基因的多形现象(rs6092)与骨坏死风险相关,PAI-1多形现象和PAI-1的血清水平与血栓形成密切相关,所以PAI-1的基因变异可以导致骨坏死风险的增加。
Van Staa等[16]报道,日剂量是糖皮质激素治疗患者缺血性骨坏死的很重要的决定因素,并且在开始应用激素不久即可导致股骨颈骨折[33]。骨细胞凋亡在这些患者中很常见[34],正如GPRD研究中观察到的那样,骨折的另外一个可能原因是缺血性骨坏死以外的因素(即更轻微的细胞凋亡),其导致的骨折风险和日剂量之间亦有很大关系。有研究发现与对照相比,持续应用大于10 mg的泼尼松超过90 d的患者髋骨骨折的几率增加了7倍,椎骨骨折的几率增加了17倍[35]。
3 GIOP及骨折风险的评估
GIOP及骨折风险的评估及检测方法有骨矿物质密度(bone mineral density,BMD)、计算机断层扫描(computed tomography,CT)、QCT或HRQCT、骨折风险预测简单工具(fracture risk assessment tool,FRAX®)、双能量X射线吸收测定术(dual energy X-ray absorptiometry, DXA)、T-分数分析、椎骨骨折分析(VFA)、骨小梁分数(TBS)等。
2008年国际骨质疏松基金会推出FRAX®(http:∥www.shef.ac.uk/FRAX/),适用于绝经后女性和50岁以上男性,正如Lekamwasam等[36]所描述的一样,FRAX®是一个基于计算机算法的方法,该工具是多因素评价体系,用来估计未来10年骨折(椎骨、肱骨或者腕骨、髋骨骨折)的可能性,尽管骨折可能性因人种的不同而各异,FRAX®已经在骨折和死亡的流行病学清楚的地区(目前有40个国家)被标准化了,越来越多的指南把这种方法加入到风险评估中;另外,FRAX®和T-分数分析在以丹麦人群为研究对象预测骨质疏松导致的骨折的连续变量中表现的最好[37]。不过FRAX®的中国模式运算结果显示可能会低估上海男性10年骨质疏松几率及骨折风险[38]。而BMD检测是评估骨状况的最简单最常用的方法,可以用于大规模筛查[39],然而,BMD的测量本身并不能准确地预测骨折风险。DXA可以和BMD测量一起用来评估其他参数(如椎骨骨折的存在、骨微结构、骨的形状和骨质组成),以帮助患者确定有无骨折高风险;DXA也是一个诊断骨质疏松时测量骨矿物质密度的参考标准[15]。VFA是一种低射线剂量查看有无肋骨及椎骨骨折的方法,和标准化放射线照相术相比,VFA可以被用于检测更多人群的无症状椎骨骨折;TBS是一种非侵袭性的评估结构参数,这种参数和与BMD相独立的3D骨微结构参数相关,可以由腰椎DXA成像决定,许多横断面研究和前瞻性研究表明TBS可以有效地确定患者有无骨折[40]。而与DXA相比,QCT和HRQCT更适合识别骨折风险较高的GIOP患者[39]。这些参数有些可以在临床实践中应用,有些只是用于科学研究。评价时不仅要根据各项检查评估结果,还需要参考性别、年龄、体质量指数及既往病史等综合考虑[41]。
4 如何预防和治疗GIOP
4.1 减少糖皮质激素对骨的不良反应[7,13,36]虽然一些疾病不得不长时间应用大量激素,但是尽可能减少用量和应用时间是减少GC相关不良反应最关键的做法。临床实践中应该根据情况正确评估患者使用GC的剂量、方式及计划使用疗程,并结合患者自身情况,通过对患者行骨密度检查等方法进行骨折高危因素评估,适时给予干预[42]。尽管吸入性和间断性应用糖皮质激素也可能会对骨骼产生退行性影响,但这2种方式比持续口服应用激素对椎骨骨折风险来说相对安全,不过目前的指南并不提倡间断应用激素的方式[43]。首先应该有明确的开始激素治疗的指征,减少不必要的使用剂量,应用短效的起效快的激素而非长效激素,每日清晨顿服而非分开口服。其次,考虑应用其他的方法,如替代疗法(免疫抑制剂)。再次,使用其他应用方式,如哮喘患者使用吸入性激素,吸入后漱口以防止口腔菌群失调,或者改变激素剂型(如布地奈德)。此外,在应用激素期间,保证营养,特别是钙和维生素D,定期监测体质量、身高、血压、血脂、血糖/尿糖、眼压和白内障的发展,以减轻这些激素不良反应。长期应用激素停药时要小心地撤退,以防止激素撤退综合症和疾病复发。注意药物相互作用,例如,利福平和激素一起应用时可以降低激素效果。戒烟、避免酗酒,并且适当规律进行身体锻炼以控制体质量,降低摔伤风险可以减少骨折。如果有可疑的椎骨骨折,应用X线或者DXA来评价。每年测量孩子的身高,特别是大剂量应用激素的患者应该使BMD维持在适当水平。最后,应定期监测激素作用效果,例如应用特立帕肽治疗后3个月测定血清总1型前胶原氨基端延长肽(P1NP)水平。
4.2 治疗 在GIOP诊疗指南中明确指出,应用GC患者出现骨量下降(T Score<-1)均应给予抗GIOP药物[42]。在停止激素应用后最好停用抗骨质疏松治疗,除非患者仍有骨折高风险;高骨折风险的患者包括超过70岁的有骨折史的绝经后女性和老年男性,或者大剂量应用激素的超过50岁的绝经后女性和老年男性,提倡这些患者在激素治疗的初期即开始应用抗骨质疏松预防或治疗GIOP[13,36]。目前国外治疗GIOP的药物主要有:钙剂和维生素D、双磷酸盐(如阿屈磷酸盐、唑来膦酸盐、伊班膦酸盐、依替膦酸、利塞膦酸盐)、甲状旁腺激素、特立帕肽[hPTH(1-34)]、降钙素、狄诺赛麦(denosumab)、雷洛昔芬、硬脂酸锶等药物,在我国仍有很多药物没有上市。其中,特立帕肽和双磷酸盐作为一线治疗用药,而钙剂和维生素D补充预防性治疗与特殊的抗骨质疏松药物相比效果欠佳,且GIOP和绝经后骨质疏松都可以用特立帕肽和双磷酸盐治疗,并且没有证据表明两者之间的治疗效果有差异[14,44~46]。
许多国家允许使用治疗绝经后骨质疏松的药物,如雷洛昔芬、硬脂酸锶,因为有些研究表明这些药物对GIOP亦有效[13,36]。许多有关GIOP治疗的指南虽已公布,但是没有开始抗骨质疏松治疗的关于BMD阈值和GC剂量的统一标准。有数据表明维生素D诱导剂比维生素D更有活性,可以提高BMD、降低骨折几率,但是这种极性维生素D诱导剂有导致高钙血症和高钙尿症的风险,不过还没有确切的对照研究。应用降钙素可以使钙和骨化三醇增高,从而阻止腰椎的骨减少,表明这种治疗或许可以减少糖皮质激素相关椎骨骨折[47]。狄诺赛麦是一种RANKL单克隆抗体,可以与RANKL特异性结合,抑制RANKL/RANK/OPG系统的活性,从而达到减少骨破坏的作用[48]。特立帕肽是一种合成的多肽类激素,是甲状旁腺激素(PTH)的重组体形式,可以刺激成骨细胞的活性并且阻止其凋亡,从而促进骨形成。一般而言,特立帕肽对严重的GIOP和骨质疏松有效,并且特立帕肽也被认为是治疗GIOP的一线药物[44]。BPs是一种基于BMD可测量的计量生物参数的药物,在GIOP的治疗和预防中都有效[2,36]。尽管阿屈磷酸盐和利塞膦酸盐目前是第一选择,但是特立帕肽或许效果更好,因为与阿屈磷酸盐相比,特立帕肽可以使BMD增加的更多,对长期应用GC的患者作为首选[14,49]。有研究表明,特发性血小板减少性紫瘢(ITP)患者联合使用碳酸钙、维生素D及帕米膦酸二钠能有效改善长期应用GC所造成的骨质丢失,增加骨密度[50]。
有研究表明,有些抗骨质疏松药物如双磷酸盐、维生素D及降钙素等可以抑制肿瘤细胞的增殖,延长肿瘤患者的寿命[51]。但是因为各种原因,抗骨质疏松药物应用受到限制,特别是对GIOP患者,这些原因包括激素副作用、骨标志物的监测受限(分析变量过多、生理周期和花费过高)、GIOP的低估和抗骨质疏松药物的副作用(包括胃肠道和发热或流感样症状)等[14,52]。将来有望应用的其他候选药物包括组织蛋白酶K阻滞剂、Wnt信号通路组成的阻滞剂和选择性骨质疏松受体调制剂等[13]。此外,根据糖皮质激素的作用机制及GIOP发生机制,进一步研究DKK-1表达的抑制,促进骨髓间充质干细胞成骨,抑制间充质干细胞成脂,减少骨量丢失,都是将来研究的重点,以更好地预防和治疗GIOP[22]。另外,改变不良生活、饮食习惯,对GIOP患者的心理护理、健康教育、饮食护理、运动指导和用药指导,提高患者生活质量,对预防和治疗GIOP具有重要意义[53]。
4.3 预防和治疗GIOP的相关指南[54]虽然已经有很多GIOP相关指南,目前没有统一的标准[14],并且很多患者并没有得到很好的GIOP的预防及治疗[45]。危险因素用于确定患者患上GIOP的风险程度。主要危险因素有:成人患者有无骨折的个人历史;一级亲属中有无骨折的历史;吸烟,体质量偏(<57 kg)。次要危险因素有:老年;雌激素减低(45岁之前进入更年期);生活中低钙摄入,运动不足;酗酒(≥3个酒精单位/天),近期跌倒;痴呆;视觉降低和健康状况不佳。这条指导原则在以下情况中不适用:使用吸入性GC、GC冲击治疗、器官移植的患者。
预计开始使用GC(预防)≥5 mg/d和估计治疗持续时间≥3个月的患者应该预防性、使用GIOP的特殊药物并且改变生活方式。但是随着对GC及其相关副作用的深入了解,近年来新的指南建议所有高危患者无论GC剂量大小都应该进行相关预防和治疗措施。对于二级预防,有证据表明绝经期前的女性单独使用钙碳酸盐(500 mg/d)和联合骨化三醇(0.25 μg/d)都有维持腰椎BMD的作用[55]。单独使用钙剂和骨化三醇加钙剂都可以维持患有红斑狼疮的使用激素超过2年的绝经后患者的腰椎BMD。然而,阿屈磷酸盐和钙剂导致腰椎和整个髋骨BMD的增加。应用激素的绝经后女性应该考虑骨质疏松的预防[56]。
骨保护治疗在之前有过骨折史的大剂量应用激素的患者中是可行的。但是育龄期女性应该注意避免使用该类药物,因为双膦酸盐可以通过胎盘影响到胎儿的骨骼发育过程。基础疾病本身也可以影响骨翻转标记物(BTMs),尚无GIOP中BTMs和骨折风险之间关系的相关评估[36]。由于没有像绝经后骨质疏松一样足够的证据[57],开始治疗GIOP的干预阈值仍有争议[14]。修订后的ACR指南提议,由FRAX®评估的骨折风险超过10%的绝经后女性和大于50岁的男性或者骨折风险未超过10%但是应用泼尼松龙的剂量超过7.5 mg/d的患者应开始口服抗骨质疏松药物。骨折风险超过10%并且激素应用剂量超过7.5 mg/d的患者比绝经后骨质疏松患者开始治疗的阈值(20%)更低[24]。 仍需进一步精确地研究评估各种药物预防及治疗GIOP和骨折的效果[58]。
2011年,中华医学会骨质疏松和骨矿盐疾病分会制定的“原发性骨质疏松症诊治指南”承认GC没有安全剂量,建议尽可能减少用量和使用时间,强调钙剂和维生素D的补充,而对于需要长期使用糖皮质激素治疗的患者,在使用GC前应及时评估骨质疏松和骨折风险,对已经发生骨量减少、骨质疏松和/或脆性骨折的患者,建议积极进行规范治疗[59]。但是在此共识制定过程中主要参考国外指南,仍缺少国内循证医学的相关证据[41]。同年,我国原卫生部办公厅颁布了《糖皮质激素类药物临床应用指导原则》,明确指出儿童处于生长发育过程中,更应谨慎GIOP等GC相关不良反应,应进行更加积极地防范,警惕其造成生长发育迟滞等严重后果,提高患儿的生存质量和预后[60]。
5 总 结
糖皮质激素因为其抑制免疫反应和抗感染功能而被广泛应用,被用来治疗很多疾病,但是除了GIOP,还有许多其他的不良反应,累及身体各个系统。GC不仅有剂量依赖性,还有时间依赖性,并且低剂量便可出现。GIOP是一个系统性的骨骼疾病,以低骨密度和骨组织微结构的退化为特点,致使骨的脆性增加,更容易发生骨折,甚至导致发病率和病死率的增加。激素通过基因和非基因2种通路来起作用,GIOP的主要原因是激素导致的骨细胞和成骨细胞的凋亡及破骨细胞作用增强。应尽量减少GC对骨的不良反应,并且要定期监测激素相关不良反应(尤其是GIOP),BMD、FRAX®、DXA、 QCT、 HRQCT等都是评估骨状况的方法。目前治疗激素导致的骨质疏松的相对特异药物主要有:双磷酸盐、特立帕肽及狄诺赛麦等,其中特立帕肽、双磷酸盐被作为一线用药。
糖皮质激素相关不良反应尤其是导致的GIOP和骨折等还没有很好的重视和治疗。虽然意识到了GIOP等GC相关不良反应的严重性,但是国内外各指南对于预防和降低这些不良反应的方法并没有统一意见,对糖皮质激素不良反应机制的研究和治疗手段的进一步探索将有助于建立一个统一的指南来指导糖皮质激素的使用,以及对其不良反应尽早进行预防、诊断和治疗。并且鉴于国人体质与国外存在种族差异,亟需国内各机构组织联合起来进行一个大规模临床调查(如记录患者性别、年龄、疾病程度、应用GC类型及剂量、预防措施、复诊信息,坚持随访进行不良事件的登记等)来研制符合国人体质的相关指南。
1 Buttgereit FR,Iipworth BJ.Optimised glucocorticoid therapy:the sharpening of an old spear[J].Lancet,2005,365(9461):801-803.
2 Den Uyl DE,Lems WF.Advances in glucocorticoid-induced osteoporosis[J].Curr Rheumatol Rep,2011,13(3):233-240.
3 Stewart PM, Krozowski ZS.11 beta-hydroxysteroid dehydrogenase[J].Vitam Horm, 1999, 57:249-324.
4 Mckay LI,Cidlowski JA.Cross-talk between nuclear factor-kappa B and the steroid hormone receptors: mechanisms of mutual antagonism[J].Mol Endocrinol,1998,12(1):45-56.
5 Vayssiere BM, Dupont S, Choquart A, et al. Synthetic glucocorticoids that dissociate transactivation and AP-1 transrepression exhibit antiinflammatory activity in vivo[J]. Mol Endocrinol, 1997, 11(9):1245-1255.
6 Buttgereit F,Straub RH,Wehling M,et al.Glucocorticoids in the treatment of rheumatic diseases: an update on the mechanisms of action[J].Arthritis Rheum,2004,50(11):3408-3417.
7 Aulakh R,Singh S.Strategies for minimizing corticosteroid toxicity: a review[J].Indian J Pediatr,2008,75(10):1067-1073.
8 史家欣,李家树.糖皮质激素抗炎作用机制的研究进展[J].实用医学杂志,2014,30(6):983-984.
9 谢冠群,季巾君,徐莉,等.糖皮质激素对固有免疫细胞作用机制的研究进展[J].浙江中医药大学学报,2013,37(2):213-216.
10 Curtis JR,Westfall AO,Allison J,et al.Population-based assessment of adverse events associated with long-term glucocorticoid use[J].Arthritis Rheum,2006,55(3):420-426.
11 Cushing,H.The basophil adenomas of the pituitary body and their clinical manifestations(pituitary basophilism)[J].Obes Res,1994,2(5):486-508.
12 Kanis JA,Stevenson M,Mccloskey EV,et al.Glucocorticoid-induced osteoporosis: a systematic review and cost-utility analysis[J].Health Technol Assess,2007,11(7):1-231.
13 Rizzoli R,Adachi JD,Cooper C,et al.Management of Glucocorticoid-Induced osteoporosis[J].Calcif Tissue Int,2012,91(4):225-243.
14 Bultink IE,Lems WF.Glucocorticoid-induced osteoporosis:an update on current pharmacotherapy and future directions[J].Expert Opin Pharmacother,2013,14(2):185-197.
15 Schett G,Stach C,Zwerina J,et al.How antirheumatic drugs protect joints from damage in rheumatoid arthritis[J].Arthritis Rheum,2008,58(10):2936-2948.
16 Van Staa TP,Cooper C.The epidemiology of corticosteroid-induced osteoporosis:a meta-analysis[J].Osteoporos Int,2002,13(10):777-787.
17 Van Staa TP,Leufkens HG,Abenhaim L,et al.Use of oral corticosteroids and risk of fractures[J].J Bone Min Res,2000,15(6):993-1000.
18 Natsui K,Tanaka K,Suda M,et al.High-dose glucocorticoid treatment induces rapid loss of trabecular bone mineral density and lean body mass[J].Osteoporos Int,2006,17(1):105-108.
19 夏泰.骨质疏松的危害及其防治[J].中华老年医学杂志,2008,27(9):719-720.
20 纪宗斐,张卓君,鲍春德,等.糖皮质激素相关骨质疏松的流行病学调查[J].中华风湿病学杂志,2014,18(8):520-524.
21 李京宝,蔺潇,周虹.糖皮质激素与骨[J].中华骨质疏松和骨矿盐疾病杂志,2013,6(4):283-292.
22 夏吉利,张霄雁,李哲海,等.糖皮质激素在影响骨形成和骨吸收方面引起骨质疏松的机制研究进展[J].中国卫生产业,2014,(15):189-190, 192.
23 Weinstein RS, Jilka RL, Parfitt AM,et al.Inhibition of osteoblastogenesis and promotion of apoptosis of osteoblasts and osteocytes by glucocorticoids[J]. J Clin Invest,1998,102:274-282.
24 Watts NB,Lewiecki EM,?Miller PD,et al. National Osteoporosis Foundation 2008 Clinician's Guide to Prevention and Treatment of Osteoporosis and the World Health Organization Fracture Risk Assessment Tool (FRAX): what they mean to the bone densitometrist and bone technologist[J].J Clin Densitom,2008,11(4):433-437.
25 Fili S, Karalaki M, Schaller B.Therapeutic implications of osteopmtegerin[J].Cancer Cell Int, 2009, 9: 26-31.
26 Teitelbaum SL,Seton MP,Saag KG.Should bisphosphonates be used for long-term treatment of glucocorticoid-induced osteoporosis?[J].Arthritis Rheum,2011,63(2):325-328.
27 Mancini T,Doga M,Mazziotti G,et al.Cushing's syndrome and bone[J].Pituitary,2004,7(4):249-252.
28 Aaron JE,Francis RM,Peacock M,et al.Contrasting microanatomy of idiopathic and corticosteroid-induced osteoporosis[J].Clin Orthop Relat Res,1989,(243):294-305.
29 Chappard D, Legrand E, Basle MF, et al.Altered trabecular architecture induced by corticosteroids: a bone histomorphometric study[J]. Bone Miner Res, 1996,11(5): 676-685.
30 Dalle Carbonare L,Arlot ME,Chavassieux PM,et al.Comparison of trabecular bone microarchitecture and remodeling in glucocorticoid-induced and postmenopausal osteoporosis[J].J Bone Miner Res,2001,16(1):97-103.
31 Weinstein RS.Glucocorticoid-Induced osteoporosis and osteonecrosis[J].Endocrinol Metab Clin North Am,2012,41(3):595.
32 French D,Hamilton LH,Mattano J,et al.A PAI-1 (SERPINE1) polymorphism predicts osteonecrosis in children with acute lymphoblastic leukemia: a report from the Children's Oncology Group[J].Blood,2008,111(9):4496-4499.
33 Felson DT, Anderson JJ.Across-study evaluation of association between steroid dose and bolus steroids and vascular necrosis of bone[J]. Lancet,1987,1(8538):902-905.
34 Weinstein RS,Nicholas RW,Manolagas SC.Apoptosis of osteocytes in glucocorticoid-induced osteonecrosis of the hip[J].J Clin Endocrinol Metab,2000,85(8):2907-2912.
35 Steinbuch M,Youket TE,Cohen S.Oral glucocorticoid use is associated with an increased risk of fracture[J].Osteoporosis International,2004,15(4):323-328.
36 Lekamwasam S,Adachi JD,Agnusdei D,et al.A framework for the development of guidelines for the management of glucocorticoid-induced osteoporosis[J].Osteoporosis International,2012,23(9):2257-2276.
37 Friis-Holmberg,T,Rubin KH,Brixen K,et al.Fracture Risk Prediction Using Phalangeal Bone Mineral Density or FRAX-A Danish Cohort Study on Men and Women[J]. Clin Densitom, 2014,17(1):7-15.
38 李育红,章振林.骨折风险评估工具(FRAX(R))对男性骨折的预测价值[J].中华骨质疏松和骨矿盐疾病杂志,2013,6(4):303-307.
39 Graeff C.High resolution quantitative computed tomography-based assessment of trabecular microstructure and strength estimates by finite-element analysis of the spine,but not DXA,reflects vertebral fracture status in men with glucocorticoid-induced osteoporosis[J].Bone,2013,52(2):568-577.
40 Briot K.DXA parameters: beyond bone mineral density[J].Joint Bone Spine,2013,80(3):265-269.
41 张学武,刘湘源.再谈糖皮质激素诱导的骨质疏松的诊治[J].中华风湿病学杂志,2013,17(6):361-362.
42 吴琨,王国春,周惠琼.糖皮质激素诱导骨质疏松的诊治进展[J].中日友好医院学报,2010,24(5):307-310.
43 Rizzoli R,Adachi JD,Cooper C,et al.Management of Glucocorticoid-Induced osteoporosis[J].Calcif Tissue Int,2012,91(4):225-243.
44 Hofbauer LC,Zeitz U,Schoppet M,et al.Prevention of Glucocorticoid-Induced bone loss in mice by inhibition of RANKL[J].Arthritis Rheum,2009,60(5):1427-1437.
45 Rizzoli R,Biver E.Glucocorticoid-induced osteoporosis: who to treat with what agent?[J].Nat Rev Rheumatol,2015,11(2):98-109.
46 Saag KG.Bone safety of low-dose glucocorticoids in rheumatic diseases[J].Ann N Y Acad Sci,2014,1318(5):55-64.
47 Sambrook P,Birmingham J,Kelly P,et al.Prevention of corticosteroid osteoporosis.A comparison of Calcium,calcitriol,and calcitonin[J].N Engl J Med,1933,328(24):1747-1752.
48 Piet G.Emerging treatments for postmenopausal usteoporosis-focus on denosumab[J].Clin Interv Aging, 2009, 4: 24l-250.
49 Tanaka I.Glucocorticoid and bone. efficacy and safety of bisphosphonate in treatment of glucocorticoid induced osteoporosis[J].Clin Calcium,2014,24(9):1371-1378.
50 胡明均,李红,李玉玲.帕米膦酸二钠对长期服用糖皮质激素的特发性血小板减少性紫癜患者骨密度的影响[J].疑难病杂志,2010,9(8):611-612.
51 郭珏函,王守俊.抗骨质疏松药对乳腺癌的影响[J].中国实用医刊,2014,41(6):90-91.
52 Saag KG, Zanchetta JR, Devogelaer JP, et al.Warner MR Effects of teriparatide versus alendronate for treating glucocorticoid-induced osteoporosis: 36-month results of a randomized, double blind, controlled trial[J]. Arthritis Rheum,2009, 60(11):3346-3355.
53 王美倩.糖皮质激素性骨质疏松症患者的护理[J].医学信息,2013,26(26):307-307.
54 Rodrigues Pereira RM,De Carvalho JF,Paula AP,et al.Guidelines for the prevention and treatment of glucocorticoid-induced osteoporosis[J].Rev Bras Reumatol,2012,52(4):569-593.
55 Grossman JM,Gordon R,Ranganath VK,et al.American college of rheumatology 2010 recommendations for the prevention and treatment of Glucocorticoid-Induced osteoporosis[J].Arthritis Care Res (Hoboken),2010,62(11):1515-1526.
56 Yeap SS,Fauzi AR,Kong NC,et al.A comparison of Calcium, calcitriol, and alendronate in Corticosteroid-Treated premenopausal patients with systemic lupus erythematosus[J].J Rheumatol,2008,35(12):2344-2347.
57 Santiago T,Da Silva JA.Safety of low-to medium-dose glucocorticoid treatment in rheumatoid arthritis: myths and reality over the years[J].Ann N Y Acad Sci,2014,1318(5):41-49.
58 Asano S,Suzuki A.Assessment of the treatment of glucocorticoid-induced osteoporosis[J].Clin Calcium,2013,23(3):401-408.
59 中华医学会骨质疏松和骨矿盐疾病分会.原发性骨质疏松症诊治指南[J].中国骨质疏松和骨矿盐疾病杂志,2011,7(4):2-17.
60 杨晓,夏正坤,樊忠民,等.糖皮质激素所致儿童骨质疏松的诊断和治疗[J].医学研究生学报,2014,27(2):203-206.
100053 首都医科大学宣武医院神经内科(周晓、孙伟、王向波); 首都医科大学附属天坛医院神经内科(隋晓杰)
王向波,E-mail:xb90956@sina.cn
10.3969 / j.issn.1671-6450.2015.05.030
2014-11-06)
