中缝大核微量注射5-HT、IL-6及L-Arg对胃运动的调节作用
2015-06-07周梦鹤杨雪娟秦芳芳安书成
周梦鹤,杨雪娟,乔 卉,秦芳芳,安书成
(陕西师范大学 生命科学学院,陕西 西安 710119)
中缝大核微量注射5-HT、IL-6及L-Arg对胃运动的调节作用
周梦鹤,杨雪娟,乔 卉,秦芳芳,安书成*
(陕西师范大学 生命科学学院,陕西 西安 710119)
为了研究中缝大核(Nucleus Raphe Magnus, NRM)对胃运动的调节作用及其机制,实验采用大鼠中缝大核给药,张力传感器记录胃收缩幅度及频率。结果显示:中缝大核微量注入五羟色胺(5-hydroxytryptamine, 5-HT)能增强大鼠胃收缩幅度,纳洛酮能抑制5-HT的这一作用;中缝大核内白细胞介素-6 (Interleukin-6, IL-6)可以增强胃收缩幅度;L-精氨酸(L-Arginine, L-Arg)可以减弱胃收缩幅度,消除5-HT的强胃效应,反转IL-6的强胃效应;利醅酮可以增强L-Arg效应,消除IL-6的强胃效应。研究表明,中缝大核内的5-HT对胃运动的调节与内源性阿片肽有关,并受一氧化氮(NO)的调制。同时,5-HT也通过2A受体调节NO的作用;NRM内IL-6也参与胃运动的调节,其作用也与NO和5-HT2A受体相关。IL-6、NO和5-HT在NRM组成了一个内部调节网络,相互协同调节胃运动。
中缝大核;胃运动;5-羟色胺;一氧化氮;白细胞介素-6
中缝大核(Nucleus Raphe Magnus, NRM )在胃运动调节[1]、胃液分泌[2]、针刺镇痛及痛觉调制等方面具有重要作用。中缝大核与脑内许多的区域有着广泛联系,中缝大核接收来自脊髓、小脑和大脑皮质的投射,中缝大核下行投射到脊髓,参与调控痛觉和内脏活动等生理活动[3]。缝脊神经元中约有85%含五羟色胺(5-hydroxytryptamine, 5-HT)[4]。中缝核群5-HT能神经元在胃肠运动调节中起着重要的作用[5-6],其效应可能由5-HT2受体介导。此外,免疫组化、HRP 逆行追踪及免疫电镜等方法证实NRM 中还存在有P 物质、一氧化氮(nitric oxide, NO)[7]、脑啡肽及乙酰胆碱细胞。研究表明,在中缝大核某些部位内5-HT与NOS共存[7]。也有报道认为5-HT可引起NO生成增加[8]。
白细胞介素-6 (Interleukin-6, IL-6)作为神经—免疫通讯的主要信息分子之一,其受体在脑内的分布广泛[9]。应激大鼠胃溃疡实验中发现应激鼠下丘脑IL-6的表达会升高,侧脑室注射IL-6也可促进胃酸的分泌,且其机理可能与兴奋胆碱能神经元相关[10-11]。然而,对中缝大核中5-HT、IL-6、NO及脑啡肽在胃运动调解中的作用及其关系进行系统研究还很少有报道。本文试图通过中缝核内微量注射的方法研究5-HT、IL-6 以及NO对胃运动的综合调控机制,初步探讨对胃运动的中枢神经—免疫调节。
1 材料与方法
1.1 实验动物及分组
实验所用动物为成年SD大鼠(280~300 g),由陕西省中医院动物中心提供。动物随机分为13组,即生理盐水(Normal Saline, NS)组,NS+5-HT组,NS+L-Arg组,DMSO+L-Arg组,纳络酮+5-HT组,L-NAME+5-HT组,L-Arg+5-HT组,NS+IL-6组,DMSO+IL-6组,L-NAME+ IL-6组,L-Arg+IL-6组,利培酮+IL-6组,利培酮+L-Arg组。每组9例,共117例,有效样本共82例。
1.2 实验方法
大鼠麻醉后,使用VDT-I型脑立体定位仪向大鼠NRM处插入并固定一有内芯的不锈钢医用套管,定位坐标为:AP 9.7 mm,RL 0 mm,H 10.0 mm。饲养一周,待动物状态完全恢复后进行胃运动记录及脑内微量注射药物实验并进行记录胃运动曲线。记录仪器型号为PowerLab8.0。参数设置:采样频率 400 Hz,扫描速度 5.0 s/div,时间常数5 s,滤波频率:3 Hz。
药物注射剂量:药物浓度分别为:5-HT 12.5 μg/μL,L-Arg 50 μg/μL,L-NAME10 μg/μL,纳洛酮0.4 μg/μL,利培酮4 μg/μL,1μL/次;IL-6 200 ng/μL,0.5 μL/次。每次每种药物注射容量为0.5 μL,单独注射生理盐水组注射1 μL。
1.3 数据分析
统计药物注射前后胃收缩幅度与收缩频率均值变化百分数。各组数据均用平均值±标准误(mean±SEM)%表示,SPSS16.0软件分析,药物作用前后间的比较采用独立样本t检验。
2 结果
实验结果显示,各实验组的胃收缩频率没有显著变化,主要作用体现在对胃收缩幅度的影响。
2.1 5-HT对胃运动的作用
6例大鼠NRM内注入NS后再注入5-HT,在记录的60 min内,胃收缩幅度在10 min时有大幅增大,直至注药后60 min时一直有升高,胃收缩幅度极显著增加 (n=6,P<0.01)。结果见表1。
2.2 阿片受体阻断剂纳洛酮对5-HT调节 胃运动的作用
6例大鼠NRM内先注入naloxone后再注入5-HT,在记录的60 min内,胃收缩幅度先出现短时间的升高,在30 min时出现显著下降,在40 min、50 min和60 min时胃收缩幅度的抑制率极显著下降 (n=6,P<0.01) 。结果见表1。
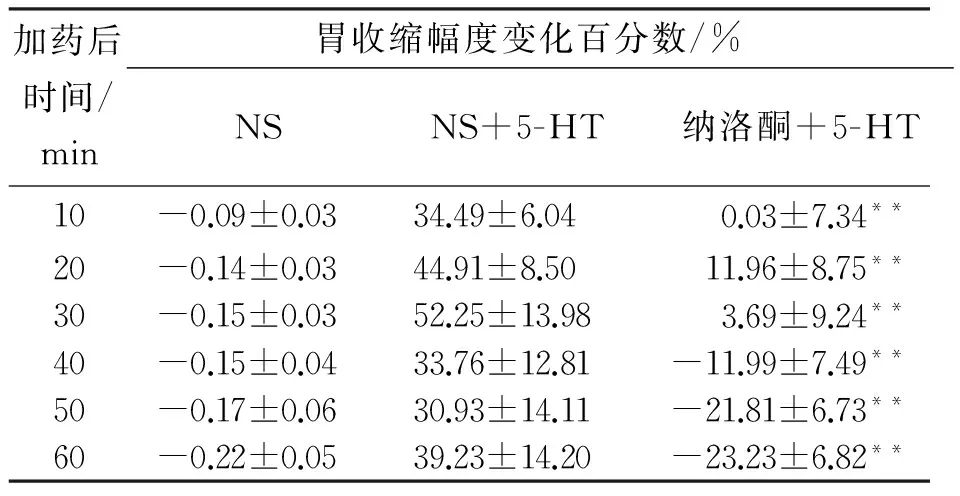
表1 注射5-HT对胃运动的调节及纳洛酮的影响Tab.1 Effects of microinjecting 5-HT and naloxone into nucleus raphe magnus on gastric motility
**P<0.01,与NS+5-HT比较。
2.3 NO在5-HT调节胃运动中的作用
9例大鼠NRM内注入NO前体L-精氨酸后再注入5-HT,在记录的60 min内与NRM内先注入NS后再注入5-HT组相比,胃收缩幅度较注药前出现极显著的下降(n=9,P<0.01)。
6例大鼠NRM内注入5-HT2A受体拮抗剂利培酮后再注入L-精氨酸,与NS+L-Arg组相比,胃收缩幅度显著下降(P<0.05)。(表2)但利培酮的溶剂DMSO不影响L-Arg对胃运动的增强作用(n=6,P>0.05)。6例大鼠NRM内注入一氧化氮合酶抑制剂L-NAME后再注入5-HT,在记录的60 min内,胃收缩幅度10 min时略有上升,40 min时仍有小幅上升,但与NS + 5-HT组相比表现出抑制的作用,开始时呈显著性差异(n=6,P<0.05),加药后时间40 min时达到极显著(n=6,P<0.01)。结果见表2。

表2 NRM中NO在5-HT调节胃运动中的影响Tab.2 Effects of NO in nucleus raphe magnus on gastric motility
*P<0.05, **P<0.01,与NS+5-HT比较; #P<0.05,##P<0.01,与DMSO+ L-Arg比较。
2.4 IL-6在NRM调节胃运动中的作用
7例大鼠中缝大核注入IL-6后20~50 min内,胃收缩幅值略有升高。较NS组,胃收缩幅度20 min时极显著升高(n=7,P<0.01)。40 min仍有显著差异(n=7,P<0.05)。结果见表3。
5例大鼠NRM内注入5-HT抑制剂利培酮后再注入IL-6,较NS+ IL-6组,胃收缩幅度有所降低,在记录的前30 min内均有显著性差异(n=5,P<0.05)。利培酮的溶剂DMSO不影响IL-6对胃运动的增强作用(n=7,P>0.05)。结果见表3。
7例大鼠中缝大核内先注入L-Arg后再注入IL-6,与中缝大核内注入NS+IL-6组相比,在记录的1 h内胃收缩幅度极显著下降(n=7,P<0.01)。
8例大鼠中缝大核内先注入L-NAME后再注入IL-6,在记录的1 h内胃收缩幅度与中缝大核内注入NS+IL-6组相比,在第20~50 min内均差异显著,其中20~40 min差异极显著性(n=8,P<0.01)。结果见表3。
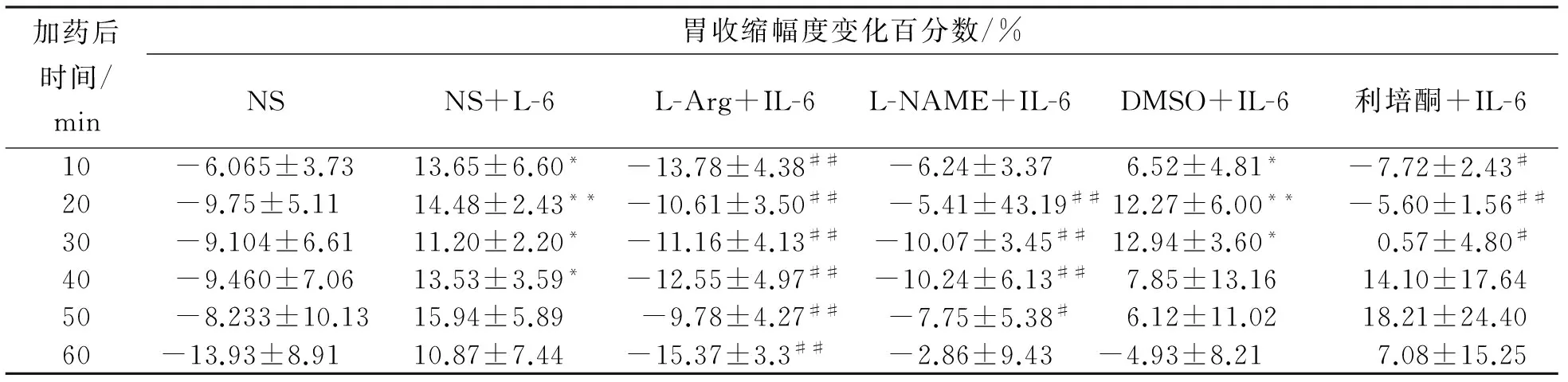
表3 NRM内注射IL-6对胃运动的调节Tab.3 Effects of microinjecting IL-6 into nucleus raphe magnus on gastric motility
*P<0.05, **P<0.01,与NS比较; #P<0.05,##P<0.01,与NS+ IL-6比较。
3 讨论
中缝大核不仅接收来自脊髓、小脑和大脑皮质的投射,也接受来自中脑导水管周围灰质、尾核头部和伏核纤维投射[12],中缝背核、楔形核[13-14]等脑区和核团的纤维也可以投射到中缝大核,外侧僵核对中缝大核有刺激中兴奋后抑制的双向作用[15]。中缝大核下行投射到脊髓,参与调控与痛觉和内脏活动等生理活动。
3.1 5-HT对胃运动的作用
NRM中存在有5-HT,P物质,脑啡肽及乙酰胆碱能神经元[16],其中5-HT 能神经元与脑内其他核团有着广泛的突触联系[17]。5-HT对胃运动的作用依赖于其部位及剂量呈兴奋或抑制效应[18]。5-HT的作用也因实验动物不同而有差异。大鼠延髓中缝核、大鼠侧脑室给予5-羟色胺可增强胃窦运动[5-6]。但也有结果表明,兔侧脑室注入5-HT,胃内压升高,胃收缩频率下降[19]。本研究再一次证实了大鼠中缝核NRM内给予5-HT仅加强胃运动幅度,并不改变其频率[6]。
阿片肽在包括PAG和NRM在内的疼痛的中枢系统中起着很重要的作用[20],纳络酮是广泛使用的非选择性阿片受体阻断剂。已有的报道表明在NRM主要是μ 和 κ受体mRNA的表达[21]。阿片肽在5-HT调节胃运动中具有重要作用,中枢脑啡肽与脑内5-HT升高引起胃收缩频率下降的作用相关[19]。本次实验显示大鼠NRM内给予纳络酮可抑制5-HT对胃运动的作用,表明5-HT调节很可能与胃运动阿片肽系统相关,且此作用有NRM中μ型受体参与。
3.2 NO在5-HT调节胃运动中的作用
研究表明,大鼠侧脑室注入L-Arg会增加其胃运动幅度,而L-NAME可以完全阻断这一效应[22]。最近的研究报道,NOS在NRM的神经元表达,并且nNOS与5-HT免疫阳性神经元在NRM内共存[10,23-24]。NO可能对在脑内5-HT系统的功能起重要调制作用。有研究表明,腹腔注射NOS的抑制剂L-NAME可引起5-HT能阳性神经元数量增多[25]。也有研究显示5-HT 对NO的合成有促进作用[8]。在海马,内皮性一氧化氮合酶可降低5-HT水平[26]。NO在视丘下部[27]和中缝核群可表现出反转5-HT浓度的效应,低浓度的一氧化氮供体可降低5-HT释放,而高浓度则相反。
本研究表明,NRM内预先注射L-Arg可以减弱5-HT增强胃收缩的效应,而抑制NO生成对5-HT的作用无明显增强效应。NRM内预先注射利醅酮可以增强L-Arg的效应,更大幅度减弱胃运动。由此可见,中缝大核内的NO和5-HT可能存在相互作用,而5-HT2A受体在其中起着重要作用。NO升高,可以抑制5-HT 2A受体活性,从而消除5-HT的效应。而激活的2A受体对NOS产生抑制作用,当2A受体被5-HT充分激活,L-Arg的效应由此减弱,而当2A受体被阻断,L-Arg的效应增强,从而下调胃收缩幅度。由此推断,NRM内注射5-HT增强胃运动的途径是其充分激活2A受体,使NO的效应受到抑制,而L-Arg减弱胃运动则是通过抑制2A受体活性,限制了5-HT的强胃效应。
3.3 IL-6在调节胃运动中的作用
白细胞介素-6(IL-6)作为神经—免疫通讯的主要信息分子之一,其受体在脑内的分布广泛[9]。在正常和病理状况下,IL-6及其受体及各自mRNA在脑内均发现有分布[9,28],最近研究表明,兴奋性氨基酸和膜去极化可以引起IL-6表达,对神经元活性和脑功能调节发挥一定的生理学效应[29]。此外,Ad,NE,SP,前列腺素,神经酰胺,组织胺等都可以刺激IL-6的合成[30-32]。IL-6在体外可以促进儿茶酚胺和类胆碱能神经元的生长[30-31]。
IL-6对NE代谢无影响[33],但是外周、静脉和脑区内注射IL-6都可以增加海马及脑干等多脑区色氨酸浓度和5-HIAA浓度以及5-HT[34-35],增加下丘脑细胞外5-HT浓度[36]。注射IL-6还可以增强纹状体处由电刺激中缝背核引起的5-HT效应[36]。预先注射L-NAME不改变色氨酸和5-HIAA对IL-6的增加效应[35]。
白细胞介素对于胃活动的影响报道甚少,侧脑室注射IL-1可降低胃酸分泌,IL-1受体阻断剂阻断其效应[37]。
本研究发现NRM内注射IL-6可以增强胃运动,阻断5-HT2A受体后,可消除该效应。而L-Arg可反转IL-6的强胃效应。这些结果提示,IL-6增强胃运动是可能是通过与其受体结合增加细胞外5-HT的浓度,通过5-HT2A受体促进其突触后效应而引起的。当外源性增加NO时,抑制了5-HT2A受体的活性,减弱胃运动。但也有可能NO通过调制IL-6及其受体或调控其他递质的释放下调IL-6的作用。
4 结论
在NRM对胃运动的调节中,5-HT,NO和IL-6形成了一个内部的调节网络,NRM内的5-HT调节胃运动与内源性阿片肽有关,作为经典神经递质的5-HT对胃运动的增强作用受到NO的调制,NO抑制胃收缩和5-HT加强胃收缩在5-HT 2A受体水平互相作用,相互调节。IL-6作为一种免疫细胞因子,也参与了NRM内对胃运动的调节,增强胃运动,其作用可能也与5-HT 2A受体有关,该作用同时受NO的调制。
[1] 陈香梅, 柳滨, 刘志敏. 中缝大核内微量注射5-羟色胺、P物质等对家兔胃运动胃电的影响[J]. 白求恩军医学院学报, 2004, 2(1):5-7.
[2] 王林嵩, 田建伟, 伍忍. 刺激中缝大核对大鼠胃酸及胃泌素分泌的影响[J]. 河南师范大学学报:自然科学版, 1994,22(1):73-76.
[3] Basbaum A I, Clanton C H, Fields H L. Three bulbospinal pathways from the rostral medulla of the cat: An autoradiographic study of pain modulating systems[J]. Journal of Comparative Neurology, 1978, 178(2):209-224.
[4] 陈良为, 施际武, 饶志仁. 大鼠孤束核内5-羟色胺能轴突终末的突触联系[J]. 解剖学报, 1994,25(3):244-247.
[5] 张荣, 周吕. 延髓中缝核5-羟色胺对清醒大鼠胃运动的影响[J]. 生理科学, 1989,9(6):16-21.
[6] 吕承云, 余承高, 卢刚. 侧脑室注射5-羟色胺对大鼠胃运动的影响[J]. 同济医科大学学报, 1990,19(5):319-321.
[7] 田美玲, 凌树才. 5-羟色胺和一氧化氮合酶在大鼠中脑导水管周围灰质和中缝核簇神经元内的共存[J]. 中国组织化学与细胞化学杂志, 2000,9(1):33-36, 125.
[8] Stewart J J, Weisbrodt N W, Burks T F.Centrally mediated intestinal stimulation by morphine[J]. Journal Pharmacology Experimental Therapeutics, 1977, 202(1):174-181.
[9] 李改丽, 王百忍, 段晓莉,等. IL-6受体的多抗制备及其在正常大鼠脑内的分布[J]. 神经解剖学杂志, 2004,20(3):281-286.
[10] Leger L, Gay N, Burlet S, et al. Localization of nitric oxide-synthesizing neurons sending projections to the dorsal raphe nucleus of the rat[J]. Neuroscience Letters, 1998, 257(3):147-150.
[11] 赵怡, 刘秀云, 张学庸,等. 白细胞介素6在应激性溃疡大鼠脑及胃粘膜中的表达[J]. 军医进修学院学报, 2002,23(1):38-40.
[12] 范天生, 楚宪襄, 张学国,等. 脑干六种神经递质纤维向中缝大核的投射-双重标记法研究[J]. 针刺研究, 1989(s1):39.
[13] 张彭三, 王平宇, 朱治远. 大鼠楔形核与下位脑干及脊髓之间的纤维联系:ARG法和HRP法研究[J]. 徐州医学院学报, 1994,14(4):295-299.
[14] 李云庆, 王智明, 施际武. 大鼠伏核向中脑导水管周围灰质直接和间接投射的超微束路追踪研究[J]. 中国疼痛医学杂志, 1998,4(4):22-26.
[15] 刘乡. 大脑皮层和皮层下核团对中缝大核的调控及其在针刺镇痛中的作用[J]. 针刺研究, 1996,21(1):4-10.
[16] Bowker R M, Westlund K N, Sullivan M C, et al. Descending serotonergic, peptidergic and cholinergic pathways from the raphe nuclei: A multiple transmitter complex[J]. Brain Research, 1983, 288(1/2):33-48.
[17] Chronwall B M. Anatomy and physiology of the neuroendocrine arcuate nucleus[J]. Peptides, 1985, 6(s2):1-11.
[18] Itoh Z, Mizumoto A, Iwanaga Y, et al. Involvement of 5-hydroxytryptamine 3 receptors in regulation of interdigestive gastric contractions by motilin in the dog[J]. Gastroenterology, 1991, 100(4):901-908.
[19] 安书成, 杨雪娟, 蔡翔. 侧脑室注射5-HT对兔胃运动的影响及其机制研究[J]. 中国应用生理学杂志, 2003,19(4):78-81.
[20] Millan M J. Descending control of pain[J]. Progress in Neurobiology, 2002, 66(6):355-474.
[21] Mansour A, Fox C A, Akil H, et al. Opioid-receptor mRNA expression in the rat CNS: Anatomical and functional implications[J]. Trends in Neurosciences, 1995, 18(1):22-29.
[22] 王光明, 闫长栋, 朱立言. 侧脑室注射L-精氨酸对清醒大鼠胃运动及胃电的影响[J]. 徐州医学院学报, 2003,23(1):17-20.
[23] Chiavegatto S, Nelson R J. Interaction of nitric oxide and serotonin in aggressive behavior[J]. Hormones and Behavior, 2003, 44(3):233-241.
[24] Majlessi N, Kadkhodaee M, Parviz M, et al. Serotonin depletion in rat hippocampus attenuates L-NAME-induced spatial learning deficits[J]. Brain Research, 2003, 963(1/2):244-251.
[25] 林殷利, 陈小美, 李忠华. 猫延髓背部微量注射纳洛酮对电针增强胃运动效应的影响[J]. 生理学报, 1984,36(1):49-55.
[26] Wegener G, Volke V, Rosenberg R. Endogenous nitric oxide decreases hippocampal levels of serotonin and dopamine in vivo[J]. Britain Journal of Pharmacology, 2000, 130(3):575-580.
[27] Kaehler S T, Singewald N, Philippu A. Dependence of serotonin release in the locus coeruleus on dorsal raphe neuronal activity[J]. Naunyn-Schmiedebergs's Archives Pharmacology, 1999, 359(5):386-393.
[28] Schobitz B, de Kloet E R, Sutanto W, et al. Cellular localization of interleukin 6 mRNA and interleukin 6 receptor mRNA in rat brain[J]. European Journal of Neuroscience, 1993, 5(11):1426-1435.
[29] Juttler E, Tarabin V, Schwaninger M. Interleukin-6 (IL-6): A possible neuromodulator induced by neuronal activity[J]. Neuroscientist, 2002, 8(3):268-275.
[30] Maimone D, Cioni C, Rosa S, et al. Norepinephrine and vasoactive intestinal peptide induce IL-6 secretion by astrocytes: synergism with IL-1 beta and TNF alpha[J]. Journal of Neuroimmunology, 1993, 47(1):73-81.
[31] Fiebich B L, Lieb K, Berger M, et al. Stimulation of the sphingomyelin pathway induces interleukin-6 gene expression in human astrocytoma cells[J]. Journal of Neuroimmunology, 1995, 63(2):207-211.
[32] Kozawa O, Suzuki A, Tokuda H, et al. Interleukin-6 synthesis induced by prostaglandin E2: Cross-talk regulation by protein kinase C[J]. Bone, 1998, 22(4):355-360.
[33] Terao A, Oikawa M, Saito M. Tissue-specific increase in norepinephrine turnover by central interleukin-1, but not by interleukin-6, in rats[J]. American Journal of Physiology, 1994, 266(2): 400-404.
[34] Zalcman S, Green-Johnson J M, Murray L, et al. Cytokine-specific central monoamine alterations induced by interleukin-1, -2 and -6[J]. Brain Research, 1994, 643(1/2):40-49.
[35] Wang J, Dunn A J. Mouse interleukin-6 stimulates the HPA axis and increases brain tryptophan and serotonin metabolism[J]. Neurochemistry International, 1998, 33(2):143-154.
[36] Barkhudaryan N, Dunn A J. Molecular mechanisms of actions of interleukin-6 on the brain, with special reference to serotonin and the hypothalamo-pituitary-adrenocortical axis[J]. Neurochemical Research, 1999, 24(9):1169-1180.
[37] Saperas E, Tache Y. Central interleukin-1 beta-induced inhibition of acid secretion in rats: Specificity of action[J]. Life Sciences, 1993, 52(9):785-792.
〔责任编辑 王 勇〕
Effect of microinjecting 5-HT,IL-6 and L-Arg into nucleus raphe magnus on gastric motility in rat
ZHOU Menghe, YANG Xuejuan, QIAO Hui, QIN Fangfang, AN Shucheng*
(School of Life Sciences, Shaanxi Normal University, Xi′an 710119, Shaanxi, China)
In order to study the modulation and mechanism of nucleus raphe magnus on gastric motility in rat, experiments were made by means of microinjecting drugs into nucleus raphe magnus(NRM)and recording the frequency and amplitude of gastric motility. The results showed that injection of 5-HT into NRM could increase gastric motility, and naloxone could inhibit the effect of 5-HT. In NRM,IL-6 could increase gastric motility. L-Arg could decrease the motility, and eliminate the effect of 5-HT, and reverse the effect of IL-6; Ritanserin could enhance the effect of L-Arg, and abolish it of IL-6. In conclusion, the effect of 5-HT on gastric motility is modulated by endogenous opioid peptides and NO. Additionally, 5-HT2A receptor could also modulate NO function; IL-6 also participates the modulation of NRM in gastric motility, and work together with NO and 5-HT2A receptor.In NRM, 5-HT, IL-6 and NO form a complex mechanism, they cooperated with each other to regulate the gastric motility.
nucleus raphe magnus(NRM); gastric motility; 5-hydroxytryptamine(5-HT); NO; Interleukin-6(IL-6)
1672-4291(2015)04-0078-05
10.15983/j.cnki.jsnu.2015.04.346
2015-03-20
国家自然科学基金(81271488); 中央高校基本科研业务费专项资金(GK200901011)
周梦鹤,女,博士研究生,主要研究方向为神经生理学。E-mail:linde19@stu.snnu.edu.cn
*通信作者:安书成,男,教授,博士生导师。E-mail: shuchengan@snnu.edu.cn
Q81
A
