急性Stanford A型主动脉夹层孙氏手术后呼吸功能不全的治疗
2015-06-06方泽民
陈 军, 魏 翔, 胡 敏, 方泽民
华中科技大学同济医学院附属同济医院心脏大血管外科,武汉 430030
急性Stanford A型主动脉夹层孙氏手术后呼吸功能不全的治疗
陈 军, 魏 翔, 胡 敏, 方泽民△
华中科技大学同济医学院附属同济医院心脏大血管外科,武汉 430030
目的 探讨急性Stanford A型主动脉夹层患者在深低温停循环(DHCA)下行孙氏手术后,发生急性呼吸功能不全(ARD)的危险因素及治疗策略。方法 2013年1月至2014年12月,武汉同济医院收治的急性Stanford A型主动脉夹层患者108例,在深低温停循环(鼻温降至22℃)下行孙氏手术。ARD定义为术后72 h内发生的低氧血症(PaO2/FiO2≤150),除外术后心源性肺水肿、肺部感染、血/气胸等因素引起的低氧血症。据此将所有患者分为两组:术后呼吸功能不全发生组与术后呼吸功能正常组。比较两组患者的临床资料及治疗方法。结果 51例患者术后发生ARD,发生率47%(51/108)。该组体质量指数、吸烟者比例及术中输血量均显著高于术后呼吸功能正常组(均P<0.05)。术后呼吸功能不全发生组采用较高PEEP的机械通气,行多次肺复张,更强的利尿脱水以及其他综合治疗。其中28例3 d内脱离呼吸机,12例5~7 d脱离呼吸机,11例因机械通气时间超过7 d行气管切开,院内死亡4例。结论 急性Stanford A型主动脉夹层孙氏术后早期ARD发生率为47%。高体质量指数、吸烟史及术中大量输血是ARD发生的危险因素。适当的呼吸机治疗、肺复张,以及利尿脱水等综合治疗策略对于急性Stanford A型主动脉夹层孙氏手术后ARD有较好的疗效。
急性Stanford A型主动脉夹层; 孙氏手术; 微小肺不张; 急性呼吸功能不全; 肺复张
急性呼吸功能不全(acute respiratory dysfunction,ARD)是急性Stanford A型主动脉夹层孙氏手术[1]后早期主要并发症之一。发生ARD患者的机械通气时间、ICU停留时间明显长于非ARD患者,院内死亡率显著增加[2]。我们于2013年1月至2014年12月收治的急性Stanford A型主动脉夹层采用孙氏手术者108例,术后51例发生急性呼吸功能不全。经采用一系列针对性的综合治疗措施取得较好疗效,现报道如下。
1 资料与方法
1.1 一般资料
本组患者108例,其中男性83例,女性25例,平均年龄48.5岁。均为武汉华中科技大学同济医学院附属同济医院住院患者。均患Stanford A型主动脉夹层,且均累及主动脉弓部,所有病例均经心脏超声和胸腹主动脉CTA检查明确诊断。术前均以降血压,控制心率治疗。部分危重患者术前行气管插管呼吸机辅助呼吸及镇静治疗。
1.2 手术方法
采用静吸复合全身麻醉,术中常规监测中心静脉压和上下肢有创血压。均采用孙氏手术,经右腋动脉、右心房插管建立体外循环。对于主动脉近端的处理,根据其病理改变,选择Bentall术、改良David手术或升主动脉置换术[3]。鼻咽温降温至20℃停循环,经右腋动脉行选择性脑灌注(5~10 mL/kg·min),行降主动脉腔内支架象鼻术及四分叉血管行全弓置换术,恢复循环后依次吻合左颈总动脉、左锁骨下动脉。再将人工升主动脉血管远端与四分叉血管近端吻合。最后吻合无名动脉。常规用残余瘤壁结合牛心包补片包裹人工血管后与右房分流。同期进行冠状动脉旁路移植术7例、二尖瓣置换术3例、股-股动脉人工血管转流术2例。
1.3 术后呼吸功能不全的诊断及分组
患者入ICU后,给予心电监护、检测有创动脉压、中心静脉压(CVP)等。查动脉血气,床边胸片及心脏超声。急性A型主动脉夹层术后呼吸功能不全定义为术后72 h内发生的氧不良,氧指数<150,且排除血/气胸、术后心源性肺水肿、肺部感染等原因[4]。按此标准将108例患者分为术后呼吸功能不全发生组(发生组)共51例与术后呼吸功能正常组(正常组)共57例。
1.4 术后呼吸功能不全的治疗
一经确诊ARD的患者即给予如下综合治疗:①呼吸机的使用:手术结束返回ICU,容量控制模式(SIMV+PSV),潮气量8~10 mL/kg;呼吸频率12~18次/min;压力支持16~20 mmHg;I:E为1:1.5~1.7;PEEP 5~10 mmHg;调整FiO2浓度保持SpO2大于90%。保持气道分压不超过35 mmHg,通常控制于29 mmHg以下。②肺复张治疗:入监护室后1 h内待患者血流动力学平稳后即行肺复张治疗。采用呼吸末正压(PEEP)递增法进行肺复张,首先调整通气模式至压力模式,压力支持15 mmHg。严密观察生命体征的同时逐步升高PEEP水平,每次增加3~5 mmHg,直到PEEP达到20~25 mmHg或血压开始下降为止,然后再逐渐降低PEEP,每次调整PEEP后,维持1~5 min。PEEP降至8~10 mmHg时改回复张前呼吸模式。每日多次行肺复张治疗。对于肺复张后氧合指数仍低于200者给予较大的PEEP(10 mmHg),并视氧合改善情况缓慢逐步降低(每天或隔天减少2~3 mmHg)。③药物治疗:20%甘露醇125 mL,静滴,3~4次/d,进行脱水治疗。呋塞米或托拉塞米持续泵注利尿(呋塞米200 mg/50 mL盐水,0.5~10 mL/h)。尿量维持大于1 mL/(kg·h),保持每天液体负平衡,持续2~3 d。补充白蛋白。静脉滴注大剂量沐舒坦等药物。部分氧合指数低于100,其他治疗效果不佳者吸入一氧化氮(NO)。不能早期拔管者术后第2天开始鼻饲饮食。拔管后的患者给予爱全乐+普米克令舒雾化吸入。④其他治疗:术后常规行床边纤维支气管镜检查,协助吸痰。对于1周左右还不能脱机的患者,尤其合并神经系统症状者,行经皮气管切开术。
1.5 统计学方法
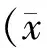
2 结果
2.1 术后发生呼吸功能不全的危险因素分析
比较术后呼吸功能不全发生组与术后呼吸功能正常组患者的术前资料,结果显示两组患者的年龄、性别、体重、发病至手术时间及合并高血压和糖尿病的差异无统计学意义,而高体质量指数和吸烟史是术后发生呼吸功能不全的危险因素(表1)。

表1 两组患者术前一般资料比较
与发生组比较,*P<0.05
两组患者术中情况比较见表2,结果显示两组之间手术时间、体外循环时间、主动脉阻断时间、停循环时间,术中出血量差异均无统计学意义,而输血量在术后发生呼吸功能不全的患者中明显增多,差异有统计学意义(P<0.05)。
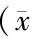
表2 两组患者术中资料比较±s)
与发生组比较,*P<0.05
2.2 两组患者治疗方法的比较
对两组治疗有明显差别,术后行肺复张次数、给予的呼气末正压值、每日液体负平衡量、术后沐舒坦用量在呼吸功能不全发生组中都高于呼吸功能正常组(表3)。
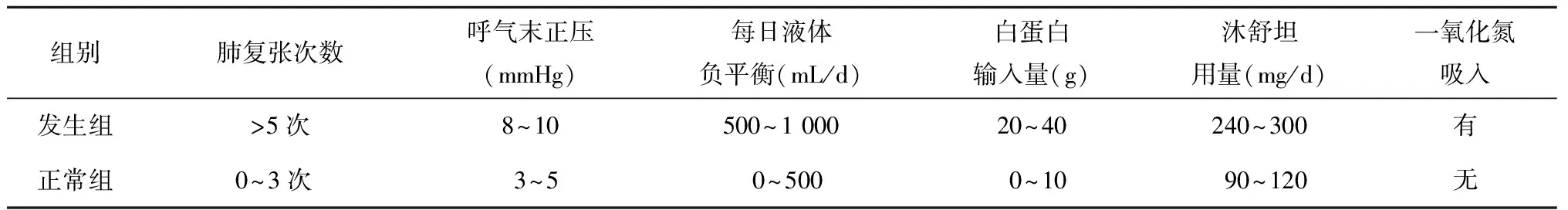
表3 两组患者术后治疗方法比较
2.3 呼吸功能不全组的治疗效果及不良反应
51例低氧血症患者中术后3 d内顺利脱机者28例(54.9%,28/51);术后5~7 d脱机者11例(21.6%,11/51);行气管切开者12例(23.5%,12/51)。院内死亡4例,院内死亡率7%(4/51)。死亡病例均合并多重耐药菌肺炎(鲍曼不动杆菌、耐甲氧西林金黄色葡萄球菌等),最终引起多器官功能衰竭死亡。
对肺复张治疗患者均可耐受,在高PEEP(>15 mmHg)时部分患者出现一过性血压下降,但在严密的血流动力学监测下,通过调整治疗参数及药物剂量,肺复张得以顺利实施,未对患者造成不良影响。脱水治疗中血肌酐升高达200 μmol/L及以上者19例。经及时停用甘露醇,或改为甘油果糖脱水,同时适当补充血容量后肌酐逐渐下降。仅3例进展为急性肾功能衰竭需透析。严重高钠血症(血清钠>160 mmol/L)患者2例。
3 讨论
急性A型主动脉夹层深低温停循环下行孙氏手术后的呼吸功能不全发生率较高,导致ICU停留时间及住院时间明显延长,且常常继发严重肺部感染而危及患者生命,因而对其的预防及治疗越来越受到重视[5]。文献报道术前氧合指数、停循环时间、体质量指数、大量输血被认为是ADR发生的危险因素[6],后两者也为我们的资料所证实。
通常认为肺组织的缺血-再灌注损伤、体外循环引起的炎症反应导致肺内皮细胞和上皮受损,以及体外循环产生的微栓及大量输血引起的肺小血管的微栓塞,是术后氧合指数降低的主要原因。现有多种术前及术中的肺保护措施,如通过应用中性粒细胞弹性蛋白酶抑制剂或血液透析的方式减少循环中炎症介质含量的方法,减轻急性主动脉夹层患者炎症反应来治疗呼吸衰竭[4];术中持续低流量肺灌注保护肺功能[7];自体输血、减少血制品用量等。我们术中常规使用自体血回输装置,使用凝血酶原复合物及纤维蛋白原等药物辅助止血以减少异体血的输入。遗憾的是,虽然采取各种预防措施,术后仍有相当一部分患者出现呼吸功能不全。
现在越来越意识到肺不张,尤其是微小肺不张是术后呼吸功能不全的重要原因。A型主动脉夹层体外循环时间长,肺间质、肺泡及小气道炎性渗出,且体外循环期间肺长期处于无通气状态,以上因素可导致部分肺泡塌陷,肺容积减小,极易形成肺不张,尤其是微小肺不张,造成术后早期低氧血症。而这些变化在胸片中常无明显反映。得不到有效治疗的微小肺不张,会逐渐进展并引起肺功能残气量的进一步下降。我们早先主要应用PEEP治疗肺不张,但实践证明单纯PEEP不能在短期内明显改善患者的氧合状态。而近年来加用肺复张治疗对改善氧合有较好疗效。多次肺复张治疗后往往可以观察到肺顺应性的明显好转,表现为容量控制通气下气道峰压的明显下降或压力支持通气时潮气量的明显增大。我们认为肺复张治疗能够快速而且显著改善深低温停循环主动脉术后低氧血症患者的氧合状态,这与国内的其他报道相一致[8]。
肺复张治疗后需防止肺的再萎陷,重点是呼吸机的合理使用。我们采用较高PEEP(8~10 mmHg),选用低呼吸频率(12~14次)和较大潮气量通气(8~10 mL/kg),以确保足够的肺泡通气量及功能残气量,防止肺再次萎陷。另外,过高的氧浓度也是造成微小肺不张的重要原因。小气道黏膜的水肿及分泌物可堵塞气道,此时与之相连接的含氧浓度过高的肺泡可因氧气吸收而萎陷。因而术后应在保证氧合的情况下尽量给予较低的吸入氧浓度(40%~50%)。对于部分肺顺应性较差的患者,较大潮气量通气(8~10 mL/kg),可导致气道分压过高,超过30 mmHg甚至35 mmHg。我们的经验是改行压力支持或压力调节容量控制(PRVC)通气模式,可在保证较低气道分压的情况下提高潮气量。对于更为严重的肺顺应性下降则只能采用保护性通气及允许性低碳酸血症策略以避免呼吸机相关性肺损伤。我们还发现A型主动脉夹层术后早期(术后1~2 d)内气道分泌物通常不多,术后早期可适当减少吸痰治疗次数以及每次吸痰时间,这样有利于维持术后早期肺的复张状态。此外,吸痰后还需及时给予肺复张治疗。
利尿脱水对术后呼吸功能不全的治疗十分重要。孙氏手术后肺血管的炎性损伤导致肺毛细血管通透性增高、血管内液外渗、肺组织含水量增加、肺间质及肺泡水肿,是引起术后ARD的重要原因。此类患者又多合并高血压及其造成的左室肥厚,而左室肥厚导致的心脏舒张功能不全亦可加重肺水肿。术后持续存在的肺水肿引起肺顺应性下降,更加促进了肺不张的发展。加强利尿,严格控制液体入量,适当维持液体负平衡等措施可促进肺水肿及早消退,有利于改善肺顺应性及肺泡-动脉血氧分压差。我们通常给予利尿剂呋塞米或托拉塞米持续泵注,实践证明可以减少尿量的波动,保证利尿的充分和脱水过程的平稳。肥胖是术后导致低氧血症的独立危险因素[9]。此类患者术后早期大量内生水生成,且生成量与体重呈正相关。我们对于此类患者加强利尿脱水治疗,通常控制液体出入量为每天负1 000 mL以上,持续3~5 d。我们还观察到肺水肿可在患者术后回监护室后继续发展,1~2 d内达峰值,之后出现改善。因而对于早期氧合指数并不理想的患者,通常延迟至术后2~3 d再考虑拔管,以避开肺水肿高峰期,减少再次插管的可能。
在利尿的同时需适当补充胶体液,如白蛋白、血浆等,以维持血管内容量。利尿的主要目的是脱去聚集于细胞及组织间隙内的血管外水。但需要保持血管内水,即血管内容量,避免低血容量导致的不利影响。低白蛋白血症可明显减弱利尿剂的作用,降低脱水效果。脱水不当导致的血管内低容量还可导致肾功能不全,尤其是在合用甘露醇的情况下。对于肌酐迅速升高者,尤其红细胞压积同时升高者需注意补充血容量。低容量下甘露醇极易造成肾损害,必要时应停用甘露醇或改用甘油果糖。脱水的同时还需防止高钠血症,我们在术后早期及时减少氯化钠的输注而改用葡萄糖,同时鼻饲或口服不含盐的水有效地减少了高钠血症的发生率。
白蛋白、血浆尚有营养支持作用。孙氏手术后患者基础代谢率显著升高,机体处于高分解代谢状态,需要积极的营养支持。而患者常常因机械通气无法进食,术后非常普遍出现的消化功能的紊乱降低了肠内营养的作用,严格的液体总量限制又使静脉营养无法满足要求。最终患者常并发营养不良,甚至严重的低白蛋白血症,进而出现呼吸肌无力和肺部感染,使患者呼吸功能进一步恶化。增加白蛋白、血浆的输入则可明显缓解这些矛盾。
对于顽固性低氧血症,通气/血流比值失调在发病机制中起到重要作用。我们给予此类患者吸入NO(5~20 ppm)。吸入的NO可以进入具备通气功能的肺泡,扩张其内的血管,从而缓解通气/血流比值失调及低氧血症。有报道对于顽固性低氧血症采取俯卧位通气治疗也有助于改善通气/血流比值失调[10]。但该方法实际操作起来较为复杂,安全性存疑,我们尚未常规开展。此外,我们还采用大剂量沐舒坦治疗,其为黏痰溶解剂,可使痰液稀薄利于排出,大剂量时还可促进肺表面活性物质的生成。我们还同时给予切诺、吉诺通等药物改善呼吸道纤毛-黏液系统的功能。
总之,我们对急性A型主动脉夹层孙氏手术后急性呼吸功能不全采取综合治疗策略,给予多次肺复张、选取合适的呼吸参数维持肺复张状态、积极利尿脱水减轻水肿、补充白蛋白并结合其他药物治疗,取得了良好的治疗效果。
[1] 孙立忠,刘志刚,常谦,等.主动脉弓替换加支架“象鼻”手术治疗Stanford A型主动脉夹层[J].中华外科杂志,2004,42(13):812-816.
[2] Apaydin A Z,Buket S,Posacioglu H,et al.Perioperative risk factors for mortality in patients with acute type A aortic dissection[J].Ann Thorac Surg,2002,74(19):2034-2039.
[3] 孙立忠,刘宁宁,常谦,等.主动脉夹层的细化分型及其应用[J].中华外科杂志,2005,43(18):812-816.
[4] Furusawa T,Tsukioka K,Fukui D,et al.The effects of a neutrophil elastase inhibitor on the postoperative respiratory failure of acute aortic dissection[J].J Thorac Cardiovasc Surg,2006,54(6):404-407.
[5] Trimarchi S,Nienaber C A,Rampoldi V,et al.Contemporary results of surgery in acute type A aortic dissection:The International Registry of Acute Aortic Dissection experience[J].J Thorac Cardiovasc Surg,2005,129(1):112-122.
[6] Nakajima T,Kawazoe K,Izumoto H,et al.Risk factors for hypoxemia after surgery for acute type A aortic dissection[J].Surg Today,2006,36(8):680-685.
[7] Suzuki T,Ito T,Kashima I,et al.Continuous perfusion of pulmonary arteries during total cardiopulmonary bypass favorably affects levels of circulating adhesion molecules and lung function[J].J Thorac Cardiovasc Surg,2001,122(2):242-248.
[8] 尚蔚,刘楠,孙立忠,等.急性A型主动脉夹层术后急性呼吸功能不全的治疗[J].心肺血管病杂志,2012,31(5):519-522.
[9] Aizawa K,Sakano Y,Ohki S,et al.Obesity is a risk factor of young onset of acute aortic dissection and postoperative hypoxemia[J].Kyobu Geka,2013,66(6):437-444.
[10] Girdauskas E,Kuntze T,Borger M A,et al.Acute respiratory dysfunction after surgery for acute type A aortic dissection[J].Eur J Cardiothorac Surg,2010,37(3):691-696.
(2015-07-10 收稿)
Treatment Experiences of Acute Respiratory Dysfunction after Sun’s Procedure in Patients with Acute Stanford Type A Aortic Dissection
Chen Jun,Wei Xiang,Hu minetal
DepartmentofCardiovascularSurgery,TongjiHospital,TongjiMedicalCollege,HuazhongUniversityofScienceandTechnology,Wuhan430030,China
Objective To explore the risk factors and therapeutic strategy of acute respiratory dysfunction (ARD) after Sun’s surgery in patients with acute Stanford type A aortic dissection.Methods One hundred and eight patients with acute Stanford type A aortic dissection
Sun’s procedure under deep hypothermic circulatory arrest (DHCA) (nose temperature below 22℃) between January 2013 and December 2014 in Tongji Hospital.Postoperative ARD was diagnosed according to hypoxia (PaO2/FiO2≤150) that occurred within 72 h of surgery in the absence of cardiogenic pulmonary edema,pneumonia,hemopneumothorax,pneumothorax and so on.All patients were divided into two groups: respiratory dysfunction group and normal respiratory function group.Clinical data and therapeutic methods were compared between the two groups.Results A total of 51 patients (51/108,47%) developed postoperative ARD.The body mass index (BMI),the proportion of smokers and the volume of blood transfusion were significantly higher in respiratory dysfunction group than those in normal respiratory function group (P<0.05).Postoperative treatments in respiratory dysfunction group included mechanical ventilation with higher positive end expiratory pressure (PEEP),more recruitment maneuvers,enhanced diuretic therapy,dehydration and other comprehensive treatments.Among them,28 patients were successfully weaned from ventilation within 3 days after operation,and 12 patients from ventilation within 5-7 days after operation.Tracheotomy was performed in 11 patients with prolonged ventilation which lasted more than 7 days.Death occurred in four cases in ARD group.Conclusion The incidence of ARD after surgery in patients with acute Stanford type A aortic dissection is 47%.The risk factors of postoperative ARD include high BMI,smoking history and massive blood transfusion during operation.Comprehensive treatments including proper mechanical ventilation,recruitment maneuver,diuretic therapy and other supportive therapy are effective for ARD after surgery in patients with acute type A aortic dissection.
acute Stanford type A aortic dissection; Sun’s procedure; microatelectasis; acute respiratory dysfunction; recruitment maneuver
R654.31
10.3870/j.issn.1672-0741.2015.05.016
陈 军,男,1976年生,主治医师,E-mail:chjunmage@hotmail.com
△通讯作者,Corresponding author,E-mail:francemine@hotmail.com
