三颗针抗菌活性成分研究*
2015-06-06吴潇潇万定荣吕静南杨新洲
徐 婵, 吴潇潇, 万定荣, 王 强, 吕静南, 黄 密, 杨新洲,3△
1中南民族大学药学院,武汉 4300742武汉科技大学医学院,武汉 4300813中国科学院上海药物研究所新药研究国家重点实验室,上海 201201
三颗针抗菌活性成分研究*
徐 婵1, 吴潇潇1, 万定荣1, 王 强2, 吕静南1, 黄 密1, 杨新洲1,3△
1中南民族大学药学院,武汉 4300742武汉科技大学医学院,武汉 4300813中国科学院上海药物研究所新药研究国家重点实验室,上海 201201
目的 系统地研究三颗针的抗菌活性成分,并比较不同来源三颗针提取物的高效液相色谱分析的稳定性和重现性。方法 运用制备高效液相色谱法结合凝胶过滤和重结晶法分离纯化化学成分,利用现代波谱技术鉴定所分离化合物的结构,采用HPLC-PDA法分析不同来源的8个三棵针样品甲醇提取物,采用肉汤稀释法测试上述8个甲醇提取物和单体生物碱成分的抗菌活性。结果 从湖北小檗甲醇提取物中分离得到7个单体化合物,鉴定为异紫堇定碱(1)、小檗胺(2)、药根碱(3)、巴马汀(4)、小檗碱(5)、4-羟基苯甲酸(6)、β-谷甾醇(7),化合物1~7为首次从该植物中分得。8个甲醇提取物与化合物2~5对革兰阳性菌金黄色葡萄球菌及表皮葡萄球菌显抗菌活性,MIC值范围为12.5~50.0 μg/mL。结论 三颗针中所含的异喹啉生物碱显示出良好的抗菌活性,不同来源的三颗针甲醇提取物高效液相色谱分析具有良好的稳定性和重现性,这些研究为三颗针进一步的开发奠定了基础。
三颗针; 湖北小檗; 抗微生物活性; 生物碱; 制备型高效液相
三颗针,又名豪猪刺、刺黄柏、刺黄连。三颗针味苦、寒,归胃、大肠、肝、胆经,具有清热燥湿、泻火解毒的功效,用于消炎抗菌、降血压、降血脂及抗肿瘤等[1]。2010年版中国药典收录的三颗针中,规定其来源为拟豪猪刺(假豪猪刺)BerberissoulieanaSchneid等小檗属数种植物的干燥根,为鄂西土家族人民常用的中草药之一[2]。当前,在鄂西地区作为三颗针药材使用的小檗属的植物主要有湖北小檗(BerberisgagnepainiiSchneid.),芒齿小檗(B.triacanthophoraFedde),川鄂小檗(B.henryana),硬齿小檗(B.bergmaniaeSchneid.),假豪猪刺(B.soulieana)。为了更好地利用和开发这一民族药用资源,我们选择在鄂西分布最广、资源最丰富的湖北小檗(BerberisgagnepainiiSchneid.)进行研究,对其化学成分进行了系统的分离和纯化,得到7个单体化合物,分别鉴定为异紫堇定碱(1)、小檗胺(2)、药根碱(3)、巴马汀(4)、小檗碱(5)、4-羟基苯甲酸(6)、β-谷甾醇(7),化合物1~7为首次从该植物中分得。我们选择8个三颗针样品(包括1个湖北小檗样品、2个芒齿小檗样品、1个川鄂小檗样品、2个硬齿小檗样品、2个假豪猪刺样品),采用高效液相法对它们进行了化学成分分析,我们也对上述8个样品的甲醇提取物和从湖北小檗中分离的单体生物碱成分进行了抗菌活性测试,这将为不同来源三颗针药材的开发和利用奠定一定的基础。
1 材料与方法
1.1 仪器与试剂
熔点:Kofler显微熔点仪(温度未校正);紫外光谱:Shimadzu UV-250型紫外光谱仪;质谱:Waters ACQUITY SQD MS质谱仪;核磁共振波谱:Bruker DRX-500 MHz核磁共振仪;Waters 2695分析型高效液相色谱仪:996二极管阵列检测器,Sunfire C18分析柱(150 mm×4.6 mm,5 μm);Waters 1525分析型高效液相色谱仪:2998二极管阵列检测器,2707自动进样器,Sunfire C18分析柱(150 mm × 4.6 mm,5 μm);Waters 2535制备型高效液相色谱仪:2998二极管阵列检测器,2707自动进样器,Sunfire C18半制备柱(150 mm×10 mm,5 μm;150 mm ×30 mm,5 μm);中压制备色谱系统:天津Alga公司;活性测试用显微镜:Olympus B202型;薄层色谱硅胶和柱色谱硅胶:烟台江友硅胶开发有限公司;HPLC级甲醇和乙腈:Merck公司;氟康唑(Fluconazole)和氯霉素(Chloroamphenicol):上海三维制药有限公司,批号分别为20121109和20130217;细菌菌株:Klebsisllapneumoniae(Kp)为上海华山医院赠送,其余的细菌Staphylococcusaureus(ATCC 25923,Sa)、S.epidermidis(ATCC 26069,Se)、Bacillussublitis(ATCC 6633,Bs)、Escherichiacoli(ATCC 25922,Ec)和Cryptococcusneoformans(Cn)从中国药品生物制品检定所购买;真菌菌株:Candidaalbicans(ATCC 64550,Ca)、C.krusei(ATCC 6258,Ck)、C.parapsilosis(ATCC22019,Cp)及Torulopsisglabrata(Tg)从中国药品生物制品检定所购买。
1.2 植物材料
湖北小檗(BerberisgagnepainiiSchneid.,B-1)的根于2012年7月采于湖北省建始县姜家坪;芒齿小檗(B.triacanthophoraFedde,B-2)的根于2012年6月采于湖北省五峰县;芒齿小檗(B.triacanthophoraFedde,B-3)的根于2012年6月采于湖北省建始县姜家坪;川鄂小檗(B.henryana,B-4)的根于2012年6月采于湖北省建始县姜家坪;硬齿小檗(B.bergmaniaeSchneid.,B-5)的根于2012年7月采于湖北省长阳县黄岩;硬齿小檗(B.bergmaniaeSchneid.,B-6)的根于2012年6月采于湖北省建始县龙坪;假豪猪刺(B.soulieana,B-7)的根于2012年5月采于湖北省建始县高坪;假豪猪刺(B.soulieana,B-8)的根于2012年5月采于湖北省长阳县榔平乡。所有采集的药材经中南民族大学药学院万定荣教授鉴定,药材标本(编号2012 B001-2012 B008)存放于中南民族大学药学院标本馆。
1.3 提取物的制备
取干燥的三颗针根粉末50 g,倒入500 mL锥形瓶中,加入250 mL分析纯甲醇,锥形瓶放入摇床中振摇2 h,过滤出滤液后,加入250 mL分析纯甲醇,继续振摇2 h,过滤出滤液,再次重复前2次操作,合并3次提取所得滤液,浓缩干,得7.6 g甲醇提取物。取5.0 g三颗针根甲醇提取物,加入甲醇80 mL加热溶解,样品液经聚酰胺(200~300目,80 g)柱层析吸附色谱,甲醇300 mL连续洗脱,合并洗脱液,减压蒸干,得4.1 g纯化的甲醇部位。
1.4 三颗针提取物LC-PDA-ESIMS分析
LC-PDA-ESIMS系统组成:Waters 1525分析型高效液相色谱仪,2998二极管阵列检测器,Waters ACQUITY SQD MS质谱仪,2707自动进样器,Sunfire C18分析柱(150 mm × 4.6 mm,5 μm)。水和乙腈分别作为流动相的A相和B相,两相均含有0.1%的三氟乙酸。色谱分析洗脱梯度如下:0~25 min,B流动相从10%增加到70%;25~30 min,B流动相从70%增加到100%。色谱分析洗脱的流速为1.0 mL/min,紫外检测波长设置在200~500 nm的范围。从高效液相色谱到质谱仪的分流率为1∶5,ESIMS质谱的工作模式设置为正离子和负离子模式。毛细管电压设定为4 000 V,毛细管出口电压140.0 V,skimmer电压设置为40 V,雾化器压力设置为40 psi,干燥气体流速设置为10.0 L/min,干燥气体温度设置为320℃,质谱扫描范围设置为100~1 500m/z。质谱数据获取和处理采用MassLynxTM4.0 software(Waters,Milford,USA)。
1.5 三颗针提取物制备纯化
0.7 g纯化的三颗针甲醇部位溶解于1.5 mL甲醇-水(60%∶40%)混合溶剂,采用制备型高效液相直接进样进行分离,Sunfire C18半制备柱(150 mm ×30 mm,5 μm),采用混合流动相(90%水∶10%乙腈→0%水∶100%乙腈,30 min,流速15.0 mL/min,其中两相分别含0.1%三氟乙酸)梯度洗脱,按峰收集,得到峰1(Rt 11.1 min)、峰2(Rt 17.1 min)、峰3(Rt 13.6 min)、峰4(Rt 14.7 min)、峰5(Rt 16.3 min)及样品6(Rt 19.3 min~28.0 min),按上面的制备纯化方法重复进样5次,合并保留时间相同的色谱峰区域得到6个样品。取粗的化合物样品1~5,采用Sephadex LH-20小柱(300×10 mm)进行纯化,纯甲醇进行洗脱,得到纯的化合物1(26.9 mg)、2(31.5 mg)、3(39.3 mg)、4(39.3 mg)、5(39.3 mg)。样品6(1.1 g)采用中压柱层析(柱层析硅胶,300~400目,80 g),石油醚-丙酮梯度洗脱(20∶1~3∶1),TLC板检测,合并洗脱液,得到6个组分Fr.1~6。取Fr.2部位溶解于5 mL热的乙醇中,自然冷却,析出白色针状结晶,过滤得化合物6(145 mg);取Fr.4部位溶解于10 mL热的甲醇中,自然冷却,析出白色针状结晶,过滤得化合物7(210 mg)。
1.6 8个不同来源的三颗针HPLC分析
Waters 1551分析型高效液相色谱仪,2998二极管阵列检测器,Sunfire C18分析柱(150 mm × 4.6 mm,5 μm)。水和乙腈分别作为流动相的A相和B相,两相均含有0.1%的三氟乙酸。色谱分析洗脱梯度如下:0~25 min,B流动相从10%增加到100%;25~30 min,B流动相维持在100%。色谱分析洗脱的流速为1.0 mL/min,紫外检测波长设置在254 nm。
1.7 抗菌活性测试
抗菌活性测试采用文献描述的肉汤稀释法[3-4]进行测试,选择8个三颗针甲醇提取物及从湖北小檗分离到的5个单体化合物作为待测样品。母液采用二甲亚砜进行配制,配制成2.0 mg/mL的浓度,母液采用二倍法梯度稀释成6个浓度梯度。具体操作如下:0.5 mL的稀释液加入到含4.4 mL含稀肉汤的试管中,接着加入0.1 mL的菌种悬浮液混合均匀,整个培养液的体积为5.0 mL。测试的样品浓度范围为6.25到200 μg/mL,阳性对照药物氯霉素和氟康唑的测试浓度范围分别为2.0~256 μg/mL和1.56~256 μg/mL。在37℃下培养24 h,测试和计算样品的最小抑菌浓度(MIC)。
2 结果
2.1 三颗针提取物LC-PDA-ESIMS分析及单体化合物的制备
对三颗针甲醇提取物的LC-PDA-ESIMS分析方法采用1.4中描述的方法进行,用含0.1%三氟乙酸的乙腈和水为流动相进行梯度洗脱,在25 min内,乙腈的体积分数由10%变为70%;在25~30 min,B流动相从70%增加到100%;流速始终保持1.0 mL/min,进样量为25 μL,2998二级管阵列检测器在254 nm检测,纯化的三颗针甲醇提取物的LC-PDA-ESIMS图谱见图1。
三颗针甲醇提取物的LC-PDA图谱(图1)显示出5个主要的色谱峰1~5,保留时间分别为8.88、14.41、15.62、17.84和18.31 min,根据这5个峰的ESIMS数据(图2,正离子模式),它们的伪分子离子峰分别为342[M+1]+、609[M+1]+、339[M+1]+、353[M+1]+、337[M+1]+,从而确定这5个色谱峰主要成分的分子量为341、608、338、352、336。参考相关文献[5-8]报道的三颗针的一些化学成分,峰2~5可以初步确定为小檗胺、药根碱、巴马汀、小檗碱,而峰1显示的分子量341的化合物却没有相关的文献报道。为了准确无误地确定峰1~5所含成分的化学结构,我们采用制备高效液相色谱对三颗针甲醇提取物进行制备分离(图3),采用1.5中所描述的方案,按色谱峰收集得到5个组分1~5,按保留时间19.3至28.0 min收集合并得到组分6。组分1~5采用Sephadex LH-20小柱(300 × 10 mm)进行纯化,纯甲醇进行洗脱,得到纯的化合物1~5;组分6用中压硅胶柱层析及重结晶方法得化合物6和7。
2.2 结构鉴定
(6R,6aS,P)-异紫堇定碱(1):黄色固体粉末;[α]D25+ 226(0.1,CHCl3);ESIMS:m/z 342[M + H]+;1H-NMR(DMSO-d6,500 MHz):δH9.18(1H,br.s,H-11),6.85(1H,d,J= 7.9 Hz,H-9),6.78(1H,dd,J= 7.9,1.1Hz,H-8),6.67(1H,br.s,H-3),3.14(1H,m,H-4α),2.67(1H,m,H-4β),2.97(1H,m,H-5α),2.46(1H,m,H-5β),2.84(1H,m,H-6 aα),3.01(1H,dd,J= 12.9,3.6 Hz,H-7α),2.41(1H,m,H-7β),3.92(3H,10-OMe),3.88(3H,2-OMe),3.71(3H,1-OMe),2.99(3H,br.s,N-Me);13C-NMR(DMSO-d6,125 MHz):δC142.4(C-1),126.2(C-1a),129.7(C-1b),151.4(C-2),111.4(C-3),130.3(C-3a),29.7(C-4),52.9(C-5),63.2(C-6a),35.9(C-7),130.5(C-7a),119.3(C-8),111.2(C-9),149.7(C-10),144.2(C-11),120.4(C-11a),44.1(N-Me),63.2(1-OMe),56.2(2-OMe),56.5(10-OMe)。其波谱数据与文献报道的一致[5],故鉴定化合物1为(6R,6aS,P)-异紫堇定碱[(6R,6aS,P)-isocorydine]。

图1 湖北小檗甲醇提取物的LC-PDA-ESIMS图谱(254 nm)Fig.1 The chromatogram of LC-PDA-ESIMS of methanolic extracts of B.gagnepainii(254 nm)
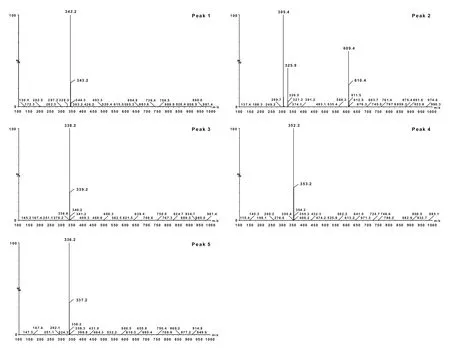
图2 湖北小檗甲醇提取物所含5个生物碱的质谱数据Fig.2 The MS analysis of five alkaloids isolated from methanolic extracts of B.gagnepainii
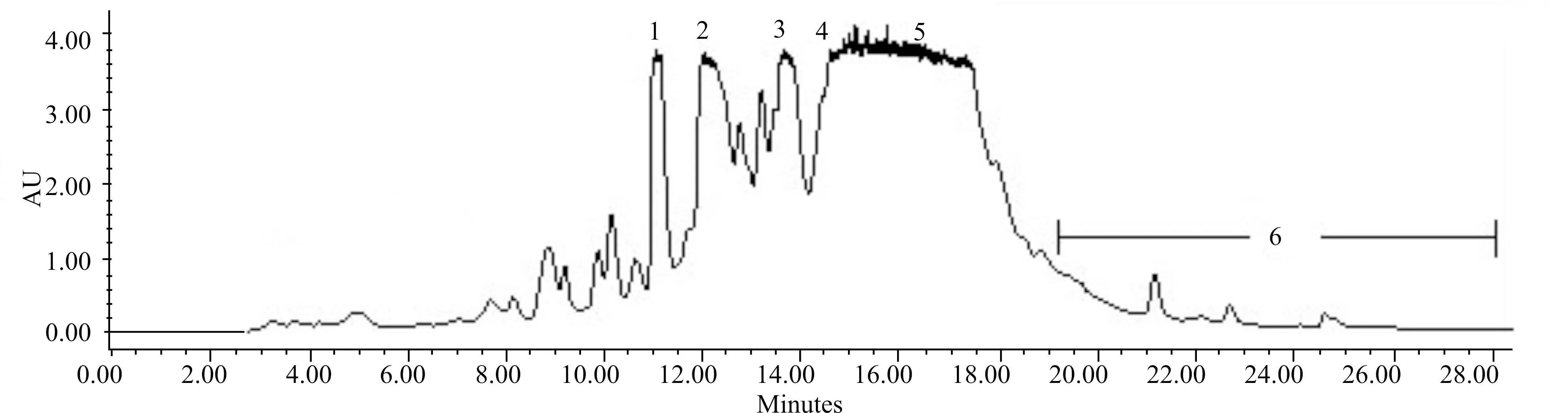
图3 湖北小檗甲醇提取物制备高效液相色谱图Fig.3 The preparative HPLC analysis of methanolic extracts of B.gagnepainii
小檗胺(2):无定形粉末;ESIMS:m/z 609[M+H]+;1H-NMR(DMSO-d6,500 MHz):δH7.34(1H,dd,J=8.0,2.0 Hz,H-14′),7.15(1H,dd,J=8.0,2.0 Hz,H-13′),6.88(1H,d,J=8.0 Hz,H-13),6.77(1H,dd,J=8.0,2.0 Hz,H-14),6.67(1H,dd,J=8.0,2.0 Hz,H-11′),6.55(1H,s,H-5′),6.47(1H,d,J=2.0 Hz,H-10),6.43(1H,dd,J=8.0,2.0 Hz,H-10′),6.29(1H,s,H-5),5.99(1H,br.s,H-8),3.98(1H,m,H-1′),3.93(1H,m,H-1),3.79(3H,s,6-OMe),3.61(3H,s,6′-OMe),3.22(3H,s,7-OMe),2.68(3H,s,2′-Me),2.30(3H,s,2-Me);13C-NMR(DMSO-d6,125 MHz):δc155.2(C-12′),152.7(C-6),151.1(C-6′),148.8(C-12),147.7(C-8),144.9(C-11),144.5(C-7′),137.8(C-7),134.5(C-9),133.2(C-9′),130.9(C-10′,14′),129.6(C-4a),127.4(C-4′a),124.4(C-14),122.3(C-8a),122.0(C-13′),120.7(C-8′),116.4(C-10),115.9(C-13),111.9(C-5′),106.1(C-5),64.3(C-1′),63.2(C-1),61.4(7-OMe),60.5(6′-OMe),56.7(6-OMe),46.6(C-3),46.5(C-3′),43.6(C-2),43.5(2′-Me),38.9(C-α′),38.7(C-α),25.9(C-4′),25.6(C-4),12.5(C-11′)。其波谱数据与文献报道一致[6],故鉴定化合物2为小檗胺(berbamine)。
药根碱(3):黄色针晶(乙醇),mp 197℃~201℃;ESIMS:m/z339 [M+H]+;其在HPLC上的保留时间及紫外吸收图谱与标准品的一致,故鉴定化合物3为药根碱(jatrorrhizine)。
巴马汀(4):橙红色结晶(甲醇),mp 194℃~197℃;ESIMS:m/z353 [M+H]+;其在HPLC上的保留时间及紫外吸收图谱与标准品的一致,故鉴定化合物4为巴马汀(palmatine)。
小檗碱(5):黄色针晶(乙醇),mp 265℃~268℃;ESIMS:m/z337 [M+H]+;其在HPLC上的保留时间及紫外吸收图谱与标准品的一致,故鉴定化合物5为小檗碱(berberine)。
4-羟基苯甲酸(6):无色针状结晶(EtOH),mp,214~216℃;ESIMS:m/z 137[M-H]-;1H-NMR(MeOH-d4,500 MHz):δH7.76(2H,d,J=8.5 Hz,H-2,6),6.80(2H,d,J=8.5 Hz,H-3,5);13C-NMR(MeOH-d4,125 MHz):δ 121.3(C-1),131.8(C-2,C-6),115.2(C-3,C-5),161.6(C-4),168.2(C=O)。其波谱数据与文献报道的一致[7],故鉴定化合物6为4-羟基苯甲酸(4-hydroxybenzoic acid)。
β-谷甾醇(7):无色针状结晶(MeOH),m.p.,140~142℃;EI-MSm/z414[M]+;1H-NMR(CDCl3,500 MHz):δH5.34(1H,d,J=5.0 Hz,H-6),3.50(1H,m,H-3),0.99(3H,s,H-19),0.92(3H,d,J=8.1 Hz,H-21),0.84(3H,t,J=7.7 Hz,H-29),0.82(3H,d,J=8.7 Hz,H-27),0.80(3H,d,J=8.7 Hz,H-26),0.66(3H,s,18-Me);13C-NMR(CDCl3,125 MHz):δc37.5(C-1),31.8(C-2),72.3(C-3),42.5(C-4),140.9(C-5),122.0(C-6),32.2(C-7),32.0(C-8),50.2(C-9),36.7(C-10),21.2(C-11),39.9(C-12),42.5(C-13),57.1(C-14),24.3(C-15),28.5(C-16),56.2(C-17),12.1(C-18),19.5(C-19),36.2(C-20),18.9(C-21),34.2(C-22),26.4(C-23),46.2(C-24),29.3(C-25),20.1(C-26),19.2(C-27),23.3(C-28),12.0(C-29)。其波谱数据与文献报道的一致[8],故鉴定化合物7为β-谷甾醇(β-sitosterol)。
以上化合物1~5的结构见图4。
2.3 8个不同产地的三颗针HPLC分析
我们采用高效液相方法对8个不同产地的三颗针进行了化学成分分析,色谱分析结果(图5)显示1~8号样品的3个主要色谱峰(保留时间10.8、14.0、14.5 min)具有较好的稳定性和重现性,并且3~7号样品4个主要色谱峰(保留时间9.2、10.8、14.0、14.5 min)具有较好的稳定性和重现性。
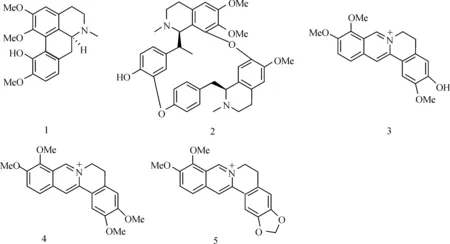
图4 湖北小檗中分离的化合物1~5的化学结构Fig.4 The chemical structures of monomeric compounds 1-5 isolated from B.gagnepainii
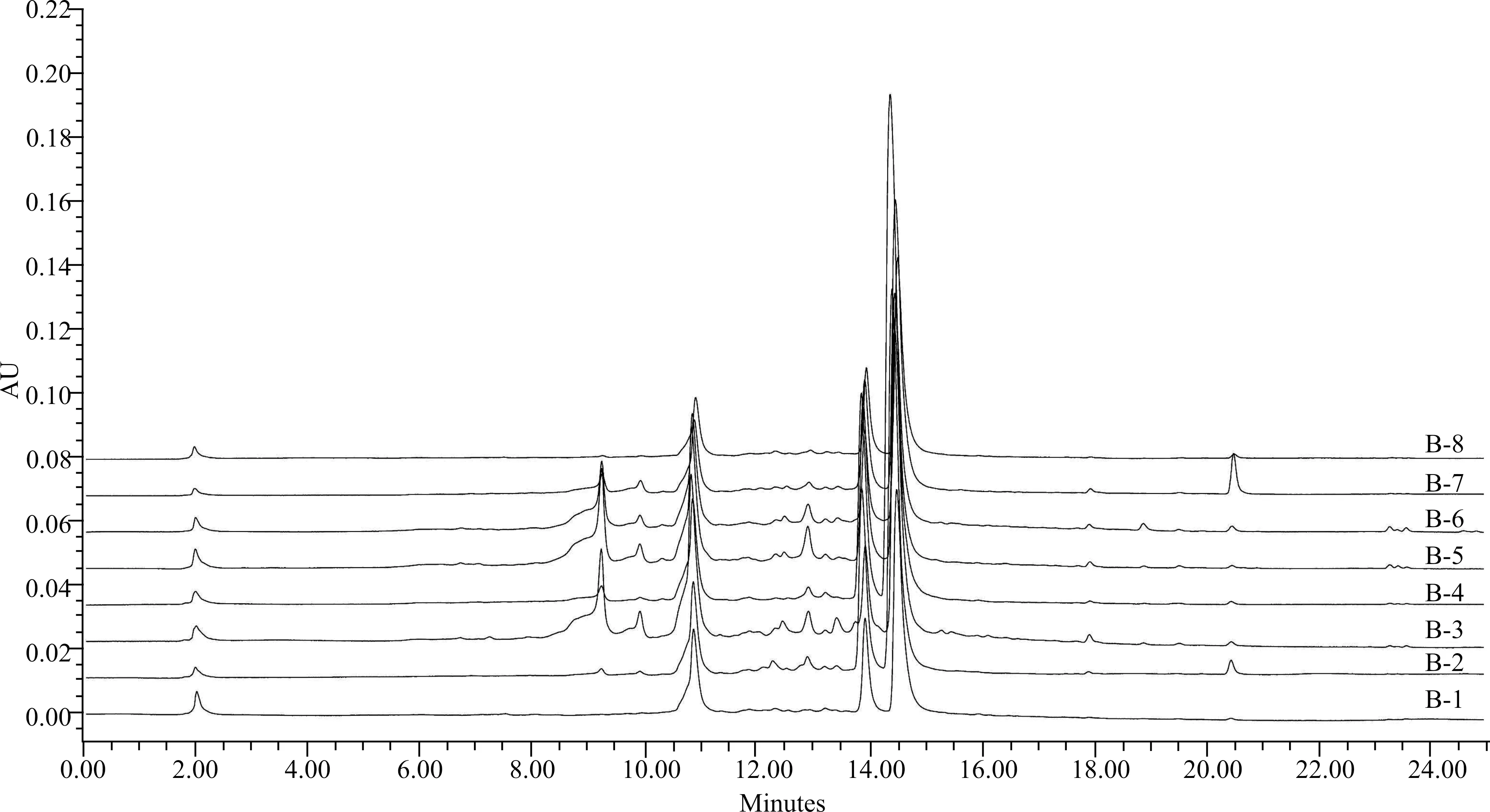
图5 8个不同产地三颗针甲醇提取物的高效液相色谱图Fig.5 The HPLC-PDA analysis of “San Ke Zhen”methanolic extracts from eight different regions
2.4 抗菌活性结果
抗菌活性测试[3]采用文献描述的肉汤稀释法[4]作为筛选方法,选择5种细菌菌株Staphylococcusaureus(Sa)、S.epidermidis(Se)、Escherichiacoli(Ec)、Bacillussublitis(Bs)、Klebsisllapneumoniae(Kp)及5种真菌菌株Candidaalbicans(Ca)、C.krusei(Ck)、C.parapsilosis(Cp)、Torulopsisglabrata(Tg)、Cryptococcusneoformans(Cn)进行抗菌活性筛选。抗菌筛选结果(表1)显示三颗针甲醇提取物和化合物1~5在高达200 μg/mL的浓度时对所有真菌均无抑制活性,而对细菌具有一定的抗菌活性,特别是8个提取物与化合物2~5对革兰阳性菌金黄色葡萄球菌(Sa)及表皮葡萄球菌(Se)显示较好的抗菌活性,MIC值范围在12.5~50.0 μg/mL。
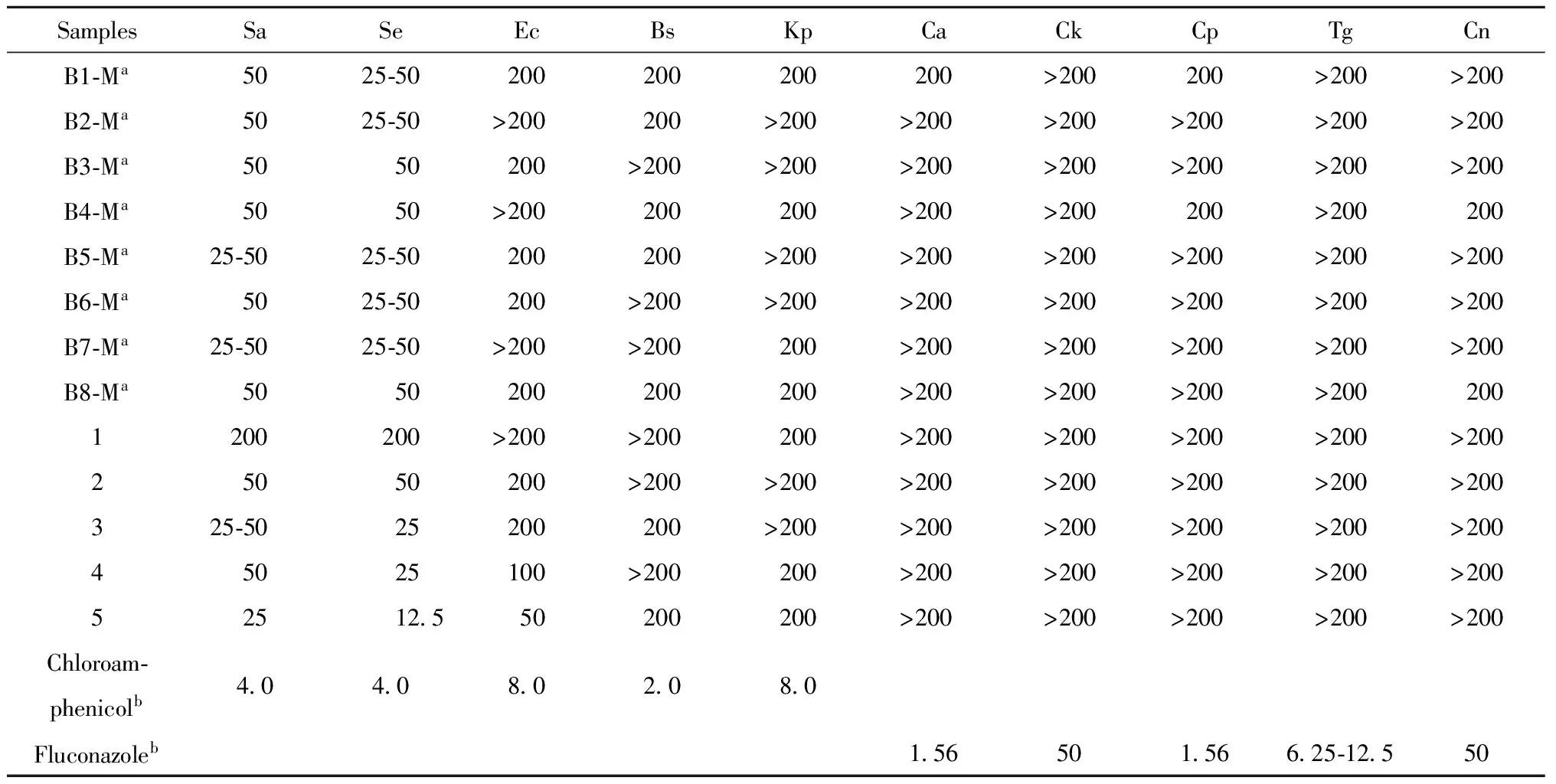
表1 三颗针提取物和单体化合物1~5的抗菌活性(MIC,μg/mL,n=3)
aM代表为甲醇提取物;bChloroamphenicol和Fluconazole作为阳性对照
3 讨论
三颗针为鄂西土家族人民常用的土家药之一,具有抗菌、消炎、清热燥湿、泻火解毒的功效。但由于其来源非常广泛,导致其质量的可控性、有效性与安全性得不到保证。为了更好地利用和开发这一民族药用资源,我们选择在鄂西分布最广、资源最丰富的湖北小檗进行研究,对其化学成分进行了系统的分离和纯化,得到7个化合物;采用HPLC-PDA方法对8种不同来源的三颗针化学成分进行了分析,1~8号样品的主要色谱峰具有较好的稳定性和重现性;对不同来源8种提取物和分离的单体生物碱成分进行了抗菌活性测试。对民族药三颗针的系统化学成分分离纯化、HPLC分析及抗菌活性研究将为这个资源丰富的民族药的进一步开发和利用打下基础。
[1] 国家中医药管理局《中华本草》编委会.《中华本草》第八卷[M].上海:上海科学技术出版社,1999:291.
[2] 卫生部药典委员会.《中华人民共和国药典》(2010版,1部)[M].北京:人民卫生出版社,2010:13.
[3] 蔡昌学,常燕子,姚海兰.大柴胡颗粒的抗菌作用研究[J].华中科技大学学报:医学版,2004,33(5):619-621.
[4] National Committee for Clinical Laboratory Standards.Reference method for broth dilution antifungal susceptibility testing of yeast tentative standards M27-T[M].Pennsylvania:NCCLS,1997:1.
[5] Ferreira M L,de Pascoli I C,Nascimento I R,et al.Aporphine and bisaporphine alkaloids fromAristolochialagesianavar.Intermedia[J].Phytochemistry,2010,71(4):469-478.
[6] 徐海波,张晓维,孙超,等.甘肃小檗枝、叶化学成分研究的分离与鉴定[J].中国药房,2012,23(47):4493-4495.
[7] 黄洪波,包文芳,杨芳芳,等.灯盏花的化学成分研究[J].沈阳药科大学学报,2001,18(4):266-268.
[8] 王志东,宋宝安,杨松,等.贵州中草药三颗针化学成分研究[J].贵州大学学报:自然科学版,2009,26(3):11-17.
(2015-05-18 收稿)
Analysis of Antimicrobial Activity Constituents of “San Ke Zhen”
Xu Chan,Wu Xiaoxiao,Wan Dingrongetal
CollegeofPharmacy,South-CentralUniversityforNationalities,Wuhan430074,China
Objective To systematically investigate the antimicrobial activity constituents of Chinese medicine“San Ke Zhen”and compare the stability and reproducibility of HPLC-PDA analysis of methanolic extracts of “San Ke Zhen”of different origins.Methods The isolation and purification of chemical constituents were performed with preparative HPLC,Sephadex LH-20 gel column chromatography and recrystallization.Structures of isolated pure compounds were identified by modern spectrum analysis.The HPLC-PDA method was performed to analyze eight methanolic extracts from different regions.Antimicrobial activities of the eight methanolic extracts and the monomeric alkaloids were evaluated by using the broth dilution method.Results Seven monomeric compounds were obtained from methanolic extracts,and after identification,they were found to be (1)isocorydine,(2)berbamine,(3)jatrorrhizine,(4)palmatine,(5)berberine,(6)4-hydroxybenzoic acid and (7)β-sitosterol.Compounds 1-7 were firstly isolated from this plant.Theinvitroresults showed that all eight methanolic extracts and compounds 2-5 displayed antimicrobial activities againststaphylococcusaureusandstaphylococcusepidermidis,with MIC values ranging from 12.5 to 50.0 μg/mL.Conclusion Isoquinoline alkaloids isolated from“San Ke Zhen”exhibit good antimicrobial activities.HPLC-PDA analysis of methanolic extracts of different origins is of good stability and reproducibility,which lays a foundation for further studies on“San Ke Zhen”.
San Ke Zhen;Berberisgagnepainii; antimicrobial; alkaloids; preparative HPLC
*新药研究国家重点实验室开放基金(No.SIMM1403KF-07);国家科技支撑计划项目(No.2012BAI27B06);中南民族大学"十二五"民族药学国家级实验教学示范中心资助;湖北省教育厅重点项目(No.D20131103)
R284.1/R284.2
10.3870/j.issn.1672-0741.2015.05.014
徐 婵,女,1990年生,硕士研究生,E-mail:xuchan00@163.com
△通讯作者,Corresponding author,E-mail:yxzyxz01@163.com
