X-射线照射对乳腺癌小鼠实验性肺转移的影响
2015-06-06关江锋胡作为
关江锋, 胡作为, 杨 航, 李 娜
1武汉市第一医院肿瘤科,武汉 4300222武汉市第五医院,武汉 430050
X-射线照射对乳腺癌小鼠实验性肺转移的影响
关江锋1, 胡作为1, 杨 航1, 李 娜2△
1武汉市第一医院肿瘤科,武汉 4300222武汉市第五医院,武汉 430050
目的 利用放射诱导乳腺癌小鼠肺损伤,探讨放射诱导的肺损伤对乳腺癌小鼠实验性肺转移的影响。方法 采用MA782细胞株建立小鼠乳腺癌模型。28只建模后的C57BL/6小鼠随机分为2组:对照组和照射组(每组n=14),右肺单次照射9 Gy后1~4周,观察记录其体重变化及肺、肝、脾等脏器转移情况;苏木精-伊红(HE)染色观察肺组织形态学改变;免疫组化检测肺组织中趋化因子CXCL12/CXCR4的表达。结果 照射后的1~2周,两组肝重、脾重和肺重变化无显著性差异(均P>0.05);然而,随着照射时间的推移,照射组小鼠在3~4周肺重、肺结节和肺脏指数明显增加(P<0.05或P<0.01)。肺组织形态学观察显示,在照射后的早期(1~2周)出现炎性细胞浸润;在照射后的第3~4周出现更多的肺转移性结节;肺泡壁增厚明显,肺间质各种细胞成分增加;支气管壁及血管外膜有明显的纤维化增厚,肺泡区域有纤维化形成。照射组肺组织中CXCL12/CXCR4表达显著高于对照组。结论 X-射线照射诱导的乳腺癌小鼠放射性肺损伤加速了肺转移,CXCL12-CXCR4生物信号轴在肿瘤发展、侵袭和肺转移中发挥重要作用。
照射; 肿瘤移植; 肺转移; CXCL12/CXCR4
放射治疗是肿瘤治疗的主要传统治疗手段之一,但对于乳腺癌、食管癌、肺癌、纵隔淋巴癌等胸部肿瘤来说,放疗过程中部分肺部组织不可避免受到照射,往往容易导致放射性肺损伤的发生。放射诱导的肺损伤造成的亚急性肺炎和后期肺纤维化往往是导致死亡的重要原因。近来研究发现,放疗能改变细胞形态和肿瘤微环境,导致残余肿瘤细胞转移的概率增加[1]。有证据表明,肿瘤微环境中的炎性成分参与影响肿瘤转移的机制[2],但这种机制目前还不十分清楚。本研究旨在观察X-射线照射诱导的肺损伤对乳腺癌小鼠实验性肺转移的影响,并对其可能的作用机制进行了初步探讨,为临床上如何防治因肿瘤放疗可能会导致的放射性肺损伤和转移提供新思路。
1 材料与方法
1.1 动物和细胞
雌性4~6周龄近交系C57BL/6小鼠28只,体重16~21 g,购于华中科技大学同济医学院实验动物学部,饲养于SPF级环境中。小鼠乳腺癌MA782/5S-8102细胞株,购于武汉大学中国典型培养物保藏中心。
1.2 小鼠乳腺癌模型的建立
将MA782细胞快速解冻复苏,用RPMI 1640培养液[含10%胎牛血清、青霉素-链霉素混合溶液(100×双抗)]置于37℃、5%CO2培养箱中培养,取对数生长期的细胞用不含血清的RPMI 1640稀释制成单细胞悬液,锥虫蓝计数细胞活性>95%。取细胞悬液按0.2 mL/只(细胞数1×106)注射(接种)于腹壁近右侧乳腺皮下部位,当肿瘤大小约2 mm×2 mm左右时(肿瘤部位皮肤剃毛处理后,初步用游标卡尺测量肿瘤大小),判断为造模成功。
1.3 动物分组和处理
1.3.1 动物分组 小鼠造模后随机分为2组,空白对照组和X-射线照射处理组,每组14只。照射组于肿瘤细胞移植后1周,当肿瘤大小达2 mm×2 mm时,将小鼠麻醉后用6 MV高能X-射线医用直线加速器(美国Varian公司)进行右胸部位单次照射,剂量9 Gy,照射区域1.3 cm ×0.8 cm,用10 cm厚铅砖屏蔽小鼠其余部分,源皮距100 cm,吸收剂量率300 cGy/min,照射时间为3 min。
1.3.2 标本处理 分别在照射后的1、2、3、4周,每组取3只活体取材,取小鼠肝脏、脾脏、肺脏称重。
1.3.3 观察指标 每周观察小鼠生活状况、体重及肺转移情况;记录肺表面的白色圆形结节数;苏木精-伊红(HE)染色观察肺组织形态学改变;肺脏指数=全肺湿重(mg)/身体体重(g);免疫组化分析肺组织中CXCL12/CXCR4表达。
1.4 统计学方法
2 结果
2.1 肿瘤移植后小鼠的一般生活状况
肿瘤移植后1~4周,对照组小鼠体重逐渐增加,出现精神萎靡不振、食欲下降、晚期腹部膨胀隆起。相对于对照组,照射组小鼠体重下降明显,最初1~3 d,可能由于急性放射性损伤,体重下降;在7~15 d,由于肿瘤发生肺部转移,体重下降,形体消瘦;在16~30 d,由于肿瘤疯狂生长,肿瘤负荷加重,因而体重急剧增加。见图1。
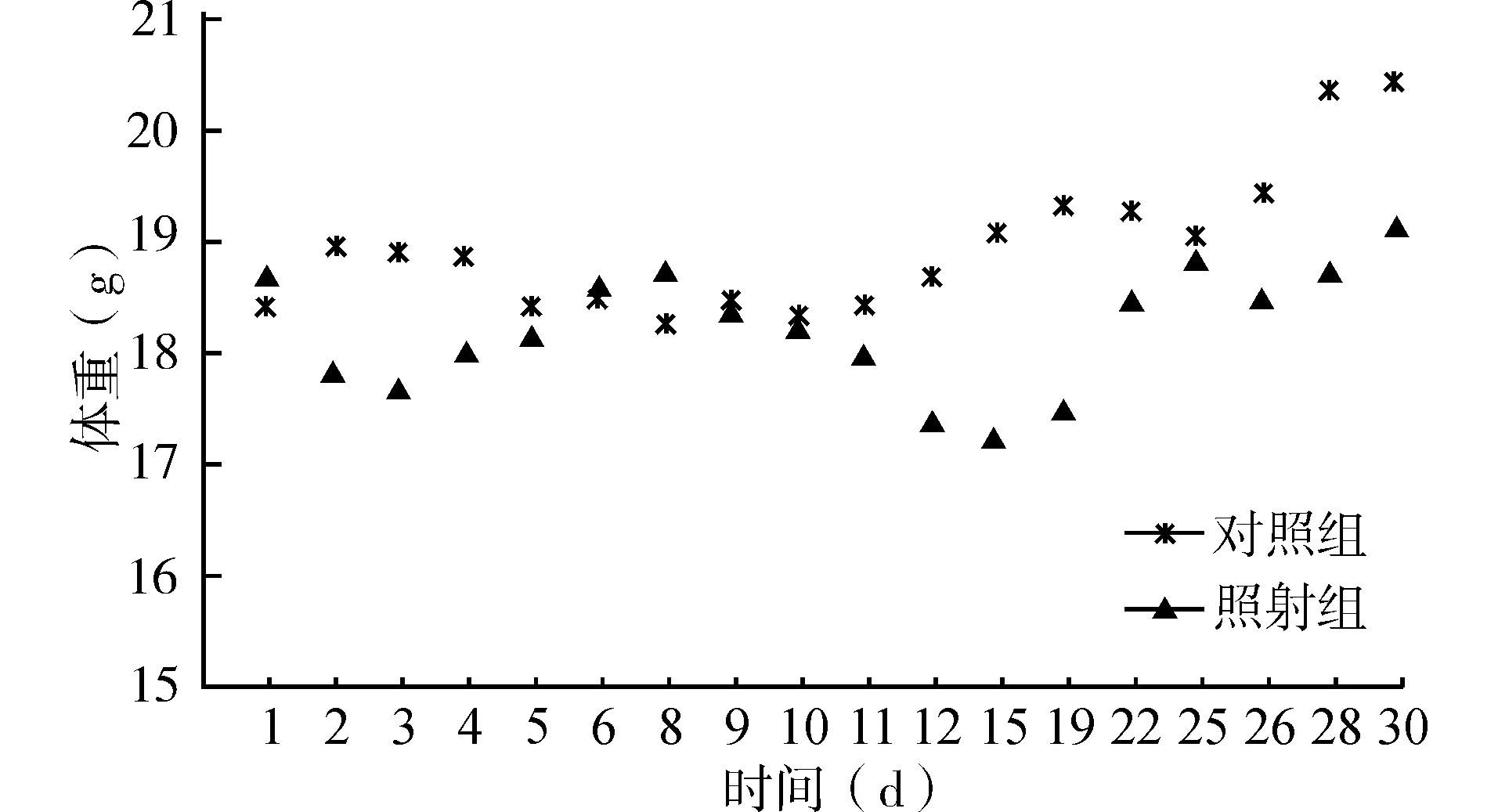
图1 两组小鼠体重变化曲线Fig.1 Weight change curves of mice in the two groups
2.2 肝重、脾重、肺重、肺指数和肺部结节变化
在最初的1~2周,两组肝重、脾重和肺重变化差异均无统计学意义(均P>0.05);在3~4周,两组肺重、肺指数明显增加,差异有统计学意义(均P<0.01),同时出现肺部转移性结节,照射组肺结节数显著多于对照组(P<0.05或P<0.01),肝脏和脾脏未见明显肿瘤转移。见表1。
2.3 肺部组织病理改变
肺部组织病理切片(HE染色)观察显示,在照射后的早期阶段出现炎性细胞浸润,在第3周开始出现肺转移结节,与对照组相比,照射组结节更多,第4周肺泡壁增厚更明显,肺间质各种细胞成分增加。支气管壁及血管外膜有明显的纤维化增厚,肺泡区域有纤维化形成。
2.4 免疫组化检测CXCL12/CXCR4表达水平
照射组第4周CXCL12/CXCR4表达水平显著高于对照组,提示CXCL12-CXCR4信号轴与放射性肺损伤加速肺转移有关(图2)。
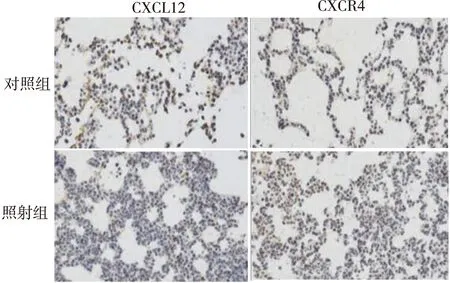
图2 免疫组化检测两组肺组织中CXCL12/CXCR4的表达(×400)Fig.2 Expression of CXCL12/CXCR4 in lung tissues of the two groups detected by immunohistochemistry(×400)
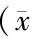
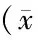
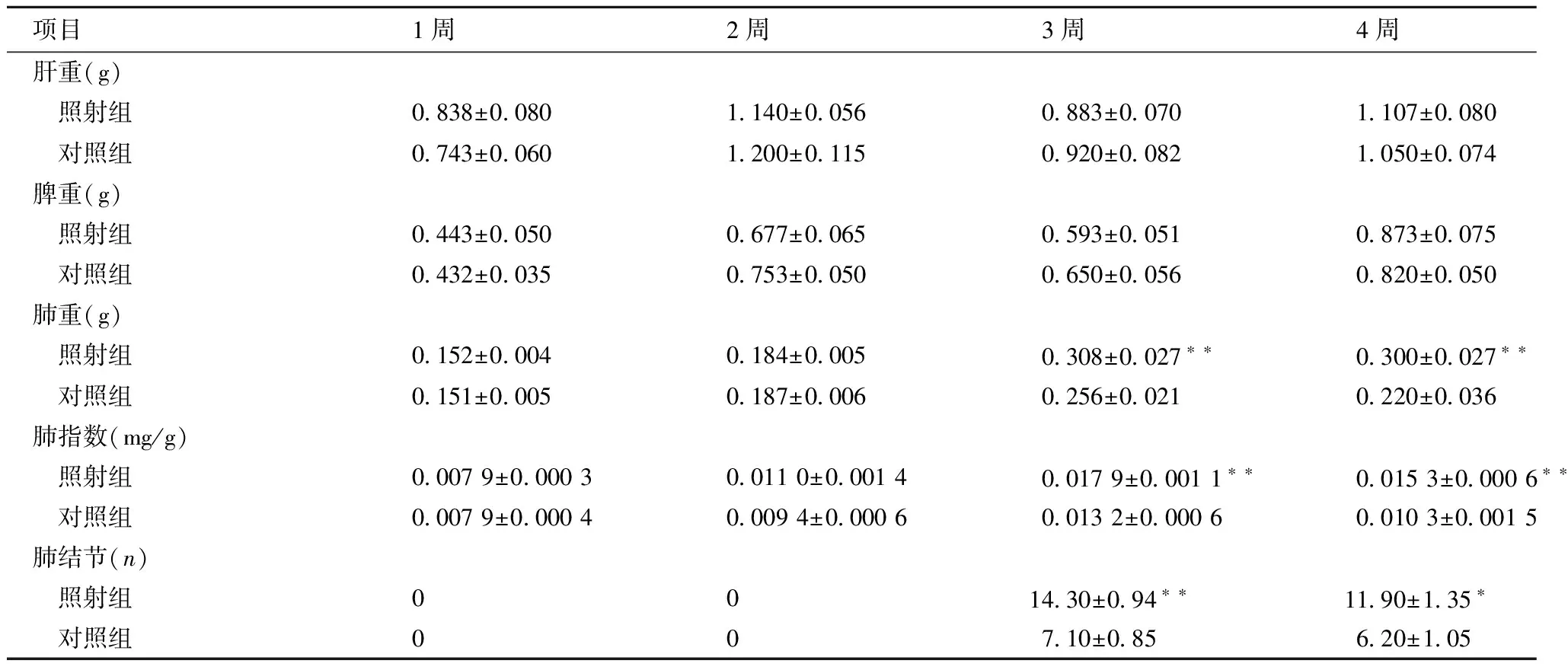
项目1周2周3周4周肝重(g) 照射组0 838±0 0801 140±0 0560 883±0 0701 107±0 080 对照组0 743±0 0601 200±0 1150 920±0 0821 050±0 074脾重(g) 照射组0 443±0 0500 677±0 0650 593±0 0510 873±0 075 对照组0 432±0 0350 753±0 0500 650±0 0560 820±0 050肺重(g) 照射组0 152±0 0040 184±0 0050 308±0 027∗∗0 300±0 027∗∗ 对照组0 151±0 0050 187±0 0060 256±0 0210 220±0 036肺指数(mg/g) 照射组0 0079±0 00030 0110±0 00140 0179±0 0011∗∗0 0153±0 0006∗∗ 对照组0 0079±0 00040 0094±0 00060 0132±0 00060 0103±0 0015肺结节(n) 照射组0014 30±0 94∗∗11 90±1 35∗ 对照组007 10±0 856 20±1 05
与对照组比较,*P<0.05**P<0.01
3 讨论
放射性肺损伤(RILI)主要表现为早期的急性放射性肺炎(RP)和后期的放射性肺纤维化(RPF)。早期炎症阶段一般表现为肺泡细胞耗竭,炎症细胞聚集。在这一过程中刺激特异性白细胞亚群活化产生细胞生长因子、趋化因子等参与炎症反应。后期则由损伤的靶细胞释放多种细胞因子,尤其是促纤维生长因子,启动成纤维细胞的增殖和细胞外基质蛋白合成增加,表现为成纤维细胞增生,胶原蛋白的积累和肺泡间隔增厚,最终形成肺间质纤维化。放射性肺损伤的发生是一个连续同时又极其复杂的网状交织过程,目前它们之间的信号通路还不是非常清楚。
细胞因子级联学说认为[3]:电离辐射产生的活性氧损伤肺实质细胞,包括肺泡巨噬细胞、成纤维细胞、肺泡Ⅱ型细胞等,引发分泌多种细胞因子,其中氧化应激所致的自由基过度生成、炎症细胞及相关细胞因子参与的炎症反应过程是放射性肺损伤的关键因素。照射后间质细胞释放细胞因子,由细胞因子诱发的各种免疫样反应是放射性肺损伤的决定因素。
目前研究认为,电离辐射可引起肺内效应细胞即成纤维细胞、肺泡巨噬细胞和血管内皮细胞产生释放多种致炎、致纤维化细胞因子,介导炎性反应,启动和促进肺组织纤维化,通过介导多细胞间的信号传递和相互作用,刺激成纤维细胞分裂增殖,导致肺组织胶原蛋白合成,胶原沉积和纤维化形成[4]。
放射治疗是治疗肿瘤的主要方法之一,但有证据表明放射能够促进肿瘤细胞的侵袭和转移[1,5]。其中肿瘤细胞和周围的基质细胞的相互作用在肿瘤的进展中发挥重要作用。体外实验表明,将胰腺癌细胞与未照射的成纤维细胞共培养,胰腺癌细胞的浸润和侵袭能力显著增加,而与经照射过的成纤维细胞共培养,这种侵袭能力则进一步加快[6]。辐射后周围基质细胞的激活和炎症细胞的聚集以及致癌基因激活、骨髓单核细胞及调节剂被认为参与了肿瘤侵袭、转移的全过程[7]。本研究病理检测结果显示,小鼠在照射后的早期出现炎性细胞浸润,在照射后的第3周开始出现更多肺转移结节;同时,小鼠肺重、肺结节和肺指数在照射后的3~4周明显增加(P<0.05或P<0.01),表明照射小鼠出现了放射性肺损伤,并且这种肺放射性损伤进一步加剧了乳腺癌肿瘤的肺部转移,研究结果与Delgado等[8]报道类似。由于原位肿瘤本身并没有被照射,也不是由照射引起,因此这种放射诱导的肺损伤加速肺转移现象可以用肿瘤细胞与正常细胞相互作用的旁观者效应机制解释,即直接受到照射的细胞通过信号转导引起临近细胞的损伤,表明在肿瘤放疗的过程中,不仅要考虑肿瘤细胞的辐射效应,照射对正常的细胞影响也要考虑在内。在目前的研究中,有关辐射诱导的放射性肺损伤与肿瘤转移的确切机制尚不十分清楚。
趋化因子CXCL12及其受体CXCR4是趋化家族中的重要成员,在多种肿瘤的生长、播散、器官特异性转移、血管新生及肿瘤免疫抑制中发挥重要作用[9-10]。研究表明,针对CXCR4的治疗可减慢肿瘤生长的速率,减少血管内皮生长因子的表达,使肿瘤体积缩小,并使远处转移率降低[11]。CXCR4、CXCL12的高表达与肺、肝、淋巴结和骨髓等转移有关[12]。因而CXCL12/CXCR4被认为是肿瘤侵袭、扩散和转移的诱导剂。CXCL12及其受体CXCR4的激活在放射诱导的肺纤维化发生过程中发挥重要作用。在放射性肺损伤中,骨髓来源的成纤维前体细胞表达CXCR4并聚集到肺纤维化部位。CXCL12-CXCR4生物学信号轴还参与了放射诱发的与肿瘤复发和转移密切相关的肿瘤新生血管生成;研究还证实从浸润性乳腺癌组织中提取的间质成纤维细胞比癌旁正常组织中的同类细胞更容易促进乳腺癌细胞生长和肿瘤新生血管生成[13-16]。并且,在肺、肝和淋巴结组织中高含量的CXCL12更容易导致CXCR4在这些部位的循环表达。肿瘤细胞高表达的CXCR4与较差的临床预后相关[17]。本研究结果表明,照射处理后小鼠肺组织中CXCL12/CXCR4表达水平显著增加(P<0.05)。因此,我们推断CXCL12-CXCR4信号轴在乳腺癌小鼠放射性肺损伤加速的肺转移中扮演重要角色,阻断趋化因子受体CXCL12-CXCR4交互作用或抑制下游信号的活动可能成为肿瘤治疗新靶点[7]。
综上所述,放射性肺损伤诱发的急性炎症反应,为肿瘤细胞创造了一个有利于生存和转移的微环境。CXCL12-CXCR4生物学信号轴在肿瘤的扩增、侵袭、血管生成和转移中扮演重要角色,有望成为胸部肿瘤(乳腺癌)治疗的新靶点。
[1] Sofia Vala I,Martins L R,Imaizumi N,et al.Low doses of ionizing radiation promote tumor growth and metastasis by enhancing angiogenesis[J].PLoS One,2010,5(6):e11222.
[2] Yangie H,Hisa T,Ono M,et al.Chemokine and chemokine receptor related to cancer metastasis[J].Gan To Kagaku Ryoho,2010,37(11):2052-2057.
[3] Trott K R,Herrmann T,Kasper M.Target cells in radiation pneumopathy[J].Int J Radiat Oncol Biol Phys,2004,58(2):463-469.
[4] Tsoutsou P G,Koukourakis M I.Radiation pneumonitis and fibrosis:mechanisms underlying its pathogenesis and implications for future research[J].Int J Radiat Oncol Biol Phys,2006,66(5):1281-1293.
[5] Morgan G W,Breit S N.Radiation and the lung:a reevaluation of the mechanisms mediating pulmonary injury[J].Int J Radiat Oncol Biol Phys,1995,31(2):361-369.
[6] Ohuchida K,Mizumoto K,Murakami M,et al.Radiation to stromal fibroblasts increases invasiveness of pancreatic cancer cells through tumor-stromal interactions[J].Cancer Res,2004,64(9):3215-3222.
[7] Shu H K,Yoon Y,Hong S,et al.Inhibition of the CXCL12/CXCR4-axis as preventive therapy for radiation-induced pulmonary fibrosis[J].PLoS One,2013,8(11):e79768.
[8] Delgado O,Batten K G,Richardson J A,et al.Radiation-enhanced Lung cancer progression in a transgenic mouse model of lung cancer is predictive of outcomes in human lung and breast cancer[J].Clin Cancer Res,2014,20(6):1610-1622.
[9] Bonecchi R,Locati M,Mantovani A.Chemokines and cancer:a fatal attraction[J].Cancer Cell,2011,19(4):434-435.
[10] Wu P F,Lu Z P,Cai B B,et al.Role of CXCLl2/CXCR4 signaling axis in pancreatic cancer[J].Chin Med J(Engl),2013,126(17):3371-3374.
[11] Hassan S,Buchanan B,Jaban K,et a1.CXCR4 peptide antagonist inhibit S primary breast tumor growth,metastasis and enhances the efficacy of anti-VEGF treatment or docetaxel in a transgenic mouse model[J].Int J Cancer,2011,129(1):225-232.
[12] 张婕,刘斌雅,齐聪.CXCL12-CXCR4/CXCR7趋化因子轴在肿瘤中的研究进展[J].中华临床医师杂志:电子版,2014,8(4):769-774.
[13] Orimo A,Weinberg R A.Stromal fibroblasts in cancer:a novel tumor-promoting cell type[J].Cell Cycle,2006,5(15):1597-1601.
[14] Muller A,Homey B,Soto H,et al.Involvement of chemokine receptors in breast cancer metastasis[J].Nature,2001,410(6824):50-56.
[15] 孔德光,吴高松.p53与乳腺癌转移的关系及其机制[J].华中科技大学学报:医学版,2014,43(6):720-722.
[16] 吕峰,于洋,李兆明,等.高表达蛋白LATS1对乳腺癌MCF-7细胞增殖能力的影响[J].华中科技大学学报:医学版,2013,42(1):66-69.
[17] Staller P,Sulitkova J,Lisztwan J,et al.Chemokine receptor CXCR4 down-regulated by von Hippel-Lindau tumour suppressor pVHL[J].Nature,2003,425(6955):307-311.
(2014-12-30 收稿)
Effect of X-ray Irradiation on Experimental Lung Metastasis in Mice with Breast Cancer
Guan Jiangfeng,Hu Zuowei,Yang Hangetal
DepartmentofOncology,WuhanNo.1Hospital,Wuhan430022,China
Objective To establish the radiation-induced lung injury model in mice with breast cancer,explore the effect of X-ray irradiation on lung metastasis in these mice and observe whether the radiation-induced lung injury will accelerate lung metastasis.Methods The breast cancer model was established with MA782 cells in C57BL/6 mice by intraperitoneal injection.Twenty-eight C57BL/6 mice after modeling were randomly divided into 2 groups:control group and irradiation group(n=14 in each group).In irradiation group,the right chest was irradiated with a dose of 9 Gy one time when tumors grew to about 2 mm×2 mm in diameter.One to four weeks after the irradiation,the body weight was measured and liver,lung and spleen metastases were observed.HE staining was used to observe the morphological changes of lung tissues and the expression of chemokine factor CXCL12/CXCR4 in lung tissues was immunohistochemically detected.Results There was no statistical significance in the liver weight,spleen weight and lung weight between the two groups 1 or 2 weeks after the irradiation(P>0.05).With the irradiation time extended,especially in 3-4 weeks,lung weight,lung nodules and lung index in the irradiation group were significantly increased(P<0.05 orP<0.01).Lung tissue morphology showed that the inflammatory cell infiltration was found in the early time(1-2 weeks)of irradiation;lung metastatic nodules were significantly increased 3-4 weeks after irradiation;the alveolar wall was thickened and various cellular components in pulmonary interstitial tissues were obviously increased;fibrosis developed in the bronchial wall and vascular adventitia;fibrosis was found in the alveolar region.The expression level of CXCL12/CXCR4 was much higher in lung tissues in irradiation group than in control group.Conclusion X-ray irradiation-induced lung radioactive injury accelerates lung metastasis in mice with breast cancer.CXCL12-CXCR4 biological signal axis may play an important role in tumor development,invasion and metastasis.
irradiation; tumor transplantation; lung metastasis; CXCL12/CXCR4
R737.9
10.3870/j.issn.1672-0741.2015.05.013
关江锋,男,1979年生,主治医师,E-mail:1051889475@qq.com
△通讯作者,Corresponding author,E-mail:419589127@qq.com
