萼花臂尾轮虫毒性试验的方法学研究
2015-06-05徐吉洋张文萍李少南郎倩萍
徐吉洋,张文萍,李少南,郎倩萍
浙江大学农药与环境毒理研究所,杭州310029
萼花臂尾轮虫毒性试验的方法学研究
徐吉洋,张文萍,李少南*,郎倩萍
浙江大学农药与环境毒理研究所,杭州310029
为尝试以群体取代个体作为轮虫室内毒性试验目标物的可行性,本项研究以萼花臂尾轮虫(Brachionus calyciflorus)作为实验生物开展相关实验,建立生命表并确定接种密度对于种群生长率的影响,并且用3种农药(毒死蜱、丁草胺、三唑酮)开展了轮虫毒性试验。生命表实验结果表明,轮虫的平均寿命和世代周期分别为(78.76±33.08) h和(51.56±20.55) h。接种密度实验结果表明,随着接种密度的提高,轮虫种群增长率呈下降趋势。基于接种密度实验的结果,毒性试验以35个·(100 mL)-1作为受试种群的起始密度,试验周期定为144 h。毒性试验结果显示,毒死蜱对轮虫的96 h-EC50和120 h-EC50分别为0.6066 mg·L-1和0.7323 mg·L-1;丁草胺对轮虫的96 h-EC50和120 h-EC50分别为1.851 mg·L-1和3.058 mg·L-1;三唑酮对轮虫的96 h-EC50和120 h-EC50分别为12.84 mg·L-1和11.63 mg·L-1。本项研究的结果肯定了以群体取代个体作为轮虫室内毒性试验目标物的可行性。
毒死蜱;丁草胺;三唑酮;萼花臂尾轮虫;毒性试验;接种密度;试验周期
轮虫具有生殖速度快、生活周期短、对毒物敏感、全球分布而成为生态毒理学研究的受试动物[1]。轮虫是水生生态系统中的重要成员,连接食物链中的初级生产者与高级消费者,在物质转化与能量传递方面起着十分重要的作用[2],因此也已经成为水生毒理学研究中的受试动物之一,目前国内外有许多污染物对轮虫毒性的研究[3]。
开展生态毒理学研究的一个关键问题就是寻找适宜、敏感度高的测试终点[4]。目前,大多数急性毒性试验所用的受试动物都是臂尾轮虫属的种类。Snell等[5]分别利用红臂尾轮虫(B. rubens)和褶皱臂尾轮虫(B. plicatilis)的休眠卵得到受试动物,提出了标准化24 h-LC50实验方案。目前被美国公共卫生协会(APHA)和美国材料与试验协会(ASTM)采用的轮虫标准毒性试验方法(24 h急性毒性试验和48 h无性繁殖试验)只包括了轮虫生命史的一部分。但是,就自然环境中的生物而言,可能是生命史的某阶段暴露在毒物中,也可能是生命史都暴露在毒物中,因此,敏感的测试终点应能够代表整个生命史[4]。从轮虫的毒性试验方法和应用上来看,赵玉明等[6]进行了在蒙古裸腹溞培养中用药物杀灭褶皱臂尾轮虫的研究,得出了5种常用化学药物甲醛、次氯酸纳、次氯酸钙、孔雀石绿、碘对蒙古裸腹溞和褶皱臂尾轮虫的24 h-LC50和48 h-LC50。赵含英等[7]研究了Cu2+对萼花臂尾轮虫的毒性影响,得出了Cu2+对萼花臂尾轮虫的24 h、48 h、96 h-LC50。谢钦铭等[8]研究了孔雀石绿、高锰酸钾和甲醛对褶皱臂尾轮虫的24 h急性毒性。吕林兰等[9]采用2天种群增长和生命表,研究了不同浓度氟他胺对萼花臂尾轮虫的毒性影响。从这些报道可以看出,测试终点集中在24 h和48 h,均以单个个体为实验对象。如果在24 h和48 h内不频繁的检查结果,由于轮虫生命周期短,生殖速度快,短时间内会产出下一代,如果参照OECD“化学品测试准则202”[10]的毒性测定方法,会在一定程度上对结果的准确性产生很大的影响。因此,探索一个易于操作并能适当延长试验周期的轮虫毒性试验方法具有重要的生态毒理学意义。
目前,关于萼花臂尾轮虫毒性试验方法的研究较少,大多数都是采用24 h或48 h急性试验的方法,Gallardo等[11]曾参照脊椎动物方法研究激素对褶皱臂尾轮虫种群变化影响。本文以萼花臂尾轮虫喂受试生物,系统的提出了以种群增长完成轮虫毒性试验的方法,为利用轮虫评价农药毒性风险提供依据。
1 材料与方法(Materials and methods)
1.1 实验生物来源与培养
实验用的萼花臂尾轮虫(Brachionus calyciflorus,以下简称轮虫)来自浙江大学农药与环境毒理研究所,经实验室连续培养,培养时间6个月以上。选用蛋白核小球藻(Chlorella pyrenoidosa)作为轮虫的饵料。藻种来自浙江大学农药与环境毒理研究所,实验室条件下培养至指数生长期,经离心浓缩后至4 ℃冰箱中冷藏待用。采用L9培养液,24 h光照,光照强度为1 000~1 200 lx,培养温度为25 ℃~30 ℃。
1.2 供试化学品
97%毒死蜱(chlorpyrifos)原药、90%丁草胺(butachlor)、90%三唑酮(triadimefon)均由浙江新农化工有限公司提供。用丙酮配成一定浓度的母液,使用前用稀释水配成不同浓度的稀释液。
1.3 轮虫的预培养
采用用6孔细胞培养板,每孔放入5只活泼健壮带孤雌生殖卵的雌体,每4小时观察一次,待幼体出生后选择约2 h内幼体作为生命表编制实验的实验材料。轮虫培养液采用Gilbert[2]配方。实验前,用(美国环境保护局)EPA[3]为培养液,并调节pH值为7.5,静置30 min左右后备用。预培养条件设置为:培养温度为(25±2) ℃,光周期昼长比为16 h∶8 h,光强度为1 000~2 000 lx。以实验室培养的经离心浓缩的蛋白核小球藻(Chlorella pyrenoidosa)作为轮虫的食物来源,密度约为6×107cells·mL-1。
1.4 生命表实验
生命表参数的定义和计算方法与席贻龙和黄祥飞的[14]基本相同。采用24孔细胞培养板,每孔添加3 mL EPA培养液,接种1只出生2 h左右的轮虫,投喂30 μL小球藻,小球藻密度约为6×107cells·mL-1,每4小时检查一次实验结果,记录轮虫的产卵数、孵化出的幼体数及母体的存活数,并移去幼体,实验期间不更换培养液。实验至全部个体死亡为止。实验共操作了291个轮虫。
1.5 接种密度实验
1.5.1 实验设置
实验设置了19种接种密度,在预培养轮虫中挑选活泼健壮的不带卵的成体,采用100 mL烧杯。分别为0.05,0.10,0.15,0.20,0.25,0.30,0.35,0.40,0.60,0.80,1.00,1.20,1.40,1.60,2.00,4.00,6.00,8.00,10.00个·mL-1营养液,接种后每天投喂饵料为1 mL,投喂小球藻为用L9营养液培养7 d左右离心后的小球藻,浓度约为6×107cells·mL-1。光照强度1 000~1 200 lx;控制温度(25±2) ℃ 。
1.5.2 计数方法
每24 h计数一次,采用1 mL计数板计数,取样时将烧杯轻轻搅拌,取1 mL轮虫培养液,在体视镜下计算轮虫的总个数,计数3次取平均值。实验周期为240 h,实验期间不更换培养液。轮虫数量的增长倍数和平均日增长率计算方法分别为:
增殖倍数=轮虫总量/接种轮虫数
平均日增长率R=(lnNt-lnNo)/t
No和Nt分别表示实验开始时和结束时轮虫种群密度,t表示实验时间[15]。为便于比较,本文在计算日平均增殖率时,Nt均采用轮虫达到最高密度时的数值。
1.6 三种农药对轮虫毒性试验的应用
采用丙酮为助溶剂设置1个空白对照组和1个丙酮最大浓度(0.01 %)照组,以及5个浓度水平,分别每个浓度设置4个重复。先用丙酮将原药配成母液,再用稀释水配成不同浓度的稀释液。各浓度组稀释液中丙酮的终浓度不超过0.1 mL·L-1。己有研究显示该丙酮浓度对实验结果无显著影响[16]。设空白和溶剂(丙酮)两组对照。溶剂对照中丙酮的终浓度与最高浓度组相同。毒死蜱浓度设为0、0.1、0.2、0.4、0.8、1.6 mg·L-1;丁草胺的浓度设置为0、1、2、4、6、8 mg·L-1;三唑酮的浓度设置为0、4、6、8、10、14 mg·L-1。根据接种密度实验结果,每个烧杯中放35个活泼健壮不带卵的成体。实验期间不更换实验溶液。投喂饵料与计数方法同接种密度实验。
2 结果与讨论(Results and discussion)
2.1 生命表实验结果与分析
从表1中得出,轮虫的平均寿命为(78.76±33.08) h,世代时间为(51.56±20.55) h,可见轮虫在较短的时间内就可以由幼体转变为成体,最快在一天左右就进入到繁殖期,大多数的轮虫在实验周期内都处在生殖前期和生殖期,轮虫会产出幼体,幼体会在较短时间内转化为成体,如果受试轮虫挑选不严密、检查周期和试验周期不合理,在很大程度上会影响毒性试验结果的准确性。
2.2 接种密度实验结果与分析
通过表2得出接种密度为0.35个·mL-1在第144小时的增殖倍数为136.4,最高种群密度为47.75个·mL-1,在所有接种密度中最高,达到最高种群密度的时间也最短,仅需要144 h。接种密度在低于0.35个·mL-1时,随着接种密度的增高,在一定时间里所能达到的最高种群密度越高;接种密度在0.40个·mL-1和1.60个·mL-1之间时,随着接种密度的增高,在一定时间里所能达到的最高种群密度也越高,但是趋势不明显;接种密度在2.00个·mL-1和10.00个·mL-1之间时最高种群密度没有明显的波动,随着接种密度的增高,平均日增长率呈明显的降低趋势。总之,接种密度为0.35个·mL-1在所有接种密度中具有很高的代表性,具有短时间内达到最高种群密度的优势,所以选择0.35个·mL-1作为毒性试验开展时所需要的接种密度。
选择差异性较显著的接种密度组作出图1。接种密度为0.35个·mL-1在第4至第8天的种群密度明显高于其他各组。在实验第5天,接种密度为0.35个·mL-1的种群密度为41个·mL-1,分别是接种密度为0.20个·mL-1、0.60个·mL-1、1.20个·mL-1和2.00个·mL-1的1.28倍、1.86倍、1.62倍和2.05倍。由此可见,接种密度为为0.35个·mL-1在所有各组中种群增长最快,在144 h时达到最高种群密度,所以选择144 h作为毒性实验的周期具有合理性。

表1 萼花臂尾轮虫的生命表Table 1 Brachionus calyciflorus’s life table
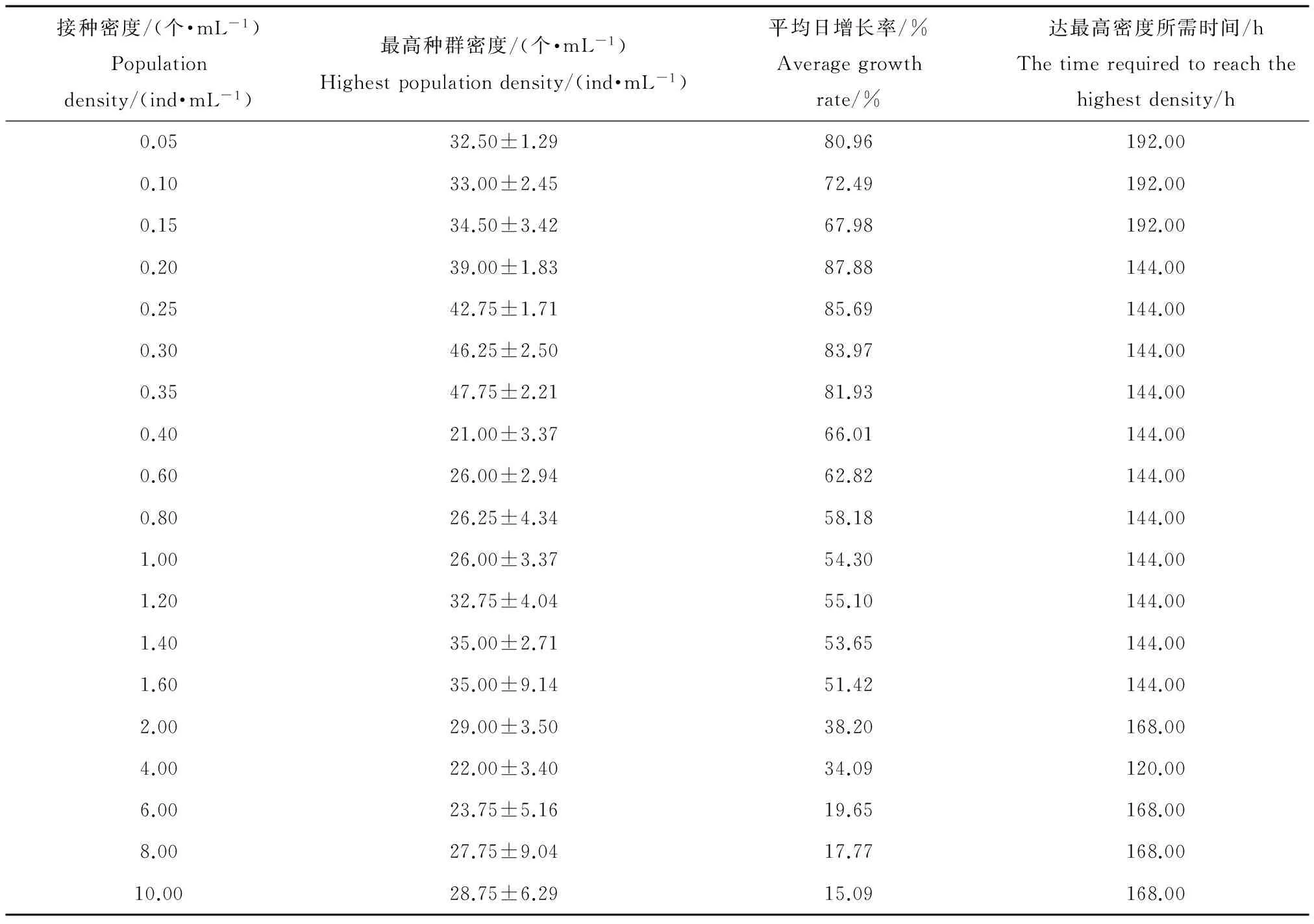
表2 不同接种密度下轮虫可达最高种群密度与种群日平均增殖率Table 2 Maximum population density and population growth rate of Brachionus calyciflorus cultured from the different initial population densities
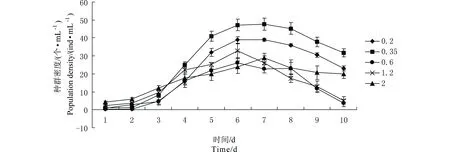
图1 不同接种密度对轮虫种群增长的影响Fig. 1 Effects of initial population densities on population growth of Brachionus calyciflorus
2.3 分析与讨论
从轮虫24 h急性毒性试验方法的应用来看并不统一,或者没有严格的按照标准方法操作。储昭霞等[17]取龄长在0~2 h内的轮虫幼体若干个,将每10个个体放入容量为3 mL的小玻璃杯中,然后加入体积为2 mL(内含密度为3.0×109cells·mL-1的斜生栅藻)的各浓度草甘膦溶液24 h后,检查记录每个玻璃杯中轮虫个体的存活数。黄林等[18]从预培养的试管中随机吸取带非混交卵的轮虫雌体若干个置于培养皿中进行培养,2 h后收集孵化出的轮虫幼体。每10个轮虫幼体放人容积为5 mL的特制小玻璃杯中,加人3 mL测试液。分别于24 h、48 h后观察记录每个小杯中轮虫的死亡数目。陈艳等[19]取预培养48 h中活泼健壮带孤雌生殖卵的雌体置入另外同样条件的烧杯中培养,观察卵的孵出情况,取2 h内孵出的幼体作为毒性试验的材料,24 h后观察记录试验结果。张才学等[20]用浮游植物网过滤出幼小轮虫,在每支试管各加入随机抽取的30个不带卵的幼小轮虫。试验期间不充气,约投以1×106cells·mL-1小球藻和少量酵母。于6 h,12 h,24 h分别检查各时间段的轮虫死亡个数。然而,对比前人的实验操作方法,本方法具有较多优势,本方法在轮虫生命表的基础上,以种群为研究对象,通过接种密度实验找到了较适宜的接种密度,克服了频繁检查实验结果的困难(采用24 h检查一次实验结果),将测试周期可以延长到7 d,在一定程度上降低了实验操作的复杂性,提高了方法的可行性和准确性。
本文应用的毒死蜱、三唑酮和丁草胺都是中国稻田里的常用农药,将轮虫的毒性试验方法应用于这3种农药具有很高的代表性。毒死蜱(chlorpyrifos)作为高毒有机磷类农药的替代品种,在我国有着广阔的应用空间。值得注意的是,随着该农药的大力推广,其亲体及代谢产物有可能通过多种途径进入水体。例如美国环境保护局(EPA)从1987年开始对毒死蜱的水体污染进行检测。1987—1996年间在水体中检测到的毒死蜱浓度为0.04~0.40 μg·L-1,并且呈逐年上升趋势[21]。至于该农药的生态毒性,以往对鱼类有较多研究[22-24],对水生生物的毒性研究还不够充分。三唑酮(triadimefon)是一种高效、低毒、内吸性强的广谱杀菌剂,对多种植物上的真菌病害如白粉病、锈病等有良好的防治效果[25]。三唑酮在农田施用后能够向土壤深处迁移和扩散,从而污染土壤和地下水体,并对土壤生态环境造成破坏[26]。Vincelli[27]模拟了三唑酮施用于高尔夫球场后发现,浓度在0.3 mg·L-1时,三唑酮会大量出现在地表水中。目前,关于三唑类杀菌剂对水生生物的毒性研究不多,国内的相关研究涉及更少。丁草胺(butachlor)是我国在水稻田使用最多的一种除草剂。己有的研究表明丁草胺不仅在上壤中具有明显的持留性[28]。而且对水生生物有较高的毒性[29]。通过轮虫毒性试验方法得到3种农药对轮虫的毒性效应,进一步评价了这3种农药在稻田中应用的风险性。
2.4 轮虫毒性试验的结果与分析
通过毒性试验结果可以得出,3种农药对轮虫的毒性大小为毒死蜱>丁草胺>三唑酮。我国“化学农药环境安全评价试验准则”[30]将农药对溞类的毒性划分为3个等级:LC50≤1 mg·L-1为高毒,1 mg·L-1
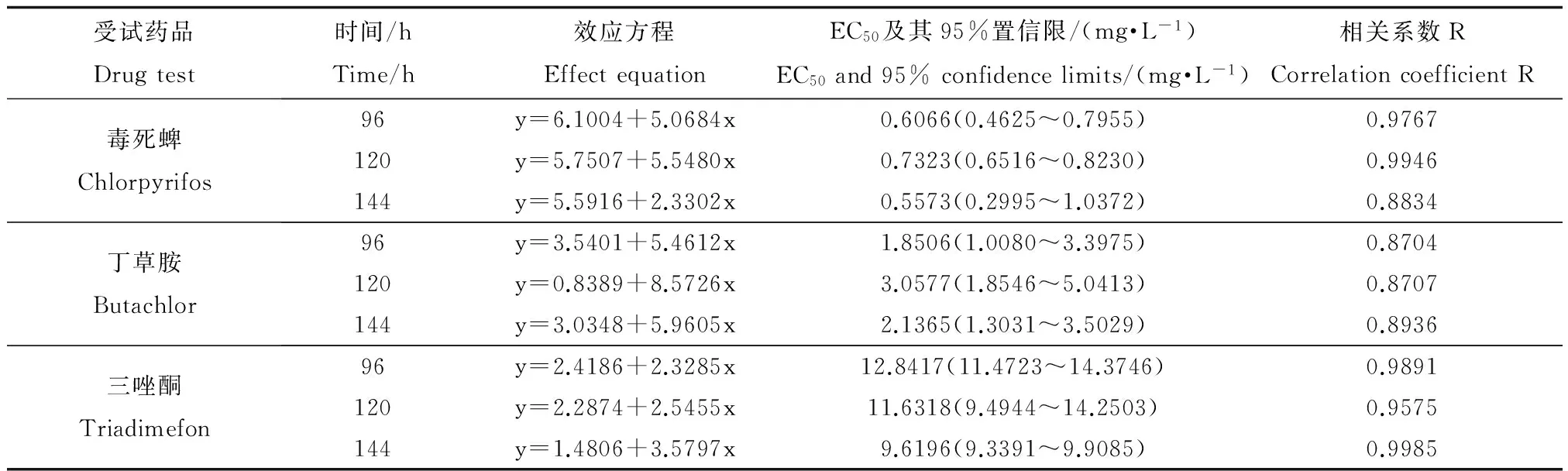
表3 三种农药对轮虫的毒性试验汇总Table 3 Summary of the three pesticides’ toxicity test to Brachionus calyciflorus
综上,本文根据轮虫的生命表实验,接种密度实验,选择了包含轮虫整个生命周期的试验周期。从种群增长的角度肯定了以群体取代个体作为轮虫室内毒性试验目标物的可行性。
通过把这种轮虫毒性试验方法应用到毒死蜱、三唑酮、丁草胺,与轮虫传统的24 h和48 h急性毒性方法相比,这种新的方法易于操作,不需要单独操作一只轮虫,而是从种群增长的角度完成毒性试验;便于测定,不需要每4 h或6 h测定一次实验结果,而是24 h观察记录一次实验结果;误差相对较小,实验设置4个重复,取样前将轮虫轻轻搅拌均匀,每个重复计数3次求平均值;试验周期合理,包含了轮虫的整个生命史。因此,将接种密度设置为35个·(100mL)-1,试验周期设置为120 h或144 h都较为合理,但这种轮虫毒性试验方法的完善和推广还有待于进一步研究。
[1] Snell T W, Janssen C R. Rotifers in ecotoxicology: A review [J]. Hydrobiologia, 1995, 313/314: 231-247
[2] Wallace R L, Snell T W. Phylum Rotifera [M] //Thorp J H, Covich A P. Ecology and Classification of North American Freshwater Invertebrates. San Diego: Academic Press, 2001: 195-254
[3] Kotani T, Hagiwara A, Snell T, et al. Euryhaline Brachionus strains (Rotifera) from tropical habitats: Morphology and allozyme patterns [J]. Hydrobiologia, 2005, 181: 161-167
[4] 吕林兰. 环境内分泌干扰物对萼花臂尾轮虫繁殖生物学的影响[D]. 南京: 南京师范大学, 2010: 17-18
Lv L L. Reproductive biology of environmental endocrine disruptors on B. calyciflorus [D]. Nanjing: Nanjing Normal University, 2010: 17-18
[5] Snell T W, Persoone G. Acute toxicity bioassays using rotifers. II. A freshwater test with Brachionus rubens [J]. Aquatic Toxicology, 1989, 14: 81-92
[6] 赵玉明, 何志辉. 在蒙古裸腹溞培养中用药物杀灭褶皱臂尾轮虫的研究[J]. 大连水产学院学报, 2002, 17(1) : 32-36
Zhao Y M, He Z H. Studies on chemicals killing of Brachionus plicatilis in culture of Moina mongolicaby chemicals Ⅱ. The chronic toxicity of five chemicals to Moina mongolica [J]. Journal of Dalian Fisheries University, 2002, 17(1): 32-36 (in Chinese)
[7] 赵含英, 杨家新, 陆正和, 等. Cu2+对萼花臂尾轮虫的毒性影响[J]. 南京师大学报: 自然科学版, 2002, 25(4): 81-85
Zhao H Y, Yang J X, Lu Z H, et al. The toxic effect of Cu2+on rotifer Brachionus calyciflorus [J]. Journal of Nanjing Normal University: Natural Science Edition, 2002, 25(4): 81-85 (in Chinese)
[8] 谢钦铭, 赵伟伟. 三种药物对褶皱臂尾轮虫的急性毒性[J]. 南昌大学学报: 理科版, 2007, 31(1): 100-102
Xie Q M, Zhao W W. Acute toxicity of three medicines to rotifer Brachionus plicatilis [J]. Journal of Nanchang University: Natural Science, 2007, 31(1): 100-102 (in Chinese)
[9] 吕林兰, 杨家新, 匡腾蛟, 等. 氟他胺对萼花臂尾轮虫的毒性影响[J]. 淡水渔业, 2012, 42(4): 63-65
Lv L L, Yang J X, Kuang T J, et al. Toxic effects of flutamide on Brachionus calyciflorus [J]. Freshwater Fisheries, 2012, 42(4): 63-65 (in Chinese)
[10] OECD. Guideline for Testing of Chemicals No.202 Daphnia sp.: Acute Immobilisation Test [S]. Paris: OECE, 2004
[11] Gallardo W G, Hagiwara A, Tomita Y, et al. Effect of some vertebrate and invertebrate hormones on the population growth, mictic female production, and body size of the marine rotifer Brachionus plicatilis Muller [J]. Hydrobiologia, 1997, 358(1/3): 113-120
[12] Gilbert J J. Mictic female production in rotifer Brachionus calyciflorus [J] Journal of Experimental Zoology, 1963, 153: 113-124
[13] US EPA. Methods for measuring the acute toxicity of effluents to freshwater and marine organisms. EPA/600/485/013. [R] Washington DC: US EPA, 1985
[14] 席贻龙, 黄祥飞. 食物种类和浓度对壶状臂尾轮虫实验种群动态的影响[J]. 水生生物学报, 1994, 23(3): 227-234
Xi Y L, Huang X F. Effect of food supply in both food quality and quantity on the population dynamics of Brachionus urceolaris [J] Acta Hydrobiologica Sinica, 1994, 23(3): 227-234 (in Chinese)
[15] Park H G, Lee K W, Cho S H, et al. High density culture of the freshwater rotifer, Brachionus calyciflorus [J]. Hydrobiologia, 2001, 446: 369-374
[16] Snell T W, DesRosiers N J D. Effect of progesterone on sexual reproduction of Brachionus manjavacas (Rotifera) [J]. Journal of Experimental Marine Biology and Ecology, 2008, 363(1/2): 104-109
[17] 储昭霞, 席贻龙, 徐晓平. 除草剂草甘膦对萼花臂尾轮虫生活史特征的影响[J]. 应用生态学报, 2005, 16(6): 1142-1145
Chu Z X, Xi Y L, Xu X P. Effects of glyphosate on life history characteristics of freshwater rotifer Brachionus calyciflorus [J]. Chinese Journal of Applied Ecology, 2005, 16(6): 1142-1145 (in Chinese)
[18] 黄林, 刘昌利, 韦传宝. 两种拟除虫菊酯类杀虫剂对萼花臂尾轮虫的急性毒性研究[J]. 安徽农业科学, 2011, 39(23): 14172-14174
Huang L, Liu Y L, Wei C B. Acutetoxicity of two pyrethroid pesticides to Brachionus calyciflorus [J]. Journal of Anhui Agricultural Sciences, 2011, 39(23): 14172-14174 (in Chinese)
[19] 陈艳, 王金秋, 王阳. 微囊藻毒素对褶皱臂尾轮虫的毒性效应和种群增长影响[J]. 中国环境科学, 2002, 2(3):198-201
Chen Y, Wang J Q, Wang Y. Toxicity and population growth effects of microcystin on the rotifer Brachionus plicatilis [J]. China Environmental Science, 2002, 2(3): 198-201 (in Chinese)
[20] 张才学, 郑文凯, 林玉凤. 4种重金属离子及其混合液对壶状臂尾轮虫的急性毒性试验[J]. 湛江海洋大学学报, 2005(1): 57-59
Zhang C X, Zheng W K, Lin Y F. Acute toxic test of four heavy metal ions and their mixed solution on the Brachionus urceus [J]. Journal of Zhanjiang Ocean University, 2005(1): 57-59 (in Chinese)
[21] 田芹, 周志强, 江树人, 等. 毒死蜱在环境水体中降解的研究[J]. 农业环境科学学报, 2005, 24(2): 289-293
Tian Q, Zhou Z Q, Jiang S R, et al. Degradation of chlorpyrifos in environmental water [J]. Journal of Agro-environment Science, 2005, 24(2): 289-293 (in Chinese)
[22] 余向阳, 赵于丁, 王冬兰, 等. 毒死蜱和三唑磷对斑马鱼头部AChE活性影响及在鱼体内的富集[J]. 农业环境科学学报, 2008, 27(6): 2452-2455
Yu X Y, Zhao Y D, Wang D L, et al. Impact on the activity of acetylcholinesterase (Ache) in head and bioconcentration in zebrafish (Brachydanio rerio)after chronic exposure to chlorpyrifos and triazophos [J]. Journal of Agro-environment Science, 2008, 27(6): 2452-2455 (in Chinese)
[23] Rao J V, Rani C H S, Kavitha P, et al. Toxicity of chlorpyrifos to the fish Oreoehromis mossatnbicus [J]. Bulletin of Environmental Contamination and Toxicology, 2003, 70(5): 985-992
[24] Varó I, Serrano R, Pitarch E, et al. Toxicity and bioconcentration of chlorpyrifos in aquatic organisms: Artemia parthenogenetica (Crustacea), Gambusia affinis, and Aphanius iberus (Pisces) [J]. Bulletin of Environmental Contamination and Toxicology, 2000, 65: 623-630
[25] 刘长令. 世界农药大全一杀菌剂卷[M]. 北京: 化学工业出版社,2006: 237
[26] 薛南冬, 杨仁斌. 丙硫克百威在几种土壤中的迁移和降解研究[J]. 土壤学报, 2003, 40(1): 130-135
Xue N D, Yang R B. Studies on the translocation and degradation of benfuracarb in different soils [J]. Acta Pedologica Sinica, 2003, 40(1): 130-135 (in Chinese)
[27] Vincelli P. Simulations of fungicide runoff following applications for turfgrass disease control [J]. Plant Disease, 2004, 88(4): 391-396
[28] Shu S Q. Generalily of Herbicides [M]. Beijing: Science Press, 1989: 163-166
[29] Li F Z, Zhi L F. Effects of noxious property on carps' seed, young fish fry and frog egg following butachlor treatments [J]. Pesticides, 1989, 28(2): 30- 36
[30] 国家环境保护局. 化学农药环境安全评价试验准则[J]. 农药科学与管理, 1990(4): 4-9, 3
◆
Research on Toxicity Test Method forBrachionuscalyciflorus
Xu Jiyang, Zhang Wenping, Li Shaonan*, Lang Qianping
Institute of Pesticide and Environmental Toxicology, Zhejiang University, Hangzhou 310029, China
5 May 2014 accepted 12 August 2014
To investigate the possibility of taking the populations instead of the individuals as object of indoor toxicity tests of rotifer, Brachionus calyciflorus was employed in this study to perform experiments to establish life-table and to determine population growth rates corresponding to different densities of inoculation. In addition to that, rotifer toxicity tests were performed using three types of pesticides, i.e. chlorpyrifos, butachlor and triadimefon. The experiment for life-table establishment indicated that the average lifetime and generation cycle of the rotifer were (78.76±33.08) h and (51.56±20.55) h, respectively. The experiments on inoculation density indicated that with increase in density of inoculation, growth rate of the populations decreased. Due to the information from the experiments, the toxicity tests started in density of 35 ind·(100 mL)-1and the tests lasted 144 h. Result of the toxicity tests showed that 96 h-EC50and 120 h-EC50were 0.6066 mg·L-1and 0.7323 mg·L-1, respectively, for chlorpyrifos; they were 1.851 mg·L-1and 3.058 mg·L-1, respectively, for butachlor; and the values were 12.84 mg·L-1and 11.63 mg·L-1, respectively, for triadimefon. Result of the study affirmed the possibility of taking the populations instead of the individuals as object of indoor toxicity tests of rotifers.
chlorpyrifos; butachlor; triadimefon; Brachionus calyciflorus; toxicity tests; inoculation density; test period
浙江省自然科学基金(LY12B07008)
徐吉洋(1988-),男,硕士,研究方向为水生生物生态毒理,E-mail: xujiyang2012@163.com;
*通讯作者(Corresponding author), E-mail: snli@zju.edu.cn
10.7524/AJE.1673-5897.20140505002
2014-05-05 录用日期:2014-08-12
1673-5897(2015)2-346-07
X55; Q81
A
李少南(1963—),农学博士,副教授,主要研究方向为生态毒理学,重点研究农药对非目标生物的影响及生态效应,发表学术论文60余篇。
徐吉洋, 张文萍, 李少南, 等. 萼花臂尾轮虫毒性试验的方法学研究[J]. 生态毒理学报, 2015, 10(2): 346-352
Xu J Y, Zhang W P, Li S N, et al. Research on toxicity test method for Brachionus calyciflorus [J]. Asian Journal of Ecotoxicology, 2015, 10(2): 346-352 (in Chinese)
