利用室内微宇宙系统研究三唑酮对淡水浮游动物群落的影响
2020-11-13孙健肖鹏飞刘毅华尹晓辉朱国念
孙健,肖鹏飞,刘毅华,尹晓辉,朱国念
1. 浙江农林大学,杭州 311300 2. 浙江农林大学暨阳学院,诸暨 311800 3. 中国林科院亚热带林业研究所,富阳 311400 4. 浙江大学农药与环境毒理研究所,杭州 310029
三唑酮(triadimefon)是一种甾醇合成抑制剂,因其广谱性的杀菌作用,可用于防治水稻锈病[1]。在我国,三唑酮在农田中被广泛使用。施用方式的原因导致三唑酮利用率不高,最终在环境中存在残留。根据中华人民共和国环境保护部2008年发布的《杂环类农药工业水污染物排放标准》,三唑酮原药生产企业废水处理设施总排放口的排放标准为5 000 μg·L-1。如果按照国家标准的临界值浓度排放含有三唑酮的工业废水,三唑酮有可能在环境中表现出短期高浓度暴露[2]。付岩[3]在农药使用期间检测到稻田沟渠水中三唑酮的残留浓度为12 μg·L-1,稻田附近池塘检测到三唑酮浓度达到0.4 μg·L-1。三唑酮的用途广泛,在国外,三唑酮可用于草坪防治灰斑病,Vincelli[4]模拟了高尔夫球场草地施用三唑酮后,检测周围地表水中农药的残留情况,结果表明,水中三唑酮含量峰值可高达300 μg·L-1。除了三唑酮在施用地点的环境浓度有报道外,在江河湖口也有三唑酮检出。游明华[5]在九龙江江口丰水期时检测到三唑酮含量达0.173 μg·L-1,刘娜等[6]在2014—2017年于太湖流域饮用水源地检测出三唑酮,浓度为0.002 μg·L-1。
三唑酮可以通过抑制细胞色素P-450酶系,以抑制麦角甾醇合成,使新生真菌细胞壁畸形,达到抑菌效果[7]。P-450酶系参与生物体多种内分泌生物通路,因此,三唑酮可能会对水生动物造成影响,这个影响可能是由于甾醇合成受抑制而导致生物内分泌紊乱[8],进而对脊椎动物和无脊椎动物产生致畸作用。刘少颖[9]发现在实验室条件下三唑酮浓度达到2 000 μg·L-1和4 000 μg·L-1时,斑马鱼胚胎出现畸形。三唑酮进入水体后可在非洲爪蟾体内累积,干预神经嵴细胞的迁移,致使爪蟾胚胎鳃弓畸变[10]。Kenneke等[11]的21 d慢性毒性研究表明,当三唑酮浓度>50 μg·L-1时可导致大型溞幼溞蜕皮频率降低。有研究表明,三唑酮可以推迟大型溞的蜕皮时间,并对子代眼部造成畸形[12]。三唑酮可以抑制生物发育,进而导致生物种群增长受抑制。胡芳华等[13]的研究表明,三唑酮的浓度达到160 μg·L-1时,三唑酮可以影响母溞的产溞数量,并抑制幼溞的体长。
水环境中往往含有多种农药,三唑酮可以和其他杀虫剂产生协同增效毒性作用。Cedergreen和Streibig[14]的研究表明,很多杀虫剂和杀菌剂的组合存在明显的协同增效作用,其中,大约96%属于唑类杀菌剂(包括咪唑、吡唑和三唑类)和神经毒剂杀虫剂的组合。Bjergager等[15]通过联合使用咪酰胺和高效氯氰菊酯,发现该协同增效作用在浮游动物群落水平上同样存在。淡水浮游动物在水生态系统中起着承上启下的作用,受到影响后会影响其他水生动物。
因此,研究三唑酮在水环境中的生态毒性十分必要。目前,三唑酮的研究主要是其对动物个体的影响,对动物的群落效应研究不多。本文利用标准微宇宙进行试验,评定三唑酮对淡水浮游动物种群的生态风险。
1 材料与方法(Materials and methods)
1.1 微宇宙试验系统构建
室内微宇宙系统在投药前14 d(记为-14 d)开始装配,依次加入4种淡水藻类(购自中国科学院水生生物研究所)和8种浮游动物(由浙江大学农药与生态毒理研究所提供),生物种类及数量如表1所示。微宇宙系统静置孵育4 d后投放农药,投药当日记为0 d。微宇宙系统构建工作流程图如图1所示。整个实验周期,微宇宙系统安置于大型水浴装置上(图3(a))。自-14~0 d,为微宇宙系统构建平衡期,保持温度24~26 ℃,光强度3 000 lux,光周期L∶D = 14 h∶10 h。自0 d起,每隔7 d向系统补充藻类(1×103cells·mL-1,1 mL)和浮游动物(轮虫储备液1 mL,甲壳纲生物5个成体)。

图1 微宇宙系统构建工作流程图注:(a)水生微宇宙系统;(b)大型控温水浴设备。Fig. 1 Aquatic microcosm system internal structure and establishment flowsheetNote: (a) Aquatic microcosm system; (b) thermostat water bath equipment.
1.2 受试化学品、浓度设置及其检测方式
受试化学品为三唑酮原药(纯度98.5%,由江苏剑牌股份有限公司提供)。试验设置6个浓度,依次为0 μg·L-1(ds0)、156 μg·L-1(ds1)、315 μg·L-1(ds2)、625 μg·L-1(ds3)、1 250 μg·L-1(ds4)和2 500 μg·L-1(ds5),每个暴露浓度重复3次。在投药后2 h采集所有处理组的水样,在投药后1、3、5、7、10、14、21、28和35 d采集最高浓度处理组的水样,检测三唑酮在水中的残留量。
所有水样通过有机溶剂萃取,采用气相色谱法检测其浓度,色谱条件为:Agilent 6 890气相色谱仪,HP-5色谱柱,ECD检测器,进样口温度240 ℃,检测器温度250 ℃,柱温初始温度70 ℃,进样体积1 μL,载气为高纯氮(99.999%),恒压180 kPa,梯度升温程序为柱温70 ℃保持2 min,15 ℃·min-1升至190 ℃保持1 min,5 ℃·min-1升至240 ℃。进样模式为不分流进样。在此检测条件下,三唑酮的保留时间为9.4 min(图2)。三唑酮的回收率为93.6% (SD=0.1)。

图2 三唑酮检测的气相色谱图Fig. 2 Gas chromatography of triadimefon
1.3 水质理化参数测定
水质理化指标包括酸碱度(pH)、电导率(EC)、溶解氧浓度(DO)和可溶性有机碳浓度(DOC)。酸碱度和电导率的测定均在每次生物样品采集前进行。为排除采集水样对溶解氧浓度的干扰,溶解氧浓度测定在水样采集前一日完成(即试验进行的第1、6、13、20、27和34天),测定2次,分别在光周期开始前(在8:00—9:00内完成),定义为系统中溶解氧浓度最低值(DOd);暗周期开始前(在22:00—23:00内完成),定义为系统中溶解氧浓度最高值(DOL)。计算得到每日溶氧消耗量(DOδ= DOL-DOd)。溶氧消耗量可以间接表征微宇宙系统整体的代谢情况。可溶性有机碳样品采集与生物样品采集同时进行,采集50 mL水样经过0.4 μm水性滤膜过滤,使用CN200TOC-VCPH FA有机碳测定仪检测水样中有机碳浓度。

表1 构建标准化微宇宙的浮游动物及淡水藻类种类来源Table 1 Freshwater algae source and zooplankton for standardized microcosm
1.4 生物样品采集与检测
在0 d投药前以及投药后7、14、21、28和35 d采集上覆水,采用0.5 L深水采样器(图3(c))采集上覆水样品。分3次采集水样,共采集1.5 L上覆水,混匀后保留0.5 L分样品用于浮游生物镜检。向样品中滴加2 mL鲁哥氏液(Lugol’s solution)固定染色,静置48 h后用虹吸管(管头包有孔径为25 μm绢纱)排去上清液,浓缩至20 mL左右,用10%甲醛溶液定容至30 mL。浓缩样品装入棕色塑料样品瓶,4 ℃冷藏待镜检。体视镜下采用5 mL和0.1 mL生物技术框(图3(b))镜检计数浮游动物。

图3 自制的微宇宙系统设备注:(a)大型控温水浴设备;(b)浮游生物计数板;(c)深水采样器。Fig. 3 Microcosmic test equipmentNote: (a) thermostat water bath equipment; (b) plankton counting chamber; (c) water sampler.
1.5 数据分析
使用SPSS 22.0对水质参数、浮游动物数据进行描述性统计分析。对浮游动物群落结构变化采用Canoco®5.0软件分析,分析内容包括(1)对微宇宙系统内的浮游动物组成进行主成分分析PCA[16-18],获得浮游动物在微宇宙内的第一排序轴取值(CaseRZ.);(2)对0~35 d内浮游动物丰度的变化进行主效应曲线分析PRC[19-22],并进行蒙特卡洛置换检验(Monte Carlo permutation test),随机置换599次,置信限为95%,以验证标准化微宇宙中浮游动物随时间变化的显著性。浮游动物种群的最大无作用剂量(NOECspecies)的计算方法为通过方差分析得到与对照组差异不显著的最大浓度;浮游动物群落的最大无作用剂量(NOECcommunity)的计算方法为:按照PCA分析得到2个独立的统计变量CaseR1.和CaseR2.,将三唑酮浓度和取样时间设为自变量,各处理组及不同采样日样品的CaseR1.和CaseR2.设为因变量,取每个取样样品与对照组在95%置信限水平下无显著性差异的最高浓度。
2 结果(Results)
2.1 三唑酮在水体中的浓度变化
投药后2 h水中三唑酮浓度的分析结果显示,三唑酮实际暴露浓度为名义浓度的65.3%~86.1%(表2)。最高浓度处理组的三唑酮消解动态结果如图4所示。三唑酮的消解动力学方程为cDT= 2705.5e-0.12t,cDT为时间为t时的三唑酮浓度,t为时间,R2= 0.9782,半衰期DT1/2为8.28 d。

表2 三唑酮处理组的理论和实际浓度Table 2 Nominal and actual concentrations of triadimefon treatment

图4 三唑酮在标准化微宇宙上覆水中的消解动力学曲线注:cDT为时间为t时的三唑酮浓度,t为时间。Fig. 4 Kinetics curve of triadimefon in standardized aquatic microcosm overlying waterNote: When the time is t, the concentration of triadimefon is cDT.
2.2 三唑酮对水质参数的影响
在试验周期内测定了所有微宇宙系统的光周期和暗周期的溶解氧浓度,并在根据溶氧检测数据计算微宇宙系统中暗周期溶解氧消耗量(DOc)。三唑酮处理组的DOc变化趋势与对照组一致(P>0.05,Duncan test)。各个微宇宙系统的pH值始终在7.08~7.65,保持中性。方差分析显示,各系统酸碱度在处理组和时间上没有显著性差异(P>0.05,Duncan test)。各个微宇宙系统的电导率(EC)在694~794 μS·cm-1范围内无显著性差异(P>0.05,Duncan test)。各微宇宙系统的可溶性有机碳浓度(DOC)范围在39.40~44.09 mg·L-1,方差分析显示无显著性差异(P>0.05,Duncan test)。由此判断三唑酮在(119.06 ± 11.16)~(2 078.88 ± 153.18) μg·L-1浓度下对标准微宇宙系统水质指标没有影响。
2.3 三唑酮对单物种丰度的影响
试验开始(0 d)时,各微宇宙系统间8种浮游动物数量无显著性差异,平均丰度分别为:无节幼虫(327 ± 126.4) ind·L-1、锯缘真剑水蚤(107 ± 41.4) ind·L-1、中华薄壳介(5 ± 2.9) ind·L-1、隆线溞(10 ± 7.2) ind·L-1、低额溞(7 ± 3.2) ind·L-1、平突船卵溞(10 ± 6.0) ind·L-1、盘肠溞(9 ± 5.7) ind·L-1、萼花臂尾轮虫(45 ± 32.2) ind·L-1和单趾轮虫(52 ± 25.5) ind·L-1。随着暴露时间的延长,三唑酮对枝角类生物的影响比较明显,三唑酮处理组中的枝角类生物丰度大多低于同期对照组(表3),当三唑酮浓度>104.97 μg·L-1(实际暴露浓度,下同),在7~21 d时,处理组枝角类生物丰度与对照组差异显著。

表3 三唑酮对枝角类丰度的影响Table 3 Effects of triadimefon on Cladocerans secies abundance
2.4 三唑酮对浮游动物种群的影响
对照组和各三唑酮处理组中浮游动物组成变化经PRC分析的结果如图5所示。置换检验结果表明,三唑酮处理组中浮游动物组成随时间变化达到显著水平(Pseudo-F = 12.9,P= 0.002)。图5中Resp.1反映的是不同物种对三唑酮的敏感性差异。本研究中浮游生物对三唑酮的敏感性依次为:盘肠溞>平突船卵溞>隆线溞>萼花臂尾轮虫>低额溞≥锯缘真剑水蚤≥无节幼虫≥单趾轮虫≥中华薄壳介。三唑酮处理对单趾轮虫以及介虫没有明显的作用(Resp.1接近0);锯缘真剑水蚤与其无节幼虫受到三唑酮轻微的影响;三唑酮对枝角类生物具有显著的负效应(Resp.1为1~4.8)。

图5 三唑酮对浮游动物组成结构的影响注:图例中的浓度值为三唑酮理论浓度/实际浓度。Fig. 5 Effects of triadimefon on zooplankton assemblageNote: The concentration is theoretical concentration/actual concentration in legend.
笔者研究发现,三唑酮对室内标准微宇宙试验的浮游动物群落没有出现崩溃式的影响[23]。三唑酮暴露下的浮游动物群落演替过程可分为:演替前期(表现农药直接效应)、演替后期(表现农药间接效应)和平衡期[24]。在试验初期(即0~7 d)三唑酮对枝角类生物产生明显的负效应,对桡足类生物则产生轻微的负效应。三唑酮对浮游动物群落的影响逐渐减小。试验开始14 d后,三唑酮对浮游动物群落的影响不明显。在试验21 d后除了最高浓度处理组,其余的处理组生物丰度有显著的回升。
三唑酮对整个室内微宇宙的显著效应主要在试验初期,在该时间段三唑酮对隆线溞的NOEC为537.98 μg·L-1(实际浓度,下同);对低额溞、平突船卵溞和盘肠溞的NOEC均为1 042.97 μg·L-1。其他阶段,三唑酮对其他生物的NOEC均>2 078.88 μg·L-1。经过PCA分析得到统计变量CaseR1.和CaseR2.。CaseR1.体现了轮虫物种丰度信息,CaseR2.主要体现了三唑酮对其他甲壳类浮游生物的影响。两者所代表的生物变量组成接近,对变量总体的解释能力分布为30.87%和20.02%。各物种对CaseR1.和CaseR2.排序轴的贡献度如表4所示。对CaseR1.和CaseR2.进行方差分析,结果表明,在浮游动物水平上三唑酮仅在试验早期7 d内有明显作用,其NOECcommunity为537.98 μg·L-1,对三唑酮处理组浮游动物主成分分析如图6所示。三唑酮整个试验周期NOECcommunity>2 078.88 μg·L-1(表5)

图6 三唑酮处理组中浮游动物组成结构主成分分析注:(a)和(b)象限内物种种群数量与三唑酮浓度呈正相关;(c)和(d)象限内的呈负相关。Fig. 6 Principal component analysis of triadimefon treated zooplankton communityNote: Species in (a) and (b) quadrants are positive correlation with concentration of triadimefon, and those in (c) and (d) quadrants are negative correlation.
3 讨论(Discussion)
三唑酮对微宇宙系统的直接效应主要表现在施药后的0~7 d。从PRC图分析可以看出,浮游动物对三唑酮的敏感程度排序主要是枝角类>桡足类≥轮虫类≥介形虫。其中,枝角类为最敏感的动物,这与Yin等[25]对咯菌腈暴露的室外微宇宙研究的结果类似。三唑酮对整个室内微宇宙的显著效应主要在试验初期(即0~7 d),在该时间段三唑酮对隆线溞的NOEC为537.98 μg·L-1(实际浓度,下同);对低额溞、平突船卵溞和盘肠溞的NOEC均为1 042.97 μg·L-1。其他阶段三唑酮对其他生物的NOEC均>2 078.88 μg·L-1。方差分析表明,三唑酮仅在试验早期7 d内对微宇宙系统的生物群落有明显作用,其NOECcommunity为537.98 μg·L-1,这个值与三唑酮对大型溞的NOEC值相同,表明三唑酮对微宇宙系统的NOECcommunity与系统内最敏感浮游动物的NOECspecies有关。其余时间段三唑酮对微宇宙试验系统的NOECcommunity均>2 078.88 μg·L-1。根据文献报道,在三唑酮使用期间,稻田附近沟渠水三唑酮浓度为12 μg·L-1,这个值低于本实验三唑酮暴露初期的NOECcommunity(即537.98 μg·L-1)。因此,三唑酮对浮游动物群落产生的生态效应很小。

表4 三唑酮处理组浮游动物对主成分排序轴的贡献度及相关性Table 4 Species contribution and correlation for PCA axis in triadimefon treatment
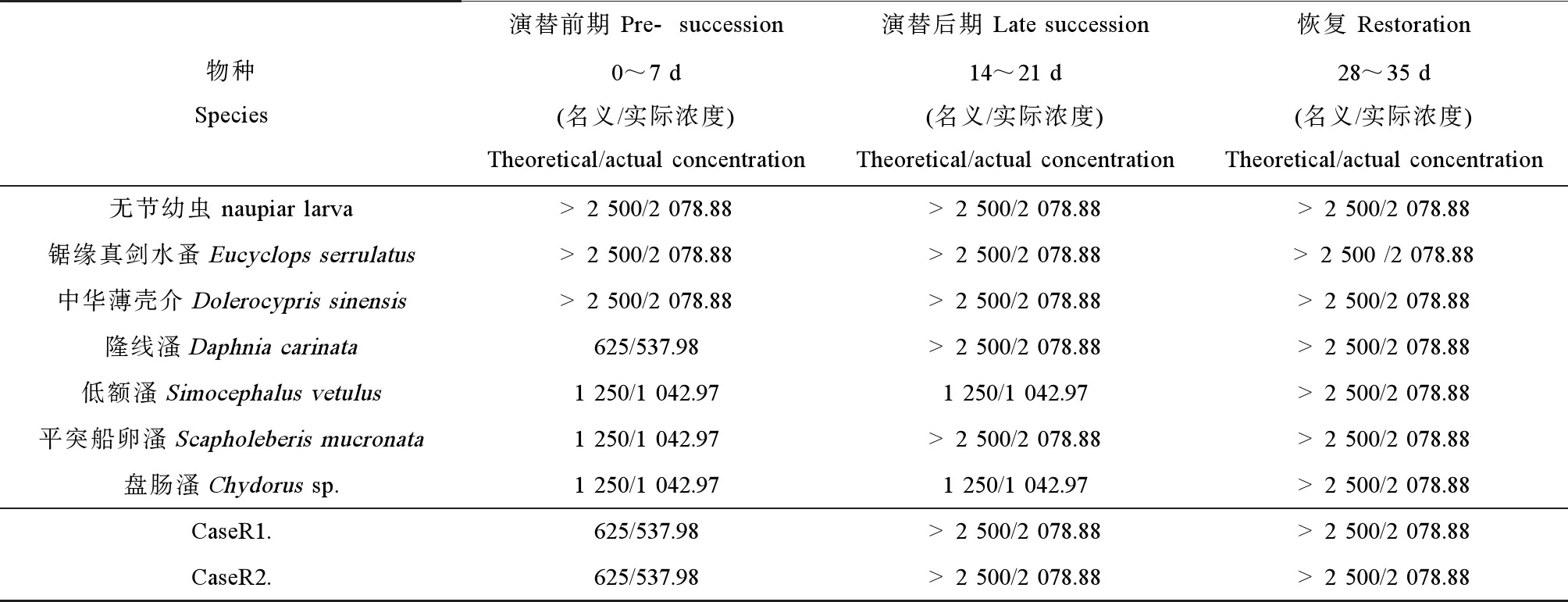
表5 三唑酮对浮游动物物种及其群落的最大无作用浓度(NOEC)Table 5 The no observed effect concentration (NOEC) of triadimefon to zooplankton species and its community (μg·L-1)
◆
