苯系物对仿刺参catalase基因表达及酶活性的影响
2015-06-05高士博王摆董颖高杉蒋经伟孙红娟殷旭旺周遵春
高士博,王摆,董颖,高杉,蒋经伟,孙红娟,殷旭旺,周遵春,*
1. 大连海洋大学,大连 116023 2. 辽宁省海洋水产科学研究院,大连 116023
苯系物对仿刺参catalase基因表达及酶活性的影响
高士博1,2,王摆2,#,董颖2,高杉2,蒋经伟2,孙红娟2,殷旭旺1,周遵春2,*
1. 大连海洋大学,大连 116023 2. 辽宁省海洋水产科学研究院,大连 116023
以仿刺参(Apostichopus japonicus)为受试生物,采用半静水式试验方法,设置3种不同浓度(1/5、1/25、1/125的96 h-LC50)的苯、甲苯、乙基苯、邻-二甲苯、间-二甲苯和对-二甲苯处理健康仿刺参,检测仿刺参过氧化氢酶(CAT)基因在呼吸树、肠组织中的表达和酶活性变化情况。结果发现:在各苯系物处理组的仿刺参呼吸树和肠组织中,cat基因的转录表达变化显著;苯、甲苯、乙基苯、邻-二甲苯对呼吸树中CAT活性具有诱导作用,其中乙基苯的诱导倍数最高,为12.0~19.8倍;6种苯系物对肠组织中CAT活性具有抑制作用,抑制程度大小顺序为:邻-二甲苯>乙基苯>对-二甲苯>甲苯>间-二甲苯>苯。表明苯系物对仿刺参呼吸树、肠具有氧化胁迫作用,可能造成2种组织的氧化损伤。相关性分析表明:苯系物处理后,仿刺参肠组织中cat mRNA相对表达倍数与CAT活性变化呈显著正相关;仿刺参肠和呼吸树中cat mRNA相对表达倍数变化呈显著正相关。以上结果为苯系物对仿刺参的生物毒性评价提供了基础数据。
苯系物(BTEX);仿刺参;氧化损伤;过氧化氢酶(CAT);呼吸树;肠
苯系物(BTEX)中的苯(Benzene)是已知的致癌物,甲苯(Toluene)和乙基苯(Ethyl benzene)具有致畸致突变作用,二甲苯(Xylene)具有致畸作用[1]。苯系物作为全球生产和使用最为广泛的50种化合物之一,由于海上石油开发、石油运输,海洋溢油及沿海石油化工企业的迅猛发展,造成苯系物入海量增加,具有较高生物毒性的苯系物引发的近岸海洋生态危害日益引起社会和学者广泛关注。苯系物是石油中水溶性单环芳烃的重要组分[2-3],据报道,巴西福塔拉萨沿岸表层海水6种苯系物的平均含量为4.86 μg·L-1[4]。浙江舟山潮间带沉积物中二甲苯含量曾经高达40.24~124.45 mg·kg-1,造成近岸海洋底栖环境苯系物污染[5]。因此,研究近岸海洋环境中苯系物对海洋底栖生物的影响十分必要。仿刺参(Apostichopus japonicus)是黄、渤海重要底栖生物类群,主要摄食底泥中细菌、底栖硅藻和有机质碎屑[6-7],作为我国重要海水增养殖品种之一,其生物学数据基本完备、并且取材方便,是海洋底栖环境污染物生物毒性评价的理想受试生物。
生物体应对污染物胁迫造成生物体内超氧自由基(·O2·-)产生速率上升和H2O2含量增加而导致的氧化胁迫或氧化损伤主要表现为抗氧化酶对活性氧的清除能力[8-9]。生物体内存在多种抗氧化酶系统,其中,过氧化氢酶(Catalase, CAT)是一种重要的抗氧化酶,能将生物体内H2O2转化为H2O和O2,通过清除过量的H2O2保护组织细胞免遭生物体病变和环境胁迫造成的氧化损伤[10-12],可作为指示污染物胁迫的重要生理生化指标[13-14]。前期研究发现苯系物导致仿刺参体内脂质过氧化损伤[15]。仿刺参的过氧化氢酶基因(cat)编码500个氨基酸,蛋白分子量56.56 kDa,属于单功能酶,在仿刺参抗氧化和免疫应答中发挥重要作用,其表达存在组织差异,在肠中表达量最高,呼吸树次之,体壁中表达量最低[16]。因此,本文选择仿刺参为受试生物,研究6种苯系物对仿刺参呼吸树、肠组织中cat基因表达及酶活性的影响,为开展苯系物对海洋底栖生物毒性评价提供基础数据。
1 材料与方法(Materials and methods)
1.1 仪器与试剂
仪器:Mx3005pTM实时荧光定量PCR仪(美国Stratagene),NanoPhotometer微量核酸蛋白分析仪(德国Implen),多功能酶标仪(瑞士Tecan),CT15RE型台式微量高速离心机(日本Hitachi)。
药品和试剂:组织RNA常温保存液(TaKaRa),Trizol试剂(TaKaRa),PrimeScriptTMRT reagent Kit (TaKaRa),SYBR PrimeScriptTMRT-PCR Kit II (TaKaRa),过氧化氢酶(CAT)测试盒(南京建成),苯、甲苯、乙基苯、邻-二甲苯、间-二甲苯、对-二甲苯和二甲基亚砜(DMSO)均为分析纯(中国国药有限公司)。
1.2 仿刺参的处理及取样
仿刺参(A. japonicus)为辽宁省海洋水产科学研究院引育种中心培育的幼参,体重(10±2) g,驯养1周后,选取健康幼参用于试验。
6种苯系物的处理浓度设置为1/5、1/25和1/125的96 h-LC50(见表1),分别对应苯(B1、B2、B3)、甲苯(T1、T2、T3)、乙基苯(E1、E2、E3)、邻-二甲苯(O1、O2、O3)、间-二甲苯(M1、M2、M3)、对-二甲苯(P1、P2、P3)处理组,同时设置空白对照组(C),各处理组设置3个平行。配置1 000倍母液,在玻璃缸中配制15 L实验溶液,每个缸中加5~6只幼参,试验条件:水温15 ℃,盐度30,pH 8.0,间断性充氧,确保溶解氧大于4.5 mg·L-1,避光。根据预实验结果,取各处理组12 h的仿刺参3只,于冰上取仿刺参呼吸树、肠组织样品,RNA样品放于RNA保存液(TaKaRa),4 ℃过夜,-20 ℃保存备用,蛋白样品放于0.1 mol·L-1PBS缓冲液,-20 ℃保存备用。
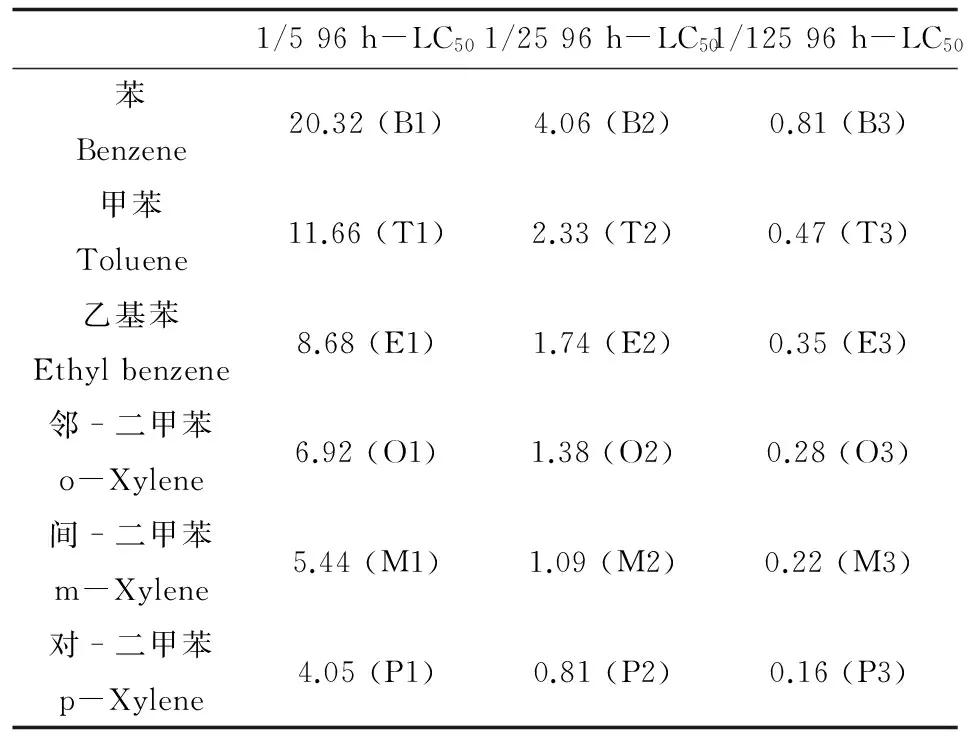
表1 6种苯系物浓度设置(mg·L-1)Table 1 Concentration gradients of six BTEXs experimental treatments (mg·L-1)
Trizol法分别提取仿刺参呼吸树、肠组织的总RNA,电泳检测RNA的完整性,微量核酸蛋白分析仪检测RNA的纯度和浓度。
1.3 实时定量PCR
仿刺参呼吸树、肠组织中cat mRNA实时定量PCR参照高杉等实验方法[16-17]。分别取各处理组和空白对照组呼吸树、肠组织900 ng总RNA用PrimeScriptTMRT reagent Kit (TaKaRa)进行反转录。使用Mx3005pTM实时荧光定量PCR仪,采用SYBR PrimeScriptTMRT-PCR Kit II进行实时定量PCR。
cat基因的引物序列:
cat-F:5’-GTGAAGTTCTACACAGAGGATGGCA-3’;
cat-R:5’-CTTCT GGGTGTGGATGAAACTGG-3’。
内参基因Cytb的引物序列:
Cytb-F:5’-TGAGCCGCAAC AGTAATC-3’;
Cytb-R:5’-AAGGGAAAAGGAAGTGAAAG-3’。
反应条件:95 ℃,30 s;95 ℃,10 s,55 ℃,25 s,72 ℃,25 s,40个循环。采用384 v.2 (REST) 软件计算仿刺参呼吸树、肠组织中cat mRNA相对表达倍数[17]。
1.4 仿刺参呼吸树、肠CAT活性测定
仿刺参呼吸树、肠组织CAT活性测定采用南京建成生物研究所的CAT测试盒测定。
CAT (U·mg-1prot)活性定义为:每毫克组织蛋白酶分解1 μmol的H2O2的量为一个活性单位(U)。
1.5 数据统计分析
采用SPSS 17.0 软件,在P=0.05的置信水平对cat mRNA相对表达倍数变化和CAT活性变化情况进行ANOVA分析,并用Origin 7.5软件作图(在以下柱形图中,*,**分别表示:与对照相比,P<0.05,P<0.01)。SPSS 17.0 软件对仿刺参呼吸树、肠组织中cat mRNA相对表达倍数变化与CAT活性进行相关性分析(表中*表示相关性显著,P<0.05)。

图1 苯系物对仿刺参呼吸树cat mRNA相对表达倍数变化的影响Fig. 1 The effects of BTEXs on the relative fold changes of cat mRNA in A. japonicus respiratory tree
2 结果(Results)
2.1 苯系物对仿刺参呼吸树cat mRNA相对表达倍数变化及CAT活性的影响
6种苯系物对仿刺参呼吸树cat mRNA相对表达倍数变化的影响见图1。各浓度苯系物处理组的呼吸树cat mRNA表达倍数变化显著。苯、对-二甲苯处理组的呼吸树cat mRNA表达显著下调,呈显著剂量-效应关系,其中,高浓度苯处理组的下调倍数为35.7倍;而甲苯、乙基苯、邻-二甲苯、间-二甲苯与呼吸树cat mRNA表达倍数变化呈现非单调性剂量—效应关系。其中,高浓度邻-二甲苯处理组的呼吸树cat mRNA表达显著上调,上调倍数为1.3倍,中、低浓度的极显著下调,下调倍数分别为6.5、29.4倍;与之相反,高浓度甲苯、乙基苯、间-二甲苯处理组的呼吸树cat mRNA表达显著下调,下调倍数分别为1.1、1.7、4.1倍,中、低浓度处理组的极显著上调,中浓度甲苯处理组的上调倍数为6.2倍。
6种苯系物对仿刺参呼吸树CAT活性的影响结果见图2。与对照相比,苯系物对仿刺参呼吸树CAT活性主要表现为诱导作用。各浓度苯、甲苯和乙基苯处理组呼吸树CAT活性显著上升,随着处理浓度升高,CAT活性增强,呈显著剂量-效应关系,其中乙基苯的诱导倍数最高,为12.0~19.8倍。
2.2 苯系物对仿刺参肠cat mRNA相对表达倍数变化及CAT活性的影响
6种苯系物对仿刺参肠cat mRNA相对表达倍数变化的影响结果见图3。各浓度苯系物处理组的肠cat mRNA表达倍数变化显著,均表现为非单调性的剂量-效应关系。高浓度苯和对-二甲苯处理组的肠cat mRNA表达极显著上调,上调倍数分别为9.8倍和11.4倍,中、低浓度苯和对-二甲苯处理组肠cat mRNA表达极显著下调;各浓度甲苯处理组肠catmRNA表达极显著上调,上调倍数在1.9~18.8倍之间;高、中浓度乙基苯处理组肠cat mRNA表达显著下调,低浓度乙基苯处理组的极显著上调,上调倍数为31.3倍;各浓度邻-二甲苯处理组肠cat mRNA表达极显著下调,下调倍数在6.4~52.6倍之间;高浓度间-二甲苯处理组肠cat mRNA表达极显著下调,下调倍数为1.7倍,中浓度处理组的极显著上调,上调倍数为2.0倍。
6种苯系物对仿刺参肠CAT活性的影响结果见图4。苯系物对仿刺参肠CAT活性具有抑制作用。与对照组相比,高浓度乙基苯处理组肠CAT活性下降了75.21%;各浓度邻-二甲苯和对-二甲苯处理组肠CAT活性显著下降,邻-二甲苯对肠CAT活性抑制率为48.75%~70.17%;对-二甲苯对肠CAT活性抑制率为35.31%~67.11%。6种苯系物对肠CAT活性抑制程度顺序为:邻-二甲苯>乙基苯>对-二甲苯>甲苯>间-二甲苯>苯。

图2 苯系物对仿刺参呼吸树CAT活性的影响Fig. 2 The effects of BTEXs on the CAT activities of A. japonicus respiratory tree
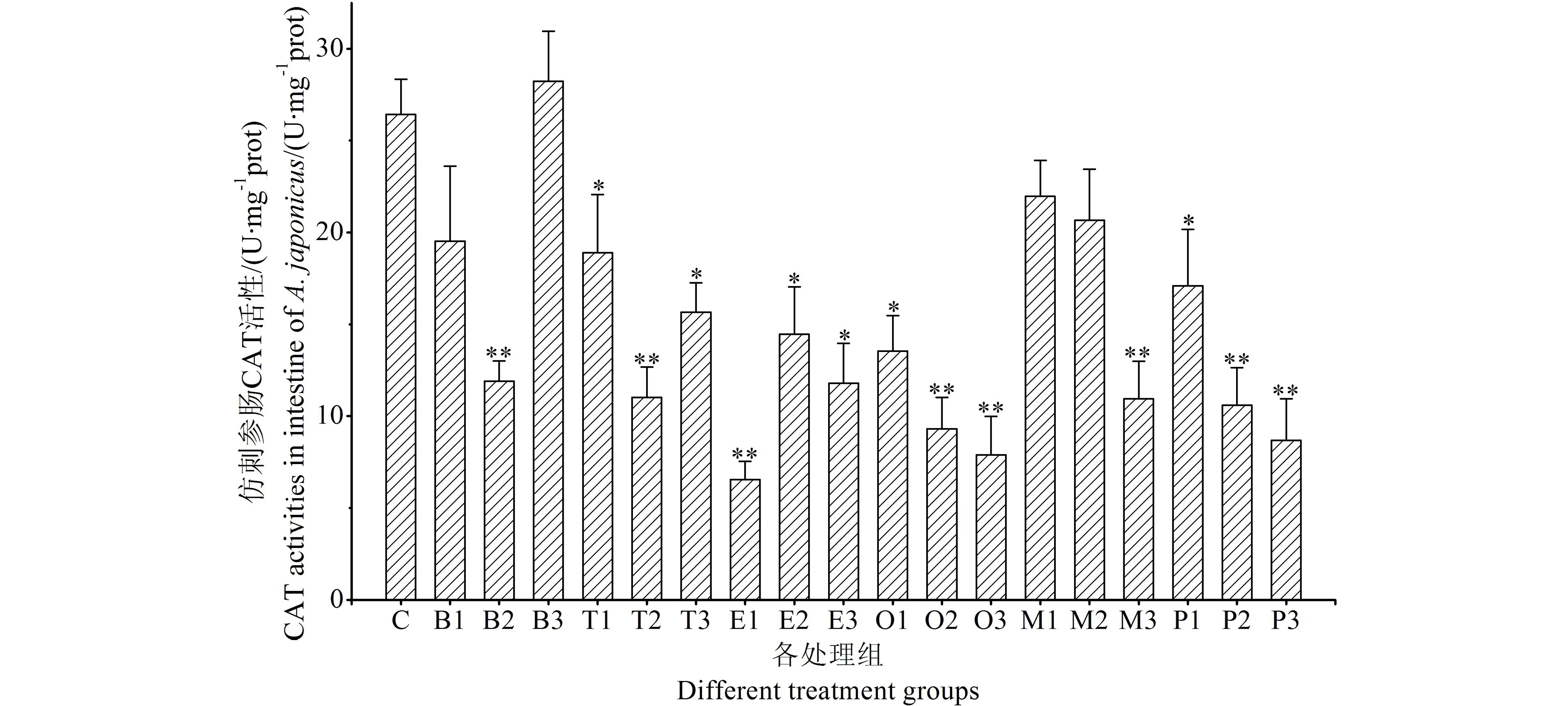
图4 苯系物对仿刺参肠CAT活性的影响Fig. 4 The effects of BTEXs on the CAT activities of A. japonicus intestine
2.3 仿刺参肠、呼吸树cat mRNA相对表达倍数变化与CAT活性相关性分析
6种苯系物处理后,仿刺参肠、呼吸树cat mRNA相对表达倍数变化与CAT活性的相关性见表2。苯系物处理后,仿刺参肠组织中cat mRNA相对表达倍数变化与CAT活性变化呈显著正相关;仿刺参肠和呼吸树中cat mRNA相对表达倍数变化呈显著正相关;而呼吸树中cat mRNA相对表达倍数变化与CAT活性变化,肠组织中cat mRNA相对表达倍数变化与呼吸树CAT活性变化之间均无显著相关性。
3 讨论(Discussion)
污染物胁迫可促使机体细胞的酶系统和非酶系统反应,通过还原产生活性氧和氧自由基,造成生物体内活性氧含量增加,打破生物体内活性氧代谢平衡,如不及时清除会导致氧化损伤[18]。生物体内存在2种活性氧清除机制,即酶清除系统和非酶清除系统[8]。CAT是酶清除系统的重要组分,能将细胞内H2O2催化分解为H2O和O2,避免细胞、组织遭受氧化损伤。目前,污染物对生物CAT活性及其基因表达的影响研究主要集中于重金属、持久性有机污染物[8-9, 19-21],而有关苯系物对海洋生物CAT活性及其基因表达的影响尚未见报道。本研究中,经过6种苯系物处理后,仿刺参呼吸树、肠组织中cat mRNA相对表达倍数变化呈不同程度的上调或下调;与对照组相比,6种苯系物对呼吸树CAT活性主要表现为诱导作用,对肠CAT活性表现为抑制作用,表明苯系物造成仿刺参呼吸树和肠组织的氧化胁迫。这与前期相关研究结论相似,6种苯系物处理导致仿刺参体腔液中丙二醛含量显著变化,引起仿刺参体内脂质过氧化损伤[15]。陈芸燕等[22〗研究发现,2.30 mg·L-1亚硝酸氮可以诱导仿刺参体壁CAT活性增加,11.50和57.50 mg·L-1亚硝酸氮显著抑制体壁CAT活性,表现为非单调性剂量-效应关系。氨氮胁迫可导致仿刺参氧化损伤,降低其免疫力,增加细菌的易感性[23]。本文实验结果表明,6种苯系物处理造成仿刺参体内呼吸树、肠2种组织的氧化胁迫和氧化损伤。

表2 仿刺参肠、呼吸树cat mRNA相对表达倍数变化与CAT活性的相关性Table 2 Correlation between relative fold changes of cat mRNA and CAT activity in A. japonicus respiratory tree and intestine
在仿刺参不同组织中,cat基因在肠组织中表达量最高,呼吸树次之[16]。而呼吸树CAT活性却高于肠的[24]。苯系物处理后,肠中cat mRNA相对表达倍数变化程度略大于呼吸树中的,苯系物对呼吸树CAT活性影响表现为诱导作用,对肠CAT活性影响表现为抑制作用。仿刺参肠管壁由粘膜层、粘膜下层、肌层和外膜组成,富含蛋白酶、脂酶、非特异性脂酶和碱性磷酸酶[25],主要消化摄食的底泥、硅藻、微生物和有机碎屑;呼吸树由泄殖腔壁分出的两支树枝状分管,由体腔上皮、肌肉血腔和内皮层组成,通过泄殖腔泵水、排水进行体内外的气体交换[26-27]。苯系物对仿刺参cat mRNA相对表达量和CAT活性影响的组织差异可能与苯系物进入仿刺参暴露途径以及呼吸树、肠的生物学结构和功能有关。
苯系物处理后,仿刺参呼吸树cat mRNA相对表达倍数变化和CAT活性呈现不同的变化趋势;肠的cat mRNA相对表达倍数变化和CAT活性呈相似的变化趋势。CAT的抗氧化能力是在其基因转录成mRNA,再表达合成蛋白质,并形成一定的空间结构后才能发挥作用[8]。Gonçalves-Soares等[28]研究发现,100 μg·kg-1微囊藻(Microcystis aeruginosa)毒素导致凡纳滨对虾(Litopenaeus vannamei)CAT活性显著上升,为空白对照组的1.5倍,而cat基因表达却显著下调,为对空白照组的0.26倍。Li等[29]研究发现3~24 mg·kg-1呋喃西林暴露,导致海洋纤毛虫—扇形游仆虫(Euplotes vannus) 的CAT活性与cat基因转录水平呈现不同动态变化趋势。污染物胁迫后cat转录水平和蛋白水平不同变化趋势,可能与污染物胁迫导致cat基因翻译后蛋白的氧化修饰有关,氧化的CAT蛋白可能是特异的过氧化物氧化蛋白酶的攻击目标[30]。通过比较发现仿刺参2种组织cat基因转录水平对苯系物处理的响应比CAT活性水平的更为敏感。这与Li等[29]研究结论相似,呋喃西林胁迫后,扇形游仆虫cat基因转录水平比CAT活性水平更敏感。Trasvia-Arenas等[31]研究发现,缺氧胁迫和再充氧条件下凡纳滨对虾鳃组织中cat基因转录水平比CAT活性变化更为敏感。
不同苯系物处理后,仿刺参呼吸树和肠组织中cat mRNA相对表达倍数和CAT活性变化,表现为不同类型的剂量-效应关系,即单调的正相关性或负相关性,及非单调的相关性。瞿建宏等[21]研究发现罗非鱼肝脏组织CAT活性与苯酚暴露浓度之间存在剂量-效应正相关性,而肌肉组织CAT活性与苯酚之间表现为非单调的剂量-效应关系。陈芸燕等[22]研究报道亚硝酸氮暴露与仿刺参体壁CAT活性表现为非单调性剂量-效应关系。Li等[29]研究发现呋喃西林暴露与扇形游仆虫的CAT活性呈非单调性剂量效应关系,而与cat mRNA相对表达量呈剂量效应正相关性。有关污染物胁迫后,海洋无脊椎动物cat基因转录和CAT活性动态变化趋势的分子机制尚有待于深入研究和探讨。
苯、甲苯、乙基苯和二甲苯属于非极性麻醉型化合物,其毒性可以用辛醇—水分配系数(log Kow)确定[32-34]。苯系物对仿刺参急性致死作用表现为二甲苯>乙基苯>甲苯>苯,与苯系物log Kow值呈显著的相关性。前期研究发现,6种苯系物对球等鞭金藻(Isochrysis galbana)和新月菱形藻(Nitzschia closterium)生长抑制作用与其log Kow值有较好的相关性[35]。范亚维等[33]和周启星等[34]研究发现,甲苯、乙基苯和二甲苯对斑马鱼(Brachydanio rerio)、大型溞(Daphnia magna)和霍甫水丝蚓(Limnodrilus hoffmeisteri)急性致死作用与3种苯系物log Kow值呈显著的相关性。而6种苯系物log Kow值与仿刺参2种组织cat基因转录、CAT活性之间不存在显著的相关性。在亚致死浓度下,苯系物对仿刺参的氧化胁迫作用可能是导致仿刺参死亡的因素之一。
[1] 李学峰, 周启星. BTEX的环境质量标准研究进展[J]. 生态学杂志, 2011, 30(2): 369-375
Li X F, Zhou Q X. Environmental quality standard of BTEX: A review [J]. Chinese Journal of Ecology, 2011, 30(2): 369-375 (in Chinese)
[2] Mazzeo D E C, Fernandes T C C, Marin-Morales M A. Cellular damages in the Allium cepa test system, caused by BTEX mixture prior and after biodegradation process [J]. Chemosphere, 2011, 85(1): 13-18
[3] 白红妍, 韩彬, 陈军辉, 等. 静态顶空气相色谱-质谱联用法快速测定海水中13种苯系物[J]. 色谱, 2012, 30(5): 474-479
Bai H Y, Han B, Chen J H, et al. Rapid determination of benzene series in seawater by gas chromatography- mass spectrometry with static headspace extraction [J]. Chinese Journal of Chromatography, 2012, 30(5): 474-479 (in Chinese)
[4] Cavalcante R M, de Andrade M V F, Marins R V, et al. Development of a headspace-gas chromatography (HS-GC-PID-FID) method for the determination of VOCs in environmental aqueous matrices: Optimization, verification and elimination of matrix effect and VOC distribution on the Fortaleza Coast, Brazil [J]. Microchemical Journal, 2010, 96(2): 337-343
[5] 朱四喜, 周唯, 杨红丽, 等. 浙江舟山潮间带沉积物中二甲苯的检测[J]. 广东化工, 2010, 37(2): 125-127
Zhu S X, Zhou W, Yang L H, et al. Determination of xylene in interdial sediments in Zhoushan, Zhejiang Province [J]. Guangdong Chemical Industry, 2010, 37(2): 125-127 (in Chinese)
[6] 张宝琳, 孙道元, 吴耀泉. 灵山岛浅海岩礁区刺参(Apostichopus japonicus)食性初步分析[J]. 海洋科学, 1995, 3: 11-13
Zhang B L, Sun D Y, Wu Y Q, et al. Preliminary analysis on the feeding habit of Apostichopus japonicus in the Rocky Coast Water off Lingshan Island [J]. Marine Science, 1995, 3: 11-13 (in Chinese)
[7] 刘晓威, 姜森颢, 周一兵, 等. 大连地区仿刺参养殖池塘底栖硅藻生产状况的周年变化研究[J]. 水产科学, 2013, 31(11): 679-682
Liu X W, Jiang S H, Zhou Y B, et al. Annual changes in production of benthic diatoms in sea cucumber Apostichopus japonicus culture ponds in Dalian [J]. Fiheries Science, 2013, 31(11): 679-682 (in Chinese)
[8] 赵士诚, 孙静文, 马有志, 等. 镉对玉米幼苗活性氧代谢, 超氧化物歧化酶和过氧化氢酶活性及其基因表达的影响[J]. 中国农业科学, 2008, 41(10): 3025-3032
Zhao S C, Sun J W, Ma Y Z, et al. Effects of cadmium on reactive oxygen species metabolism, activities and gene expressions of superoxide dismutase and catalase in maize (Zea Mays) seedling [J]. Scientia Agricultura Sinica, 2008, 41(10): 3025-3032 (in Chinese)
[9] 罗立新, 孙铁珩, 靳月华. 镉胁迫下小麦叶中超氧阴离子自由基的积累[J]. 环境科学学报, 1998, 18(5): 495-499
Luo L X, Sun T H, Jin Y H. Accumulation of superoxide radical in wheat leaves under cadmium stress [J]. Acta Scientiae Circumstantiae, 1998, 18(5): 495-499 (in Chinese)
[10] Ho Y S, Xiong Y, Ma W, et al. Mice lacking catalase develop normally but show difntial sensitivity to oxidant tissue injury [J]. The Journal of Biological Chemistry, 2004, 279: 32804-32812
[11] Bai J, Rodriguez A M, Melendez J A, et al. Overexpression of catalase in cytosolic or mitochondrial compartment protects HepG2 cells against oxidative injury [J]. Journal of Biological Chemistry, 1999, 274(37): 26217-26224
[12] Bai J, Cederbaum A I. Catalase protects HepG2 cells from apoptosis induced by DNA-damaging agents by accelerating the degradation of p53 [J]. Journal of Biological Chemistry, 2003, 278(7): 4660-4667
[13] Roma L P, Bosqueiro J R, Cunha D A, et al. Protection of insulin-producing cells against toxicity of dexamethasone by catalase overexpression [J]. Free Radical Biology and Medicine, 2009, 47(10): 1386-1393
[14] Chi Z, Liu R, Zhang H. Potential enzyme toxicity of oxytetracycline to catalase [J]. Science of the Total Environment, 2010, 408(22): 5399-5404
[15] 姜北, 刘薇, 周遵春, 等. 苯系物对仿刺参体内脂质过氧化程度的影响[J]. 水产科学, 2014, 33(1): 15-21
Jiang B, Liu W, Zhou Z Z, et al. Effects of benzene, toluene, ethyl benzene, and xylene (BTEX) on lipid peroxidation in sea cucumber Apostichopus japonicus [J]. Fiheries Science, 2014, 33(1): 15-21 (in Chinese)
[16] 高杉, 周遵春, 董颖, 等. 仿刺参过氧化氢酶基因全长 cDNA 的克隆及表达分析[J]. 中国农业科技导报, 2014, 16(2): 127-134
Gao S, Zhou Z Z, Dong Y, et al. Full-length cDNA cloning and expression analysis of catalase gene from sea cucumber (Apostichopus japonicus) [J]. Journal of Agricultural Science and Technology, 2014, 16(2): 127-134 (in Chinese)
[17] Sun H, Zhou Z, Dong Y, et al. Identification and expression analysis of two Toll-like receptor genes from sea cucumber (Apostichopus japonicus) [J]. Fish & Shellfish Immunology, 2013, 34(1): 147-158
[18] Winston G W, Di Giulio R T. Prooxidant and antioxidant mechanisms in aquatic organisms [J]. Aquatic Toxicology, 1991, 19(2): 137-161
[19] 赵元凤, 吕景才. 镉污染对鲢鱼超氧化物歧化酶和过氧化氢酶活性的影响[J]. 农业生物技术学报, 2002, 10(3): 267-271
Zhao Y F, Lv J C. Effect of cadmium on activities of superoxide dismutase and catalase in Aristchthys nobilis [J]. Journal of Agricultural Biotechnology, 2002, 10(3): 267-271 (in Chinese)
[20] Romero-Puertas M C, Corpas F J, Rodríguez-Serrano M, et al. Differential expression and regulation of antioxidative enzymes by cadmium in pea plants [J]. Journal of Plant Physiology, 2007, 164(10): 1346-1357
[21] 瞿建宏, 陈家长, 胡庚东, 等. 苯酚胁迫下罗非鱼组织中过氧化氢酶与谷胱甘肽-S-转移酶的动态变化[J]. 生态环境, 2006, 15(4): 687-692
Qu J H, Chen J C, Hu G Q, et al. Dynamic changes of catalase and glutathione-S-transferase in the different tissues of tilapia exposed to phenol [J]. Ecology and Environment, 2006, 15(4): 687-692 (in Chinese)
[22] 陈芸燕, 田相利, 于晓, 等. 亚硝酸氮胁迫对刺参体壁非特异性免疫能力及 HSP70 表达的影响[J]. 中国海洋大学学报: 自然科学版, 2013, 43(11): 35-42
Chen Y Y, Tian X L, Yu X, et al. Effect of nitrite stress on non-specific immune response and HSP70 expression of sea cucumber Apostichopus japonicus [J]. Periodical of Ocean University of China, 2013, 43(11): 35-42 (in Chinese)
[23] 刘洪展, 郑风荣, 孙修勤, 等. 氨氮胁迫对刺参几种免疫酶活性的影响[J]. 海洋科学, 2012, 36(8): 47-52
Liu H Z, Zhen F R, Sun X Q, et al. Effect of exposure to ammonia nitrogen stress on immune enzyme of holothurian Apostichopus japonicus [J]. Marine Science, 2012, 36(8): 47-52 (in Chinese)
[24] Zang Y, Tian X, Dong S, et al. Growth, metabolism and immune responses to evisceration and the regeneration of viscera in sea cucumber, Apostichopus japonicus [J]. Aquaculture, 2012, 358: 50-60
[25] 崔龙波, 董志宁. 仿刺参消化系统的组织学和组织化学研究[J]. 动物学杂志, 2000, 35(6): 2-4
Cui L B, Dong Z N. Histological and histochemical studies on the digestive system of Apostichopus japonicus [J]. Chinese Journal of Zoology, 2000, 35(6): 2-4 (in Chinese)
[26] 刘晓云, 包振民, 范瑞青, 等. 刺参呼吸树的超微结构观察与研究[J]. 海洋科学, 2005, 29(12): 25-30
Liu X Y, Bao Z M, Fan R Q, et al. Ultrastructural observation and study on the respiratory trees of Apostichopus japonicus [J]. Marine Science, 2005, 29(12): 25-30 (in Chinese)
[27] 王吉桥, 田相利. 刺参养殖生物学新进展[M]. 北京: 海洋出版社, 2012: 22, 225-236
[28] Gonçalves-Soares D, Zanette J, Yunes J S, et al. Expression and activity of glutathione-S-transferases and catalase in the shrimp Litopenaeus vannamei inoculated with a toxic Microcystis aeruginosa strain [J]. Marine Environmental Research, 2012, 75: 54-61
[29] Li J, Zhou L, Lin X, et al. Characterizing dose-responses of catalase to nitrofurazone exposure in model ciliated protozoan Euplotes vannus for ecotoxicity assessment: Enzyme activity and mRNA expression [J]. Ecotoxicology and Environmental Safety, 2014, 100: 294-302
[30] Romero-Puertas M C, Palma J M, Gómez M, et al. Cadmium causes the oxidative modification of proteins in pea plants [J]. Plant, Cell & Environment, 2002, 25(5): 677-686
[32] Schultz T W, Sinks G D, Bearden A P. QSAR in Aquatic Toxicology: A Mechanism of Action Approach Comparing Toxic Potency to Pimephales promelas, Tetrahymena pyriformis, and Vibrio fischeri [M]. Taylor & Francis, 1998: 51-109
[33] 范亚维, 周启星, 王媛媛, 等. 水体BTEX 污染对大型溞和霍普水丝蚓的毒性效应及水环境安全评价[J]. 环境科学学报, 2009, 29(7): 1485-1490
Fan Y W, Zhou Q X, Wang Y Y, et al. Toxic effects of BTEX in water on Daphnia magna and Limnodrilus hoffmeisteri and safety assessment of the aquatic environment [J]. Acta Scientiae Circumstantiae, 2009, 29(7): 1485-1490 (in Chinese)
[34] 范亚维, 周启星. 水体甲苯、乙苯和二甲苯对斑马鱼的毒性效应[J]. 生态毒理学报, 2009, 4(1): 136-141
Fan Y W, Zhou Q X. Toxic effects of toluene, ethylbenzene and xylene in waters on zebrafish Brachydanio rerio [J]. Asian Journal of Ecotoxicology, 2009, 4(1): 136-141 (in Chinese)
[35] 王摆, 高士博, 董颖. 6 种苯系物对球等鞭金藻和新月菱形藻的生长抑制[J]. 生态毒理学报, 2014, 9(2): 233-238
Wang B, Gao S B, Dong Y, et al. Inhibitory effect of six kinds of BTEXs on growth of the chrysophyceae Isochrysis galbana and the diatom Nitzschia closterium [J]. Asian Journal of Ecotoxicology, 2014, 9(2): 233-238 (in Chinese)
◆
The Effects of BTEXs on thecatalaseGene Expression and Catalase Activities in Respiratory Tree and Intestine of Sea CucumberApostichopusjaponicus
Gao Shibo1,2, Wang Bai2,#, Dong Ying2, Gao Shan2, Jiang Jingwei2, Sun Hongjuan2, Yin Xuwang1, Zhou Zunchun2,*
1. Dalian Ocean University, Dalian 116023, China 2. Liaoning Ocean and Fisheries Science Research Institute, Dalian 116023, China
5 September 2014 accepted 2 December 2014
The present study is aimed to evaluate the effects of BTEXs on the activities of catalase (CAT) and relative fold changes of cat gene in respiratory tree and intestine of sea cucumber Apostichopus japonicus. Three different concentrations (1/5, 1/25, 1/125 of 96-LC50) of benzene, toluene, ethyl benzene, o-, m-, p-xylene were selected to treat the healthy sea cucumber individuals using semi-static water experimental method. The results showed that the fold changes of cat gene in respiratory tree and intestine were remarkably changed in different BTEXs treatment groups. The activities of CAT in respiratory tree were induced in benzene, toluene, ethyl benzene and o-xylene treatment groups, and the highest relative folds (12.0~19.8 fold) were found in ethyl benzene treatment group. The activities of CAT in intestine were inhibited in BTEXs treatment groups, and the activities in descending order were o-xylene, ethyl benzene, p-xylene, toluene, m-xylene and benzene treatment groups. This suggested that BTEXs have oxidative stress on the respiratory tree and intestine of A. japonicus, and might have oxidative damage on the two tissues. Correlation analysis showed that CAT activities was remarkably positive correlated with the relative fold changes of cat gene in intestine, which was also remarkably positive correlated with that of respiratory tree. These results will provide the basic data for toxic assessment of BTEXs on the sea cucumber A. japonicus.
BTEX; Apostichopus japonicus; oxidative damage; CAT; respiratory tree; intestine
海洋公益性行业科研经费专项项目(201205012-7);大连市科学技术基金(2012J21DW029);辽宁省海洋与渔业厅项目(201301)
高士博(1987-),男,硕士,研究方向为海洋生态毒理学,E-mail: 392083670@qq.com;
*通讯作者(Corresponding author), E-mail: zunchunz@hotmail.com
10.7524/AJE.1673-5897.20140905001
2014-09-05 录用日期:2014-12-02
1673-5897(2015)2-297-09
Q89; X55
A
周遵春(1967-),男,海洋生物学博士,研究员,主要研究方向海洋生物学,发表学术论文80余篇。
王摆(1981-),男,海洋生物学博士,副研究员,主要研究方向为海洋生态毒理学,发表学术论文20余篇。
# 共同通讯作者(Co-corresponding author),E-mail: wangbai1980@hotmail.com
高士博, 王摆, 董颖, 等. 苯系物对仿刺参catalase基因表达及酶活性的影响[J]. 生态毒理学报, 2015, 10(2): 297-305
Gao S B, Wang B, Dong Y, et al. The effects of BTEXs on the catalase gene expression and catalase activities in respiratory tree and intestine of sea cucumber Apostichopus japonicus [J]. Asian Journal of Ecotoxicology, 2015, 10(2): 297-305(in Chinese)
