环境激素甲草胺对摇蚊谷胱甘肽硫转移酶的抑制作用
2015-06-05李修伟校新蕾梁亚萍张春萍张淑兰谷祖敏祁之秋
李修伟,校新蕾,梁亚萍,张春萍,张淑兰,谷祖敏,祁之秋
沈阳农业大学植物保护学院,沈阳 110866
环境激素甲草胺对摇蚊谷胱甘肽硫转移酶的抑制作用
李修伟*,校新蕾,梁亚萍,张春萍,张淑兰,谷祖敏#,祁之秋
沈阳农业大学植物保护学院,沈阳 110866
谷胱甘肽硫转移酶(GST)是生物体内重要的解毒酶。为研究环境激素甲草胺对溪流摇蚊GST的抑制作用及机理,采用酶标仪微量法测定甲草胺对溪流摇蚊4龄幼虫GST的抑制活性及抑制类型。结果表明甲草胺在72 h活体染毒和离体状态下均能显著抑制溪流摇蚊GST的活性,且抑制程度随着药物浓度的增大而增大。甲草胺抑制GST活性的反应为可逆性抑制。进一步的酶动力学分析揭示甲草胺对GST的特异底物1-氯-2,4-二硝基苯(CDNB)和还原型谷胱甘肽(GSH)均表现为竞争性抑制,即甲草胺仅影响米氏常数(Km),不改变酶促反应的最大反应速度(Vmax)。以上结果表明农药残留污染物甲草胺在胁迫下对摇蚊幼虫GST酶活性会受到显著影响,甲草胺对GST的抑制机制为可逆性和竞争性抑制。
甲草胺;溪流摇蚊;谷胱甘肽硫转移酶;抑制机制
摇蚊是世界性分布的水生昆虫,几乎遍及所有的淡水生境,其分类上归属昆虫纲,双翅目,长角亚目,摇蚊科[1]。摇蚊幼虫种类繁多,生物量约占底栖生物总量的70%~80%,是多种经济鱼类的优良天然饵料,在生态系统中占据重要环节[2-3]。科研上常将摇蚊幼虫作为水体环境污染生物监测的重要指示生物[4-12]。
甲草胺是酰胺类选择性芽前除草剂,由美国孟山都公司开发并于1969年商品化。主要用于一年生禾本科杂草及阔叶杂草的防除。其作用机制是通过内吸进入植物体内抑制蛋白酶的活性,使蛋白质无法合成,进而抑制细胞分裂,最终造成植物芽和根生长停止,无法形成不定根[13]。甲草胺是国际上应用最广泛的除草剂之一,在美国,其2001年的年用量高达3 500 t左右[14]。我国20世纪70年代在黑龙江率先引进甲草胺,一度占据市场绝对优势份额。然而随着乙草胺的国产化以及药效、成本等因素影响,目前甲草胺已不再占据优势份额,仅在相应的应用范围和地域拥有一定的市场[15]。截至2014年12月,在农业部农药检定所登记的甲草胺原药产品有12种,单剂及复配制剂32种。每年的产量在1 000 t以上,仅占除草剂市场份额的3‰,主要用于防治春、夏大豆田、花生田、棉花田和玉米田等的杂草[16]。甲草胺在地表水和地下水及水体沉积物中均能不同程度的检测到[17],其在水体中的残留量最高可达3 000 μg·L-1[18];其中在水体沉积物中的残留量可达183 μg·L-1。甲草胺在地表水中的半衰期约为30 d,在地下水的半衰期为808~1 508 d,在有氧土壤和缺氧土壤中的半衰期分别为20 d和5 d[15]。甲草胺是典型的环境激素类农药,具有致畸及内分泌干扰活性,已被日本国立研究所列入具有内分泌干扰作用的黑名单[19],美国规定其在饮用水的最低浓度值(MCL)为2 μg·L-1[20]。
谷胱甘肽硫转移酶(GST)为生物体内重要的代谢酶系,通过谷胱甘肽的轭合作用参与生物体对外源物质的初级代谢和次级代谢。GST功能主要表现在以下3个方面:一是对异源有毒物质进行解毒代谢:GST可催化致癌剂、突变剂、农药、药物、抗生素物质等外源性化合物与还原型谷胱甘肽轭合,生成更易溶于水的物质代谢或分泌出体外,从而保护细胞免受这些物质的伤害,这是GSTs最基本的解毒和保护特性[21]。二是保护细胞免受氧化损伤,抑制微粒体过氧化反应,修复自由基引起的膜磷脂损伤,清除体内的过氧化氢物。三是对激素、内源代谢物和外源化合物进行细胞间运输[22]。Ying等[23]的研究发现甲草胺可以显著抑制摇蚊GST活性,Li等[24]的研究证实了这一现象并发现甲草胺可以诱导3个GST基因CtGSTd1,CtGSTs2和CtGSTs3上调表达。然而关于甲草胺影响GST的作用机理、抑制效应及酶促动力学等方面的研究较少。
溪流摇蚊(Chironomus riparius Meigen)是世界性分布的水生昆虫,国内分布于天津、河北、浙江、海南、青海、辽宁等地[25],其幼虫具有体型小、世代周期短、易于养殖管理等优点,在欧美国家已被作为生态毒理研究模式生物[12, 26]。以溪流摇蚊为供试对象,研究不同浓度甲草胺对活体和离体情况下GST活性的影响,系统测定甲草胺对摇蚊GST的抑制效应,抑制类型和酶促动力学参数的影响,以期从生物化学层面全面了解环境激素甲草胺对GSTs的抑制机理,为全面评价甲草胺对水生生物的生态毒理效应提供生化依据。
1 材料与方法(Materials and methods)
1.1 仪器与试剂
仪器:SpectraMax 340多功能酶标仪(美国Molecular Devices公司),CF16RXII型冷冻离心机(日本日立公司),Potter-Elvehjem组织匀浆器(美国Sigma-Aldrich公司)。
试剂:2,2-联喹啉-4,4-二甲酸二钠(BCA二钠盐)、无水碳酸钠、酒石酸钠、氢氧化钠、碳酸氢钠、硫酸铜、磷酸氢二钠、磷酸二氢钠、曲拉通-100(TritonX-100)、三羟甲基氨基甲烷、2,4-二硝基氯苯(CDNB)、牛血清蛋白、还原性谷胱甘肽(GSH)、无水乙醇、丙酮均为中国国药集团化学试剂股份有限公司分析纯试剂。甲草胺(分析标准品)购自美国Sigma-Aldrich公司。
1.2 实验材料
实验用摇蚊采自于沈阳市沈河区满堂河支流牤牛河河段(沈阳农业大学附近),该河段污染来源主要是生活污水,河水经满堂河污水处理厂处理净化后达到GB18918—2002的一级B标准[27];沉积物符合GB18918—2002的相应标准[28]。所采集摇蚊经鉴定为溪流摇蚊(Chironomus riparius)[29]。摇蚊带回实验室采用曝气自来水于75 cm×45 cm×60 cm的玻璃缸内人工传代饲养。饲养条件为(25±1) ℃,光照时间16 h/8 h(光/暗)。
1.3 实验方法
1.3.1 染毒试验、酶液制备及GST活性测定
挑取实验室人工传代饲养的,个体大小基本一致、健康的溪流摇蚊4龄初期幼虫置于1 000 mL烧杯中,每烧杯10头。参考Li等[24]的方法,各烧杯中分别加入100 μL含有不同量的甲草胺丙酮溶液,使得甲草胺浓度分别为1、10、100、1 000 μg·L-1,对照组添加100 μL丙酮。每处理重复3次。试虫置于光照培养箱内72 h,温度(25±1) ℃,光照时间16 h/8 h(光/暗)。72 h收集存活的摇蚊幼虫用蒸馏水冲洗数遍,滤纸吸干后待用。
收集甲草胺处理后存活的试虫分别放入预冷的组织匀浆器中,按每头100 μL的比例加入预冷的0.1 mol·L-1含0.3% TritonX-100的磷酸缓冲液(pH 7.4),研磨至无明显肉眼可见的虫体组织,匀浆后10 000 g离心10 min,上清液即为待测酶液。
参考Habig等[30]的方法测定72 h处理后甲草胺对摇蚊GST酶活的影响。取酶标板分别加入底物1-氯-2,4-二硝基苯(CDNB)和还原型谷胱甘肽(GSH)各100 μL并混匀,放入酶标仪内37 ℃孵育20 min,然后加入20 μL酶液,于340 nm处每隔1 min计数,共计数5 min,记录其OD值,设3次重复并计算GST比活力(nmol·min-1·mg-1protein),对照以20 μL磷酸缓冲液代替酶液。酶液蛋白质含量采用2,2’-联喹啉4,4’-二羧酸二钠(BCA)法测定[31]。依照以下公式计算酶活力:
GSTs活力单位(nmol·min-1)=(ΔOD340·υ)/(ε·L)
式中ΔOD340为吸光度每分钟的变化值(ΔOD340·min-1),υ为酶促反应体积(mL),ε为产物的消光系数[0.0096L·(μmol·cm)-1]。
GSTs比活力[nmol·min-1·mg-1protein]=酶活力单位/酶液蛋白含量。
1.3.2 离体状态下甲草胺对溪流摇蚊GST活性的影响测定
收集未染毒的健康溪流摇蚊4龄幼虫采用1.3.1的方法制备酶液。分别将5 μL浓度为0(丙酮)、1、10、100、1 000 μg·L-1甲草胺丙酮溶液与100 μL CDNB和100 μL GSH混合。在酶标仪内37 ℃温育20 min,然后加入20 μL酶液,采用1.3.1的方法测定酶活性,计算酶活力。
1.3.3 甲草胺对摇蚊GSTs抑制效应的测定
在GSTs活性测定体系中,固定底物CDNB,GSH的浓度,改变加入的酶液量,测定不同甲草胺浓度下酶活力随底物浓度变化的规律,以加入酶液量对酶活力作图,从而判断化合物的抑制效应。
1.3.4 甲草胺对摇蚊GST抑制类型及抑制常数的测定
GST是双底物酶,因此需要分别测定甲草胺对2种底物的抑制类型及抑制常数[32],方法如下:在GST活性测定体系中,固定酶液和GSH的浓度,测定不同甲草胺浓度下酶活力随底物CDNB浓度变化的规律;固定酶液和CDNB的浓度,测定不同甲草胺浓度下酶活力随底物GSH浓度变化的规律。所得数据以Lineweaver-Burk双倒数作图,计算比较甲草胺对GST表观米氏常数(Km)和最大反应速度(Vm)的影响。根据两者的变化规律判断抑制类型,计算抑制常数。
1.3.5 数据处理与分析
试验结果采用Microsoft Excel 2003软件计算平均数和标准差;所得数据采用PASW Statistics 18统计软件进行单因素方差分析(one-way ANOVA),用Duncan法对均值进行多重比较,显著水平为P<0.05;极显著水平为P<0.01。
2 结果与分析(Results and analysis)
2.1 甲草胺对溪流摇蚊GST活性的影响
甲草胺染毒72 h后溪流摇蚊4龄幼虫GST活性变化如图1所示。不同浓度甲草胺对溪流摇蚊4龄初期幼虫GST活性具有显著的影响,其活性在处理72 h后明显被抑制(t检验,P<0.05),且抑制程度随着药物浓度的增大而增大。与同期对照相比,浓度为10、100、1 000 μg·L-1的甲草胺处理后GST比活力分别被抑制1.32、1.57和1.94倍。
2.2 离体状态下甲草胺对溪流摇蚊GST活性的影响
离体状态下甲草胺对溪流摇蚊4龄幼虫GST活性变化如图2所示。与活体染毒试验结果相类似,不同浓度甲草胺亦能抑制离体状态下溪流摇蚊4龄初期幼虫GST活性。在浓度为10、100、1 000 μg·L-1的甲草胺作用下,摇蚊GST比活力分别被抑制1.21、1.33和1.41倍。
2.3 甲草胺对溪流摇蚊GSTs抑制效应
GST经甲草胺作用后酶活力与酶液量之间的关系如图3所示。酶活力对酶液量作图得到一组通过原点的直线,且直线的斜率随着甲草胺浓度的增大而降低。此结果表明甲草胺抑制GST活力的反应是可逆性抑制。此外,由图3可以看出在同等酶液量下,酶活力随甲草胺浓度的增加而降低,这与前述结果一致,进一步说明甲草胺能对溪流摇蚊GST产生抑制作用。
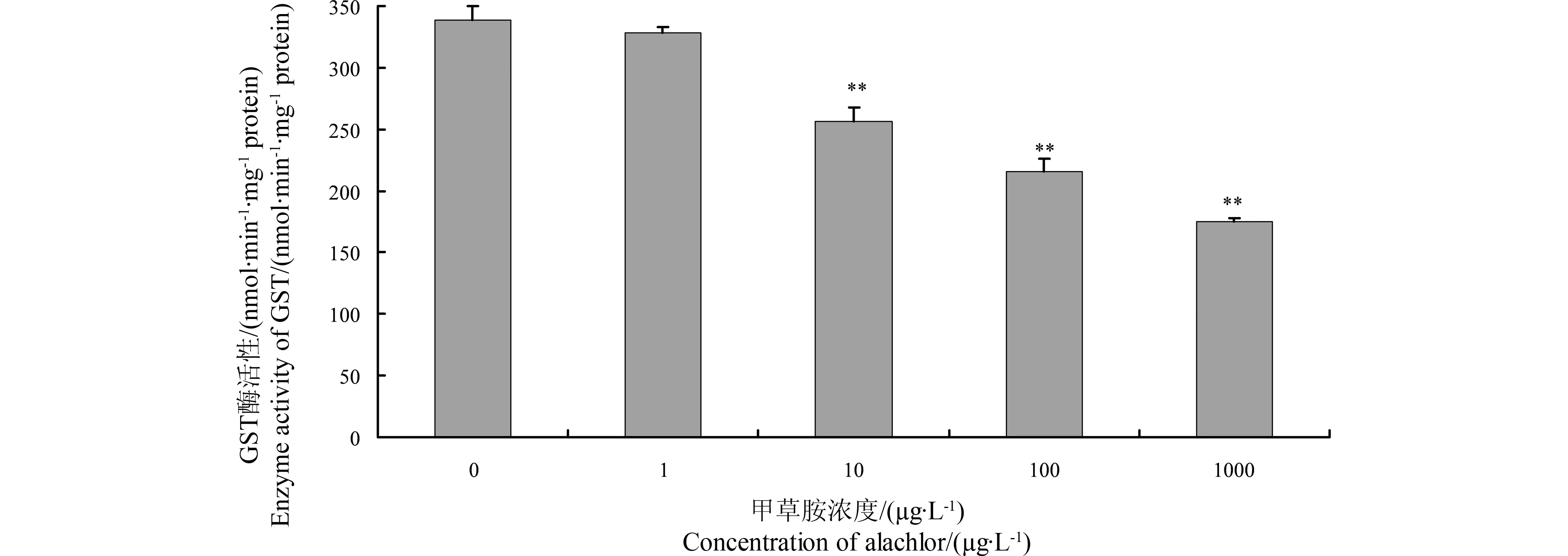
图1 甲草胺对溪流摇蚊4龄期幼虫GST酶活性的影响(72 h)Fig. 1 Effects of alachlor on GST activities in fourth-instar larvae of C. riparius (72 h)
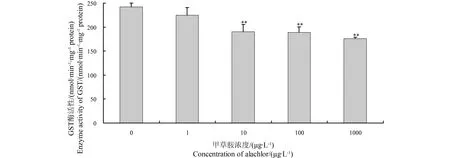
图2 离体状态下甲草胺对溪流摇蚊4龄期幼虫GST酶活性的影响Fig. 2 In vitro effects of alachlor on GST activities in fourth-instar larvae of C. riparius
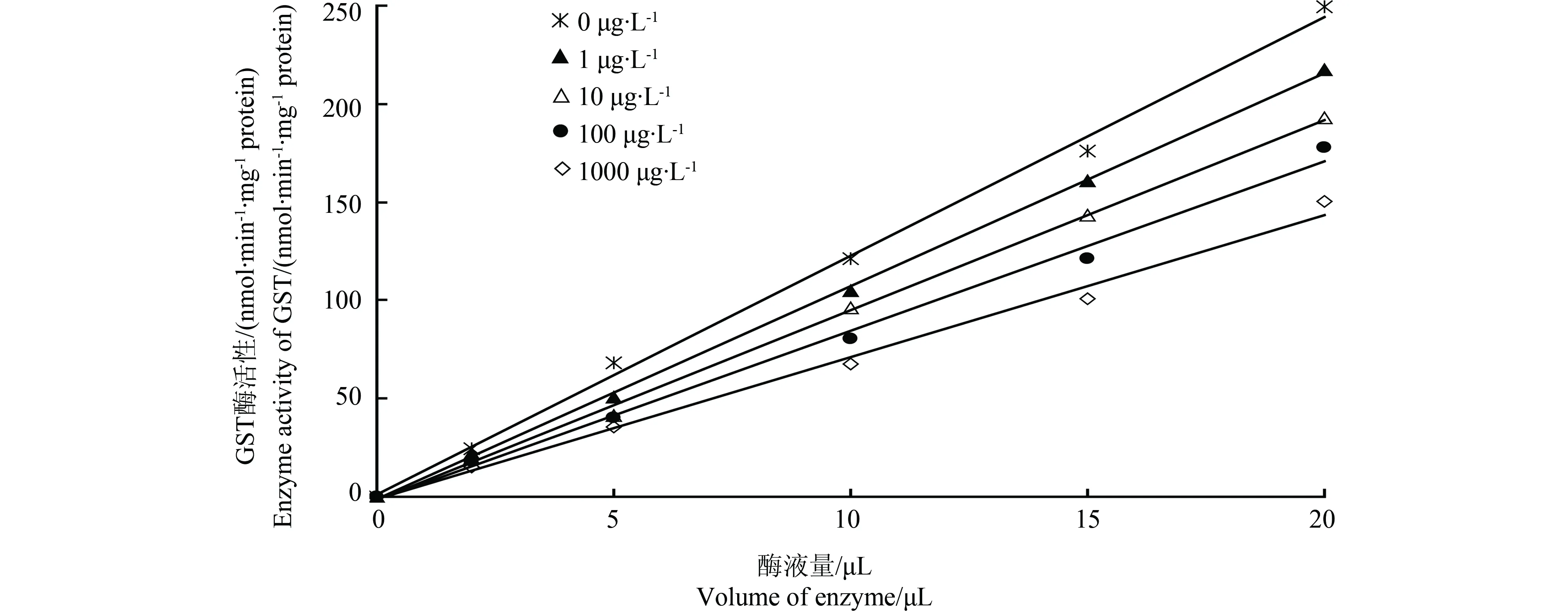
图3 甲草胺存在下溪流摇蚊GST酶活性与酶量的关系Fig. 3 Relationship between GST activity and enzyme content of C. riparius at different concentrations of alachlor
2.4 甲草胺对摇蚊GST抑制类型及抑制常数
2.4.1 以CDNB为底物时甲草胺对溪流摇蚊GST的抑制类型及抑制常数

表1 对CDNB,不同浓度甲草胺作用下溪流 摇蚊GST的Vmax和KmTable 1 Vmax and Km of GST at different concentrations of alachlor against CDNB
注:Vmax为反应最大速度;Km为米氏常数。
Note: Vmaxrepresents the maximum speed of reaction, and Kmrepresents the Michaelis constant.
对CDNB,甲草胺对溪流摇蚊GST抑制作用Lineweaver-Burk双倒数图,如图4所示,为一组纵轴截距不变的直线,测定的数据(表1)表明甲草胺不改变酶促反应的最大反应速度(Vm),只影响米氏常数(Km),
其值随着抑制剂浓度的增大而增大,其抑制机理表现为竞争性抑制[33]。运用二次作图法以不同浓度甲草胺对酶抑制作用下测得的Km对甲草胺作图,得到一条直线Y=0.0002X+0.1508,计算可知对CDNB,甲草胺对溪流摇蚊的抑制常数(KI)为754 μg·L-1。
2.4.2 以GSH为底物时甲草胺对摇蚊GSTs的抑制类型及抑制常数
对GSH,甲草胺对溪流摇蚊GST抑制作用Lineweaver-Burk双倒数图,如图5所示,为一组纵轴截距不变的直线,测定的数据(表2)表明甲草胺不改变酶促反应的最大反应速度(Vm),只影响米氏常数(Km),其值随着抑制剂浓度的增大而增大,其抑制机理表现为竞争性抑制。运用二次作图法以不同浓度甲草胺对酶抑制作用下测得的Km对甲草胺作图,得到一条直线Y=0.0002X+0.1081,计算可知对GSH,甲草胺对溪流摇蚊的抑制常数(KI)为540.5 μg·L-1。

表2 对GSH,不同浓度甲草胺作用下溪流 摇蚊GST的Vmax和KmTable 2 Vmax and Km of GST at different concentrations of alachlor against GSH
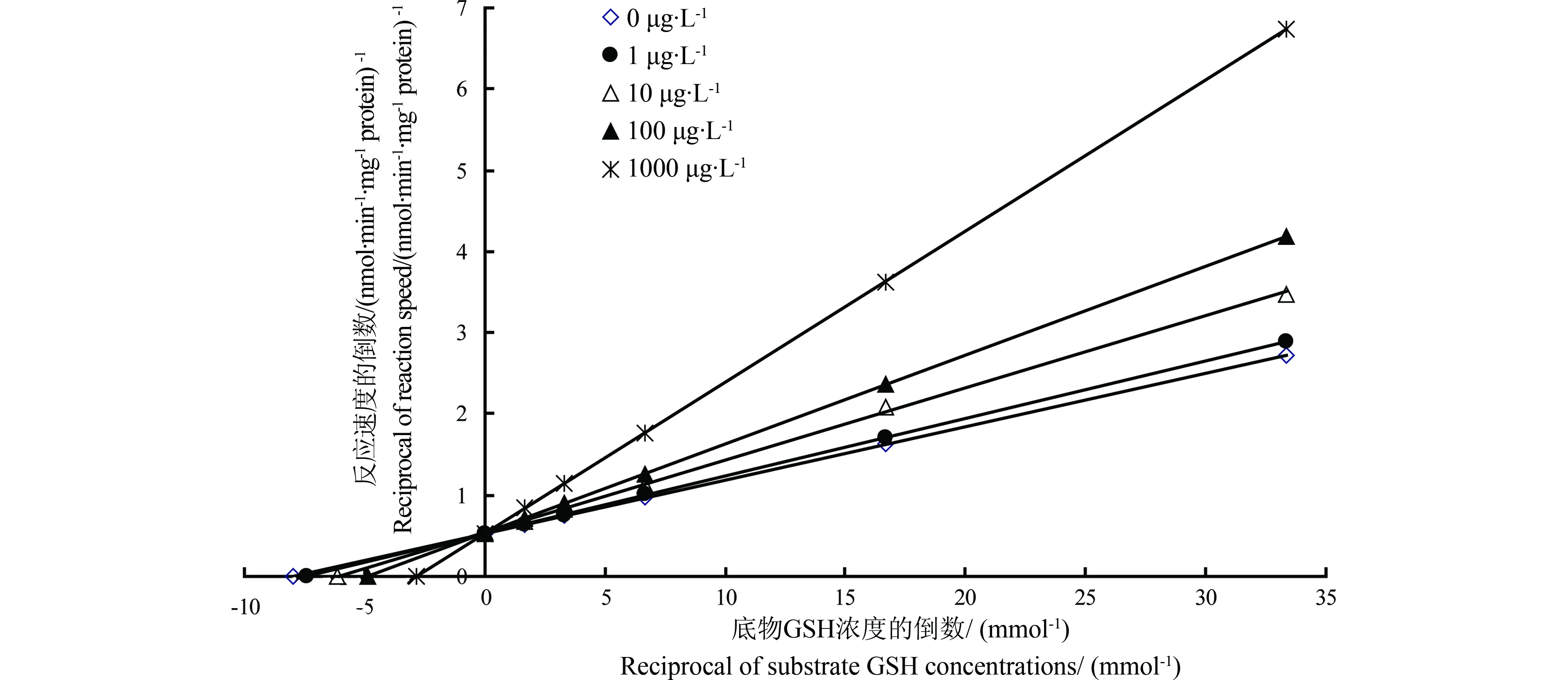
图4 甲草胺抑制下底物CDNB浓度和溪流摇蚊GST活性的双倒数图Fig. 4 Lineweaver-Burk plots of CDNB concentration and GST activity under the inhibition of alachlor
对CDNB和GSH,甲草胺对溪流摇蚊GST的抑制作用均表现为可逆竞争性抑制作用,表明甲草胺既可以与CDNB竞争酶结合位点,又可以与GSH竞争酶结合位点,从而导致酶的活性丧失。
3 讨论(Discussion)
甲草胺是水体常见的环境激素类农药。已有的研究表明甲草胺具有肝脏毒性、肾毒性、内分泌干扰毒性等作用和潜在的致癌性,能对生物体造成生殖及发育缺陷[34],因此相关研究的开展具有重要的意义。本研究显示甲草胺在活体染毒和离体状态下均能对溪流摇蚊GST产生显著的抑制影响。这与Ying等[23]和Li等[24]在研究甲草胺污染对伸展摇蚊(Chironomus tentans)GST活性的影响所得出的结论一致。此外,甲草胺也能影响尼罗罗非鱼(Oreochromis niloticus)多种组织GST活性[35]。持续低剂量暴露下甲草胺会对鲫鱼肝脏谷胱甘肽(GSH)、激素代谢关键酶GST和尿苷二磷酸葡萄糖醛酸转移酶(UDPGT)产生干扰[36]。这些结果表明甲草胺不仅仅影响多种双翅目摇蚊科昆虫的GST活性,也能影响其他水生生物的GST活性。
GST是生物体内重要的II相解毒酶,在生物体外源有毒物质代谢中和自由基清除中起到非常重要的作用。抑制GST的活性会降低摇蚊的解毒能力[37],增加外源有毒物质的毒性。有研究表明甲草胺单独作用下并不能对摇蚊产生显著的毒性,但在联合作用下会显著增强毒死蜱对伸展摇蚊幼虫的毒性[38]。进一步的生化酶活测定显示这种增毒效应主要归因于GST活性受到抑制。此外,摇蚊幼虫生活的底栖环境含氧量相对较少导致其体内容易产生较多的自由基,这些自由基和水体沉积物中的重金属沉积污染及水体中农药残留污染对摇蚊幼虫生长发育造成不利影响。摇蚊GST活性受到抑制会降低其解毒能力及自由基清除作用,削弱摇蚊幼虫在污染环境中的生存能力,最终影响到整个水生生态系统。
本文研究显示甲草胺对GST的特异底物CDNB和GSH均表现为可逆性竞争抑制,对CDNB,甲草胺对溪流摇蚊的抑制常数(KI)为754 μg·L-1;对GSH,甲草胺对溪流摇蚊的抑制常数(KI)为540.5 μg·L-1。CDNB和GSH都是GST的经典底物,CDNB代表外源性有毒物质,而GSH为生物体内源性物质,两者与GST结合部位不同,甲草胺与两者具有相同的抑制作用说明甲草胺不仅仅与GSH竞争结合位点,也与CDNB竞争结合位点,从而导致酶活性的丧失。此外甲草胺对GSH的抑制常数低于对CDNB的抑制常数,说明甲草胺更易于与GSH竞争结合位点。同时正是由于对底物的竞争性抑制,甲草胺才可以对不同生物的GST造成类似的抑制作用。
本文以CDNB和GSH为底物,采用酶标仪微量法研究了甲草胺对溪流摇蚊GST的影响。结果显示甲草胺在72 h活体染毒和离体状态下均能显著抑制溪流摇蚊GST的活性。酶动力学分析揭示甲草胺对GST的特异底物CDNB和GSH均表现为可逆性竞争抑制,且甲草胺更易于与GSH竞争结合位点。
致谢:感谢沈阳农业大学李彦博士在文章修改中给予的帮助。
[1] Cranston P S, Pinder L C V, Armitage P D, et al. The chironomidae: Biology and ecology of non-biting midges [M]. Chapman and Hall, 1995: 31-61
[2] Power M E, Dietrich W E. Food webs in river networks [J]. Ecological Research, 2002, 17(4): 451-471
[3] Leonard C. Ferrington Jr. Global diversity of non-biting midges (Chironomidae; Insecta-Diptera) in freshwater [J]. Hydrobiologia, 2008, 595(1): 447-455
[4] 刘丽, 钟文珏, 祝凌燕, 等. 沉积物中六氯苯对摇蚊幼虫的慢性毒性效应[J]. 生态毒理学报, 2014, 9(2): 261-267
Liu L, Zhong W Y, Zhu L Y, et al. Chronic effects of hexachlorobenzen (HCB) in sediments to Chironomus kiiensis larvae [J]. Asian Journal of Ecotoxicology, 2014, 9(2): 261-267 (in Chinese)
[5] 布吉红, 陈辉辉, 许宜平, 等. 辽河表层沉积物重金属生态风险与综合毒性表征[J]. 生态毒理学报, 2014, 9(1): 24-34
Bu J H, Chen H H, Xu Y P, et al. Ecological risk of interstitial water heavy metals and toxicity characterization of surface sediments in branches of Liao river [J]. Asian Journal of Ecotoxicology, 2014, 9(1): 24-34 (in Chinese)
[6] 徐吉洋, 张文萍, 李少南, 等. 毒死蜱对六种淡水节肢动物的毒性与风险评价[J]. 生态毒理学报, 2014, 9(3): 563-568
Xu J Y, Zhang W P, Li S N, et al. Toxicity and risk of chlorpyrifos to six species of freshwater arthropods [J]. Asian Journal of Ecotoxicology, 2014, 9(3): 563-568 (in Chinese)
[7] Nair P M G, Park S Y, Choi J H, et al. Expression of catalase and glutathione S-transferase genes in Chironomus riparius on exposure to cadmium and nonylphenol [J]. Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology, 2011, 154(4): 399-408
[8] Nair P M G, Choi J H. Identification, characterization and expression profiles of Chironomus riparius glutathione S-transferase (GST) genes in response to cadmium and silver nanoparticles exposure [J]. Aquatic Toxicology, 2011, 101(3-4): 550-560
[9] Park K Y, Park J G, Kim J K, et al. Biological and molecular responses of Chironomus riparius (Diptera, Chironomidae) to herbicide 2,4-D (2,4-dichlorophenoxyacetic acid) [J]. Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology, 2010, 151(4): 439-446
[10] Ha M H, Choi J H. Effects of environmental contaminants on hemoglobin of larvae of aquatic midge, Chironomus riparius (Diptera: Chironomidae): A potential biomarker for ecotoxicity monitoring [J]. Chemosphere, 2008, 71(10): 1928-1936
[11] Ha M H, Choi J H. Chemical-induced alteration of hemoglobin expression in the 4th instar larvae of Chironomus tentans Mg. (Diptera: Chironomidae) [J]. Environmental Toxicology and Pharmacology, 2008, 25(3): 393-398
[12] Watts M M, Pascoe D. A comparative study of Chironomus riparius Meigen and Chironomus tentans Fabricius (Diptera:Chironomidae) in aquatic toxicity tests [J]. Archives of Environmental Contamination and Toxicology, 2000, 39(3): 299-306
[13] 罗守进. 甲草胺的研究[J]. 农业灾害研究, 2012, 2(2): 8-16
Luo S J. Study on alachlor [J]. Journal of Agricultural Catastrophology, 2012, 2(2): 8-16 (in Chinese)
[14] Kiely T, Donaldson D, Grube A, et al. Pesticides Industry Sales and Usage: 2000 and 2001 Market Estimates [R]. Washington DC: United States Environmental Protection Agency (US EPA) , 2004
[15] 中华人民共和国环境保护部. 关于征求《酰胺类农药工业水污染物排放标准》(征求意见稿)等两项国家环境保护标准意见的函[EB/OL]. (2008-07-01) [2014-11-18]. http://www.zhb.gov.cn/info/bgw/bbgth/200807/t20080704_125026.htm
[16] 中国农药信息网. 农药综合查询系统[DB/OL]. (2008-09-24) [2014-11-26]. http://www.chinapesticide.gov.cn/service/aspx/B3X.aspx?aiid=HEALA.
[17] Battaglin W A, Furlong E T, Burkhardt M R, et al. Occurrence of sulfonylurea, sulfonamide, imidazolinone, and other herbicides in rivers, reservoirs and ground water in the Midwestern United States, 1998 [J]. Science of The Total Environment, 2000, 248(2-3): 123-133
[18] 朱忠林. 合理使用农药,防止地下水的污染[J]. 农药科学与管理, 1994(3): 34-37
[19] 邓南圣, 吴峰. 环境中的内分泌干扰物[M]. 北京:化学工业出版社, 2004: 1-241
[20] 李海燕, 曲久辉, 赵翔, 等. 饮用水中内分泌干扰物甲草胺的O3氧化降解机制研究[J]. 环境科学, 2004, 25(2): 43-46
Li H Y, Qu J H, Zhao X, et al. Degradation mechanism of ozonation of endocrine disruptor ( alachlor ) in drinking water [J]. Environmental Science, 2004, 25(2): 43-46 (in Chinese)
[21] Enayati A A, Ranson H J H. Insect glutathione transferases and insecticide resistance [J]. Insect Molecular Biology, 2005, 14(1): 3-8
[22] Hayes J D, Strange R C. Glutathione S-transferase polymorphisms and their biological consequences [J]. Pharmacology, 2000, 61(3): 154-66
[23] Clark Y J, Anderson T, Yun Z K, et al. Effect of alachlor and metolachlor on toxicity of chlorpyrifos and major detoxification enzymes in the aquatic Midge, Chironomus tentans (Diptera: Chironomidae) [J]. Archives of Environmental Contamination and Toxicology, 2008, 54(4): 645-652
[24] Li X W, Zhang X, Zhang J Z, et al. Identification and characterization of eleven glutathione S-transferase genes from the aquatic midge Chironomus tentans (Diptera: Chironomidae) [J]. Insect Biochemistry and Molecular Biology, 2009, 39(10): 745-754
[25] 王俊才, 王新华. 中国北方摇蚊幼虫[M]. 北京: 中国言实出版社, 2011: 220
[26] Watts M M, Pascoe D. Comparison of Chironomus riparius Meigen and Chironomus tentans Fabricius (Diptera: Chironomidae) for assessing the toxicity of sediments [J]. Environmental Toxicology and Chemistry, 2000, 19(7): 1885-1892
[27] 袁英兰, 常文越, 张帆, 等. 人工湿地污染物去除效率稳定性分析——以沈阳市满堂河污水处理中心为例[J]. 环境保护科学, 2011, 37(3): 31-33.
Yuan Y L, Chang W Y, Zhang F, et al. Analysis on stability of contaminants removal efficiency in the constructed wetland--taking Shenyang Mantang River Wastewater Treatment Center as example [J]. Environmental Protection Science, 2011, 37(3): 31-33 (in Chinese)
[28] 王杰, 杨春璐, 郑涛, 等. 沈阳市污水污泥中重金属含量及其生物有效性[J]. 实验室研究与探索, 2014, 33(5): 26-32
Wang J, Yang C L, Zheng T, et al. Study on the heavy metals and its availability of sewage sludge in Shenyang City [J]. Laboratory Research and Exploration, 2014, 33(5): 26-32 (in Chinese)
[29] 校新蕾, 李修伟, 梁亚萍, 等. 摇蚊基因组DNA提取及COI基因克隆与序列分析[J]. 西北农业学报, 2014, 23(11): 143-149
Xiao X L, Li X W, Liang Y P, et al. Genomic DNA extraction,cloning and sequencing analysis of COI gene from the aquatic midges [J]. Acta Agriculturae Boreali-occidentalis Sinica, 2014, 23(11): 143-149 (in Chinese)
[30] Habig W H, Pabst M J, Jakoby W B, et al. Glutathione S-transferases. The first enzymatic step in mercapturic acid formation [J]. Journal of Biology Chemistry, 1974, 249(22): 7130 -7139
[31] Smith P K, Krohn R I, Hermanson G T, et al. Measurement of protein using bicinchoninic acid [J]. Analytical Biochemistry, 1985, 150(1): 76-85
[32] 杨秀芬, 杨子明. 二氢杨梅素对小鼠肝脏谷胱甘肽-S-转移酶的抑制作用及其动力学分析[J]. 中国药理学通报, 2010, 26(7): 894-898
Yang X F, Yang Z M. Inhibition of glutathione-S-transferase by dihydromyricetin and its kinetics analysis in liver of mice [J]. Chinese Pharmacological Bulletin, 2010, 26(7): 894-898 (in Chinese)
[33] 陈清西. 酶学及其研究技术[M]. 厦门: 厦门大学出版社, 2010: 108-123
[34] Housenger J E. Alachlor: Reregistration Eligibility Decision (RED) Facts [R]. Washington DC: United States Environmental Protection Agency (US EPA) , 1999
[35] Peebua P, Kosiyachinda P, Pokethitiyook P, et al. Evaluation of alachlor herbicide impacts on Nile tilapia (Oreochromis niloticus) using biochemical biomarkers [J]. Bulletin of Environmental Contamination and Toxicology, 2007, 78(2): 138-141
[36] Yi X H, Ding H, Lu Y Y, et al. Effects of long-term alachlor exposure on hepatic antioxidant defense and detoxifying enzyme activities in crucian carp (Carassius auratus) [J]. Chemosphere, 2007, 68(8): 1576-1581
[37] 李修伟, 张兴, Zhu K Y, 等. 雷公藤总生物碱对摇蚊幼虫杀灭活性和谷胱甘肽硫转移酶的影响[J]. 西北农林科技大学学报:自然科学版, 2010, 38(4): 157-163
Li X W, Zhang X, Zhu K Y, et al. Effects of tripterygium wilfordii total alkaloids on insecticidal activity, glutathione S-transferase of Chironomus tentans [J]. Journal of of Northwest A & F university: Natural Science Edition, 2010, 38(4): 157-163 (in Chinese)
[38] Clark Y J. Synergistic effects of selected herbicides on the toxicity of chlorpyrifos to the aquatic midge, Chironomus tentans (Diptera: Chironomidae) [D]. Manhattan: Kansas State University, 2005:1-141
◆
Inhibition Effect of Alachlor on GlutathioneS-transferase ofChironomusriparius(Diptera: Chironomidae)
Li Xiuwei*, Xiao Xinlei, Liang Yaping, Zhang Chunping, Zhang Shulan, Gu Zumin#, Qi Zhiqiu
College of Plant Protection, Shenyang Agricultural University, Shenyang 110866, China
19 November 2014 accepted 14 January 2015
Glutathione S-transferases (GST) is an important detoxification enzyme of the organisms. To investigate the inhibition effect and the mechanism of the environmental hormone pesticide alachlor against GST of Chironomus riparius, the inhibition activity and inhibition type of alachlor against fourth-instar larvae of C. riparius were determined by microtitration assay. The results showed that alachlor significantly inhibited GST activities both in vivo 72 h exposure and in vitro, and the inhibition degree increased in an alachlor concentration-dependent manner. The inhibition reaction of alachlor on GST was reversible. Further analysis of enzyme kinetics revealed that the inhibition was competitive with specific substrate of 1-chloro-2,4- dinitrobenzene (CDNB) and reduced Glutathione (GSH), that was to say that alachlor did not change the Vmvalue of enzymatic reaction, but affected the michaelis constant (Km). These results suggested that the GST activities of aquatic midge could be significantly affected by the pesticide residue of alachlor, while the inhibition mechanism of alachlor on GST was reversible and competitive.
alachlor; Chironomus riparius; glutathione S-transferase; inhibitory kinetics
国家自然科学基金(31101675)
李修伟(1978-),男,博士,研究方向为毒理学,E-mail: xiuwei001@syau.edu.cn;
# 共同通讯作者(Co-corresponding author), E-mail: guzumin1212@163.com
10.7524/AJE.1673-5897.20141119004
2014-11-19 录用日期:2015-01-14
1673-5897(2015)2-243-08
X171.5
A
李修伟(1978—),男,农药学博士,讲师,主要研究方向为天然产物农药,农药毒理学和生态毒理学,在国内外学术期刊发表学术论文10余篇。
谷祖敏(1973—),女,农药学博士,副教授,主要研究方向为微生物农药,农药环境毒理学,在国内外学术期刊发表学术论文30余篇。
李修伟, 校新蕾, 梁亚萍, 等. 环境激素甲草胺对摇蚊谷胱甘肽硫转移酶的抑制作用[J]. 生态毒理学报, 2015, 10(2):243-250
Li X W, Xiao X L, Liang Y P, et al. Inhibition effect of alachlor on glutathione S-transferase of Chironomus riparius (Diptera: Chironomidae) [J]. Asian Journal of Ecotoxicology, 2015, 10(2): 243-250 (in Chinese)
