日粮中铜胁迫对吉富罗非鱼幼鱼抗氧化、脂质过氧化及肝脏组织结构的影响
2015-06-05王文龙崔欣安立龙效梅高涵李成成邢星李延伟许英梅
王文龙,崔欣,安立龙,*,效梅,高涵,李成成,邢星,李延伟,许英梅
1. 广东海洋大学 动物科学系,湛江 524088 2. 广东海洋大学 动物医学系,湛江 524088 3. 中国药科大学 药物制剂系,南京 211198 4. 中华人民共和国钦州保税港区出入境检验检疫局,钦州 535008
日粮中铜胁迫对吉富罗非鱼幼鱼抗氧化、脂质过氧化及肝脏组织结构的影响
王文龙1,崔欣1,安立龙1,*,效梅2,#,高涵3,李成成1,邢星4,李延伟1,许英梅1
1. 广东海洋大学 动物科学系,湛江 524088 2. 广东海洋大学 动物医学系,湛江 524088 3. 中国药科大学 药物制剂系,南京 211198 4. 中华人民共和国钦州保税港区出入境检验检疫局,钦州 535008
吉富罗非鱼是我国南方沿海地区水产养殖中的主要经济鱼类之一,但近年来,随着我国城镇化和工业化进程的推进,罗非鱼养殖面临着前所未有的铜富集的挑战。为探明日粮中铜胁迫对吉富罗非鱼幼鱼抗氧化系统和肝脏组织结构的影响,将1 080条罗非鱼幼鱼暴露于6个浓度梯度(0、3、30、300、1 000、3 000 mg·kg-1)的高铜日粮中,通过60 d的暴露试验,实时测定罗非鱼血清与肝脏抗氧化能力,监测肝脏病理变化。结果表明,在本试验条件下,罗非鱼幼鱼血清和肝脏中MDA的含量随日粮中铜含量的增加和胁迫时间的延长显著升高,而SOD、GSH-PX和CuZn-SOD的活性表现出先升高后降低的趋势;各组间肝脏表现出不同程度的病变,主要是浊肿变性和脂肪变性,且第Ⅲ、Ⅳ、Ⅴ组肝脏病变严重。综上,日粮中铜胁迫对吉富罗非鱼幼鱼的抗氧化机能有较明显的抑制作用,长时间的暴露能严重损伤其肝脏的组织结构,因此,建议吉富罗非鱼幼鱼日粮中铜的实际含量应控制在42.36 mg·kg-1以下。
日粮中铜胁迫;吉富罗非鱼幼鱼;肝脏病变;抗氧化;脂质过氧化;浊肿变性
现代工业社会、社会经济和人类各种生产活动都会引起重金属的输入,对生态环境造成严重的危害[1-3],特别是近几十年来随着我国工业化进程的不断升级,日益加剧的重金属污染及其引发的生态和食品安全问题成为我国学者关注的焦点[1,4]。铜(copper, Cu)是主要的重金属之一,也是有机生命正常生理生化反应必须的微量元素之一[5],但过量的Cu则会导致毒性效应,对生物体机体造成损伤[2,6],Cu在水生生物体内的富集已经成为无法规避的安全隐患。
早在20世纪90年代,西方学者就已经预见到了水源性和食源性Cu暴露对水生生物的毒害作用[6-7],引发了人们的广泛关注。而我国针对Cu的生态毒性研究起步较晚,随着90年代中后期我国地域环境中Cu的输入量逐渐攀高,Cu等重金属引发的生态风险和食品安全问题才慢慢进入我国学者的视野,过量的Cu对水生动物肝脏造成巨大伤害,进而影响动物机体的抗氧化体系的正常运转,引发动物机体代谢、免疫等诸多方面功能紊乱[2,4,6]。目前关于日粮中高Cu胁迫对畜禽的毒性作用的报道比较多,但日粮中Cu暴露对鱼类的毒性研究较少,未见探讨日粮中Cu暴露影响罗非鱼抗氧化功能、脂质过氧化和肝脏组织结构的报道,少数的相关研究仅限于对Cu最适添加量的探索,汪华[8]的研究表明,吉富罗非鱼的日粮Cu需要量为8 mg·kg-1左右,但为保证鱼对Cu的需要量,鱼日粮中Cu的实际含量往往大于其实际需要量,且在不同饲养环境和饲养条件下鱼的需要量和耐受度也不尽相同[9-11]。
本课题组立足于现今重金属污染愈发严重,两广、福建等地区水生生物Cu等重金属富集加剧的大背景下开展了一系列关于罗非鱼Cu耐受以及Cu暴露条件下罗非鱼机体抗氧化响应机制的工作,前期研究表明,Cu在各组织中积累量的顺序依次为:肝脏>脾脏>肠道>鳃>肌肉,与对照组相比,肝脏、脾脏、肠道中Cu的含量随着时间和日粮中Cu浓度的升高而逐渐升高[4],肝脏是Cu最大的储存器官,也是鱼体内最重要的解毒器官,其病理变化可以直观地反映出Cu痕量长时间蓄积或大量短时摄入对鱼体造成损伤,与此同时,血清生化指标也能敏感地反映动物机体的生理状态,基于此,本文以饲喂Cu暴露日粮的吉富罗非鱼幼鱼为模型,研究日粮中Cu暴露对罗非鱼幼鱼抗氧化、脂质过氧化和肝脏组织结构的影响,探究日粮Cu暴露对吉富罗非鱼幼鱼机体抗氧化系统及功能脏器的损伤机制,为罗非鱼养殖中日粮Cu的需要量和使用限量研究提供依据。
1 材料与方法(Materials and methods)
1.1 试验动物与材料
试验鱼由广东省吴川国联罗非鱼良种场提供,试验前用药浴消毒(投入0.02%的高锰酸钾溶液浸泡5 min,将有不良反应的病鱼去除),用对照组日粮驯养15 d,使其适应试验环境及试验日粮,选择健康无病、活跃灵敏的个体作为试验用鱼;试验中Cu以CuSO4·5H2O(分析纯,上海易蒙斯化工科技有限公司)形式添加。
1.2 试验日粮
以鱼粉、豆粕、玉米粉、面粉、磷酸二氢钙、豆油、胆碱、食盐、预混料配制基础日粮,经粉碎后过60目筛后混匀,微量原料采用逐级扩大法混合,混合均匀后-20 ℃密封保存,备用,试验基础日粮及营养组成见表1。试验中设计Cu的添加梯度为:0 mg·kg-1、3 mg·kg-1、30 mg·kg-1、300 mg·kg-1、1 000 mg·kg-1、3 000 mg·kg-16个水平,用电感耦合等离子体质谱仪(ICP-MS,美国安捷伦科技有限公司)测得各组日粮中Cu的实际含量如表2所示。

表1 试验基础日粮及营养水平(饲喂基础)Table 1 Ingredients and nutrient level of basal diet (fed-basis)
注:*每千克预混料含VA 350 000 IU、VD3100 000 IU、VE 4 000 mg、VK3250 mg、VB1400 mg、VB21 500 mg、VB6600 mg、VB122.5 mg、D-泛酸钙2 000 mg、烟酰胺2 500 mg、叶酸250 mg、D-生物素5 mg、肌醇7 000 mg、VC 6 300 mg、锌2 250 mg、锰1 200 mg、铁6 500 mg、钴120 mg、碘120 mg、硒25 mg。
Note:*Each kilogram of premix provided: VA 350 000 IU, VD3100 000 IU, VE 4 000 mg, VK3250 mg, VB1400 mg, VB21 500 mg, VB6600 mg, VB122.5 mg, calcium D-pantothenate 2 000 mg, nicotinamide 2 500 mg, folic acid 250 mg, biotin 5 mg, Inositol 7 000 mg, VC 6 300 mg, Zn 2 250 mg, Mn 1 200 mg, Fe 6 500 mg, Co 120 mg, I 120 mg, Se 25 mg.
1.3 试验分组与饲养管理
选取健康无病的罗非鱼1 080尾(平均体重为(9.20±0.18) g),将其分为6组(见表2),每组3个重复,每个重复60尾,饲养在规格为500 L的玻璃钢鱼缸中。空气压缩机增氧,每3天监测一次水质:水温为(31.50±1.50) ℃,溶解氧不小于5 mg·L-1,氨氮含量不超过0.02 mg·L-1,水体pH为7.8~8.3;每3天换水1/2缸,每天上午9点和下午6点投放2次相应组别的日粮,日投料量为鱼体重的3%(每10天测一次鱼的平均体重,及时调整日投料量),30 min后将剩余饵料吸出,烘干称重,每天观察记录罗非鱼摄食和死亡情况。
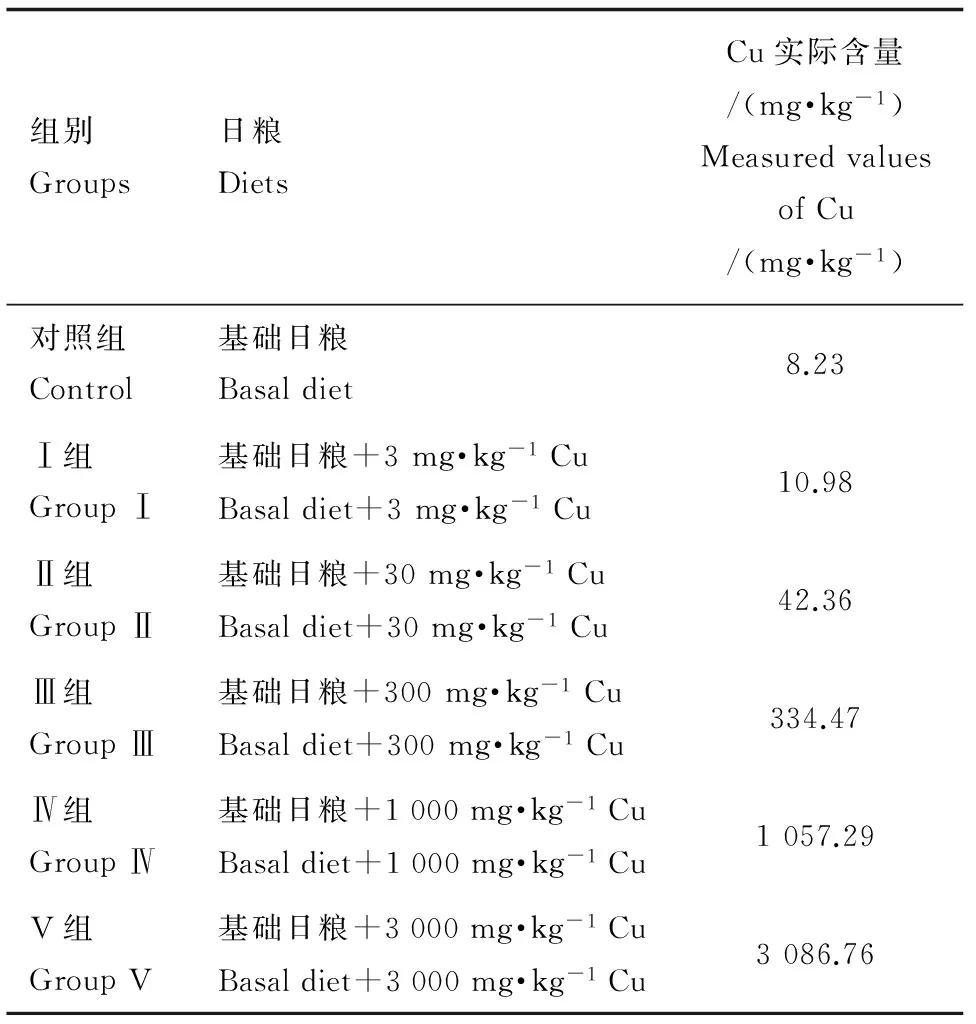
表2 试验分组Table 2 Design of experiment
1.4 样品采集与指标测定
分别于试验第20天、40天、60天采样,采样前饥饿24 h,每个重复取12条鱼,其中4尾进行尾静脉采血,室温静置待其凝固后3 000 r·min-1离心10 min,取制得的血清于-20 ℃保存,待测;余下的8尾鱼则采用捣毁脑髓法处死,其中6尾取肝脏用4 ℃预冷的生理盐水漂洗并滤干,切1.0 g左右肝脏组织块制成10%组织匀浆,冷冻离心机(3K30,德国SIGMA公司)2 500 r·min-1离心10 min,取上清液于-20 ℃保存,待测。脂质过氧化与抗氧化指标的测定均严格按照南京建成生物工程研究所相应试剂盒的使用说明进行。
取其余2尾的新鲜肝脏、脾脏用4 ℃预冷的生理盐水漂洗并滤干,切成大小约为0.5 cm×0.5 cm×0.5 cm的小组织块放于配好的波音氏(Bouin’s)固定液中固定(波音氏液的体积约为组织块的15~20倍),固定24 h;再经脱水、透明、浸蜡、包埋、切片(5 μm)、展片、烘干、水洗、染色,最后用中性树胶封片,贴上标签并编号,备用,Nikon-E200显微镜下观察并拍照(Olympus DP70显微成像系统,奥林巴斯中国有限公司)。
1.5 数据处理
采用SPSS 20.0软件对试验数据进行单因素方差分析,采用Duncan’s法多重比较差异的显著性,差异显著定义为P<0.05,数据表示为“Mean±SD”。
2 结果(Results)
2.1 日粮Cu胁迫对罗非鱼幼鱼抗氧化、脂质过氧化的影响
2.1.1 日粮Cu胁迫对罗非鱼幼鱼MDA含量的影响
由表3可见血清中MDA的含量略低于肝脏中MDA的含量。在第20、40、60天时,对照组~Ⅱ组血清中MDA的含量无显著差异,Ⅲ~Ⅴ组血清中MDA的含量随着Cu的升高而逐渐升高,第60天时第Ⅴ组血清MDA的含量达到最高(7.08±0.04) nmol·mL-1。
随着日粮Cu胁迫时间的延长,对照组~Ⅲ组血清中MDA的含量无显著差异(P>0.05)。第Ⅳ组血清中MDA的含量随时间的延长显著升高,而第Ⅴ组在第40天时比在第20天时显著升高(P<0.05),到60 d时无显著变化(P>0.05)。说明日粮中高剂量的Cu可引起脂质过氧化,使血清中MDA含量升高。
肝脏中MDA含量的变化与血清中MDA的变化规律相似。肝脏中MDA含量在第20天时对照组~Ⅲ组间无显著差异(P>0.05);第Ⅳ组和第Ⅴ组显著高于其他组。第40天时,第Ⅰ组中MDA的含量最少,为(5.35±0.02) nmol·mg-1prot,但之后随着日粮中Cu浓度的升高,肝脏中MDA的含量也随着升高;而与对照组相比,第Ⅳ、Ⅴ组肝脏中MDA的含量显著升高(P<0.05)。第60天时,肝脏中MDA的含量随日粮中Cu浓度的升高而升高,第Ⅴ组肝脏中MDA的含量此时达到最高,为(8.69±0.05) nmol·mg-1prot。对照组~第Ⅳ组肝脏中MDA的含量随时间的延长无显著变化(P>0.05),而第Ⅴ组肝脏中MDA的含量随时间的延长显著增加(P<0.05),其原因可能是日粮中高Cu引起脂质过氧化,使肝脏中MDA含量升高。
2.1.2 日粮Cu胁迫对罗非鱼幼鱼SOD活性的影响
如表4所示,血清中SOD的活性与肝脏差异不显著。在20 d时,对照组~第Ⅱ组血清中SOD的活性无显著差异(P>0.05),之后随着Cu的升高SOD的活性也逐渐增强。40 d时,第Ⅲ组SOD的活性最高,第Ⅴ组次之,最低为第Ⅰ组。60 d时,随着日粮中Cu浓度的升高,SOD的活性呈现先升高再降低的趋势,最高是第Ⅱ组,达到了(115.71±7.25) U·mL-1。对照组和第Ⅰ组血清中SOD的活性随着日粮Cu胁迫时间的延长无显著变化,第Ⅱ组随着时间的延长而升高,第Ⅲ组呈先升高后降低的趋势,第Ⅳ、Ⅴ组均呈下降的趋势,且SOD活性在第60天时显著低于第20天时的活性(P<0.05)。
肝脏中SOD的活性在20 d时,随着日粮中Cu浓度的升高也逐渐升高。40 d时,第Ⅲ组SOD的活性最高,达到(126.15±19.27) U·mg-1prot。第60天时,第Ⅰ组SOD的活性最高,为(120.26±14.03) U·mg-1prot,在这2个时期,SOD的活性均随Cu浓度的升高呈现抛物线型变化。

表3 日粮Cu胁迫条件下罗非鱼幼鱼的MDA含量Table 3 Concentration of MDA in juvenile GIFT tilapia under dietary Cu stress
注:同行或同列肩标中大写或小写字母完全不同,表示显著差异(P<0.05),未标字母或字母有相同者表示差异不显著(P>0.05)。下表同。
Note: In the same row or column, values with totally different uppercase or lowercase superscripts mean significant difference (P<0.05), while with the same letter or no letter mean no significant difference (P>0.05). The same as below.

表4 日粮Cu胁迫条件下罗非鱼幼鱼的SOD活性Table 4 Activity of SOD in juvenile GIFT tilapia under dietary Cu stress
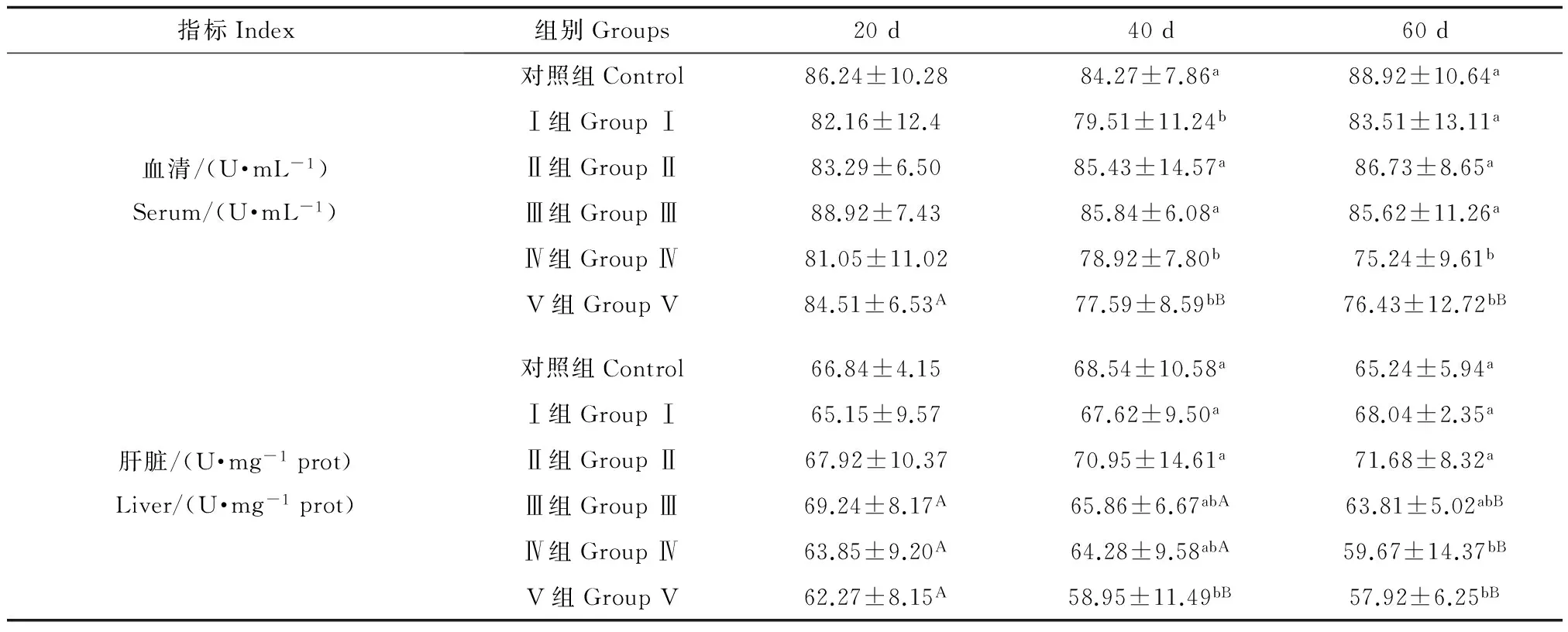
表5 日粮Cu胁迫条件下罗非鱼幼鱼的CuZn-SOD活性Table 5 Activity of CuZn-SOD in juvenile GIFT tilapia under dietary Cu stress
随着日粮Cu胁迫时间的延长,对照组肝脏中SOD的活性无显著变化(P>0.05),第Ⅰ组呈上升趋势,但无显著差异,第Ⅱ、Ⅲ组为先升高再降低的趋势,而第Ⅳ、Ⅴ组呈下降趋势,且差异显著(P<0.05),说明日粮中高剂量的Cu可能会抑制血清和肝脏中SOD的活性。
2.1.3 日粮Cu胁迫对罗非鱼幼鱼CuZn-SOD活性的影响
由表5可知,在第20天时,各组间血清中CuZn-SOD的活性无显著差异(P>0.05),第Ⅳ组最低,为(81.05±11.02) U·mL-1,最高的第Ⅲ组为(88.92±7.43) U·mL-1;第40天时,对照组和Ⅱ、Ⅲ组间无显著差异(P>0.05),Ⅰ组和Ⅳ、Ⅴ组间无显著差异(P>0.05);第60天时,随日粮中Cu浓度的升高总体呈现出降低的趋势,且与对照组相比,Ⅳ、Ⅴ组显著降低(P<0.05)。
随着日粮Cu胁迫时间的延长,第Ⅴ组血清中CuZn-SOD的活性显著降低(P<0.05),在第20天时为(84.51±6.53) U·mL-1,第60天时则降至(76.43±12.72) U·mL-1,其他各组随日粮Cu胁迫时间的延长无显著变化(P>0.05)。
肝脏中CuZn-SOD的活性略低于血清。在第20天时,各组间无显著差异;第40天和60天时,肝脏CuZn-SOD的活性都随着日粮中Cu浓度的升高而呈现出先升高后降低的趋势,第Ⅱ组在第60天时最高,为(71.68±8.32) U·mg-1prot,显著高于对照组(P<0.05)。
随着日粮Cu胁迫时间的延长,对照组和Ⅰ、Ⅱ组肝脏中CuZn-SOD的活性无显著变化(P>0.05);第Ⅲ、Ⅳ、Ⅴ组均随时间的延长逐渐降低,第Ⅴ组在60 d时最低,为(57.92±6.25) U·mg-1prot;表明日粮中过高浓度的Cu可能会抑制罗非鱼血清和肝脏中CuZn-SOD的活性。
2.1.4 日粮Cu胁迫对罗非鱼幼鱼GSH水平和GSH-PX活性的影响
由表6可知,肝脏中GSH的含量在20 d时随日粮中Cu浓度的升高逐渐升高,最高的第Ⅴ组达到了(7.23±0.15) mg·g-1prot,显著高于对照组(P<0.05);在40 d时,各组间无显著差异(P>0.05);在60 d时,随日粮中Cu含量的升高GSH含量逐渐下降。
随着日粮Cu胁迫时间的延长,对照组~第Ⅲ组无显著变化,第Ⅳ组GSH含量缓慢下降,但差异不显著,第Ⅴ组随着时间的延长显著下降(P<0.05),第60天时降至最低的(5.20±0.24) mg·g-1prot,这也表明日粮中过高剂量的Cu可能会降低肝脏中GSH的含量。

表6 日粮Cu胁迫条件下罗非鱼幼鱼肝脏中的 GSH水平(U·mg-1 prot)Table 6 Concentration of GSH in liver of juvenile GIFT tilapia under dietary Cu stress (U·mg-1 prot)
如表7所示,在20 d时,第Ⅳ组和第Ⅴ组GSH-PX的活性分别为(28.64±2.04) U·mg-1prot和(27.75±1.38) U·mg-1prot,显著高于对照组(P<0.05)。到第60天时,随日粮中Cu含量的升高,各组间呈现先升高后降低的变化趋势,与对照组相比,第Ⅳ、Ⅴ组GSH-PX的活性显著降低(P<0.05)。
对照组和Ⅰ、Ⅱ组中GSH-PX的活性随着日粮Cu胁迫时间的延长无显著变化,第Ⅱ组在40 d时含量最低;第Ⅲ组GSH-PX的活性随着时间的延长逐渐升高,而第Ⅳ、Ⅴ组随时间的延长逐渐降低,表明日粮中过高剂量的Cu也可能会抑制GSH-PX的活性。
2.2 日粮Cu胁迫对罗非鱼幼鱼肝脏组织结构的影响
2.2.1 肝脏病理解剖的观察
第20天时,解剖发现对照组与第Ⅰ~Ⅳ组肝脏颜色正常,表面湿润光滑,质地柔软,富有弹性;第Ⅴ组肝脏颜色略发黄,质地柔软,弹性略差。第40天时,对照组与第Ⅰ、Ⅱ、Ⅲ组肝脏依旧正常,而第Ⅳ组肝脏颜色发黄,弹性变差;第Ⅴ组肝脏颜色呈淡黄色,质地脆软,部分出现颗粒变性。第60天时,对照组与第Ⅰ、Ⅱ组肝脏表现正常,第Ⅲ组肝脏颜色略发黄。第Ⅳ组肝脏颜色为土黄色,质地脆软,出现颗粒变性。第Ⅴ组肝脏颜色呈土黄色,质地脆软易碎,有明显的颗粒变性,部分可见出血斑点。
2.2.2 肝脏组织切片的观察
第20天时,对照组和第Ⅰ、Ⅱ、Ⅲ组肝脏细胞结构正常,肝细胞呈圆形或多角形,细胞膜完整清晰,细胞核圆形,染色比较深,细胞质染色较浅(图1-A1),肝小叶周边细胞呈放射状排列整齐,肝索结构明显(图1-A2);第Ⅳ组肝脏细胞中有较小的分散的空泡,细胞界限不清晰(图1-B1);第Ⅴ组肝细胞中圆形空泡较多,肝细胞拥挤肿大,核固缩现象明显,细胞界限模糊,出现轻度的脂肪变性(图1-B2)。

表7 日粮Cu胁迫条件下罗非鱼幼鱼肝脏中的GSH-PX活性(mg·g-1 prot)Table 7 Activity of GSH-PX in liver of juvenile GIFT tilapia under dietary Cu stress (mg·g-1 prot)

图1 日粮Cu胁迫条件下罗非鱼幼 鱼肝脏组织病理变化图注:H.E, ×400;其中,A1、A2为第20天时肝脏正常结构图, B1、B2分别为第20天时Ⅳ组和Ⅴ组的肝脏结构图, C1、C2、C3分别为第40天时Ⅲ、Ⅳ、Ⅴ组的肝脏结构图, D1、D2、D3分别为第60天时Ⅲ、Ⅳ、Ⅴ组的肝脏结构图。Fig. 1 The pathological changes of livers of juvenile GIFT tilapia under dietary Cu stressNote: H.E, ×400; A1 & A2, the normal structure of livers in 20th day; B1, B2, the histological structure of livers in group Ⅳ and Ⅴ in 20th day; C1, C2, C3, the histological structure of livers in group Ⅲ, Ⅳ and Ⅴ in 40th day; D1, D2, D3, the histological structure of livers in group Ⅲ, Ⅳ and Ⅴ in 60th day.
第40天时,对照组和第Ⅰ、Ⅱ组肝脏细胞结构正常;第Ⅲ组肝脏细胞出现分散的空泡,细胞界限模糊,有轻微的核固缩现象(图1-C1);第Ⅳ组肝脏出现轻度的脂肪变性,细胞空泡变大,肝索紊乱,细胞浆内出现细颗粒物质(图1-C2);第Ⅴ组肝脏脂肪变性加重,空泡明显变大,出现局灶性坏死(图1-C3)。
第60天时,对照组和第Ⅰ组肝脏细胞结构正常;第Ⅱ组肝脏细胞出现分散的空泡,细胞界限开始模糊;第Ⅲ组肝脏细胞中分散空泡变大,细胞界限更加模糊,核固缩现象明显,出现轻度脂肪变性(图1-D1);第Ⅳ组肝脏出现大面积的脂肪变性,细胞结构破坏,呈紊乱的一片红色(图1-D2);第Ⅴ组肝脏遭到严重破坏,局灶性坏死现象加剧,坏死处肝细胞崩解(图1-D3)。
3 讨论(Discussion)
脂质过氧化(lipid peroxidation, LPO)是反应脂质过氧化作用强弱的重要指标之一[12]。刘向阳等[13]在日粮中分别添加Cu 0.54 mg·kg-1(缺Cu)和6.05 mg·kg-1(正常Cu),发现缺Cu组肝脏中MDA比正常组提高了18%,血浆中MDA也相应升高9%,且肝脏中MDA的含量显著高于血浆中的含量。在本实验中,肝脏中MDA的含量略高于血清中MDA的含量,对照组与前3组血清中MDA的含量随时间的延长无显著变化,说明日粮中添加低于300 mg·kg-1Cu时,没有造成明显的脂质过氧化;而当日粮中Cu含量升高为1 057.29 mg·kg-1时,血清中MDA的含量渐渐升高;当添加量达到3 000 mg·kg-1后,血清中MDA的含量随胁迫时间的延长明显升高,表明在本试验条件下,日粮中Cu含量为1 057.29 mg·kg-1时,可引起罗非鱼血清中的脂质过氧化,同样在肝脏中也可得到类似的结论。
生物体内参与清除过氧化因子的物质主要包括:SOD、CuZn-SOD、GSH和GSH-PX等。在本研究中低浓度组血清中SOD的活性无显著差异,而高浓度组与对照组相比在前期显著升高,之后又逐渐降低。肝脏中SOD的活性在日粮中Cu含量为1 057.29 mg·kg-1和3 086.76 mg·kg-1时也表现出先升高后降低的趋势,且随着日粮中Cu浓度的升高,肝脏中SOD的活性呈下降趋势。Knox等[14]研究表明,肝脏中SOD的活性随着日粮中Cu含量的升高而降低,这与本研究的结果一致。鲁双庆等[15]在研究Cu对黄鳝肝脏保护酶SOD、CAT、GSH-PX活性的影响时发现,随着时间的推移,SOD活性表现出先抑制,之后升高又降低的变化趋势,本试验前期没有发现有抑制现象,这可能与Cu的浓度或胁迫时间的长短有关。肝脏是动物体内重要的解毒器官,有较强的主动调节能力,当Cu浓度升高时,罗非鱼肝脏会产生适应性的诱导反应,此时SOD活性增强,清除自由基使机体免受伤害,但当Cu浓度继续升高,或时间继续延长,超过肝脏的耐受极限,肝脏就会表现出中毒反应,最后导致SOD活性下降[16]。CuZn-SOD是所有生物体的一种重要的自由基清除剂,保护机体免受超氧阴离子的损害[17]。乔永刚[18]分别以硫酸铜和蛋氨酸铜为Cu源,在军曹鱼基础日粮中添加0、4、8、16、32、64 mg·kg-1Cu,发现对军曹鱼肝脏中CuZn-SOD的活性无显著影响。本试验中,对照组与前3组血清中CuZn-SOD的活性没有显著差异,这与乔永刚[18]的研究相一致;但当Cu含量超过1 000 mg·kg-1时,随着日粮中Cu胁迫时间的延长,CuZn-SOD的活性下降,而且随着日粮中Cu浓度的升高CuZn-SOD的活性也随之下降。肝脏中CuZn-SOD的活性也随着日粮中Cu的增加而下降,且日粮中Cu的添加量超过300 mg·kg-1时,随着时间的推移,CuZn-SOD的活性就开始下降,这也表明肝脏中CuZn-SOD的活性比血清中CuZn-SOD的活性更敏感,而且高Cu抑制了CuZn-SOD的活性。这可能是由于随着Cu含量的升高,自由基反应的速度加快,没有被及时清除的氧自由基就会破坏细胞结构,加速细胞衰老,损害细胞,因此,CuZn-SOD的活性降低可能与细胞解毒能力的过饱和有关。还原型谷胱甘肽(GSH)在分解过氧化物时起重要作用,也是生物体内含量丰富的抗氧化剂。刘慧等[19]在研究Cu对鲫鱼肝脏谷胱甘肽的影响时发现,在不同浓度的Cu诱导下,GSH含量升高,且认为肝脏GSH含量的升高是机体对Cu浓度升高的适应性反应。而在本试验前期,随着日粮中Cu含量的升高肝脏中GSH的含量也随之升高,这和刘慧等的研究结果一致。但在中后期第Ⅳ组和第Ⅴ组肝脏中GSH的含量开始下降,尤其是第Ⅴ组与对照组相比显著下降,而其他组没有显著变化,表明低浓度的Cu并没有对GSH产生诱导作用。而高浓度组GSH的含量随着暴露时间的延长而降低,可能是罗非鱼在高浓度Cu的胁迫下产生的大量活性氧直接与GSH结合,消耗了GSH;或是高浓度的Cu使得以GSH为底物的酶GSH-PX活性受到抑制,导致的GSH含量下降[20]。GSH-PX是生物体内广泛存在的一种酶,它能催化H2O2分解,从而保护细胞免受损害[21]。本实验中,在第20天时,随着日粮中Cu含量的升高,肝脏中GSH-PX的活性也随之升高,这与Shao等[22]的研究结果一致。而刘慧等[23]报道也表明较高浓度的Cu对彭泽鲫鱼肝脏中GSH-PX的活性均有不同程度的抑制作用;王凡等[24]也发现,随着Cu浓度的升高,栉孔扇贝内脏团中GSH-PX的活性表现出先抑制后诱导又抑制的规律。在本研究中,高浓度组随着时间的延长,肝脏中GSH-PX的活性也随之降低,而且在60 d时,随着日粮中Cu的升高,各组也表现出降低的趋势,这与刘慧等[23]、王凡等[24]的研究结果一致,机制可能是因为Cu含量升高,罗非鱼肝脏中对谷胱甘过氧化物酶代谢外源化合物的能力已达到饱和,或者可能是过氧化氢酶(消耗H2O2比GSH-PX快)活性显著提高,抑制了GSH-PX的活性。日粮中高Cu胁迫可促使膜脂质过氧化产物MDA含量增加,破坏细胞膜结构,对机体造成一定的损伤,同时,罗非鱼肝脏和血清中SOD活性与肝脏中GSH的含量、GSH-PX活性也发生相应变化。SOD和GSH-PX作为内源活性氧清除剂,在高Cu的胁迫下能清除体内过量的氧自由基,使动物在一定程度上减缓逆境的胁迫[21,25]。但随着Cu含量的继续升高或胁迫时间的继续延长,抗氧化酶的活性就会受到抑制,从而损伤细胞膜,降低生物的适应性[25]。
肝脏是Cu对鱼类损害的主要靶器官,同时也是脂肪代谢的重要器官,通常最容易也最常见的变性就是脂肪变性。一般情况下,肝细胞胞浆内没有脂肪滴,但如果胞浆内脂肪增多,出现一些不正常的脂肪滴或超过细胞所含脂肪滴的正常范围,则会发生肝细胞脂肪变性[26]。在本实验中,第Ⅴ组罗非鱼肝脏在第20天时就出现了轻微的脂肪变性,之后脂肪变性逐渐加重。第Ⅲ组和第Ⅳ组分别在第60天和第40天时也出现了轻微的脂肪变性。在本实验中,第Ⅳ、Ⅴ组在第20天时就出现细胞界限不清晰的现象,而第Ⅲ组在第40天时也出现了细胞界限模糊,有轻微核固缩的现象,其机制可能是由于Cu对细胞产生了毒性作用,抑制了细胞内酶的活性,使体内产生大量自由基,引发细胞膜的脂质过氧化作用,造成细胞的完整性受到破坏,细胞结构和功能受到影响。黄启福[27]认为,如果有比较强烈的有害刺激或者细胞内坏境严重紊乱时,会导致部分生物体细胞或局部组织急剧死亡(局灶性坏死),甚至整个肢体或器官坏死(全局性坏死)。在本实验中,第Ⅴ组在40天时出现散在的局灶性坏死,而到第60天时,局灶性坏死现象加重,原因可能是Cu中毒时,大量的Cu首先聚集在肝细胞核、线粒体和肝浆液中,在肝细胞溶酶体内贮存,当溶酶体被破坏后,Cu和水解酶被释放出来,损伤细胞结构,引起肝功能异常;如果肝脏从血液中吸收的Cu超过其贮存的限度,则可能抑制多种酶的活性,从而导致肝细胞变性、坏死[28]。
综上,本实验以吉富罗非鱼为研究对象,分别在日粮中添加0、3、30、300、1 000、3 000 mg·kg-1Cu,研究了对其抗氧化功能、脂质过氧化和肝脏组织结构的影响,得出以下主要结论:(1)日粮Cu胁迫条件下,膜脂质过氧化产物MDA含量增加,罗非鱼幼鱼血清和肝脏中MDA的含量随日粮中Cu含量的升高和胁迫时间的延长显著升高,而SOD、GSH-PX和CuZn-SOD的活性表现出先升高后降低的趋势,(2)随着暴露时间的推移和日粮中Cu含量的升高,各组间肝脏表现出不同程度的病变,主要是浊肿变性和脂肪变性,试验中第Ⅲ、Ⅳ、Ⅴ组均能观测到较为严重的肝脏病变;(3)在本试验条件下,吉富罗非鱼幼鱼日粮中Cu的实际含量不得高于42.36 mg·kg-1。
致谢:感谢广东海洋大学动物科学系412实验室全体同仁,以及广东恒兴集团湛江恒兴水产科技有限公司、广东吴川国联罗非鱼良种场对本试验的支持。
[1] Lapointe D, Pierron F, Couture P. Individual and combined effects of heat stress and aqueous or dietary copper exposure in fathead minnows (Pimephales promelas) [J]. Aquatic Toxicology, 2011, 104(1-2): 80-85
[2] Luoma S N, Rainbow P S. Metal Contamination in Aquatic Environments: Science and Lateral Management [M]. Cambridge: Cambridge University Press, 2008: 1-38
[3] 张亚南, 贺青, 陈金民, 等. 珠江口及其邻近海域重金属的河口过程和沉积物污染风险评价[J]. 海洋学报(中文版), 2013, 35(2): 178-186
Zhang Y N, He Q, Chen J M, et al. Heavy metal’s process in water and pollution risk assessment in surface sediments of the Zhujiang River Eatuary [J]. Acta Oceanologica Sinica (in Chinese), 2013, 35(2): 178-186 (in Chinese)
[4] 王文龙, 崔欣, 李成成, 等. 饲料中铜暴露对吉富罗非鱼幼鱼血红细胞微核和组织中铜蓄积的影响[J]. 生态毒理学报, 2014, 9(4): 757-764
Wang W L, Cui X, Li C C, et al. Effects of dietary copper exposure on micronucleus of erythrocyte and accumulation in different tissues of juvenile GIFT tilapia (Oreochromis niloticus) [J]. Asian Journal of Ecotoxicology, 2014, 9(4): 757-764 (in Chinese)
[5] Shaw B J, Handy R D. Dietary copper exposure and recovery in Nile tilapia, Oreochromis niloticus [J]. Aquatic Toxicology, 2006, 76(2): 111-121
[6] Handy R D. Dietary exposure to toxic metals in fish [M]// Taylor E W. Ed. Toxicology of Aquatic Pollution. Cambridge: Cambridge University Press, 1996: 29-60
[7] Van Vuren J H J, Vandermerwe M, Du Preez H H. The effects of copper on the blood chemistry of Clarias gariepinus (Claridae) [J]. Ecotoxicology and Environment Safety, 1994, 29(2): 187-199
[8] 汪华. 吉富罗非鱼对饲料铁、铜需要量的研究[D]. 武汉: 武汉工业学院, 2012: 15-27
Wang H. Study on nutrition requirements of iron and copper in genetically improved farmed tilapia [D]. Wuhan: Wuhan Polytechnic University, 2012: 15-27 (in Chinese)
[9] 于丹. 饲料Cu、Fe对罗非鱼幼鱼生长、生理机能及器官微量元素含量的影响[D]. 南宁: 广西大学, 2010: 4-30
Yu D. Effect of dietary Cu and Fe supplement on growth performance, physiological function and the trace element concentration of the different organs in Oreochromis niloticus×O.aureus [D]. Nanning: Guangxi University, 2010: 4-30 (in Chinese)
[10] Jacquet C, Thermes V, Luze A, et al. Effects of microcystin-LR on development of medaka fish embryos (Oryzias latipes) [J]. Toxicon, 2004, 43(2): 141-147
[11] 王振, 金小伟, 王子健. 铜对水生生物的毒性: 类群特异性敏感度分析[J]. 生态毒理学报, 2014, 9(4): 640-646
Wang Z, Jin X W, Wang Z J. Taxon-specific sensitivity differences of copper to aquatic organisms [J]. Asian Journal of Ecotoxicology, 2014, 9(4): 640-646 (in Chinese)
[12] 贾秀英, 董爱华. Cd、Cr(Ⅵ)及复合污染对鲫鱼组织脂质过氧化的影响[J]. 浙江大学学报(农业与生命科学版), 2003, 29(3): 325-328
Jia X Y, Dong A H. Effects of Cd, Cr(Ⅵ) single and combined pollution on lipid peroxidation in Cruciar carp [J]. Journal of Zhejiang University (Agric. & Life Sci.), 2003, 29(3): 325-328 (in Chinese)
[13] 刘向阳, 计成, 丁丽敏, 等. 日粮硒、铜水平对大鼠体内有关的抗氧化物酶活性及脂质过氧化产物的影响[J]. 中国农业大学学报, 1998, 3(3): 107-112
Liu X Y, Ji C, Ding L M, et al. The effects of dietary selenium and copper on rat’s activity of some antioxidant enzymes and lipid peroxidation products [J]. Journal of China Agriculture University, 1998, 3(3): 107-112 (in Chinese)
[14] Knox D, Cowey C D, Adron J W. Effects of dietary copper and copper: Zinc ratio on rainbow trout, Salmo gairdneri [J]. Aquaculture, 1982, 27(2): 111-119
[15] 鲁双庆, 刘少军, 刘红玉, 等. Cu2+对黄鳝肝脏保护酶SOD、CAT、GSH-PX活性的影响[J]. 中国水产科学, 2002, 9(2): 138-141
Lu S Q, Liu S J, Liu H Y, et al. Effects of Cu2+on activities of protecting enzymes SOD, CAT and GSH-PX in liver tissue of Monopterus albus [J]. Journal of Fishery Sciences of China, 2002, 9(2): 138-141 (in Chinese)
[16] 戴伟, 杜华华, 付玲琳, 等. 不同水平铅对罗非鱼生长性能及组织中铅残留的影响[J]. 浙江大学学报(农业与生命科学版), 2009, 35(3): 345-349
Dai W, Du H H, Fu L L, et al. Effects of dietary Pb at different levels on growth performance and Pb residues in tissues of tilapia (Oreochromis niloticus) [J]. Journal of Zhejiang University (Agric. & Life Sci.), 2009, 35(3): 345-349 (in Chinese)
[17] 张博润, 谭华荣. 超氧化物歧化酶的研究进展和应用前景[J]. 微生物学通报, 1992, 19(6): 352-357
Zhang B R, Tan H R. Research progress and application prospects of superoxide dismutase [J]. Microbiology China, 1992, 19(6): 352-357 (in Chinese)
[18] 乔永刚. 军曹鱼微量元素锌铁铜营养生理的研究[D]. 青岛: 中国海洋大学, 2007: 70-79
Qiao Y G. Study on nutrition physiology of zinc, iron and copper in cobia (Rachycentron canadum) [D]. Qingdao: Ocean University of China, 2007: 70-79 (in Chinese)
[19] 刘慧, 王晓蓉, 张景飞,等. 铜及其配合物对鲫鱼肝脏谷胱甘肽的影响[J]. 南京大学学报: 自然科学版, 2004, 40(3): 356-361
Liu H, Wang X R, Zhang J F, et al. Effects of copper and its complex compound (Cu-EDTA) on the Gluta thione system of liver in goldfish (Carassius auratus) [J]. Journal of Nanjing University: Natural Science, 40(3): 356-361 (in Chinese)
[20] 陈亮, 郭红岩, 沈红, 等. 低浓度铅暴露对鲫鱼肝脏抗氧化系统的影响[J]. 环境化学, 2002, 21(5): 485-489
Chen L, Guo H Y, Shen H, et al. Effect of trace lead on the antioxidant system of fish liver [J]. Environmental Chemistry, 2002, 21(5): 485-489 (in Chinese)
[21] Kanak E G, Dogan Z, Eroglu A, et al. Effects of fish size on the response of antioxidant systems of Oreochromis niloticus following metal exposures [J]. Fish Physiology and Biochemistry, 2014, 40(4): 1083-1091
[22] Shao X, Liu W, Xu W, et al. Effects of dietary copper sources and levels on performance, copper status, plasma antioxidant activities and relative copper bioavailability in Carassius auratus gibelio [J]. Aquaculture, 2010, 308(1-2): 60-65
[23] 刘慧, 王晓蓉, 张景飞, 等. 铜及其EDTA配合物对彭泽鲫鱼肝脏抗氧化系统的影响[J]. 环境化学, 2004, 23(3): 263-267
Liu H, Wang X R, Zhang J F, et al. Effects of copper and its EDA complex (Cu-EDTA) on the antioxidant system of Carassius auratus liver [J]. Environmental Chemistry, 2004, 23(3): 263-267 (in Chinese)
[24] 王凡, 赵元凤, 吕景才, 等. 铜污染对扇贝内脏团抗氧化酶活性的影响[J]. 水产科学, 2008, 27(12): 622-624
Wang F, Zhao Y F, Lu J C, et al. Effect of Cu2+on the antioxidant enzymes of scallop Chlamys farres viscera [J]. Fisheries Science, 2008, 27(12): 622-624 (in Chinese)
[25] Selvi M, ÇavaT, Çlan Karasu Benli A, et al. Sublethal toxicity of esbiothrin relationship with total antioxidant status and in vivo genotoxicity assessment in fish (Cyprinus carpio L., 1758) using the micronucleus test and comet assay [J]. Environmental Toxicology, 2013, 28(11): 644-651
[26] 郭慕依, 叶诸榕. 病理学[M]. 上海: 上海医科大学出版社, 2001: 7-11
[27] 黄启福. 病理学[M]. 北京: 科学出版社, 2004: 35-36
[28] Azizishirazi A, Dew W A, Bougas B, et al. Dietary sodium protects fish against copper-induced olfactory impairment [J]. Aquatic Toxicology, 2015, 161C(4): 1-9
◆
Effects of Dietary Copper Stress on Antioxidation, Lipid Peroxidation and Tissue Structure of Liver in Juvenile GIFT Tilapia (Oreochromisniloticus)
Wang Wenlong1, Cui Xin1, An Lilong1,*, Xiao Mei2, #, Gao Han3, Li Chengcheng1, Xing Xing4, Li Yanwei1, Xu Yingmei1
1. Department of Animal Science, Guangdong Ocean University, Zhanjiang 524088, China 2. Department of Animal Medicine, Guangdong Ocean University, Zhanjiang 524088, China 3. Department of Pharmaceutics, China Pharmaceutical University, Nanjing 211198, China 4. The People’s Republic of China Qinzhou Free Trade Port Area Entry-Exit Inspection and Quarantine Bureau, Qinzhou 535008, China
16 Junuary 2015 accepted 17 March 2015
GIFT tilapia is an important economic species in aquaculture production in coastal regions in south of China, where is now facing an increasing challenge from Cu contamination with accelerated urbanization and industrialization. In order to evaluate the effects of dietary Cu stress on antioxidant activity and liver structure of juvenile GIFT tilapia, a total of 1 080 fishes were fed with 6 different concentrations of Cu in diets (0, 3, 30, 300, 1 000, 3 000 mg·kg-1) for 60 days. Antioxidation of serum and liver was measured, and the pathological changes of liver were observed. The results showed that the concentration of MDA in serum and liver increased significantly with exposure time and the increase of Cu accumulation in diets. Activities of SOD, CuZn-SOD and GSH-PX showed a down trend after a rise. Meanwhile, cloudy swelling and fatty degeneration in cells of liver was observed, especially pathological changes of liver aggravated when Cu concentration was increased to group Ⅲ, Ⅳ and Ⅴ. It could be concluded that dietary Cu stress depressed the antioxidant activity and damaged the liver of tilapia. Therefore, we suggest that Cu concentration in diets for juvenile tilapia should not be more than 42.36 mg·kg-1.
dietary copper stress; GIFT tilapia; pathological changes in liver; antioxidation; lipid peroxidation; cloudy swelling degeneration
广东省科技计划项目(2010B090400376);国家级大学生创新创业训练计划项目(201310566005)
王文龙(1989-),男,硕士,研究方向为动物营养与环境、生态毒理学,E-mail: wangwenlong2012@yeah.net;
*通讯作者(Corresponding author), E-mail: anlilong@126.com;
10.7524/AJE.1673-5897.20150116001
2015-1-16 录用日期:2015-3-17
1673-5897(2015)2-266-10
X171.5
A
安立龙(1967-),男,博士,教授,主要研究方向为动物营养与环境。
效梅(1965-),女,教授,主要从事动物组织与胚胎工程的科研和教学工作。
# 共同通讯作者(Co-corresponding author), E-mail: xiao0812@126.com
王文龙, 崔欣, 安立龙, 等. 日粮中铜胁迫对吉富罗非鱼幼鱼抗氧化、脂质过氧化及肝脏组织结构的影响[J]. 生态毒理学报, 2015, 10(2): 266-275
Wang W L, Cui X, An L L, et al. Effects of dietary copper stress on antioxidation, lipid peroxidation and tissue structure of liver in juvenile GIFT tilapia (Oreochromis niloticus) [J]. Asian Journal of Ecotoxicology, 2015, 10(2): 266-275 (in Chinese)
