传染性单核细胞增多症患儿细胞免疫功能变化及意义
2015-06-05刘志强段荣柯江维
刘志强,段荣,柯江维
(江西省儿童医院检验科,江西 南昌330006)
传染性单核细胞增多症(infectious mononucleosis,IM)是由 EB 病毒(Epstein-Barr virus,EBV)感染引起的淋巴细胞增生性传染病,小儿时期常见。临床上以发热、咽峡炎、淋巴结及肝脾大、外周血中淋巴细胞增加并出现异型淋巴细胞等为特征[1.2]。近年来,随着临床免疫学研究的发展,本病免疫功能的改变受到更多的关注。DNT细胞 (CD3+CD4-CD8-T细胞)是新近发现的一类细胞表面既不表达CD4分子同时也不表达CD8分子的T细胞群,它属于双阴性调节性T淋巴细胞,对免疫应答有抑制作用,是机体在感染、肿瘤及自身免疫等过程中进行调节的关键因素[3]。本文通过检测IM患儿不同病期外周血DNT细胞与T淋巴细胞分化抗原(CD)的表达水平,并与健康儿童的相应指标作对比分析,观察IM患儿细胞免疫状态的变化及可能对预后的影响。
1 资料与方法
1.1 标本来源 3例IM患儿均为本院血液科2011年9月至2013年7月收治的住院患儿。男36例,女27例。年龄12个月~9岁。均符合IM诊断标准[4]。健康对照组30例,均为同期体检的健康儿童,男17例,女13例;年龄1~8.5岁。两组间性别、年龄相比无显著性差异(P>0.05)。
1.2 检测方法
1.2.1 标本采集 采集IM患儿急性期、恢复期及对照组健康儿童清晨空腹静脉血lml,置含肝素抗凝管中,标本2h内检测。
1.2.2 淋巴细胞CD系列表达检测 取美国BD公司CD3-PerCP、CD4-FITC、CD8-PE 鼠抗人荧光单克隆抗体混合试剂20ml,加入肝素抗凝血100μl,混匀,室温避光孵育20min,分别加入红细胞裂解液1ml,室温避光放置 10min,1000r/min 离心 5min,弃上清液,用PBS洗涤2次,弃上清,加PBS 250μl上机,采用BD公司FACSCanto流式细胞仪检测受检者外周血淋巴细胞CD3+CD4-CD8-淋巴细胞及CD3+、CD3+CD4+CD8-、CD3+CD4-CD8+淋巴细胞的百分率,采用BD FACSDiva软件进行结果分析。
1.3 统计学处理采用SPSSl3.0软件处理,数据以表示,组间均数比较采用配对和成组设计t检验,P<0.05为差异有统计学意义。
2 结果
急性期IM患儿DNT细胞、CD3+T细胞、CD3+CD4-CD8+T细胞百分比显著高于恢复期IM患儿和对照组儿童 (P<0.01),CD3+CD4+CD8-T细胞百分比显著低于恢复期IM患儿和对照组儿童 (P<0.01)。恢复期IM患儿DNT细胞、CD3+T细胞、CD3+CD4-CD8+T细胞、CD3+CD4+CD8-T细胞百分比与对照组比较无显著性差异(P>0.05)。见表1。
表1 IM患儿与对照组DNT细胞及T淋巴细胞亚群水平测定值(s,%)
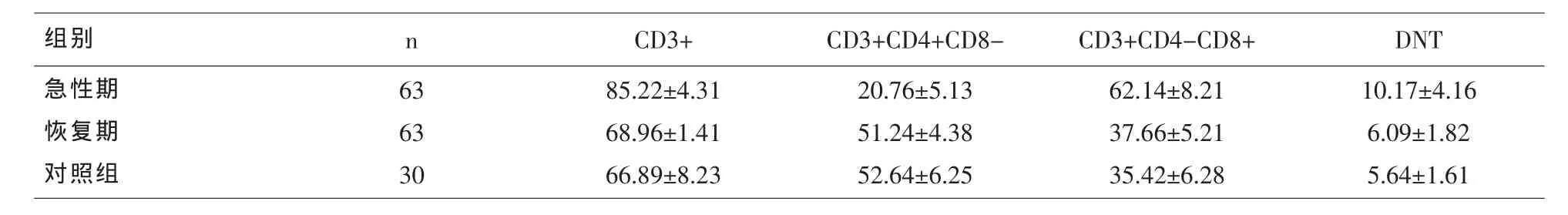
表1 IM患儿与对照组DNT细胞及T淋巴细胞亚群水平测定值(s,%)
组别 n CD3+ CD3+CD4+CD8- CD3+CD4-CD8+ DNT急性期恢复期对照组63 63 30 85.22±4.31 68.96±1.41 66.89±8.23 20.76±5.13 51.24±4.38 52.64±6.25 62.14±8.21 37.66±5.21 35.42±6.28 10.17±4.16 6.09±1.82 5.64±1.61
3 讨论
IM是儿童原发性EBV感染的典型表现,有关研究发现EBV对机体免疫功能的影响可能在IM的发病过程中起着重要作用[5]。典型的IM约80%是CD3+CD4-CD8+细胞毒性T细胞(CTL)扩增活化,它们有良好的溶细胞能力,不仅能识别并杀死EBV感染的B细胞,抑制其分化增殖,还能通过释放过量细胞因子导致IM症状[6]。所以IM患儿的症状不是病毒复制直接引起,而是T淋巴细胞免疫反应的结果。亦有研究显示T细胞激活程度和IM临床症状严重程度有一定关联[7]。因此监测IM患儿细胞免疫功能的改变、掌握正常免疫个体T细胞亚群变化的规律有重要的临床意义。
本实验测定了IM患儿不同时期外周血淋巴细胞 CD3+、CD3+CD4+CD8-、CD3+CD4-CD8+的表达,结果显示:急性期CD3+、CD3+CD4-CD8+T细胞百分比明显增高,CD3+CD4+CD8-T细胞百分比明显降低,与林珊[8]报道一致。恢复期CD3+CD4+CD8-T细胞百分比升高、CD3+CD4-CD8+T细胞百分比降低,但与健康儿童无显著性差异 (P>0.05),CD3+T细胞百分比与健康儿童比较无显著性差异 (P>0.05),与金海荣等[9]的报道不相一致,是否因样本因素或其它因素有待进一步的观察。
在急性EBV感染后,大量EBV特异性CD3+CD4-CD8+T细胞增殖,它们有很强的细胞毒作用功能,能杀灭感染的B细胞,并消除病毒[10]。而CD3+CD4+CD8-T细胞在细胞免疫过程中起到免疫辅助作用,同时也具备杀伤功能,在维持EBV感染后细胞免疫反应与被感染细胞清除的平衡中起到一定的作用[11]。本文中IM患儿急性期与对照组健康儿童比较CD3+CD4+CD8-T明显下降,CD3+CD4-CD8+T明显升高,而且CD3+CD4-CD8+T急性期与恢复期比较明显升高且有显著性差异(P<0.05)。分析原因由于IM患儿急性期CD3+CD4-CD8+T淋巴细胞大量扩增以控制EBV诱导B淋巴细胞增殖,而CD3+CD4+CD8-T淋巴细胞在辅助此过程中被消耗。
以往研究发现,在外周DNT细胞中存在去甲基化的CD8基因[12],对DNT细胞基因高保守序列进行多个基因位点分析,得出DNT细胞的前体细胞可能是CD8+T细胞[13],以上研究暗示DNT细胞可能来源于CD3+CD4-CD8+T细胞。体外研究表明,人类DNT细胞在体外被激活后可产生TNF-α,IFN-γ,而不分泌IL-4[14];从转基因小鼠中纯化出的DNT细胞可通过抑制同系基因型CD4+T细胞或CD8+T细胞来发挥其免疫抑制功能[15]。而Kyttaris等[16]用IL-23R处理取自 MRL/lpr小鼠淋巴结的淋巴细胞可诱导出DNT细胞,此DNT细胞亦高表达IL-17,向淋巴细胞缺陷小鼠输注此DNT细胞后可导致小鼠狼疮样肾炎发生。本研究发现急性期IM患儿DNT细胞是增多的,推测其可能因为EBV的感染,导致大量EBV特异性CD3+CD4-CD8+T细胞增殖,进而促进DNT细胞大量增殖,协同促进炎症反应的加重。但对于IM患儿DNT细胞确切的作用及机理目前还不清楚。
总之,IM是T细胞功能紊乱性疾病,检测外周血DNT细胞与T细胞亚群变化对评估患儿的细胞免疫功能状况,判断病情预后具有十分重要的临床意义,同时,针对IM患者细胞免疫功能紊乱的状态,在原治疗的基础上进行细胞免疫调节治疗,一定程度上可促进病情恢复,有效改善预后。
[1]Souza TA,Stollar BD,Sullivan JL,et al.Influence of EBV on the Peripheral Blood Memory B Cell Compartmentl[J].J Immunol,2007,179(5):3153-3160.
[2]PaulGA.Recentadvance in the understanding ofinfectious mononucleosis:are prospects improved for treatment or control?[J].Expert Rev Anti Infect Ther,2006,4(6):1039-1049.
[3]Thomson CW,Lee BP,Zhang L.Double-negative regulatory T cells:non-conventional regulators[J].Immunol Res,2006,35 (I-2):163.178.
[4]胡亚美,江载芳,诸福棠.实用儿科学[M].第 7版.北京:人民卫生出版社,2003,821-827.
[5]叶中绿,庞伟君,黄秀兰.EB病毒感染患儿细胞因子水平与T细胞亚群检测的临床意义 [J].现代预防医学,2008,35(12):2306-2308.
[6]Williams H,Crawford D.Epsteion-Barr virus:the impact of scientific advances on clinical practice[J].Blood,2006,107(3):862-869.
[7]胡晨曼,孙梅.EB病毒感染及其免疫反应[J].国际儿科学杂志.2010,37(1):33-35.
[8]林珊.十种血液病患儿外周血T淋巴细胞亚群检测及临床意义[J].实验与检验医学,2009,27(2):133-134.
[9]金海荣,马名方,蔡云祥.小儿传染性单核细胞增多症淋巴细胞亚群动态观察及临床意义[J].浙江实用医学,2010,15(6):453-454.
[10]Margaret L.Gulley and Weihua Tang Laboratary Assays for Epstein-Barr Virus-Related Disease [J].J Molecular Diagnostics,2008,10(4):279-292.
[11]姚瑶,谢正德,申昆玲,等.原发性EB病毒感染后特异性T细胞免疫功能的研究进展[J].国际儿科学杂志,2010,37(1):30-32.
[12]Landolfi MM,Van Houten N,Russell JQ,et al.CD2-CD4-CD8-lymphnode T lymphocytes in MRL lpr/lpr mice are derived from a CD2+CD4+CD8+thymic precursor[J].Immunol,1993,151:1086-1096.
[13]Han M,Harrison L,Kehn P,et al.Invariant or highly conserved TCRa are expressed on double-negative(CD3+CD4-CD8-)and CD8+T cells[J].J Immunol,1999,1631:301-311.
[14]陈炯,杜敏,杨兵,等.DNT细胞分离鉴定及其在正常人外周血中含量的检测[J].国际外科学杂志,2009,36(3):154-157.
[15]Yonezawa A,Onaka T,Imada K,et a1.Cytomegalovims-associated infectious mononu-cleosis like syndrome accompanied by transient Monoclonal expansion of CD8+T-cells[J].Rinsho Ketsueki,2009,50(8):652-657.
[16]Kyttaris VC,Zhang Z,Kuchroo VK,et al.Cutting edge:IL-23 receptor deficiency prevents the development of lupus nephritis in C57BL/6-lpr/lpr mice[J].Immunol,2010,184:4605-4609.
