成骨细胞中小凹和小凹蛋白在其增值分化等过程中的作用
2015-06-05郭俊峰综述谭颖徽审校
郭俊峰综述,谭颖徽审校
(第三军医大学附属新桥医院口腔科,重庆400037)
成骨细胞中小凹和小凹蛋白在其增值分化等过程中的作用
郭俊峰综述,谭颖徽审校
(第三军医大学附属新桥医院口腔科,重庆400037)
近年来,小凹和小凹蛋白成为生物膜和细胞生物学领域的一个新热点,越来越受到国内外学者的关注。尤其是当今社会,科学技术飞速发展,交通工具日新月异,交通伤害防不胜防,颌面部创伤的诊治和修复显得越来越重要,学者们对颌面部成骨修复研究也越来越多。成骨细胞中的小凹和小凹蛋白在成骨过程中的作用也越来越受到关注,本文简要概括了成骨细胞中的小凹和小凹蛋白的相关作用。
1 小凹(Caveolae)及其蛋白质家族
1953年,Palade第一个用电子显微镜观测到心脏连续内皮细胞上亚细胞结构Caveolae,并以“质膜囊泡”(plasmalemmal vesicles)命名。随后,张勤勤等[1]在胆囊上皮细胞中也发现了类似的凹陷的“窝”状结构。细胞质膜微囊即小凹(Caveolae)也称作陷窝是一类50~100 nm大小的细胞膜上呈长颈瓶样内陷入胞浆的细胞膜亚单位结构[2-3],其含有小蛋白质(18~24 kDa),由小凹蛋白基因家族编码,在哺乳动物中主要是Caveolin-1(Cav-1)、Caveolin-2(Cav-2)、Caveolin-3(Cav-3)[4-6],Cav-1由在跨物种序列高度保守的三个外显子组成,有两个亚型:178个残基的Cav-1a和147个残基的Cav-1b,它们来自一个内部翻译起始位点Met32[7]。Cav-2是由三个外显子编码的162个残基的蛋白质组成,与Cav-1的基因序列高度相似。Cav-2α是完整的蛋白质,已确定有两种其他亚型[8],但是没有特异性。Cav-3是由两个外显子编码的151个残基的蛋白质组成[9]。在小鼠中这3个基因定位于6号染色体上;在人类中,Cav-1和Cav-2基因定位到染色体位点7q31.1的D7S522的遗传标记,其中包括已知的脆弱点附近(FRA7G),Cav-3定位到3p25。尽管假设Cav-1和Cav-2源自基因重复,但Cav-1和Cav-3却具有高度一致的氨基酸序列[10]。Cav-1(也称为Caveolin或VIP21)是小凹结构的基础和标志蛋白,也是第一个被确定为小凹的结构部件和运输高尔基体衍生的囊泡的家庭成员。根据细胞类型的不同,Cav-1可能有可溶性细胞质形式以及分泌形式[5,11]。Cav-1广泛表达,在脂肪细胞、内皮细胞、成纤维细胞、平滑肌细胞、成骨细胞及多种上皮细胞中高水平表达[10]。
Cav-2和Cav-3(也称为M-caveolin)比Cav-1后发现。Cav-2与Cav-1常共表达,而Cav-3主要表达在横纹肌细胞[5,11]。大多数的小凹在细胞和组织中的形成只需要Cav-1表达,而Cav-2的缺失并不影响小凹本身的形成,最近的研究表明Cav-2在Cav-1依赖的小凹动力学和专门的小凹蛋白功能中有一定的作用[12]。另一方面,在骨骼肌细胞和心肌细胞中的小凹主要由Cav-3形成[10]。
小凹和小凹蛋白参与囊泡运输、细胞内外钙稳态、胆固醇稳态和内吞作用[5,11]。此外,它们还在信号转导、细胞增殖和肿瘤进展中发挥重要作用[12-13]。从功能上看,小凹和小凹蛋白对于区室化和各类信号分子(包括受体和非受体酪氨酸激酶,血管内皮型一氧化氮合酶,和小GTP酶等)的浓度以及干扰下游许多蛋白质和癌基因蛋白(如c-Src、H-Ras和增殖作用蛋白激酶等)的活性和信号转导至关重要[5-6,11]。最近的研究也表明,小凹蛋白可以独立发挥他们的作用,无论是在有小凹的细胞(如心肌细胞和成纤维细胞),还是那些缺乏小凹的细胞(如神经元和白细胞)中发挥作用[14]。因此,这些发现表明,小凹蛋白功能的实现不一定依赖于小凹的存在,这些蛋白质可能发挥与他们相关的小凹以外的和其他相关的生物学作用。同时,也可以根据需要重建小凹来恢复小凹依赖的相关功能,如用全长PTRF-CAVIN转染重建小凹结构[15]。
由于小凹和小凹蛋白的普遍存在性和组织的差异表达,小凹蛋白对于正常细胞和组织的生理非常重要,并参与调控多种人类疾病。如小凹可以影响成骨细胞、破骨细胞等细胞的各种生理活动从而调控人体骨量稳态,小凹蛋白可以用于某些恶性肿瘤的辅助诊断等[16-17]。
2 小凹和小凹蛋白-1(Caveolin-1)与成骨细胞
成骨细胞中存在大量的小凹结构[18],它主要表达Cav-1和Cav-2[19],小凹结构是刺激感受装置和信号集成平台,它能浓缩并区室化信号分子,对信号传播、放大甚至可以为各种信号因子之间的交换沟通创造局部环境[20],其中,Cav-1的分布最为广泛,是形成小凹结构的主要分子基础和功能蛋白。在成骨细胞中,小凹及Cav-1在其成骨过程中起着重要作用。
正常小鼠和人的成骨细胞高水平的表达Cav-1和Cav-2,而检测不到Cav-3的表达[21-23],从功能上看,Cav-1对成骨细胞的生理学影响和功能似乎比Cav-2有更为密切的联系,Cav-2不介导小凹的内陷,与Cav-1相比,Cav-2只能与很少的分子发生相互作用[24]。因此,在成骨细胞和骨组织中几乎没有Cav-2的相关研究,而到目前为止,大多数研究都聚焦在Cav-1及其如何影响成骨细胞分化、增殖、矿化等方面。
一些实验研究表明,Cav-1可以通过调节内皮型一氧化氮合酶的酶活性作为成骨细胞的一个调节器。这种酶引起的一氧化氮的产生,是成骨细胞功能调节的重要介质,其定位于小凹结构中Cav-1脚手架域[23]。通过与内皮型一氧化氮合酶结合,Cav-1可以调节一氧化氮的产生,从而调节成骨细胞的活性。同时,在成骨细胞的小凹中发现一些Cav-1丰富的膜信号复合体,如生长因子受体、Src家族和丝裂原活化蛋白激酶信号通路酪氨酸激酶,可被Cav-1进行分选、加工、修饰进而在成骨细胞的生长和分化中发挥相应的作用[25]。其次,Cav-1可以通过多条胞内信号转导通路(如MAPK/ERK、eNOS/NO、Wnt/β-catenin等)调节成骨细胞的分化成熟。
Rubin等[25]发现Cav-1有助于骨祖细胞保持低分化状态,而它的缺失会导致骨成熟更迅速。换句话说,Cav-1可以调节细胞内信号向骨祖细胞传递,选择性的阻止这些信号引起的成骨细胞分化。Boyan等[26]发现饲养8周的Cav-1沉默的小鼠生长板形态特征发生改变,包括骨小梁细胞过度增多且细胞肥大。提示Cav-1成骨细胞的增殖分化中有一定作用(图1)。Janet等[27]通过Cav-1沉默的小鼠模型研究发现,其骨骼大小和劲度都有所增强,说明Cav-1在骨代谢中具有重要作用。此外,也有证据表明Cav-1基因参与调控成骨细胞介导的细胞外基质的钙化。Rubin等[25]还发现Cav-1沉默的小鼠虽然具有正常的骨骼性状,但在骨小梁内皮质骨的尺寸增大,坚硬的细胞外基质大量沉积。这些数据表明,Cav-1抑制骨基质矿化,与它抑制对成骨细胞分化的影响一致(图1),但其具体作用机制依然不明。然而,Sawada等[24]研究强调Cav-1在骨矿化中发挥的作用是很复杂的。他们的研究表明,在小鼠成骨细胞MC3T3-E1中,当Cav-1过表达时,矿化增强,这个结论与上面的讨论完全相反。Serra等[10]发现,在小鼠成骨细胞MC3T3-E1中,Cav-1以膜基质囊泡的形式分泌,释放在细胞外基质,增加成骨细胞的分化。在小鼠成骨细胞MC3T3-E1中,沉默Cav-1会减少基质囊泡形成,表明分泌型Cav-1与增强骨细胞钙化相关的膜基质囊泡的形成密切相关(图1)。即Cav-1可以作为脂蛋白颗粒分泌到细胞外。我们推测,胞浆中分泌型Cav-1可以不通过小凹结构而作为膜基质囊泡直接参与和直接影响一些信号途径,从而独立的对成骨外基质的钙化起着一定促进的作用。

图1 [10]Cav-1参与成骨细胞分化和骨形成
2.1 雌激素/植物雌激素与Cav-1
成骨细胞分化为骨细胞经过了增殖、分化及矿化等三个不同时期,雌激素对这些阶段均有不同程度的正性调节作用,多条信号转导途径介导了雌激素对成骨细胞分化相关基因表达的调控。近年研究表明,雌激素除通过经典的胞浆/核雌激素受体(ER)途径之外,还可以通过胞膜ER信号途径如内皮型一氧化氮合酶(eNOS/NO)等途径调节成骨细胞的分化成熟,并在整体实验中得到证实。
该研究发现胞膜ER、eNOS等信号分子和激酶均存在于的小凹结构中,雌激素对于增殖和矿化期小鼠成骨细胞MC3T3-E1中Cav-1蛋白表达无明显影响,但可以剂量依赖性下调分化期细胞Cav-1表达,即Cav-1可以负性调控雌激素对分化期小鼠成骨细胞MC3T3-E1的促分化作用[28]。8-Prenylnaringenin(8-PN)是迄今发现活性最强的植物雌激素,其改善实验性绝经后骨质疏松的作用已有报道。该研究发现,8-PN具有同雌激素类似的调节Cav-1对成骨细胞分化影响的作用,提示植物雌激素8-PN可促进小鼠成骨细胞MC3T3-E1的分化成熟,其促成骨细胞分化作用可能与Cav-1途径有关[29]。
2.2 PTRF/cavin-1与Cav-1
PTRF/cavin-1在各种细胞中均高表达,包括脂肪细胞、成骨细胞和肌肉(心脏、骨骼、平滑肌)细胞。PTRF/cavin-1和磷脂酰丝氨酸具有高结合亲,从而促进其掺入小凹结构;在小凹中,PTRF/cavin-1位于Ω形的细胞质膜微区,有研究证实,PTRF/cavin-1的丢失会导致小凹结构的减少,改变膜内组织信号通路,这可能会导致细胞行为改变[30]。同时,PTRF/ cavin-1与小凹的形成有关[30],其在小凹中大量存在,并且与Cav-1共分布于小凹(位于小凹的胞浆侧)中和细胞骨架蛋白有着密切的联系[31-32]。新近研究表明,小凹蛋白与PTRF/ cavin-1在细胞的迁移中起重要的作用,提示PTRF/cavin-1可能在Cav-1和小凹的上游介导细胞的迁移。而过度表达PTRF/cavin-1或者下调PTRF/cavin-1的表达能引起Cav-1表达量相应的改变[33]。
有研究表明PTRF/cavin-1可以改变前列腺癌细胞来源的细胞外小泡和内化衰减外囊泡介导的成骨细胞和破骨细胞增殖[15]。但其具体作用途径、作用效应与机制还不明确,尤其是在前列腺癌的研究中,成骨细胞和破骨细胞在前列腺癌发生发展中的作用等相关问题还有待进一步探讨。同时,相关研究还指出PTRF/cavin-1和Cav-1共定位与小凹结构,直接与细胞骨架网络相互作用,形成Caveolae-caveolin-1-PTRF/cavin-1这样一个相互沟连的极为复杂的调控系统,为细胞内外各种信号分子、信号通路等提供了一个交换沟通的大型分子平台。目前,这方面的研究主要在心血管系统中的血管平滑肌方面[33],而在成骨细胞中还未见相关报道,因此我们可以对其进行进一步的深入研究。
2.3 Wnt/β-catenin信号通路与Cav-1
近年来的研究表明,Wnt/β-catenin途径在促进成骨细胞分化方面具有十分重要的作用。通过Wnt信号途径可以增加骨量,包括更新干细胞,诱导成骨细胞形成及抑制成骨细胞和骨细胞凋亡等[34-35]。Galbiati等[36]在MDCK细胞中使用共聚焦显微镜观察到Wnt通路的核心分子β-catenin浓缩于小凹中,与小凹形成稳定的复合物。Cav-1可以调整βcatenin的核定位[37],研究结果提示β-catenin在小凹结构中的定位与解离平衡对于Wnt/β-catenin信号的转导有重要作用。Cav-1可以通过Wnt/β-catenin通路调节成骨细胞成熟分化过程,小鼠成骨细MC3T3-E1分化成熟过程中下调Cav-1表达后,使β-catenin游离从而被降解,储备β-catenin数量下降,导致矿化期Wnt/β-catenin信号消减,有利于钙化结节的形成,但不影响基质形成期[38]。
3 钙敏感受体(CaSR)、Cav-1与成骨细胞
在骨骼中,细胞外钙离子招募刺激骨祖细胞增殖、分化为成熟的成骨细胞,并形成骨及使之矿化。细胞外钙离子可能通过CaSR抑制破骨细胞的形成和活性,CaSR动员细胞外钙离子往往是在钙离子缺乏和当钙离子丰富而又需要保留在骨骼中时发生[39]。Chang等[40]用小鼠模型证明了在成骨细胞和软骨细胞中的CaSR是调节骨骼发育的关键调节器。CaSR在通过感知血液中钙离子浓度的细微变化和产生/分泌钙离子调节激素,甲状旁腺激素、降钙素、FGF23和1,25(OH)2D3维持钙离子稳态,以便适当的调节钙离子通过肾脏、肠、骨进入或者排出血液。此外,Cav-1除了参与骨的形成,它似乎也参与细胞内外钙离子稳态的调节和影响骨吸收,如图2所示,体内钙稳离子态由成骨细胞和破骨细胞的活性来调控。Jung等[41]获得的证据表明,Cav-1可能通过结合CaSR和调节其活性来调控生理性钙离子稳态。在骨细胞中,CaSR和Cav-1共定位于小凹,并形成蛋白质-蛋白质复合体。在正常生理条件下,Cav-1参与调节细胞外钙离子浓度增加。
众所周知,改变细胞外钙浓度会改变破骨细胞的形态和抑制骨吸收[42],在成骨细胞中细胞外钙浓度的增加诱导增殖反应从而使骨形成增强,与此一致,更多的证据表明,增加吸收陷窝局部钙离子浓度,通过CaSR介导的细胞外钙浓度升高来抑制破骨细胞的骨吸收活性,这对骨量的调节非常重要[10]。因此,这些研究结果的基础上,可以得出的结论,Cav-1在体内骨重建和/或CaSR相关的疾病的病理生理过程中起重要作用。同时,Hu等[43]研究发现,升高细胞外钙离子浓度可以刺激CaSR,激活磷脂酶C(PLC),然后开放钙库操作性钙离子通道(SOCE),最终引起细胞内钙离子浓度升高。这个过程在成骨细胞增殖中被细胞外高浓度钙离子所诱发。这个发现可促进对成骨细胞增殖机制形成新的认识,也可以提供一些骨重建的生理调节提供细胞学基础。
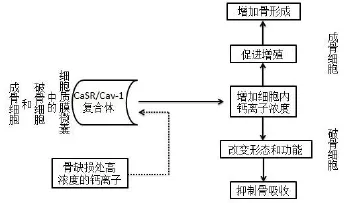
图2 [10]:Cav-1在钙和骨稳态中的作用
4 结论
综合目前已发表的文献可知,Cav-1参与成骨细胞分化和骨形成,在钙离子和骨的稳态调节中起着至关重要的作用;同时CaSR也定位在小凹结构上,影响成骨细胞的增值和分化,也协同参与调节细胞内外钙离子浓度,从而维持细胞内外钙离子浓度;Cav-1还可以与其他相关分子(如雌激素、8-PN、PTRF/cavin-1、Wnt/β-catenin、MAPK/ERK、eNOS/ NO等)共同调节细胞内的各种生命活动等,但它在这些过程中的具体作用仍然有待进一步研究。
小凹结构是一个信号平台(即小凹结构中有大量的信号分子和信号通路),其中的小凹蛋白参与细胞内外信号转导网络的构成,其作用机制并不是十分清楚,还需要更深入的研究来证实小凹、Cav-1以及其他小凹蛋白在骨组织生物学和生理学中的作用。相信随着研究的深入,成骨细胞中的小凹和小凹蛋白及小凹平台上的各种信号分子以及信号分子通路,都将会被人们阐述清楚,进而为治疗骨骼相关疾病提供新的思路。
1.张勤勤,孙润广,李连启.Caveolae及其蛋白家族的生物学结构和功能的研究现状[J].北京生物医学工程,2011,30 (02):215-220.
2.Parton RG,Hanzal-Bayer M,Hancock JF.Biogenesis of caveolae:a structural model for caveolin-induced domain formation[J].J Cell Sci,2006,119(05):787-796.
3.Lisanti MP,Scherer PE,Vidugiriene J,et al.Characterization of caveolin-rich membrane domains isolated from an endothelial-rich source:implications for human disease[J]. J Cell Biol,1994,126(01):111-126.
4.杜雯文,王爱鱼,宁宝森.Caveolae蛋白与胃癌发生发展的表观遗传学关系[J].川北医学院学报,2013,28(06):596-599.
5.Gumbleton M,Abulrob AG,Campbell L.Caveolae:an alternative membrane transport compartment[J].Pharmaceutical Research,2000,17(09):1035-1048.
6.Burgermeister E,Liscovitch M,Rocken C,et al.Caveats of caveolin-1 in cancer progression[J].Cancer Letters,2008, 268(02):187-201.
7.Scherer PE,Tang Z,Chun M,et al.Caveolin isoforms differ in their N-terminal protein sequence and subcellular distribution.Identification and epitope mapping of an isoform-specific monoclonal antibody probe[J].The Journal of Biological Chemistry,1995,270(27):16395-16401.
8.Scherer PE,Okamoto T,Chun M,et al.Identification,sequence,and expression of caveolin-2 defines a caveolin gene family[J].Proceedings of the National Academy of Sciences of the United States of America,1996,93(01):131-135.
9.Tang Z,Scherer PE,Okamoto T,et al.Molecular cloning of caveolin-3,a novel member of the caveolin gene family expressed predominantly in muscle[J].The Journal of Biological Chemistry,1996,271(04):2255-2261.
10.Serra M,Scotlandi K.Caveolins in the development and diseases of musculoskeletal system[J].Cancer Letters,2009,284 (02):113-121.
11.Williams TM,Lisanti MP.The caveolin proteins[J].Genome Biology,2004,5(03):214.
12.Schubert W,Sotgia F,Cohen AW,et al.Caveolin-1-and caveolin-2-deficient mice both display numerous skeletal muscle abnormalities,with tubular aggregate formation[J]. The American Journal of Pathology,2007,170(01):316-333. 13.Williams TM,LisantiMP.Caveolin-1 in oncogenic transformation,cancer and metastasis[J].American Journal of Physiology,2005,288(03):494-506.
14.Head BP,Insel PA.Do caveolins regulate cells by actions outside of caveolae[J].Trends in Cell Biology,2007,17(02): 51-57.
15.Inder KL,Ruelcke JE,Petelin L,et al.Cavin-1/PTRF alters prostate cancer cell-derived extracellular vesicle content and internalization to attenuate extracellular vesiclemediated osteoclastogenesis and osteoblast proliferation[J]. Journal of Extracellular Vesicles,2014,25(3):23784.
16.袁碧英,易斌,鲁开智.Caveolin-1在肿瘤中的作用机制的研究进展[J].中国医学创新,2014,11(06):129-131.
17.董伟家,张建国,杨景武,等.Caveolin-1在肿瘤中的表达及临床意义[J].基础医学与临床,2008,28(10):1111-1116.
18.Rajab A,Straub V,Mccann LJ,et al.Fatal cardiac arrhythmia and long-QT syndrome in a new form of congenital generalized lipodystrophy with muscle rippling (CGL4)due to PTRF-CAVIN mutations[J].PLoS Genet, 2010,6(03):1000874.
19.Cantiani L,Manara MC,Zucchini C,et al.Caveolin-1 Reduces Osteosarcoma Metastases by Inhibiting c-Src Activity and Met Signaling[J].Cancer Research,2007,67(16): 7675-7685.
20.Krajewska WM,Maslowska I.Caveolins:structure and function in signal transduction[J].Cell Mol Biol Lett,2004,9 (02):195-220.
21.Solomon KR,Danciu TE,Adolphson LD,et al.Caveolin-enriched membrane signaling complexes in human and murine osteoblasts[J].Journal of Bone and Mineral Research,2000,15(12):2380-2390.
22.Solomon KR,Adolphson LD,Wank DA,et al.Caveolae in human and murine osteoblasts[J].Journal of Bone and Mineral Research,2000,15(12):2391-2401.
23.Lofthouse KA,Davis JR,Frondoza CG,et al.Identifica-tion of caveolae and detection of caveolin in normal human osteoblasts[J].The Journal of Bone and Joint Surgery, 2001,83(01):124-129.
24.Sawada N,Taketani Y,Amizuka N,et al.Caveolin-1 in extracellular matrix vesicles secreted from osteoblasts[J]. Bone,2007,41(01):52-58.
25.Rubin J,Schwartz Z,Boyan BD,et al.Caveolin-1 knockout mice have increased bone size and stiffness[J]. Journal of Bone and Mineral Research,2007,22(09):1408-1418.
26.Boyan BD,Wong KL,Wang L,et al.Schwartz Z Regulation of growth plate chondrocytes by 1,25-dihydroxyvitamin D3 requires caveolae and caveolin-1[J].Bone Miner Res,2006,21(10):1637-1647.
27.Janet Rubin,Zvi Schwartz,Barbara D Boyan,et al.Caveolin-1 Knockout Mice Have Increased Bone Size and Stiffness[J].J Bone Miner Res,2007(22):1408-1418.
28.易福东.雌激素对成骨细胞小凹蛋白-1表达的影响及其作用[D].江西:南昌大学医学院基础医学院,2009.
29.康路妹.8-Prenylnaringenin(8-PN)对小鼠成骨细胞MC3T3-E1分化影响的实验研究[D].江西:南昌大学医学院药学系,2009.
30.Low J,Nicholson HD.Emerging role of polymerase-1 and transcript release factor(PTRF/Cavin-1)in health and disease[J].Cell and Tissue Research,2014,357(03):505-513.
31.PilchPF,SoutoRP,LiuL,et al.Cellularspelunking:exploring adipocytecaveolae[J].JLipidRes,2007,48(10):2103-2111.
32.Liu L,Pilch PF.A critical role of cavin(polymerase I and transcript release factor)in caveolae formation and organization[J].J Biol Chem,2008,283(07):4314-4322.
33.谈智,陈兆煜,袁乔.Caveolae-caveolin-1-PTRF/cavin-1系统与血管平滑肌细胞迁移:一种可能的机制[J].中国病理生理杂志,2013,29(05):957-960.
34.Bodine PV,Zhao W,Kharode YP,et al.The Wnt antagonist secreted frizzled-related protein-1 is a negative Regulator of trabecular bone formation in adult mice[J].Mol.Endocrinol,2004,18(05):1222-1237.
35.DayTF,GuoX,Garrett-Beal L,et al.Wnt/beta-catenin signaling in mesenchymal progenitors controls osteoblast and chondrocyte differentiation during vertebrate skeletogenesis[J].Dev.Cell,2005,8(05):739-750.
36.Galbiati F,Volonte D,Brown AM,et al.Caveolin-1 expression inhibits Wnt/beta-catenin/Lef-1 signaling by recruiting beta-catenin to caveolae membrane domains.[J].J Biol Chem,2000,275(30):233,68-77.
37.Lu Z,Ghosh S,Wang Z,et al.Downregulation of caveolin-1 function by EGF leads to the loss of E-csdherin,increased transcriptional activity of beta-catenin,and enhanced tumor cell invasion[J].Cancer Cell,2003,4(06):499-515.
38.何欢.Caveolin-1通过Wnt/β-catenin途径调节成骨细胞矿化及其机制研究[D].江西:南昌大学医学院药学系, 2010.
39.BrownEM.Roleofthecalcium-sensing receptorinextracellular calcium homeostasis[J].BestPractice&Research Clinical Endocrinology&Metabolism,2013,27(03):333-343.
40.Chang W,Dvorak M,Shoback D.Assessing Constitutive Activity of Extracellular Calcium-Sensing Receptors In Vitro and in Bone[J].Methods Enzymol,2010(484):253-266.
41.Jung SY,Kwak JO,Kim HW,et al.Calcium sensing receptor forms complex with and is up-regulated by caveolin-1 in cultured human osteosarcoma(Saos-2)cells[J].Experimental and Molecular Medicine,2005,37(02):91-100.
42.Caudarella R,Vescini F,Buffa A,et al.Role of calciumsensing receptor in bone biology[J].J Endocrinol Invest, 2011,34(07):13-7.
43.Hu F,Pan L,Zhang K,et al.Elevation of extracellular Ca2+induces store-operated calcium entry via calciumsensing receptors:A pathway contributes to the proliferation of osteoblasts[J].Plos One,2014,9(09):107217.
(2015-06-20收稿)
R782.2,R782.4
A
10.3969/j.issn.1000-2669.2015.06.020
郭俊峰(1990-),男,硕士生。E-mail:229713862@qq.com
