白芍多糖颗粒活性炭脱色试验研究*
2015-06-05秦亚东周娟娟汪荣斌
秦亚东,周娟娟,汪荣斌,3
(1安徽中医药高等专科学校药学系,2芜湖市中医医院制剂中心,3安徽中药资源研究所,安徽芜湖241317)
白芍多糖颗粒活性炭脱色试验研究*
秦亚东1,周娟娟2,汪荣斌1,3
(1安徽中医药高等专科学校药学系,2芜湖市中医医院制剂中心,3安徽中药资源研究所,安徽芜湖241317)
目的:优化白芍多糖颗粒活性炭脱色工艺。方法:以多糖脱色率和多糖保留率为指标,探索颗粒活性炭用量、pH值、吸附时间、脱色温度对白芍多糖脱色效果的影响。结果:颗粒活性炭对白芍多糖最优脱色工艺为:颗粒活性炭用量浓度1.5%,温度为25℃,调节pH=7.5,脱色2 h。白芍多糖脱色率为64.25%,保留率为71.33%。结论:颗粒活性炭可用于白芍多糖的脱色。
白芍;多糖;颗粒活性炭;脱色试验
糖是自然界中含量最丰富的生物聚合物,绝大部分生物都含有多糖。近些年来从中药提取出来的多糖已被证实具有多种生物活性并已经在临床上正式应用的药物,如灵芝多糖[1]、香菇多糖等[2]。随着对中药多糖研究的不断深入,从中药材中提取出来的多糖一般多为总多糖,由于多糖中存在着一些核酸、蛋白质、色素等杂质,这些杂质的存在严重干扰和阻碍了多糖的进一步研究。故而多糖除杂,提高其纯度,更利于多糖的理化性质、生物活性等方面的深入研究。大部分中药多糖溶液具有颜色,不仅影响了多糖的纯度,更给多糖的深入研究带来了一定的困难。因此中药多糖脱色工艺就成了精制多糖的重要环节。
多糖溶液脱色方法[3-4]主要有有氧化法(过氧化氢、次氯酸钠等)、离子交换法(各种不同型号的树脂)、金属络合法、吸附法(活性炭、硅藻土等)。氧化法有可能对多糖的三维空间结构产生影响,离子交换树脂法可能对不同类型的多糖产生的作用不同。颗粒活性炭较易于从多糖溶液中滤除,活性炭比表面积较大,物理吸附,一般不会对多糖的空间结构产生影响。基于以上原因,本文选择活性炭作为脱色剂研究其对白芍多糖脱色效果的影响。为白芍多糖的脱色工艺提供一些参考。
1 材料与仪器
美国Agilent紫外分光光度计Cary60、德国SIGMA离心机3-18K、瑞士梅特勒电子天平MS104S、河北武强县亿达仪表厂华强酒精计;试验所用白芍采集于安徽亳州地区白芍种植基地,由安徽中药资源研究所刘晓龙研究员鉴定为Paeonia lactiflora Pall;葡萄糖(中国食品药品检定研究院,批号:110833-201205)、苯酚等试验用试剂均为分析纯。
2 方法和结果
2.1 白芍多糖的制备
取白芍干燥根茎约100 g,粉碎,过60目筛,加10倍量无水乙醇浸泡过夜,滤过,滤渣再加8倍量无水乙醇浸泡过夜,滤过,除去可以溶于醇部分的小分子杂质、部分色素等杂质。
保留药渣、置于通风处,自然干燥,分别使用8倍量、6倍量蒸馏水回流提取2次,每次2 h,合并滤液,水浴浓缩至适量。放至室温,慢慢加入无水乙醇同时振摇,调节乙醇浓度为90%,置于冰水浴中,静置过夜,离心得到多糖沉淀,使用无水乙醇反复冲洗数次,真空减压干燥即得白芍多糖粉末。
2.2 白芍多糖溶液的配制
取“2.1”项下制备的白芍多糖干燥粉末约100 mg,用蒸馏水定容于50 mL量瓶中,60℃加热以促进溶解,然后5 000 r/min离心,去除不溶部分。即得橙黄色白芍多糖溶液,浓度为2 mg/mL。
2.3 色素最大吸收波长的选择
取“2.2”项下制备的溶液在可见光区(400 nm-700 nm)进行扫描,结果发现没有最大吸收,色素吸收呈现普遍吸收的特点。从溶液互补色角度考虑,选择450 nm为色素吸收检测波长。
2.4 标准工作曲线制备
精密吸取葡萄糖标准溶液0.1、0.2、0.4、0.8、1.0 mL分别置于具塞棕色试管中,于上述5只试管中按顺序分别加入0.9、0.8、0.6、0.2、0.0 mL蒸馏水,再加6.0%的苯酚溶液1.0 mL,振摇均匀,最后加浓硫酸5.0 mL,立即振摇均匀后,100℃水浴中加热20 min,取出放至室温,490 nm波长下测定吸光度(A)值。以蒸馏水同法操作,作为空白对照。以葡萄糖浓度(C, μg/mL)为横坐标,吸光度(A)为纵坐标,得到回归方程:A=8.3643C+0.0285(r=0.9995)。试验结果表明,葡萄糖标准溶液浓度在2.4~14.4 μg/mL之间,其浓度与吸光度呈良好的线性关系。
2.5 多糖脱色率、保留率的测定
多糖含量采用经典的硫酸-苯酚显色法进行测定,显色后在490 nm下测定A值,并按多糖保留率(%)=脱色后多糖含量/脱色前多糖含量×100%来计算,多糖含量依据葡萄糖标准工作曲线进行计算,显色操作方法见“2.4”;在450 nm下测定脱色前后多糖溶液吸光度A值,脱色率按脱色率(%)=(溶液脱色前吸光度值-溶液脱色后吸光度值)/溶液脱色前吸光度值×100%来进行计算。
2.6 颗粒活性炭脱色单因素试验
取“2.2”项下制备的白芍多糖溶液(2 mg/mL),每组取20 mL进行颗粒活性炭脱色单因素试验,分别考察加入量、pH、温度、时间对脱色率、多糖保留率的影响。
2.6.1 颗粒活性炭加入量对多糖脱色效果的影响
取“2.2”项下制备的白芍多糖溶液(2 mg/mL)6份,每份20 mL,用0.1%NaOH调节pH=8,分别加入不同百分含量(颗粒活性炭质量/多糖质量百分比)的颗粒活性炭,25℃下脱色处理3 h。按“2.5”项下方法测定并计算脱色率及保留率。
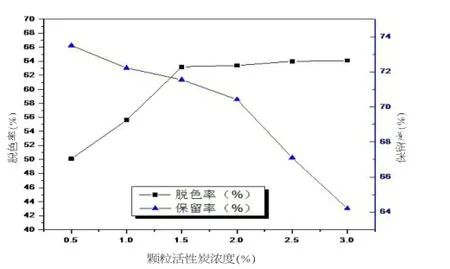
图1 活性炭浓度对脱色效果的影响
由图1可见,当颗粒活性炭浓度从0.5%增大到1.5%的过程,多糖的脱色率增加幅度较大,多糖的保留率缓慢降低;当颗粒活性炭浓度超过1.5%后,多糖脱色率增加幅度大大降低,同时多糖保留率下降较为剧烈。因此,颗粒活性炭用量不宜超过1.5%。2.6.2脱色时间对多糖脱色效果的影响
取“2.2”项下制备的白芍多糖溶液(2 mg/mL)6份,每份20 mL,用0.1%NaOH条件pH=8,加入1.5%的颗粒活性炭,在25℃下考察不同脱色时间对脱色效果的影响。按“2.5”项下方法测定并计算脱色率及保留率。效果的影响。按“2.5”项下方法测定并计算脱色率及保留率。
由图2可见,脱色时间在1~2 h内随着时间的增加,脱色率增加幅度较大,多糖保留率迅速降低;当脱色时间超过2 h以后脱色率及多糖保留率均变化缓慢。因此脱色时间为2 h,效果较理想。
2.6.3 pH对多糖脱色率及保留率的影响
取“2.2”项下制备的白芍多糖溶液(2 mg/mL)6份,每份20 mL,用0.1%NaOH条件pH=8,加入1.5%的颗粒活性炭,在25℃下考察不同脱色时间对脱色效果的影响。按“2.5”项下方法测定并计算脱色率及保留率。
由图3可见,多糖溶液pH值从酸性6.5增加到碱性9.0的过程中多糖保留率在逐渐下降,而多糖脱色率在pH=7.5时有一峰值,再继续增加pH,脱色率缓慢降低而后趋于稳定。综上考虑pH=7.5较为合适。
2.6.4 温度对多糖脱色率及保留率的影响
取“2.2”项下制备的白芍多糖溶液(2 mg/mL)6份,每份20 mL,用0.1%NaOH条件pH=8,加入1.5%的颗粒活性炭,分别在不同的温度下考察脱色时间对脱色效果的影响,脱色时间为3 h。按“2.5”项下方法测定并计算脱色率及保留率。
由图4可见,在25~45℃范围内,脱色率及保留率变化均不明显,且温度逐渐增高后多糖保留率呈下降趋势。另外从节能角度综合考虑,确定25℃为脱色温度。
2.7 正交试验
由单因素试验结果,选取颗粒活性炭浓度、脱色时间、pH为因素,设计3因素3水平进行正交试验,正交设计表L9(33)表1、3,考虑到脱色作用体现在脱色率及多糖保留率两个方面,故各赋予50%加权,求得加权后的综合得分=脱色率/2+多糖保留率/2。
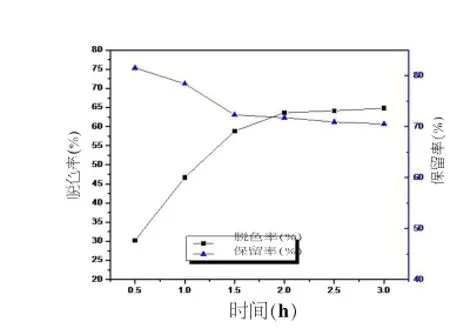
图2 脱色时间对对脱色效果的影响
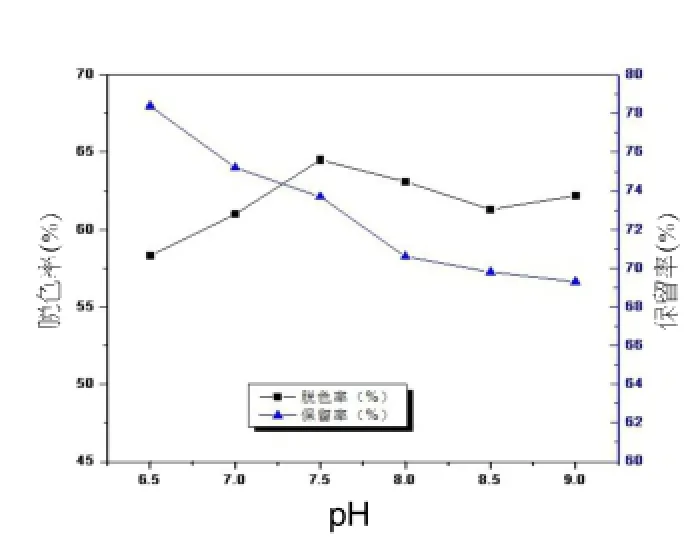
图3 pH对对脱色效果的影响
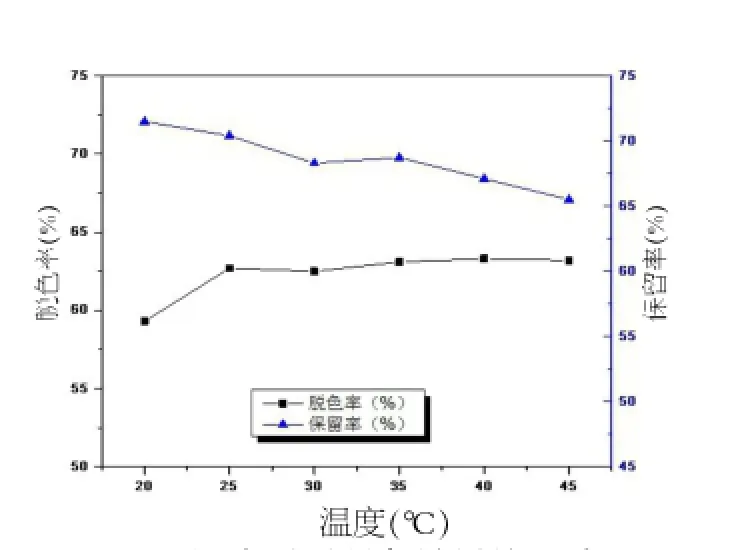
图4 温度对对脱色效果的影响
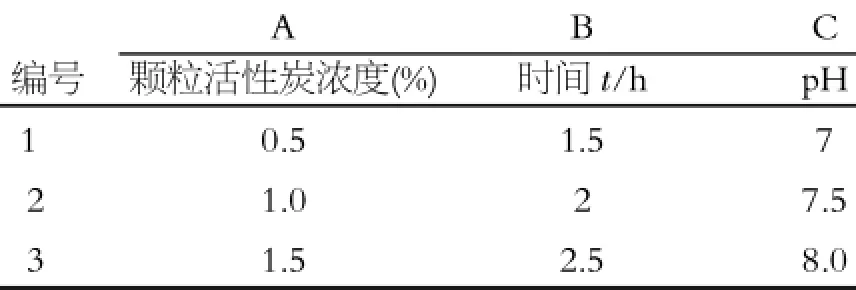
表1 因素水平表
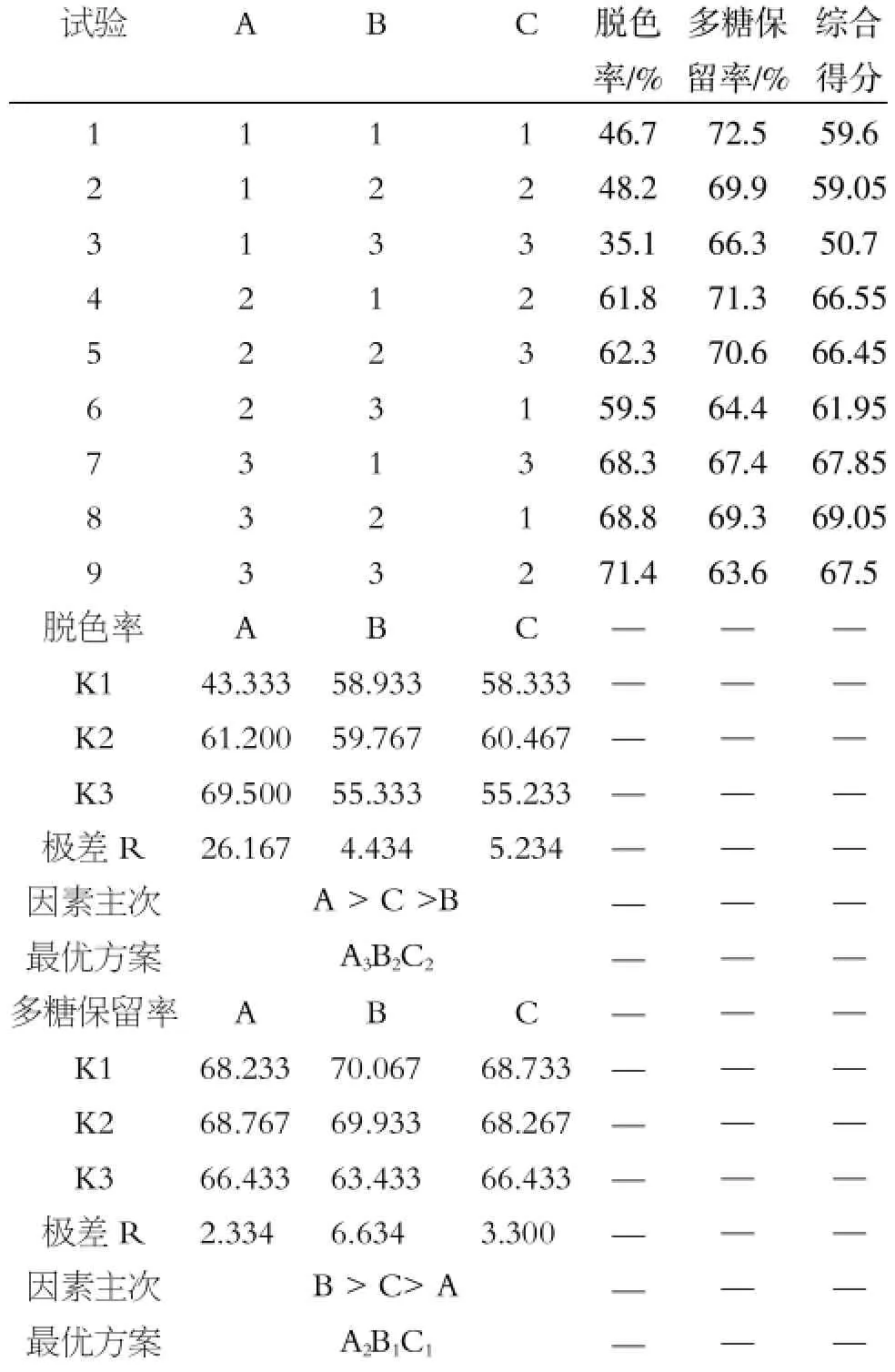
表2 正交试验设计表及结果
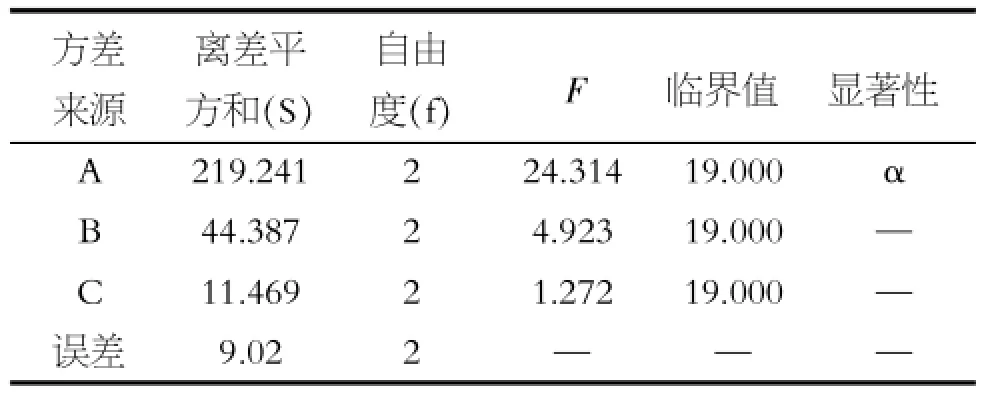
表3 方差分析表
由表2、3可以看出,各因素对脱色率的影响主次为A>C>B、对多糖保留率影响主次为B>C>A;其中A因素为主要因素,且具有呈显著性差异,故应选A3、B因素从脱色率角度看应选B2,且在保留率方面无显著性差异,故选B2;C因素分析同B因素,故选C2。故最佳脱色条件为A3B2C2,即:加入多糖的1.5%颗粒活性炭,脱色温度为25℃,调节pH= 7.5,吸附2 h。
2.8 验证试验
取“2.2”项下制备的多糖溶液,按照最优脱色方案A3B2C2进行脱色试验,测得脱色率及多糖保留率平均值分别为65.16%、71.53%,RSD分别为1.36%(n =5)、2.07%(n=5)。试验结果证实上述方案为最优方案,结果重复性符合要求。
3 讨论
本文使用水提醇沉技术得到白芍多糖,呈黄色粉末状。制备成2 mg/mL溶液使用紫外可见分光光度法在可见光区扫描未发现色素存在最大吸收波长,根据溶液的颜色及互补色,选择450 nm作为色素吸收波长。
中药多糖一般多具颜色,这些颜色为不同色素所形成,由于色素的存在,严重影响了中药多糖的进一步研究和利用。目前中药多糖提取液脱色的方法主要包括化学法、物理吸附法等,化学法一般采用双氧水、次氯酸钠等试剂对多糖溶液进行脱色,由于在脱色过程中可能对多糖产生氧化作用,为了较好的保留多糖活性,故应慎用;树脂脱色成本高、操作复杂,难于工业化使用,因此工业化使用较少;而活性炭具有无毒、无味、可反复使用、效率高、速度快、成本较低等特点[5],对多糖空间结构较少产生影响,因此为进一步研究多糖结构提供了可靠的脱色方法。一般脱色机理认为是物理吸附,当有色成分直径小于活性炭孔入口直径,即可被吸附。当然也存在一些缺点,例如对分子直径较小的多糖也产生一点的吸附作用,这样是否会改变多糖组成成分还有待于进一步研究证实,另外活性炭再生较为困难等。为了尽量保持脱色后多糖的生物活性,另外考虑脱色后活性炭的滤除难度,故没有研究粉末活性炭的脱色部分,课题组在前期研究的基础上[6-7],继续研究了颗粒活性炭的脱色工艺,经试验研究,本工艺具有较好的操作性,工业化可实施性。
1.Lin ZB,Zhang HN.Anti-tumor and immunoregulatory activities of Ganoderma lucidum and its possible mechanisms [J].Acta Pharmacol Sin,2004,25(11):1387-1395.
2.方积年,王顺春.香菇多糖的研究进展[J],中国药学杂志,1997,32(6):332-337.
3.付学鹏,杨晓杰.植物多糖脱色技术的研究.食品研究与开发[J],2007,28(11):166-169.
4.方积年,丁侃.天然药物-多糖的主要生物活性及分离纯化方法.中国天然药物[J],2007,5(5):338-347.
5.沈铁焕,魏青,时运铭,等.不同行业如何使用活性炭.石家庄师范专科学校学报[J],2000,4(2):35.
6.秦亚东,李飞,周宙.不同提取方式对白芍化学成分含量的影响.现代中药研究与实践[J],2014,28(4):50-53.
7.秦亚东,周娟娟,李飞,等.白芍生品及其炮制品中多糖及总糖的含量测定[J],长春中医药大学学报,2014,30(5):804-807.
(2015-02-05收稿)
Experimental studies on the decoloration of Paeoniae Radix Alba Polysaccharide using granular activated carbon
Qin Yadong1,Zhou Juanjuan2,Wang Rongbin1,31Department of Pharmacy,Anhui Higher Institute of Traditional Chinese Medicine,2Preparation Center,Wuhu Hospital of Traditional Chinese Medicine,3Anhui Institute of Chinese Medicine Resources,Wuhu 241317,Anhui Province,China
Objective:To optimize the decoloring conditions for Paeoniae Radix Alba Polysaccharide using Granular activated carbon.Methods:The decoloring effect of granular activated carbon was studied and the conditions for decoloring were optimized through single factor test.Results:The optimal conditions are∶temperature 25℃,1.5%granular activated carbon adjusted to pH=7.5,and maintained for 2 hours.The decolorization rate and polysaccharide retention rate of Paeoniae Radix Alba polysaccharide are 64.25%and 71.33% respectively.Conclusion:Granular activated carbon can be used for decolorization of polysaccharides of Radix Paeoniae Alba.
Paeoniae Radix Alba;Polysaccharide;Granular activated carbon;Decoloring experiment
R284
A
10.3969/j.issn.1000-2669.2015.06.004
安徽省高校省级科研项目(KJ2013B114);安徽省高职高专院校专业带头人(皖教秘人〔2011〕2号)
秦亚东(1979-),男,讲师,硕士。E-mail:qydgy2007@163.com
