泥蚶血红蛋白异源四聚体酶解多肽抗菌活性及其机理研究
2015-06-01王娟娟包永波王素芳1林志华
王娟娟,包永波,王素芳1,,林志华*
(1.宁波大学海洋学院,浙江宁波 315211;2.浙江海洋高效健康养殖协同创新中心,浙江宁波 315211;3.浙江万里学院浙江省水产种质资源高效利用技术研究重点实验室,浙江宁波 315100)
泥蚶血红蛋白异源四聚体酶解多肽抗菌活性及其机理研究
王娟娟1,2,包永波3,王素芳1,3,林志华3*
(1.宁波大学海洋学院,浙江宁波 315211;2.浙江海洋高效健康养殖协同创新中心,浙江宁波 315211;3.浙江万里学院浙江省水产种质资源高效利用技术研究重点实验室,浙江宁波 315100)
采用凝胶层析技术从泥蚶血细胞裂解物中纯化得到两种血红蛋白Tg-HbⅡ(异源四聚体)和Tg-HbⅠ(同源二聚体),回收率分别为48.15%和24.91%。胰蛋白酶酶解Tg-HbⅡ,酶解液经反相C-18色谱柱分离纯化得7种血红蛋白源多肽F1~F7。通过琼脂扩散法检测酶解多肽抑菌活性,结果发现7种多肽对金黄色葡萄球菌、大肠杆菌、恶臭假单胞菌、枯草芽孢杆菌和坚强芽孢杆菌均无抑菌作用,但多肽F2~F7对副溶血弧菌、溶藻弧菌和哈维氏弧菌具有明显抗菌活性,且多肽F2~F7对副溶血弧菌、溶藻弧菌和哈维氏弧菌的MIC值在0.012~0.200 mg/m L范围内。荧光显微镜观察酶解多肽杀菌效果发现多肽杀菌迅速,5 min内弧菌细胞几乎全部死亡。利用透射电子显微镜观察正常的和经抗菌肽处理后的溶藻弧菌和哈维氏弧菌细胞的超微结构,结果显示,对照组正常细胞内部结构完整,而经抗菌肽处理过的细胞其细胞壁完整,但因缺乏细胞内容物支持导致局部区域内陷,细胞质膜明显收缩,细胞内物质外流形成许多空泡从而导致细胞死亡。研究结果表明血红蛋白源抗菌肽对泥蚶致病菌弧菌有明显的抗菌活性,其通过破坏细胞内部结构而起到杀菌作用,这些发现为血红蛋白抗菌机制的研究奠定了基础。
泥蚶;酶解多肽;反相高效液相色谱;抗菌活性;超微结构;抗菌机理
1 引言
抗菌肽(antibacterial peptides,AMP)是一类具有抗菌活性的小分子蛋白质物质[1],广泛地分布在各类生物体内,是无脊椎动物、脊椎动物和植物等生物非特异性免疫的关键因子[2]。近年来,国内外相关研究发现,不仅从生物体内提取的某些多肽具有生物活性,蛋白质经酶解处理后也会产生具有特殊功能的活性肽[3],Estelle等研究发现,牛血红蛋白经酶解作用产生的某些肽段具有抗菌作用,而且肽段不同抗菌特性和活力也不同[4]。赵玲等通过琼脂扩散抑菌试验发现南极磷虾酶解产生的多肽对金黄色葡萄球菌具有较强的抑菌活性[5]。抗菌肽因具有抗菌谱广泛、快速查杀靶细胞、热稳定性好,特别是对靶菌株不易产生耐药性等优势,被认为是未来取代抗生素的上佳选择[6]。
泥蚶(Tegillarcagranosa),隶属于软体动物门(Mollusca),瓣鳃纲(Lamellibranchia),是我国传统养殖贝类之一。因其体内富含特有的血红蛋白,味道鲜美,营养丰富,深受人们的喜爱。近年来,海洋污染日益加剧,致使泥蚶在养殖过程中经常受到病原菌感染而造成大面积死亡[7]。由于泥蚶不具有特异性免疫系统,只能依靠体液因子和血细胞的非特异性免疫系统来抵御生活环境中病原微生物的侵袭。王素芳等[8]研究发现泥蚶血红蛋白通过其过氧化物酶活性产生ROS,从而起到对部分革兰氏阴性菌大肠杆菌和恶臭假单胞菌的抑菌作用,但对贝类致病菌弧菌却没有抗菌活性;Xu等[9]研究表明毛蚶血红蛋白对革兰氏阳性菌有明显的抗菌活性。本研究试图从血红蛋白源抗菌肽这一可能的机制入手,来分析泥蚶血红蛋白酶解多肽是否具有抗菌活性,为血红蛋白抗菌机制研究奠定基础。另外,泥蚶血红蛋白酶解多肽抗菌作用的研究几乎没有报道,因此进行泥蚶血红蛋白酶解多肽抗菌活性及其杀菌机理的研究对深入认识泥蚶自身免疫反应具有重要意义。
2 材料与方法
2.1 实验材料
实验用泥蚶材料取自于宁波市鄞州区丹艳养殖基地。溶藻弧菌(Vibrioalginolyticus)、哈维氏弧菌(V.harveyi)、副溶血弧菌(V.parahaemolyticus)、金黄色葡萄球菌(Staphylococcusaureus)、恶臭假单胞杆菌(Pseudomonasputida)、坚强芽孢杆菌(Bacillus firmus)、枯草芽孢杆菌(B.subtilis)和大肠杆菌(Eschetichiacoli)为浙江万里学院微生物实验室提供。胰蛋白酶为Promega公司产品,乙腈(ACN)和三氟乙酸(TFA)为质谱纯,纯净水为杭州哇哈哈集团有限公司生产,其他试剂均为国产分析纯。
2.2 主要仪器
均质机(SH-2A,IKA公司),紫外分光光度计(3300 pro,美国Amershaw),凝胶排阻色谱柱SephacryS-100HR(HiPrep26/60,GE公司),AKTA蛋白层析系统(pure 150,GE公司),反相C-18色谱柱(YMC-Pack-ODS-A250×10 mm,日本YMC),恒温培养箱(DHP-9162,上海慧泰仪器制造有限公司),摇床(HZ-9211KB,江苏同君仪器科技有限公司),Nano Vue plus超微量紫外分光光度计(GE公司),Triple TOF 5600高分辨液相色谱质谱联用系统(AB SCIEX公司),荧光显微镜(Nikon ECLIPSE 80i,尼康公司),透射电子显微镜(H-7650,HITACHI日立公司)。
2.3 泥蚶血红蛋白的分离纯化
将采集于养殖池塘的活体泥蚶洗净后,置于海水晶配制的海水中吐泥沙5 h。撬开贝壳后,用针筒采集血液,装在含有抗凝剂的10 m L离心管中,1 500 r/min转速4℃冷冻离心10 min,血细胞沉淀,除去上层清液。用0.9%的NaCl溶液多次漂洗血细胞直至上层溶液无色澄清,血细胞加适量磷酸盐缓冲液后进行匀浆破碎,最后以12 000 r/min高速低温离心30 min除去细胞碎片,上清为血红蛋白粗产品。将获得的血红蛋白粗产品过Sephacryl S-100 HR凝胶层析柱,用p H为7.2磷酸盐缓冲液以0.2 m L/min的流速洗脱,1 m L/管收集洗脱液,280 nm和415 nm波长检测洗脱液。
2.4 泥蚶血红蛋白浓度测定
采用考马斯亮蓝法进行泥蚶血红蛋白浓度的测定[10]。用50 mmol/L PBS对标准浓度为1.4 mg/mL的牛血清白蛋白(BSA)溶液进行梯度稀释,配制成浓度分别为0.2、0.4、0.6和0.8 mg/mL的BSA标准液。取上述BSA标准液和待测的泥蚶血红蛋白样品各10 u L,分别与1 m L考马斯亮蓝G250染液充分混匀,在室温下静置反应5 min后,用紫外分光光度计检测各混合物在595 nm波长处的吸光度(蛋白质-色素结合物在595 nm有最大光吸收)。以BSA各浓度梯度为横坐标、对应的A595值为纵坐标,绘制蛋白浓度标准曲线,再根据样品在595 nm波长处的吸光值以及标准曲线方程式计算泥蚶血红蛋白浓度(mg/mL)。
2.5 泥蚶血红蛋白异源四聚体酶解
经Sephacryl S-100 HR凝胶层析柱过滤后收集的Tg-HbⅡ,按胰蛋白酶:HBII为1∶20于50 mmol/L NH4HCO3(p H7.6)中恒温在37℃水浴中反应4 h。吸取酶解液于超滤离心管(3 kDa),超速离心30 min以除去多余的胰蛋白酶,终止酶切反应。将滤出液收集到空离心管中,在35℃下真空干燥浓缩60 min以除去NH4HCO3,继续干燥浓缩至样品量到含少量液体,此样品为HbⅡ酶解液。
2.6 HbⅡ酶解液分离纯化
采用反相高效液相色谱法进行分离。酶解液过反相C-18色谱柱,用A液(0.1%三氟乙酸)和B液(0.1%三氟乙酸和60%乙腈),以3 mL/min流速0%~100%B液梯度洗脱20 min,1 m L/管收集洗脱液,用220 nm波长检测洗脱液。
2.7 琼脂扩散法测抑菌活性
培养细菌至对数生长期,用无菌生理盐水配制成105cfu/m L的菌悬液,取200μL菌悬液均匀涂布于配制好的固体培养基上,放置好牛津杯后,依次加入200μL多肽F1(0.048 mg/mL)、F2(0.083 mg/mL)、F3(0.077 mg/m L)、F4(1.404 mg/m L)、F5(0.123 mg/mL)、F6(1.096 mg/mL)、F7(0.238 mg/mL)多肽洗脱液。大肠杆菌、不动杆菌、恶臭假单胞菌、金黄色葡萄球菌、枯草芽孢杆菌、表皮葡萄球菌和坚强芽孢杆菌置于37℃培养箱培养12 h,溶藻弧菌、哈维氏弧菌和副溶血弧菌则置28℃培养箱培养12 h,取出后拔去牛津杯观察并拍照保存实验结果。为了确保实验的准确性,每种待测菌种各做3次独立平行实验。
2.8 最低抑菌浓度(MIC)测定
采用微量肉汤稀释法。超净工作台内无菌操作,将倍比稀释后不同浓度的多肽分别加到灭菌过的96孔板中,第1至第11孔加多肽,每孔100μL,第12孔不加多肽作为生长对照。采用生长法制备浓度为0.5麦氏比浊标准的菌悬液,用MH肉汤按1∶1 000比例稀释后,向每孔中加100μL菌悬液,密封后将弧菌置于28℃,其他菌则置于37℃培养箱中培养,孵育12 h后观察判断最低抑菌浓度。为确保实验科学性,酶解多肽F2~F7洗脱液对每种试验菌各做3次独立平行实验,将3次试验结果平均值作为多肽对待测菌的最低抑菌浓度。
2.9 荧光显微法观察杀菌效果
将对数生长期的弧菌用无菌生理盐水配制成105cfu/m L菌悬液,取10μL菌液与10μL多肽F4洗脱液混匀作用5 min,对照组为加10μL 50 mmol/L PBS与10μL菌液混匀作用5 min,5 000 r/min转速离心5 min使菌体沉淀,用PBS漂洗3次以除去多肽,最后加10μL生理盐水悬浮菌体,用LIVE/DEAD核酸荧光染料试剂盒染色后,取1μL菌液于载玻片上,盖上盖玻片后用荧光显微镜观察活菌数量。
2.10 透射电镜观察抗菌肽对溶藻弧菌超微结构的影响
培养弧菌至其对数生长期,5 000 r/min转速离心5 min使菌体沉淀,用0.1 mol/m L p H 7.2磷酸盐缓冲液稀释为1×105cfu/m L。取2份1 m L弧菌菌液,其中一份加入200μL多肽F4洗脱液,另一份加200μL 50 mmol/L PBS做为对照组,28℃培养2 h后,将菌液5 000 r/min转速离心5 min,沉淀的菌体。2.5%戊二醛4℃固定24 h,经1%四氧化锇固定1 h,经50 mmol/L磷酸缓冲液漂洗,酒精梯度脱水,包埋、切片、染色后用透射电子显微镜观察并拍照。
2.11 多肽质谱鉴定
通过抑菌实验发现,多肽F2~F7对溶藻弧菌、哈维氏弧菌和副溶血弧菌均具有明显抗菌活性,进一步分析其氨基酸序列组成。将上述具有抑菌活性的多肽F2~F7采用MALDI-TOF-MS做质谱检测分析,将得到的数据用Proteinpilot软件检索比对,得到抗菌肽氨基酸序列。
3 结果与分析
3.1 泥蚶血红蛋白异源四聚体及其酶解多肽的分离纯化
泥蚶血红蛋白粗产品经凝胶过滤柱洗脱后,洗脱图谱如下图1所示。已有文献报道[8,10],根据280 nm和415 nm(蛋白质在280 nm波长附近特征性吸收峰,而Tg-Hb在415 nm波长处有独特的吸收峰),两种波长下的检测图谱,判断峰1为杂蛋白,峰2为异源四聚体(HbⅡ),峰3为同源二聚体(HbⅠ),其中,Tg-HbⅡ的回收率为48.15%,Tg-HbⅠ的回收率为24.91%(见表1)。
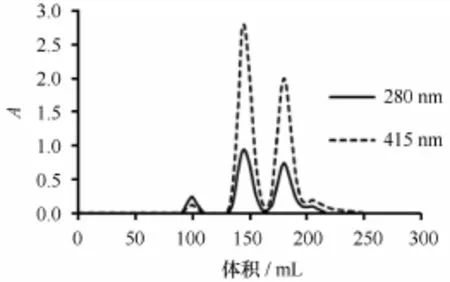
图1 泥蚶血红蛋白的凝胶层析图Fig.1 Gel chromatography of Tg-Hb
利用反相C-18色谱柱对Tg-HbⅡ酶解多肽梯度洗脱,用乙腈-水(60∶40,体积比)作为流动相,以3 m L/min流速0%~100%B液梯度洗脱20 min,用220 nm波长检测洗脱液[4]。洗脱图谱见图2。图谱中有7个主要峰,其保留时间适中,各峰能够达到较好的基线分离且峰形较好,代表了7种纯净多肽,分别以1 m L/管收集洗脱液备用。

表1 泥蚶血红蛋白的回收率Tab.1 Recovery of Tg-HbⅡfrom the blood of Tegillarca granosa
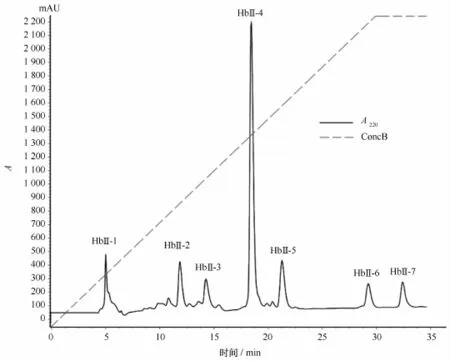
图2 泥蚶Tg-HbⅡ酶解多肽的反相C-18色谱图Fig.2 Reverse phase C-18 of peptides from enzymolysis Tg-HbⅡ
3.2 Tg-HbⅡ酶解多肽的抗菌活性
采用琼脂扩散法检测了7种多肽对5种革兰氏阴性菌即大肠杆菌、恶臭假单胞菌、溶藻弧菌、副溶血弧菌和哈维氏弧菌以及3种革兰氏阳性菌即金黄色葡萄球菌、枯草芽孢杆菌和坚强芽孢杆菌的抗菌活性。实验结果表明,多肽F2~F7对3种海洋性弧菌哈维氏弧菌、溶藻弧菌和副溶血弧菌均有明显抗菌效果而未检测到对其他几种菌有抑菌圈,而F1对所有试验菌均无抑菌活性(图3),F2对溶藻弧菌、副溶血弧菌和哈维氏弧菌的MIC分别为0.012 mg/mL,0.012 mg/m L和0.024 mg/m L,F3对3种菌均为0.020 mg/mL,F4分别为0.200 mg/m L,0.100 mg/mL和0.200 mg/mL,F5对3种菌均为0.019 mg/m L,F6分别为0.075 mg/m L,0.075 mg/m L和0.150 mg/mL,F7分别为0.096 mg/m L,0.190 mg/m L和0.096 mg/mL(表3),从中可以发现几种多肽抗菌作用具有选择性且活性差别较大。
3.3 荧光显微镜观察Tg-HbⅡ酶解多肽杀菌作用

图3 多肽对溶藻弧菌的抑菌环Fig.3 Antibacterial circles of peptides toV.alginolyticus

表2 泥蚶血红蛋白异源四聚体酶解多肽对8种菌的抗菌活性Tab.2 Antimicrobial activities of peptides against 8 kinds of bacterias
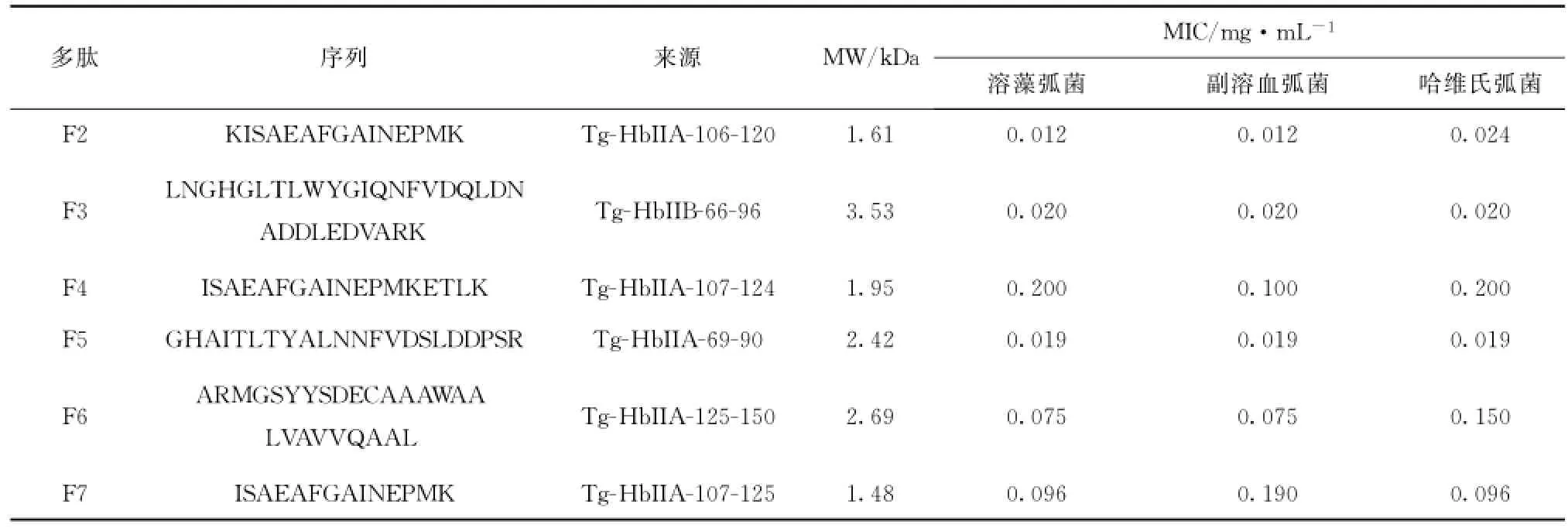
表3 泥蚶Tg-HbⅡ酶解多肽序列及最低抑菌浓度Tab.3 Sequences and the minimal inhibitory concentrations of all peptide fractions obtained from Tg-HbⅡhydrolysate
荧光显微镜观察显示,利用LIVE/DEAD荧光核酸染料染溶藻弧菌细胞核酸,该染料中含Calcein-AM和EthD-1两种染料。Calcein-AM分子能透过细胞质膜,可在各种酯酶的作用下,转化为很强的绿色荧光物质,并且保留在胞内无法扩散出完整的膜结构,使活细胞经染色后显示绿色荧光;EthD-1则是一种膜不通透的染料,能进入破损的细胞质膜和核膜,死细胞因通透性增加经染色后显示红色荧光。如图4所示,A为50 mmol/L PBS处理溶藻弧菌作为对照组,荧光明亮且细胞分布均匀,死细胞较少或几乎不含死细胞;B为经多肽F1处理,多肽F1无抑菌活性,其结果与正常对照组一样显示明亮绿色荧光,且活细胞数量与对照组相当;但弧菌经多肽F2~F7作用5 min后(C-H),绿色荧光明显淬灭,且死细胞也未发出红色荧光,表明细胞经抗菌肽作用后,弧菌细胞通透性屏障受损,其核心遭到破坏。

图4 溶藻弧菌的荧光显微观察图Fig.4 Fluorescence microscopic observation ofV.alginolyticus
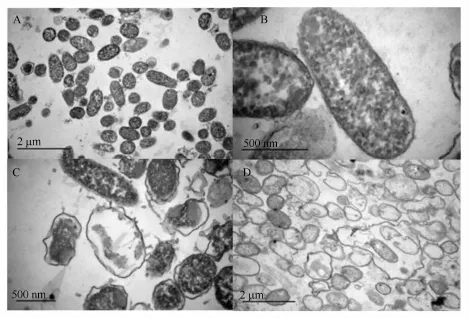
图5 正常哈维氏弧菌和抗菌肽处理的哈维氏弧菌透射电镜图Fig.5 Transmission electron microscopes ofV.harveyi
3.4 透射电镜观察观察抗菌肽对弧菌的作用
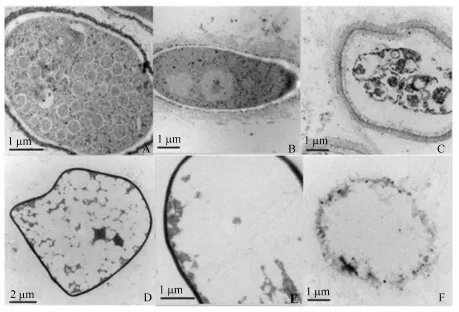
图6 正常溶藻弧菌和抗菌肽F4处理的溶藻弧菌透射电镜图Fig.6 Transmission electron microscopes ofV.alginolyticusand treated with antimicrobial peptide F4
通过荧光显微镜观察发现抗菌肽破坏了细胞结构导致细胞死亡,利用电镜进一步观察经抗菌肽处理后的弧菌细胞内部受损情况。如图5和图6所示,两图中A和B是未经抗菌肽处理的弧菌细胞,其结构完整,表面光滑,细胞壁层次分明、清晰可见。C~F是经抗菌肽作用30 min的弧菌细胞,其细胞质膜收缩(图6C),溶藻弧菌细胞因内容物外泄形成许多大小不一的空泡(图6D),弧菌死亡细胞的细胞壁依然完整,只是局部区域凹陷(图6C,D)。通过电镜观察溶藻弧菌和哈维氏弧菌两种弧菌,证实了抗菌肽作用使弧菌细胞内容物泄漏,是导致细胞死亡的主要原因。
4 讨论
4.1 泥蚶血红蛋白的分离纯化
开展Tg-HbⅡ酶解多肽免疫学研究的前提是得到高纯度的Tg-HbⅡ,王素芳等在泥蚶血红蛋白的制备及其抗菌活性研究中,通过质谱检测确定泥蚶血红蛋白含有同源二聚体和异源四聚体两种形式,并采用凝胶过滤方法分离纯化得到高纯度Tg-HbⅡ和Tg-HbⅠ[8]。Bao等已经成功克隆Tg-Hb 3个亚基的基因Tg-HbⅡA、Tg-HbⅡB和Tg-HbⅠ,并用相关软件预测其分子量分别为16.23 kDa,17.23 k Da和16.04 kDa,等电点分别为5.745,8.836和9.144,因此推测Tg-HbⅡ和Tg-HbⅠ的分子量分别约为67 k Da和32 k Da[11]。Tg-HbⅡ、Tg-HbⅠ和杂蛋白分子量存在较大差异,利用凝胶层析技术能较好地将杂蛋白和血红蛋白分开,同时两种血红蛋白在凝胶层析所用磷酸盐缓冲液中的稳定性也比较好。本研究采用280 nm和415 nm两种波长检测Tg-Hb洗脱峰,能够较好地快速判定Tg-Hb出峰情况。
4.2 泥蚶血红蛋白异源四聚体酶解多肽的分离纯化
反相高效液相色谱(reverse-phase high performance liquid chromatography,RP-HPLC)是目前分离纯化多肽物质的主要手段之一,其在多肽分离纯化中运用十分广泛[12]。在RP-HPLC流动相中,水有较高的比重,因此能较好地与多肽水溶性的生物学性质相适应,尽管其流动相中的乙腈等有机溶剂、三氟乙酸以及固定相均有可能使多肽的天然构象发生改变,但一旦去除这些因素后,一般多肽构象能够恢复原状而保持其特有的生物学活性,采用RP-HPLC技术纯化多肽回收率可达80%以上[12]。杨化新等利用RPHPLC技术,通过C-18色谱柱成功检测了重组人生长激素的肽片段[13]。本研究中Tg-HbⅡ经胰蛋白酶酶解后,获得较小分子量多肽片段。应用RP-HPLC技术成功分离纯化得到7种主要肽段,分子量在1~4 k Da范围内,去除洗脱液中的有机溶剂以后,多肽保持较好的活性。
4.3 泥蚶血红蛋白酶解多肽的抗菌活性
抗菌肽研究的兴起是从20世纪80年代初开始的,1980年由Boman等[14]从天蚕蛹中发现第一种抗菌肽天蚕素,并于次年测得了其氨基酸序列。此后,科学家们从各生物体内发现并提取了上千种抗菌肽,加上酶解及合成的抗菌肽,已构成庞大的抗菌肽数据库。虽然抗菌肽众多,但其结构具有一些共同之处,大多数抗菌肽具有强碱性,C端富含丙氨酸、亮氨酸等非极性氨基酸,N端精氨酸和赖氨酸等极性氨基酸较丰富[15]。Daoud等[16]研究发现牛血红蛋白经酶解后的某些肽段对无害利斯特菌、藤黄微球菌、大肠杆菌、及肠炎沙门氏菌有较强抗菌活性,这些肽段与抗菌肽具有类似的特点。据文献报道,生物体在特殊条件下会自身水解某类蛋白质产生具有活性的肽段。Lee[17]等研究发现淡水小龙虾在酸性条件下会水解其血蓝蛋白的羧基末端产生活性肽astacidin1。本研究采用胰蛋白酶酶解泥蚶血红蛋白异源四聚体,使其酶解产生的肽段末端为Lys或Arg,符合抗菌肽特征。结果发现酶解产生的大部分多肽对哈维氏弧菌、副溶血弧菌和溶藻弧菌海洋性弧菌具有明显的抑菌活性。
国内外学者研究发现抗菌肽主要有三类杀菌机制:第一类主要作用于细胞质膜,增加细胞质膜通透性,致使胞内物质外流而死亡;第二类主要是抗菌肽作用于宿主细胞后,激活了机体的免疫应答反应;第三类是抗菌肽通过抑制细胞呼吸或抑制细胞某些细胞器功能从而起到抑菌效果[18]。Viljanen等[19]发现人体内抗菌肽可以使细菌细胞质膜通透性增加,致使Trion X-100等物质更易进入细菌细胞内部。Uyterhoeven等[20]发现抗菌肽buforinⅡ进入细胞后与核酸(RNA/DNA)紧密结合,抑制了基因复制和表达,从而起到杀菌作用。正常细菌细胞质膜上的微孔仅容许1 nm以下的小分子物质通过[21]。利用透射电子显微镜观察经抗菌肽作用后的哈维氏弧菌和溶藻弧菌细胞,发现抗菌肽处理后的弧菌细胞,其细胞质膜通透性增加,胞内物质外流导致细胞内部结构严重损坏只剩细胞壁空架,从而导致细胞死亡,属于抗菌肽第一类杀菌机制。
本研究用胰蛋白酶酶解Tg-HbⅡ使之产生以赖氨酸或精氨酸为末端的肽段,发现大部分酶解肽段对副溶血弧菌、哈维氏弧菌和溶藻弧菌等海洋性弧菌具有抗菌作用,而对大肠杆菌、恶臭假单胞菌、金黄色葡萄球菌、坚强芽孢杆菌和枯草芽孢杆菌等一般性陆生菌则无抑菌活性,说明酶解产生肽段的抗菌作用具有选择性。猜测很可能与泥蚶生活习性相关,因泥蚶是一种埋栖于沿海滩涂的双壳贝类,难免受到常见海洋性弧菌如副溶血弧菌等的威胁,从而进化出一套独特的免疫系统,其可能只对海洋性致病菌具有杀菌作用,而对一般陆生菌则无抗菌活性。但为什么酶解多肽的抗菌作用有选择性,这需要进一步深入研究。同时,通过荧光显微镜和电镜观察其抗菌机理,证实了抗菌肽通过增加细胞质膜通透性使胞内物质外流而起到杀菌作用。这些发现,为泥蚶血红蛋白抗菌机制研究提供了一个新方向。
[1] 顾莉娟,吴健伟,苏晓庆,等.抗菌肽的研究进展[J].中国生化药物杂志,2006,27(6):383-386.
Gu Lijuan,Wu Jianwei,Su Xiaoqing,et al.Progress on antimicrobial peptides[J].Chinese Journal of Biochemical Pharmaceutics,2006,27(6):383-386.
[2] Boman H G.Peptide antibiotics and their role in innate immunity[J].Annu Rev Immunol,1995,13:61-92.
[3] 蒋菁莉,任发政,蔡华伟.牛乳酪蛋白降血压肽的超滤分离[J].食品科学,2006,27(7):124-128.
Jiang Jingli,Ren Fazheng,Cai Huawei.Separation of antihypertensive peptides derived from Yak Milk casein with ultra-filtration technology[J].Food Science,2006,27(7):124-128.
[4] Adje E Y,Balti R,Kouach M,et al.Obtaining antimicrobial peptides by controlled peptic hydrolysis of bovine hemoglobin[J].International Journal of Biological Macromolecules,2011,49(2):143-153.
[5] 赵玲,曹荣,刘淇,等.南极磷虾酶解多肽的抑菌活性[J].渔业科学进展,2011,32(4):112-116.
Zhao Ling,Cao Rong,Liu Qi,et al.Antimicrobial activity of polypeptides from Antarctic krill[J].Progress in Fishery Sciences,2011,32(4):112-116.
[6] 王军,庞广昌.抗菌肽抗菌机理的研究现状及趋势[J].食品科学,2005,26(8):526-529.
Wang Jun,Pang Guangchang.Review on the current status and development trend of mechanism of antimicrobial peptides[J].Food Science,2005,26(8):526-529.
[7] 汪青.泥蚶血红蛋白克隆、表达与免疫相关性研究[D].上海:上海海洋大学,2012.
Wang Qing.Molecular cloning,expression and immune-related research on the hemoglobin from blood clamTegillarcagranosa[D].Shanghai:Shanghai Ocean University,2012.
[8] 王素芳,包永波,施淼江,等.泥蚶血红蛋白的制备及其抗菌活性研究[J].海洋学报,2014,36(12):67-73.
Wang Sufang,Bao Yongbo,Shi Miaojiang,et al.Purification and antibacterial activity of hemoglobin fromTegillarcagranosa[J].Haiyang Xuebao,2014,36(12):67-73.
[9] Xu Bin,Zhao Jun,Jing Zhao,et al.Role of hemoglobin from blood clamScapharcakagoshimensisbeyond oxygen transport[J].Fish&Shellfish Immunology,2015,44(1):248-256.
[10] 荆昭.毛蚶(Scapharcakagoshimensis)血红蛋白的类酚氧化酶性质及其抗菌活性研究[D].青岛:中国海洋大学,2011.
Jing Zhao.Study on phenoloxidase-like properties and antibacterial activity of hemoglobin from blood clamScapharcakagoshimensis[D].Qingdao:Ocean University of China,2011.
[11] Bao Yongbo,Wang Qing,Lin Zhihua.Hemoglobin of the bloody clamTegillarcagranosa(Tg-HbI)is involved in the immune response against bacterial infection[J].Fish&Shellfish Immunology,2011,31(4):517-523.
[12] 朱晓囡,苏志国.反相液相色谱在蛋白质及多肽分离分析中的应用[J].分析化学,2004,32(2):248-254.
Zhu Xiaonan,Su Zhiguo.Application of reversed-phase liquid chromatography in separation and analysis of proteins and peptides[J].Chinese Journal of Analytical Chemistry,2004,32(2):248-254.
[13] 杨化新,张培培,徐康森.重组人生长激素胰肽图谱分析[J].药物分析杂志,1994,14(3):10-13.
Yang Huaxin,Zhang Peipei,Xu Kangsen.HPLCanalysis of tryptic mapping of recombinant human growth hormone[J].Chinese Journal of Pharmaceutical Analysis,1994,14(3):10-12.
[14] Boman H G,Steiner H,Hultmark D,et al.Sequence and specificity of two antibacterial proteins involved in insect immunity[J].Nature,1981,292(5820):246-248.
[15] 肖建光,刘文生.水产动物抗菌肽的研究进展[J].水利渔业,2005,25(1):4-5.
Xiao Jianguang,Liu Wensheng.Advances in immune peptide studies on aquaculture animals[J].Reservoir Fisheries,2005,25(1):4-5.
[16] Daoud R,Dubois V,Bors-Dodita L,et al.New antibacterial peptide derived from bovine hemoglobin[J].Peptides,2005,26(5):713-719.
[17] Lee S Y,Lee B L,Söderhäll K.Processing of an antibacterial peptide from hemocyanin of the freshwater crayfishPacifastacusleniusculus[J].Biological Chemistry,2003,278(10):7927-7933.
[18] 陈彤彤,宋晓妍,解树涛,等.植物源抗菌肽的研究进展[J].西北植物学报,2006,26(2):420-426.
Chen Tongtong,Song Xiaoyan,Xie Shutao,et al.Research advances about anti-microbial peptides of plant origins[J].Acta Botanica Boreali-Occidentalia Sinica,2006,26(2):420-426.
[19] Viljanen P,Koski P,Vaara M.Effect of small cationic leukocyte peptides(defensins)on the permeability barrier of the outer membrane[J].Infect Immunity,1988,56(9):2324-2329.
[20] Uyterhoeven E T,Butler C H,Ko D,et al.Investigating the nucleic acid interactions and antimicrobial mechanism of buforin II[J].Febs Letters,2008,582(12):1715-1718.
[21] 翟培,韩晋辉,候丽霞,等.家蝇抗菌肽的抑菌动力学研究及其机理初探[J].中国生物工程杂志,2006,26(11):33-39.
Zhai Pei,Han Jinhui,Hou Lixia,et al.Investigate antibiosis dynamics and antibacterial mechanisms of antibacterial peptides from Musca domestica Larvae[J].China Biotechnology,2006,26(11):33-39.
Antibacterial activity and mechanisms of heterotetramer hemoglobin derived polypeptide from Tegillarca granosa
Wang Juanjuan1,2,Bao Yongbo3,Wang Sufang1,3,Lin Zhihua3
(1.School of Marine Sciences,Ningbo University,Ningbo 315211,China;2.Zhejiang Collaborative Innovation Center of Ocean Efficient Healthy Culture,Ningbo 315211;3.Zhejiang Key Laboratory of Aquatic Germplasm Resources,Zhejiang Wanli University,Ningbo 315100,China)
Tg-HbⅡ(heterogeneous tetramer)and Tg-HbⅠ(homodimer)were purified by gel chromatography with a recovery 48.15%and 24.91%.Seven major peptides(F1-F7)were purified by reverse phase C-18 column from trysin enzymatic hydrolysates of Tg-HbⅡ.The agar diffusion method was used to detect their antibacterial activity.Results showed that all peptide collections exhibited no antibacterial activity toStaphylococcusaureus,Pseudomonasputida,Eschetichiacoli,BacillusfirmusandB.subtilis;but peptides F2-F7 showed antibacterial activity againstVibrioalginolyticus,V.harveyiandV.parahaemolyticus.MICs of peptide F2-F7 towardV.alginolyticus,V.parahaemolyticusandV.harveyiwere 0.012-0.200 mg/m L Using fluorescence microscopy to observe the cell that treated with peptide,found that vibrio cells die rapidly in 5 min.Using Transmission electronmicroscopy to observeV.alginolyticusandV.harveryiafter antibacterial peptides treatment,the results showed that the peptides changed permeability of cytoplasmic membrane,leading to leaking out of cytoplasmic contents.Finally,the affected Vibrio died due to leakage of the cell contents.Research results showed that theTegillarca granosahemoglobin source of antimicrobial peptides have obvious antibacterial activity against vibrio and antimicrobial peptides kill bacteria by damaging its internal structure,these findings laid a solid foundation to the research of antibacterial mechanism of hemoglobin.
Tegillarcagranosa;enzymolysis peptides;RP-HPLC;antibacterial activity;ultrastructure;antibacterial mechanism
S917.4
A
0253-4193(2015)12-0106-10
王娟娟,包永波,王素芳,等.泥蚶血红蛋白异源四聚体酶解多肽抗菌活性及其机理研究[J].海洋学报,2015,37(12):106—115,
10.3969/j.issn.0253-4193.2015.12.011
Wang Juanjuan,Bao Yongbo,Wang Sufang,et al.Antibacterial activity and mechanisms of heterotetramer hemoglobin derived polypeptide fromTegillarcagranosa[J].Haiyang Xuebao,2015,37(12):106—115,doi:10.3969/j.issn.0253-4193.2015.12.011
2015-07-20;
2015-09-28。
国家高技术研究发展计划项目(2012AA10A410);浙江省自然科学重点基金项目(LZ12C190001);浙江省重中之重学科开放基金项目(KF2014002);宁波市自然科学基金(2015A610258)。
王娟娟(1990—),女,浙江省兰溪市人,主要从事海洋生物学研究。E-mail:425107946@qq.com
*通信作者:林志华,研究员,主要研究方向为水产动物繁育及遗传育种。E-mail:zhihua9988@126.com
