南极普里兹湾及其邻近海域悬浮颗粒有机物的碳同位素组成及其影响因素
2015-06-01任春燕陈敏高众勇郭劳动贾仁明刘萧邱雨生郑敏芳
任春燕,陈敏,2*,高众勇,郭劳动,4,贾仁明,刘萧,邱雨生,郑敏芳
(1.厦门大学海洋与地球学院,福建厦门 361102;2.厦门大学近海海洋环境科学国家重点实验室,福建厦门 361102;3.国家海洋局第三海洋研究所大气与全球变化重点实验室,福建厦门 361005;4.美国威斯康星大学水科学学院,密尔沃基WI 53204)
南极普里兹湾及其邻近海域悬浮颗粒有机物的碳同位素组成及其影响因素
任春燕1,陈敏1,2*,高众勇3,郭劳动1,4,贾仁明1,刘萧1,邱雨生1,郑敏芳1
(1.厦门大学海洋与地球学院,福建厦门 361102;2.厦门大学近海海洋环境科学国家重点实验室,福建厦门 361102;3.国家海洋局第三海洋研究所大气与全球变化重点实验室,福建厦门 361005;4.美国威斯康星大学水科学学院,密尔沃基WI 53204)
依托中国第29次南极科学考察航次开展了南大洋普里兹湾及其邻近海域悬浮颗粒有机物碳同位素组成(δ13CPOC)的研究,结合温度、盐度、营养盐和溶解CO2的数据,揭示了影响研究海域颗粒有机物碳同位素组成的主控因素,计算出混合层中浮游植物吸收无机碳过程的碳同位素分馏因子。结果表明,普里兹湾及其邻近海域的δ13CPOC介于-28.5‰~-21.1‰,平均值为-24.6‰,表现出湾内大于湾外的特征。浮游植物同化吸收CO2过程的碳同位素分馏是影响研究海域混合层δ13CPOC的主要因素,根据δ13CPOC和1/[CO2(aq)]的线性拟合关系,计算出浮游植物同化吸收CO2过程的碳同位素分馏因子εp为23.4‰。δ13CPOC的垂直分布随深度增加而增大,反映出颗粒有机物垂向输送过程中颗粒有机物再矿化过程同位素分馏作用的影响。
悬浮颗粒有机物;δ13CPOC;碳同位素分馏因子;南极普里兹湾
1 引言
海洋颗粒有机物(POM)是生物泵运转的载体,POM从产生到沉降迁出至海底的过程中,一方面可将部分金属元素和污染物携带至沉积物中,另一方面,沉降过程中有机物的降解可将部分生源要素等释放至水体环境中。天然碳稳定同位素组成可用来反映海洋生物泵各种生物地球化学过程的信息,包括生物光合作用、营养盐的生物吸收、有机物质的降解、颗粒物从真光层的输出、有机物质的不同来源等。真光层颗粒有机物的碳同位素组成变化可提供有关海洋生物固碳过程的相关信息,有助于深入理解海洋环境中碳的生物地球化学循环。对诸多河口的研究发现,陆源和海源δ13CPOC有不同的端元值,这为区分陆源和海源有机物的贡献奠定了基础[1—3]。对于开阔大洋,已发现不少海域δ13CPOC和溶解CO2浓度([CO2(aq)])具有负相关关系[4—9],这为古海洋学研究中通过δ13CPOC反演海水表层溶解CO2浓度的变化提供了可能[10—11]。
南大洋是典型的高营养盐、低叶绿素海区(HN-LC),南大洋约80%海域上层水体中的叶绿素a含量都小于0.5 mg/m3,生产力较低[12],但它是全球大气重要的冷源和CO2汇,其吸收的CO2占全球海洋净吸收通量的35%,因而成为研究海洋碳循环及其与全球气候变化关系的重要区域[13]。南大洋颗粒有机物的碳同位素组成与中低纬度海域相比有明显不同的特征,悬浮颗粒有机物和沉积有机物的δ13CPOC均明显低于中低纬度海域的相应值[14—15]。研究表明,南大洋浮游植物体内有机物的δ13C值随着纬度的增加而降低,这种降低起初被认为是温度变化引起光合作用过程碳同位素分馏的变化所致,但此后的研究证实,温度引起的溶解CO2浓度变化,进而导致光合作用过程碳同位素分馏因子变化才是关键因素[4,16]。也有研究指出,南大洋较低的δ13CPOC值是由低温、低光照、高溶解CO2浓度和低浮游植物生长速率共同所致[17]。
普里兹湾位于南大洋印度洋扇区,是南极大陆沿岸面积仅次于威德尔海和罗斯海的第三大海湾,也是我国南极科学考察的重点海区。由于埃默里冰架等的隔离作用,普里兹湾受陆源输入和人类活动的影响较少。迄今为止,有关普里兹湾及其邻近海域颗粒有机物碳同位素组成的研究还比较少,且主要集中在表层和真光层。Popp等研究了伊丽莎白公主地至普里兹湾东侧一个南北向断面悬浮颗粒有机物碳同位素的控制因素,发现δ13CPOC与溶解CO2浓度([CO2(aq)])之间没有相关性,提出浮游植物种类及其生长速率的变化可能是调控δ13CPOC变化的主要因素[18]。Zhang等研究了普里兹湾上层水体碳动力学与水团构成的关系,发现海冰融化水份额与δ13CPOC之间具有显著的正相关关系[19]。尹希杰等报道了普里兹湾及其邻近海域表层海水δ13CPOC的空间分布特征及其影响因素,认为研究海域δ13CPOC的分布可能主要受浮游植物吸收CO2过程的影响[20]。
本研究利用中国第29次南极科学考察航次的机会,开展了普里兹湾及其邻近海域整个水柱中悬浮颗粒有机物碳同位素组成的研究,结合温度、盐度、营养盐和溶解CO2的数据,探讨悬浮颗粒有机物从表及底碳同位素组成空间变化的影响因素,揭示研究海域浮游植物光合作用过程的碳同位素分馏及其分馏因子。
2 实验方法
2.1 样品采集
悬浮颗粒物样品采自中国第29次南极科学考察航次,该航次由“雪龙”号科考船实施,采样时间为2013年1月31日至3月3日(南半球夏季),利用CTD采集了表层至3 500 m深度区间不同深度的海水样品。研究海区的海冰季节变化显著,一般而言,10月为海冰融化初期,11至12月是融化中期,1月至2月是海冰融化末期[21],本研究样品采集时间属于海冰融化末期。
样品采集区域最北到64.5°S,站位主要分布在5个经向断面,分别为P3(68°E)、P4(70.5°E)、P5(73° E)、P6(75°E)和P7(78°E附近)断面,共计27个站位(图1)。P3断面采集了5个站位的样品,站位北起65°S、最南至67.5°S的陆架区,靠近达恩利角冰间湖。P4断面由65°S向南延伸至陆架区弗拉姆浅滩处(67.5°S),共设有5个站位。P5断面由65°S沿73°E向南穿过普里兹湾湾口延伸至普里兹湾湾内68.5°S,此断面为历次南极科学考察的重点断面,共设有6个站位。P6断面由普里兹湾湾外66°S向南穿过四女士浅滩延伸至普里兹湾湾内69.2°S,共设有6个站位。P7断面由64.5°S向南穿过四女士浅滩至68°S,共设有5个站位。
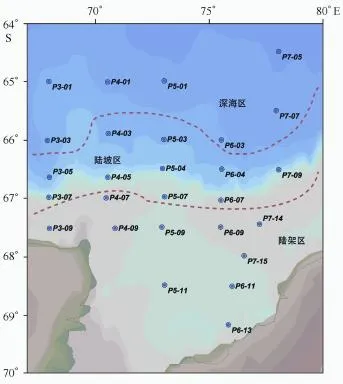
图1 普里兹湾及其邻近海域悬浮颗粒有机物碳同位素组成研究的采样站位Fig.1 Sampling locations in the Prydz Bay and its adjacent areas during 2013
2.2 方法
海水中悬浮颗粒物样品由CTD采集的海水样品(5~10 dm3)经过预先高温灼烧的47 mm GF/F滤膜(450℃,4 h)过滤后得到。将含有颗粒物的滤膜于60℃下烘干,装入滤膜盒,于-20℃下冷冻保存,带回陆地实验室进行POC及δ13CPOC的分析。在陆地实验室,滤膜干燥后用浓盐酸酸熏48 h,去除无机碳,用Milli-Q水润洗烘干后,包入锡舟送入元素分析仪-同位素比值质谱仪联机测定(EA-IRMS)(Carlo Erba NC 2500,Thermo Finnigan DELTAPLUSXP)。EAIRMS按如下条件进行设置:氧化炉温度为1 000℃,还原炉温度为650℃;色谱柱(Porapak Q)温度为50℃;He载气流量为100 cm3/min;O2流量为150 cm3/min;参考气CO2流量为150 cm3/min。颗粒物中的有机碳通过催化氧化作用转化为CO2,进而测得POC含量及δ13CPOC。POC含量测定所采用的标准物质为C6H6N2O,检出限为0.1μmol,测量精度优于0.2%。碳稳定同位素的分析标准为美国南卡罗莱州白垩系皮狄组拟箭石(PDB,Peedee Belemnite)。为确保测量过程中仪器的稳定性及所得δ13C值的准确,每间隔10个待测样品穿插一个IAEA-C8标准物质(δ13C=-18.3‰)进行单点校正,IAEA-C8标准物质测定的相对标准偏差小于0.2‰。
溶解CO2浓度根据DIC、p H和TA计算得到(CO2 SYS V2.1)[22],其中,DIC和TA分别采用无机碳分析仪(DIC Analyzer AS-C3)和总碱度滴定仪(Total Alkalinity Gran Titration System,AS-ALK1)进行测量[23],DIC和TA的测定精度均优于0.1%。p H用Thermo Orion ROSS 复合p H电极(型号8102BN)及Thermo Orion 3 star p H计测得,测量精度优于0.005 p H单位(0.1 m V)。计算中所用碳酸离解常数K1和K2采用Mehrbach等报道[24]并经Dickson和Millero修正的数值[25]。
营养盐数据由国家海洋局第二海洋研究所韩正兵、潘建明研究员提供。海水样品经0.45μm醋酸纤维膜过滤后用饱和氯化汞溶液固定,保存于洁净的塑料瓶中,带回陆地实验室。分别用铜镉柱还原法、抗坏血酸磷钼蓝法测定硝酸盐、活性磷酸盐的含量(《海洋监测规范》GB 173784-2007)。温度、盐度数据由SBE-911 plus CTD直接获得,其中温度测量的精度为±0.001℃,电导率的测定精度为±0.002 S/m。
3 结果
3.1 温度和盐度
海水的表层温度介于-1.49~0.77℃,平均值为-0.37℃。表层温度的分布整体呈现东北-西南走向,湾内温度最低(P5-11站),由湾内向湾外逐渐增高,至深海区表层温度达到最高(P7-05站)。表层水的盐度介于32.78~34.13,平均值为33.75,最低值出现在P6-13站,最高值出现在P3-07站。表层盐度的分布表现出湾内低于湾外、湾外西侧高于东侧的特征。研究区域5个断面温盐的垂直分布特征十分类似,故以P3和P5断面为例加以说明(下同)。从普里兹湾湾内外温度、盐度的垂直分布可以看出,研究区域从表到底主要存在南极夏季表层水(AASW),冬季残留水(WW),绕极深层水(CDW)和南极底层水(AABW),CDW由湾外涌升至陆坡区。陆架区受海冰融化水影响,温度、盐度低于陆坡及深海区,深海区近底层出现AABW的特征[26](图2、图3)。
3.2 营养盐
普里兹湾及其邻近海域表层海水硝酸盐浓度的变化范围为17.52~31.26μmol/dm3,平均值为27.16μmol/dm3,最低值出现在湾内的P6-13站,最高值出现在陆坡区的P4-05站。表层海水活性磷酸盐浓度的变化范围为1.16~2.56μmol/dm3,平均值为2.17μmol/dm3。活性磷酸盐和硝酸盐的变化趋势一致,陆架区由于浮游植物光合作用吸收营养盐更为强烈,硝酸盐和磷酸盐浓度明显低于陆坡区和深海区。整个研究区域硝酸盐和活性磷酸盐的垂直变化呈随深度增加而增加的趋势,中深层水体变化相对较小(图2、图3)。
3.3 CO2(aq)
普里兹湾及其邻近海域表层CO2(aq)含量介于12.6~21.8μmol/kg之间,平均值为18.5μmol/kg,最低值出现在湾内的P6-13,最高值出现在陆坡区的P3-07站。整个研究区域CO2(aq)含量的变化趋势呈现由湾内向湾外逐渐增加的特征;CO2(aq)的垂直分布则表现为随深度增加而增大,但中深层变化较小的规律,反映出真光层CO2(aq)被浮游植物吸收利用的影响(图2、图3)。
3.4 POC
普里兹湾及其邻近海域表层水POC含量介于0.86~10.83μmol/dm3之间,平均值为3.85μmol/dm3,变化范围较大,最高值出现在营养盐和CO2(aq)浓度最低的P6-13站,最低值出现在陆坡区弗拉姆浅滩处的P4-07站,总体低于此前中国南极科学考察航次报道的普里兹湾及其邻近海域表层水的POC含量(1.06~93.67μmol/dm3)[27—29],可能与采样站位的空间分布以及采样时间的不同有关。本研究在湾内采样站位较少,特别是未能采集到埃默里冰架附近海域的样品,而冰架边缘海域的浮游植物生长一般较为旺盛,具有较高的初级生产力[30—31],另外,本研究样品的采集时间处于海冰融化末期,比其他航次来得晚,此时浮游植物的藻华已处于后期。从POC的空间分布看,陆架区POC浓度高于陆坡及深海区,而中深层海水POC含量变化较小(图2、图3)。
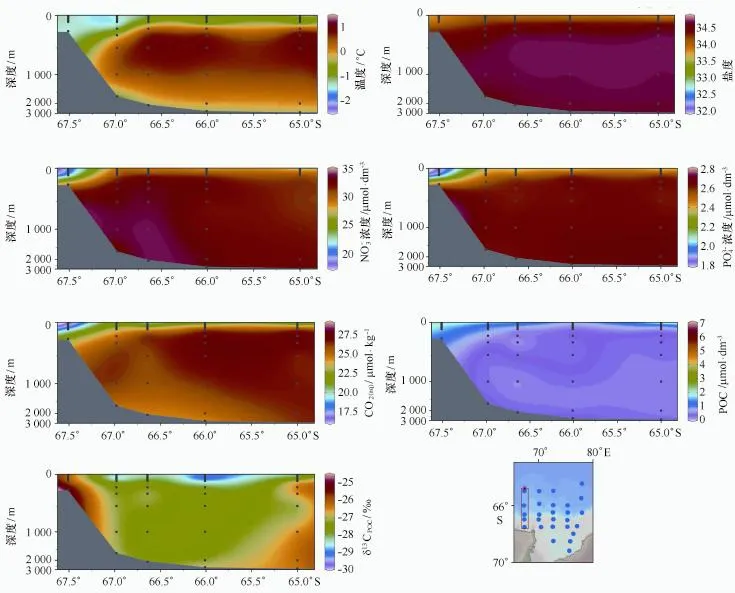
图2 普里兹湾及其邻近海域P3断面温度、盐度、硝酸盐浓度、磷酸盐浓度、CO2(aq)、POC和δ13CPOC的分布Fig.2 Sectional distributions of temperature,salinity,nitrate,phosphate,CO2(aq),POC andδ13CPOCat Section P3 in the Prydz Bay and its adjacent areas
3.5 δ13CPOC
普里兹湾及其邻近海域表层水δ13CPOC的变化范围介于-28.6‰~-26.2‰,平均值为-27.4‰,最低值出现在弗拉姆浅滩附近的P4-07站,最高值出现在达恩利角附近的P3-09站。研究海域表层水的δ13CPOC明显低于中低纬度海域的报道值,与高纬度海域的报道值相符合(表1),也与此前报道的表层水δ13CPOC随纬度增加而降低的趋势[5,7,9]相一致。对比普里兹湾表层海水δ13CPOC的数据,本研究结果比中国第22次南极考察报道的普里兹湾表层水体δ13CPOC(-27.4‰~-19.0‰)稍低[19],可能的原因在于本研究航次未采集到埃默里冰架前沿的样品,而海冰融化所释放冰藻的δ13CPOC一般较高(-15‰~-8‰)[32]。本研究结果与同一航次表层δ13CPOC的报道值(变化范围为-29.7‰~-26.3‰,平均值为-28.01‰)[20]相一致。

图3 普里兹湾及其邻近海域P5断面温度、盐度、硝酸盐浓度、磷酸盐浓度、CO2(aq)、POC和δ13CPOC的分布Fig.3 Sectional distributions of temperature,salinity,nitrate,phosphate,CO2(aq),POC andδ13CPOCat Section P5 in the Prydz Bay and its adjacent areas
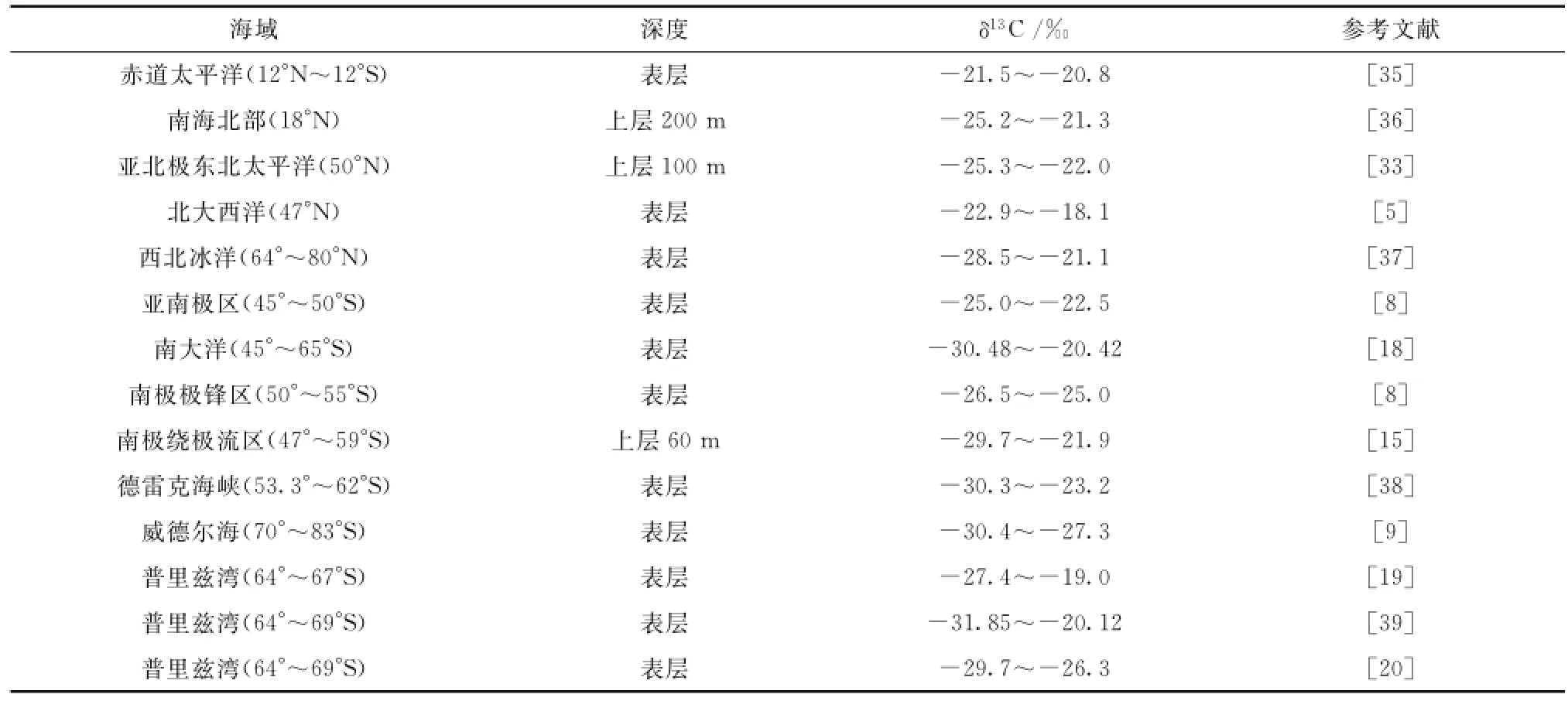
表1 海洋悬浮颗粒有机物的δ13CPOC值Tab.1 Comparisons inδ13CPOCvalues of suspended particulate organic matter from different marine environments
普里兹湾及其邻近海域δ13CPOC的空间分布显示,湾内陆架区的δ13CPOC总体高于湾外陆坡及深海区,并且无论是陆架区,还是陆坡区和海盆区,δ13CPOC均随着深度的增加而增加,如陆架区次表层的δ13CPOC比混合层高约2‰,而陆坡区和深海区深层水的δ13CPOC分别比次表层和混合层高约1‰和2‰(图2、图3)。δ13CPOC随深度增加而增加的形成可能与生源颗粒有机物垂向输送过程的再矿化作用有关,在有机物降解过程中,会优先降解贫13C的有机物,导致残留颗粒物的δ13CPOC逐渐升高[17,33-34]。与此类似,南大洋澳大利亚扇面1 500 m以浅沉降颗粒有机物δ13CPOC随着深度的增加而增加[17];亚北极东北太平洋也发现真光层以深悬浮颗粒有机物的δ13CPOC随深度的增加而显著增加[33]。
4 讨论
4.1 普里兹湾混合层δ13CPOC变化的主控因素
与中深层相比,海洋真光层中的δ13CPOC变化一般较大,其影响因素主要包括温度、p H值、光强、生物利用无机碳形态、浮游植物种群、生长速率等。各因素对δ13CPOC的影响情况归纳如下:(1)温度:研究表明,海水温度每升高1℃,δ13CPOC增加0.3‰~0.5‰[40—41]。(2)海水p H值:海水p H值主要通过影响碳酸盐体系无机碳的形态及其含量,从而影响浮游植物固碳底物的含量及其同位素分馏[42]。(3)光照:光强由于会影响初级生产过程,从而对δ13CPOC产生影响。在高纬度海域,混合层深度可作为光照强度变化的指标,一般而言,混合层越深,水柱平均光强降低,初级生产力下降,导致δ13CPOC较低;相反,混合层变浅时,水柱平均光强增强,初级生产力提高,光合作用导致反应底物浓度降低,δ13CPOC增加[19,43]。(4)生物利用无机碳形态:浮游植物利用的无机碳形态不同,其产生的δ13CPOC会产生差别。如果浮游植物吸收利用的是HCO-3和CO2-3,则其产生的δ13CPOC要高于利用CO2(aq)产生的δ13CPOC,这与不同固碳过程的同位素分馏因子不同有关,浮游植物通过C3过程Rubisco酶吸收利用CO2(aq)的碳同位素分馏因子要大于C4过程β-羧化酶利用HCO-3和CO2-3的同位素分馏因子[44]。(5)浮游植物种群:浮游植物种群结构的变化,也可能导致其产生的δ13CPOC不同,有研究表明,硅藻产生的δ13CPOC要高于甲藻[45]。(6)浮游植物生长速率:浮游植物生长速率(μ)越快,所产生的δ13CPOC越高[40,46]。另外,有研究表明,浮游植物脂类含量的不同也会影响δ13CPOC,脂类有机物的δ13C值一般低于氨基酸和蛋白质的δ13C,而温度越低,浮游植物体内的脂类物质含量往往越高,由此导致δ13CPOC的降低[17]。
温度、p H值、光强、生物利用无机碳形态、浮游植物种群、生长速率等因素引起的δ13CPOC变化本质上都是通过影响浮游植物所吸收的无机碳含量及吸收过程的同位素分馏来实现的。对于海洋以C3光合作用过程为主的海洋浮游植物而言,海水中CO2(aq)的变化将对光合作用产生的δ13CPOC起决定性作用。已有研究发现,很多海域的δ13CPOC与[CO2(aq)]之间具有显著的负相关关系,如印度洋[4]、大西洋[5]、南大洋部分海域[6,8—9]等。对全球海洋表层δ13CPOC进行的模型研究也表明,全球海洋表层水δ13CPOC的变化主要受控于[CO2(aq)]的变化[46]。δ13CPOC与[CO2(aq)]负相关性的存在主要取决于温度或者生物活动调控的[CO2(aq)],由赤道向两极方向,温度逐渐降低,CO2(aq)增加,浮游植物碳吸收过程中的同位素分馏作用加强,导致δ13CPOC降低[7]。
普里兹湾及其邻近海域远离陆地,且受埃默里冰架的隔离作用,陆源输入很小,POC主要来自浮游植物光合作用产生,因而研究海域δ13CPOC的变化受陆源输入或人类活动的影响很小[27—29]。本研究结果显示,研究区域混合层(50 m以浅)的δ13CPOC和[CO2(aq)]之间具有显著的负相关关系:δ13CPOC=-0.23[CO2(aq)]-23.38(n=78,r2=0.22,p<0.000 1)(图4),说明浮游植物同化吸收CO2过程的同位素分馏是影响普里兹湾及其邻近海域混合层δ13CPOC变化的主要调控因素。另外,普里兹湾及其邻近海域混合层POC含量与溶解CO2浓度之间具有显著的负相关关系(r2=0.36,p<0.000 1)(图5),并且溶解CO2与硝酸盐(r2=0.68,p<0.000 1)和活性磷酸盐(r2=0.79,p<0.000 1)之间均呈现显著的正相关关系(图6),这些都可佐证浮游生物活动影响到溶解CO2的含量,进而通过同化吸收过程的同位素分馏影响普里兹湾及其邻近海域δ13CPOC的变化。
4.2 浮游植物吸收无机碳过程的碳同位素分馏因子
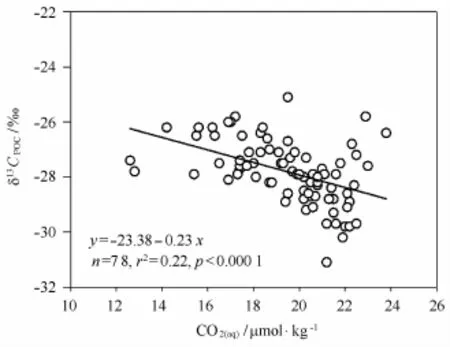
图4 普里兹湾及其邻近海域混合层中δ13CPOC和[CO2(aq)]的关系Fig.4 Relationship betweenδ13CPOCand[CO2(aq)]in the mixed layer in the Prydz Bay and its adjacent areas

图5 普里兹湾及其邻近海域混合层中[CO2(aq)]和POC的关系Fig.5 Concentrations of CO2(aq)verse particulate organic carbon(POC)in the mixed layer in the Prydz Bay and its adjacent areas
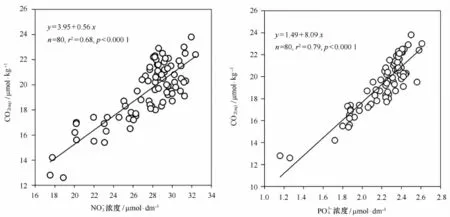
图6 普里兹湾及其邻近海域混合层中[CO2(aq)]和硝酸盐和活性磷酸盐浓度的关系Fig.6 Correlation between[CO2(aq)]and nitrate or phosphate concentration in the mixed layer of the Prydz Bay and its adjacent areas
尽管不同海域的δ13CPOC往往与[CO2(aq)]存在负相关关系,但不同海域二者之间的线性拟合方程往往不同,例如,南大西洋δ13CPOC与[CO2(aq)]的拟合关系为:δ13CPOC=-0.8[CO2(aq)]-12.6[16];德雷克海峡为:δ13CPOC=-0.9[CO2(aq)]-9.4[38];东北大西洋为:δ13CPOC=-1.5[CO2(aq)]-2.1[5]。不同海域δ13CPOC与[CO2(aq)]拟合方程的不同与浮游植物固碳过程中碳同位素分馏因子的变化有关,生物作用改变δ13CPOC主要是通过改变碳的同位素分馏程度即分馏因子εp来进行的。当无机碳只是来自浮游植物通过被动扩散所吸收的CO2(aq),考虑到浮游植物种群和生长速率,δ13CPOC与[CO2(aq)]存在如下的关系[35,37,46]:
δ13CPOC=δ13CCO2(aq)-εp+a·μ/[CO2(aq)],(1)式中,δ13CCO2(aq)是反应物CO2(aq)的碳同位素组成;εp是光合作用固碳过程的碳同位素分馏因子;μ代表浮游植物的生长速率,a是反映不同种群的常数。由公式可以看出,δ13CPOC受εp、μ和[CO2(aq)]的共同影响。
本研究获得的普里兹湾及其邻近海域混合层δ13CPOC和1/[CO2(aq)]的线性拟合方程为:δ13CPOC=(-31.4±0.9)+69.1/[CO2(aq)](r2=0.19,p<0.000 1)(图7)。拟合方程的截距(-31.4±0.9)即代表了(δ13CCO2(aq)-εp),而南大洋的δ13CCO2(aq)约为-8‰[47],因此,普里兹湾及其邻近海域浮游植物同化吸收无机碳过程中的碳同位素分馏因子εp为23.4‰±0.9‰,这与文献报道的浮游植物C3过程Rubsico酶吸收CO2(aq)的分馏因子(25‰~30‰)[43]一致,也再次证实浮游植物吸收溶解CO2过程是影响普里兹湾及其邻近海域δ13CPOC变化的主要因素。
浮游植物种群组成和生长速率的空间变化可能是影响普里兹湾及其邻近海域δ13CPOC和[CO2(aq)]拟合相关性的因素之一。普里兹湾湾内陆架区浮游植物优势种为羽纹硅藻(Nitzschiafragilariopsis)、裸鞭毛藻和个体较大的异养甲藻,水华发生时的优势种为羽纹硅藻和大的异养甲藻,而湾外海盆区的浮游植物优势种为个体较大的环纹硅藻和个体较小的甲藻,羽纹硅藻的δ13C值较高,而裸鞭毛藻和环纹硅藻的δ13C较低[43]。另外,冰融水份额也会影响δ13CPOC和[CO2(aq)]的拟合相关,对普里兹湾及其邻近海域的研究发现,表层海水δ13CPOC与冰融水份额之间具有显著的正相关关系,因此,海冰融化会通过影响浮游植物生长速率等影响到光合作用可利用CO2(aq)的变化,进而导致δ13CPOC的空间变化[19]。除浮游植物种类和生长速率的影响外,浮游植物吸收无机碳路径的不同也会导致δ13CPOC的变化,进而影响δ13CPOC和[CO2(aq)]的相关性,目前已证实硅藻中存在的β-羧化酶可通过C4路径吸收海水中的HCO3-[48]。
5 结论
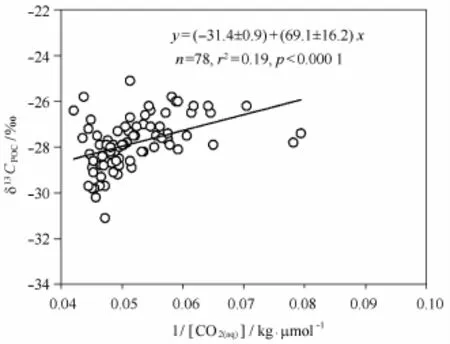
图7 普里兹湾及其邻近海域混合层中δ13CPOC和1/[CO2(aq)]的关系Fig.7 Relationship betweenδ13CPOCand 1/[CO2(aq)]in the mixed layer of the Prydz Bay and its adjacent areas
普里兹湾及其邻近海域混合层中的POC含量和δ13CPOC总体表现出湾内大于湾外的特征,可归因于浮游植物同化吸收CO2过程的同位素分馏作用。根据δ13CPOC和1/[CO2(aq)]的线性拟合关系,计算出普里兹湾及其邻近海域浮游植物同化吸收无机碳过程中的碳同位素分馏因子为23.4‰。δ13CPOC垂向分布上呈现随深度增加而增大的特征,可归因于生源颗粒有机物垂向输送过程中再矿化所致的同位素分馏作用。
致谢:感谢国家海洋局第二海洋研究所韩正兵、潘建明研究员提供营养盐的数据。
[1] Goni M A,Monacci N,Gisewhite R,et al.Distribution and sources of particulate organic matter in the water column and sediments of the Fly River Delta,Gulf of Papua(Papua New Guinea)[J].Estuarine,Coastal and Shelf Science,2006,69(1/2):225-245.
[2] Guerra R,Pistocchi R,Vanucci S.Dynamics and sources of organic carbon in suspended particulate matter and sediments in Pialassa Baiona lagoon(NW Adriatic Sea,Italy)[J].Estuarine,Coastal and Shelf Science,2013,135:24-32.
[3] Wu Y,Zhang J,Liu S M,et al.Sources and distribution of carbon within the Yangtze River system[J].Estuarine,Coastal and Shelf Science,2007,71(1/2):13-25.
[4] Francois R,Altabet M A,Goericke R,et al.Changes in theδ13Cof surface water particulate organic matter across the subtropical convergencein the SW Indian Ocean[J].Global Biogeochemical Cycles,1993,7(3):627-644.
[5] Rau G H,Takahashi T,Des Marais D J,et al.The relationship betweenδ13Cof organic matter and[CO2(aq)]in ocean surface water:Data from a JGOFS site in the northeast Atlantic Ocean and a model[J].Geochimica et Cosmochimica Acta,1992,56(3):1413-1419.
[6] Fischer G.Stable carbon isotope ratios of plankton carbon and sinking organic matter from the Atlantic sector of the Southern Ocean[J].Marine Chemistry,1991,35(1/4):581-596.
[7] Kennedy H,Robertson J.Variations in the isotopic composition of particulate organic carbon in surface waters along an 88°W transect from 67°S to 54°S[J].Deep-Sea Research PartⅡ,1995,42(4/5):1109-1122.
[8] Lourey M J,Trull T W,Tilbrook B.Sensitivity ofδ13Cof Southern Ocean suspended and sinking organic matter to temperature,nutrient utilization,and atmospheric CO2[J].Deep-Sea Research PartⅠ:Oceanographic Research Papers,2004,51(2):281-305.
[9] Rau G H,Sullivan C W,Gordon I L.δ13Candδ15N variations in Weddell Sea particulate organic matter[J].Marine Chemistry,1991,35(1/4):355-369.
[10] Bentaleb I,Fontugne M,Descolas-Gros C,et al.Organic carbon isotopic composition of phytoplankton and sea-surface pCO2reconstructions in the Southern Indian Ocean during the last 50,000 yr[J].Organic Geochemistry,1996,24(4):399-410.
[11] Freeman K H,Hayes J M.Fractionation of carbon isotopes by phytoplankton and estimates of ancient CO2levels[J].Global Biogeochemical Cycles,1992,6(2):185-198.
[12] Fukuchi M.Phytoplankton chlorophyll stocks in the Antarctic Ocean[J].Journal of the Oceanographical Society of Japan,1980,36(1):73-84.
[13] Arrigo K R,Van Dijken G,Long M.Coastal Southern Ocean:a strong anthropogenic CO2sink[J].Geophysical Research Letters,2008,35(21),doi:10.1029/2008GL035624.
[14] Cozzi S,Cantoni C.Stable isotope(δ13C andδ15N)composition of particulate organic matter,nutrients and dissolved organic matter during spring ice retreat at Terra Nova Bay[J].Antarctic Science,2010,23(1):43-56.
[15] Dehairs F,Kopczynska E,Nielsen P,et al.δ13C of Southern Ocean suspended organic matter during spring and early summer:regional and temporal variability[J].Deep-Sea Research PartⅡ,1997,44(1/2):129-142.
[16] Rau G H,Takahashi T,Des Marais D J.Latitudinal variations in planktonδ13C:implications for CO2and productivity in past oceans[J].Nature,1989,341(6242):516-518.
[17] Wada E,Terazaki M,Kabaya Y,et al.15N and13C abundances in the Antartic Ocean with emphasis on the biogeochemical structure of the food web[J].Deep-Sea Research Part A.Oceanographic Research Papers,1987,34(5/6):829-841.
[18] Popp B N,Trull T,Kenig F,et al.Controls on the carbon isotopic composition of southern ocean phytoplankton[J].Global Biogeochemical Cycles,1999,13(4):827-843.
[19] Zhang R,Zheng M F,Chen M,et al.An isotopic perspective on the correlation of surface ocean carbon dynamics and sea ice melting in Prydz Bay(Antarctica)during austral summer[J].Deep-Sea Research PartⅠ:Oceanographic Research Papers,2014,83:24-33.
[20] 尹希杰,李云海,乔磊,等.南极普里兹湾海域夏季表层水体颗粒有机碳及其同位素分布特征[J].极地研究,2014,26(1):159-166.
Yin Xijie,Li Yunhai,Qiao Lei,et al.Distribution of particulate organic carbon(POC)andδ13CPOCin surface waters in summer in the Prydz Bay,Antarctica[J].Chinese Journal of Polar Research,2014,26(1):159-166.
[21] 郑少军,史久新.南极普里兹湾邻近海域海冰生消发展特征分析[J].中国海洋大学学报,2011,41(7/8):9-16.
Zheng Shaojun,Shi Jiuxin.The characteristic of sea ice growth and melt in the Prydz Bay region,Antarctica[J].Periodical of Ocean University of China,2011,41(7/8):9-16.
[22] Lewis E,Wallace D W R.Program Developed for CO2System Calculations.ORNL/CDIAC-105[Z].Oak Ridge,Tennessee:Carbon Dioxide Information Analysis Center,Oak Ridge National Laboratory,U.S.Department of Energy,1998.
[23] 张凡.南极普里兹湾碳酸盐体系与碳通量研究[D].厦门:国家海洋局第三海洋研究所,2013.
Zhang Fan.Carbonate system and air-sea CO2fluxes in Prydz Bay,the Antarctica[D].Xiamen:The Third Institute of Oceanography,State Oceanic Administration,2013.
[24] Mehrbach C,Culberson C H,Hawley J E,et al.Measurement of the apparent dissociation constants of carbonic acid in seawater at atmospheric pressure[J].Limnology and Oceanography,1973,18(6):897-907.
[25] Dickson A G,Millero F J.A comparison of the equilibrium constants for the dissociation of carbonic acid in seawater media[J].Deep-Sea Research Part A:Oceanographic Research Papers,1987,34(10):1733-1743.
[26] 高郭平,董兆乾,侍茂崇,等.南极普里兹湾关键物理海洋学问题研究进展及未来趋势[J].上海海洋大学学报,2013,22(2):313-320.
Gao Guoping,Dong Zhaoqian,Shi Maochong,et al.Advances of physical oceanographic study on Prydz Bay and adjacent region,Antarctica[J].Journal of Shanghai Ocean University,2013,22(2):313-320.
[27] 扈传昱,张海生,潘建明,等.夏季南极普里兹湾碳的生物地球化学循环Ⅱ:POC的分布特征[J].极地研究,2001,13(3):195-204.
Hu Chuanyu,Zhang Haisheng,Pan Jianming,et al.The biogeochemistry of carbon cycle in summer of the Prydz Bay,AntarcticaⅡ:characteristics of POC distribution[J].Chinese Journal of Polar Research,2001,13(3):195-204.
[28] 于培松,扈传昱,朱根海,等.南极普里兹湾海域颗粒有机碳的变化特征[J].海洋学报,2011,33(4):181-186.
Yu Peisong,Hu Chuanyu,Zhu Genhai,et al.Characteristics of particulate organic carbon in the Prydz Bay of Antarctica[J].Haiyang Xuebao,2011,33(4):181-186.
[29] 韩正兵,扈传昱,薛斌,等.2007/2008年和2008/2009年夏季南大洋以及普里兹湾POC的分布与变化[J].极地研究,2011,23(1):11-18.
Han Zhengbin,Hu Chuanyu,Xue Bin,et al.Particulate organic carbon in the surface water of South Ocean and Prydz Bay during the austral summer of 2007/2008 and 2008/2009[J].Chinese Journal of Polar Research,2011,23(1):11-18.
[30] 邱雨生,黄奕普,刘广山,等.南极普里兹湾及邻近海域初级生产力的时空变异[J].厦门大学学报(自然科学版),2004,43(5):676-681.
Qiu Yusheng,Huang Yipu,Liu Guangshan,et al.Spatial and temporal variations of primary productivity in Prydz Bay and its adjacent sea area,Antarctica[J].Journal of Xiamen University(Natural Science),2004,43(5):676-681.
[31] 刘子琳,蔡昱明,宁修仁,等.1999/2000年夏季南极普里兹湾及湾口区叶绿素a和初级生产力[J].极地研究,2001,13(1):1-12.
Liu Zilin,Cai Yuming,Ning Xiuren,et al.Primary productivity and standing stock of phytoplankton in the Prydz Bay and the adjacent northern sea area during the austral summer of 1999/2000[J].Chinese Journal of Polar Research,2001,13(1):1-12.
[32] Gibson J A E,Trull T W,Nichols P D.Sedimentation of13C-rich organic matter from Antarctic sea-ice algae:A potential indicator of past sea-ice extent[J].Geology,1999,27:331-334.
[33] Wu Jinping,Calvert S E,Wong C S,et al.Carbon and nitrogen isotopic composition of sedimenting particulate material at station papa in the subarctic northeast Pacific[J].Deep-Sea Research PartⅡ:Topical Studies in Oceanography,1999,46(11/12):2793-2832.
[34] Guo Laodong,Tanaka T,Wang Deli,et al.Distributions,speciation and stableisotope composition of organic matter in the southeastern Bering Sea[J].Marine Chemistry,2004,91(1/4):211-226.
[35] Laws E A,Popp B N,Bidigare R R,et al.Dependence of phytoplankton carbon isotopic composition on growth rate and[CO2]aq:theoretical considerations and experimental results[J].Geochimica et Cosmochimica Acta,1995,59(6):1131-1138.
[36] Liu K-K,Kao S-J,Hu H-C,et al.Carbon isotopic composition of suspended and sinking particulate organic matter in the northern South China Seafrom production to deposition[J].Deep-Sea Research PartⅡ:Topical Studies in Oceanography,2007,54(14/15):1504-1527.
[37] Zhang Run,Chen Min,Guo Laodong,et al.Variations in the isotopic composition of particulate organic carbon and their relation with carbon dynamics in the western Arctic Ocean[J].Deep-Sea Research PartⅡ:Topical Studies in Oceanography,2012,81-84:72-78.
[38] Rau G H,Takahashi T,Des Marais D J,et al.Particulate organic matterδ13C variations across the Drake Passage[J].Journal of Geophysical Research:Oceans,1991,96(C8):15131-15135.
[39] Kopczyńska E E,Goeyens L,Semeneh M,et al.Phytoplankton composition and cell carbon distribution in Prydz Bay,Antarctica:relation to organic particulate matter and itsδ13C values[J].Journal of Plankton Research,1995,17(4):685-707.
[40] Burkhardt S,Riebesell U,Zondervan I.Effects of growth rate,CO2concentration,and cell size on the stable carbon isotope fractionation in marine phytoplankton[J].Geochimica et Cosmochimica Acta,1999,63(22):3729-3741.
[41] Hinga K R,Arthur M A,Pilson M E Q,et al.Carbon isotope fractionation by marine phytoplankton in culture:the effects of CO2concentration,p H,temperature,and species[J].Global Biogeochemical Cycles,1994,8(1):91-102.
[42] Wefer G,Killingley J S.Carbon isotopes in organic matter from a benthic algaHalimedaincrassata(Bermuda):effects of light intensity[J].Chemical Geology,1986,59:321-326.
[43] Drake B L.Using models of carbon isotope fractionation during photosynthesis to understand the natural fractionation ratio[J].Radiocarbon,2014,56(1):29-38.
[44] Falkowski P G.Species variability in the fractionation of13C and12C by marine phytoplankton[J].Journal of Plankton Research,1991,13(S1):21-28.
[45] Laws E A,Bidigare R R,Popp B N.Effect of growth rate and CO2concentration on carbon isotopic fractionation by the marine diatomPhaeodactylumtricornutum[J].Limnology and Oceanography,1997,42(7):1552-1560.
[46] Hofmann M,Wolf-Gladrow D A,Takahashi T,et al.Stable carbon isotope distribution of particulate organic matter in the ocean:a model study[J].Marine Chemistry,2000,72(2/4):131-150.
[47] Henley S F,Annett A L,Ganeshram R S,et al.Factors influencing the stable carbon isotopic composition of suspended and sinking organic matter in the coastal Antarctic sea ice environment[J].Biogeosciences,2012,9(3):1137-1157.
[48] Tortell P D,Payne C,Gueguen C,et al.Inorganic carbon uptake by Southern Ocean phytoplankton[J].Limnology and Oceanography,2008,53(4):1266-1278.
Stable carbon isotopic composition of suspended particulate organic matter in the Prydz Bay and its adjacent areas
Ren Chunyan1,Chen Min1,2,Gao Zhongyong3,Guo Laodong1,4,Jia Renming1,Liu Xiao1,Qiu Yusheng1,Zheng Minfang1
(1.College of Ocean and Earth Sciences,Xiamen University,Xiamen 361102,China;2.State Key Laboratory of Marine Environmental Science,Xiamen University,Xiamen 361102,China;3.Key Lab of Global Change and Marine-Atmospheric Chemistry,Third Institute of Oceanography,State Oceanic Administration,Xiamen 361005,China;4.School of Freshwater Sciences,University of Wisconsin-Milwaukee,WI 53204,USA)
To better understand carbon and particle dynamics in the Prydz Bay and its adjacent areas,stable carbon isotopic composition in suspended particulate organic matter(POM)along with aqueous CO2,nutrients and hydrographic data were measured to examine the spatial and vertical distributions ofδ13CPOCand their controlling factors during the 29thChinese Antarctic Research Expedition.Furthermore,carbon isotope fractionation factor during the assimilation of dissolved inorganic carbon(DIC)by phytoplankton in the mixed layer was estimated.Our resultsshowed thatδ13CPOCranged from-28.5‰to-21.1‰with an average of-24.6‰,showing an increase trend from the inner bay to open waters outside the Bay.Carbon isotope fractionation factor during phytoplankton DIC assimilation in the mixed layer was estimated to be 23.4‰based on the relationship betweenδ13CPOCand 1/[CO2(aq)],and was the major controlling factor forδ13CPOCvalues in the mixed layer in the Prydz Bay and its adjacent areas.Values ofδ13CPOCincreased in general with increasing depth in the study areas,ascribing to the isotope fractionation during POM remineralization.
suspended particulate organic matter;δ13CPOC;isotope fractionation factor;Prydz Bay;Antarctic
X145
A
0253-4193(2015)12-0074-11
任春燕,陈敏,高众勇,等.南极普里兹湾及其邻近海域悬浮颗粒有机物的碳同位素组成及其影响因素[J].海洋学报,2015,37(12):74—84,
10.3969/j.issn.0253-4193.2015.12.008
Ren Chunyan,Chen Min,Gao Zhongyong,et al.Stable carbon isotopic composition of suspended particulate organic matter in the Prydz Bay and its adjacent areas[J].Haiyang Xuebao,2015,37(12):74—84,doi:10.3969/j.issn.0253-4193.2015.12.008
2015-09-30;
2015-10-18。
南北极环境综合考察与评估专项(CHINARE01-04-03,04-01-06,04-04,04-03-05);国家自然科学基金杰出青年基金项目(41125020)。
任春燕(1985—),女,天津市人,博士研究生,从事同位素海洋化学研究。E-mail:wounderful007@163.com
*通信作者:陈敏(1970—),男,广东省兴宁市人,教授,博士,从事同位素海洋化学研究。E-mail:mchen@xmu.edu.cn
