海洋酸化对海水青鳉胚胎骨骼发育的影响
2015-06-01王晓杰肖潇李超岳娜
王晓杰,肖潇,李超,岳娜
(1.上海海洋大学海洋生物系统和神经科学研究所,上海 201306;2.上海海洋大学国际海洋研究中心,上海 201306;3.上海海洋大学省部共建水产种质资源发掘与利用教育部重点实验室,上海 201306)
海洋酸化对海水青鳉胚胎骨骼发育的影响
王晓杰1,2,3,肖潇1,李超1,岳娜1
(1.上海海洋大学海洋生物系统和神经科学研究所,上海 201306;2.上海海洋大学国际海洋研究中心,上海 201306;3.上海海洋大学省部共建水产种质资源发掘与利用教育部重点实验室,上海 201306)
本文在实验室模拟近期海洋酸化水平,对海洋酸化对海水青鳉鱼(Oryziamelastigma)胚胎骨骼发育的影响进行了初步研究。实验中,通过往实验水体中充入一定浓度CO2气体酸化海水。对照组CO2分压为450×10-6,两个处理组CO2浓度分别为1 160×10-6和1 783×10-6,对应的水体p H值分别为8.14,7.85和7.67。将海水青鳉鱼受精卵放入实验水体中至仔鱼孵化出膜,对初孵仔鱼经骨骼染色、显微拍照,挑取了仔鱼头部、躯干及尾部骨骼染色清晰的28个骨骼参数的长度进行了显微软件测量及数据统计分析。结果发现,酸化处理对实验鱼所测量的骨骼长度影响均不显著。因此推测,未来100~200年间海洋酸化对海水青鳉鱼的胚胎及初孵仔鱼的骨骼发育没有显著影响。
青鳉鱼;海洋酸化;骨骼发育
1 引言
自工业革命以来,大约1 420亿吨由人类活动产生的CO2被海洋吸收,导致海洋快速酸化。如果继续按照目前这种化石燃料消耗量和大气CO2浓度升高的趋势发展(目前浓度是390×10-6),到21世纪末CO2浓度会增加至720×10-6~1 020×10-6[1],p H值可能会下降0.3~0.4[2],而海水氢离子浓度会比工业革命以前上升100%~150%。
海洋酸化对海洋生物的影响,主要体现在对具有外骨骼或者内骨骼的海洋生物钙化过程的影响[3]。然而,对于海洋酸化对鱼类等其他非钙化生物影响的研究较少。在硬骨鱼中,在早期生活史阶段由于体内缺乏成熟的p H调节机制,对海洋酸化较为敏感。例如,较高浓度CO2(约2 000×10-6)的酸化处理,会引起鱼类早期发育的迟缓[4]、降低RNA/DNA比[5]以及身体内部多组织损伤[6]等。
鱼类体内的钙化器官,主要是内耳耳石,体内骨骼中也含有少量碳酸钙。已有研究发现,海洋酸化使海水鱼仔鱼的耳石体积、表面积和密度等显著增加[7],其影响机制可能与酸化情况下,HCO-3浓度上升导致耳石周围的内淋巴液中文石饱和度增加有关[8]。骨骼是鱼体质量的重要组成部分,头部和脊椎骨骼大约占鱼体总质量的10%~15%[9]。骨骼的主要成分是矿物质如钙、磷和胶原蛋白[10]。骨骼矿物质是一种磷灰石,主要是一类钙羟基磷灰石,并含有少量和痕量的其他成分,如碳(C)、镁(Mg)和钠(Na)。生物体内CO2-3对PO3-4离子的替换,能够导致磷灰石微晶大小变小和溶解度的增高[11]。而且生物微环境变化、血液中p H值以及HCO-3或者CO2-3都可导致生物体内几种磷灰石形式的转变[12-13]。目前,海洋酸化对仔稚鱼骨骼发育影响的研究极少,并且研究结果也不一致。Munday等研究发现,经600~850 μatm的不同酸化处理后,多棘雀鲷(Acanthochromis polyacanthus)稚鱼的骨骼参数的变化与酸化处理之间没有必然相关性[14]。但是,在对塞内加尔鳎(Solea senegalensis)进行升温和酸化的综合处理后,造成了31.5%的畸形率,畸形主要发生在头骨、脊柱、鳍等部位[15]。有限的研究不能全面了解酸化对鱼类骨骼发育的影响,因此有必要开展进一步的研究。
海水青鳉(Oryziamelastigma)具有个体小、世代时间短、两性特征明显、每日均可产卵、卵透明等优点,作为一种模式物种已广泛应用于海洋生态毒理学研究[16]。而且,淡水青鳉(Oryziaslatipes)已经完成了全基因组测序[17]。因此,本文将海水青鳉作为研究对象,研究海洋酸化对其骨骼发育的影响,为全面、深入了解酸化对鱼类影响形式及机制奠定基础。
2 材料与方法
2.1 实验鱼
海水青鳉成鱼每天投喂3次初孵卤虫,养殖水温23~28℃,每天吸底换水。受精卵经新鲜海水冲洗干净用于实验。
2.2 实验设置与水化学
经非色散式CO2测试计(TES-1370,台湾泰仕)测定实验室内CO2浓度为450×10-6,作为对照组。设两个处理组,CO2浓度分别为1 200×10-6和1 800 ×10-6,取约300粒受精6 h之内的受精卵放入5 L的三角锥形瓶中,每个处理组设3个平行,每组水温为28℃。
实验用水是由曝气自来水加入红海盐配制而成。对照组利用气泵直接通入空气,利用CO2加富器(CE 100,武汉瑞华)控制CO2浓度。利用p H计(SevenE-asy,METTLER TOLEDO)测量实验水p H值。盐度采用盐度折射计测量。海水总碱度采用滴定法测定。水中碳酸系统的其他参数利用CO2SYS软件进行计算[18]。
2.3 骨骼参数测量
每天检查瓶内是否有初孵仔鱼,当发现初孵仔鱼之后,放入-30℃冰箱中保存。
在实验结束后,在每个平行组取10尾鱼,每个处理共30尾鱼,进行骨骼的染色以及骨骼参数的测量。对初孵仔鱼,先后采用阿利新兰软骨染色方法和茜素红硬骨染色方法。在体视显微镜下拍照(Stereo Discovery.V12,ZEISS),并利用显微镜自带软件(Axio-Vision Rel.4.7)对骨骼参数进行测量。由于初孵仔鱼骨骼钙化程度低,茜素红染色不明显,阿利新兰染色较清晰,因此,根据软骨染色着色情况进行骨骼参数测量。头骨骨骼着色较深,分别对头部侧面、腹面和背面的骨骼进行测量。脊椎骨着色相对较浅,但椎骨间长度差异不显著,因此,每尾鱼选取4个椎骨进行了测量,取其平均值。选取测量骨骼参数的条件:(1)在大部分的样品中均清晰可见;(2)测量时有明显可辨别的起止点。测量的骨骼参数详见图1中海水青鳉鱼骨骼染色照片。
2.4 数据统计
所有数值采用平均值±标准差表示,用单因素方法分析(one-way ANOVA)和Duncan多重比较对组间数据进行差异显著性分析,以P<0.05为差异显著标准。统计分析使用SPSS 11.5软件进行。
3 结果
3.1 实验水体碳酸盐系统各参数测定结果
实验水体中碳酸盐系统的各参数见表1。

表1 实验水体中各实验组碳酸盐系统参数值Tab.1 Summary of seawater carbonate system parameters in the cultures
3.2 海水酸化对青鳉鱼骨骼参数的影响
在对所有初孵仔鱼进行观察后,在两个实验组中没有发现其他明显可辨别的畸形。初孵仔鱼骨骼染色图及主要骨骼示意图见图1,测量的各个骨骼参数起止点示意图见图2。
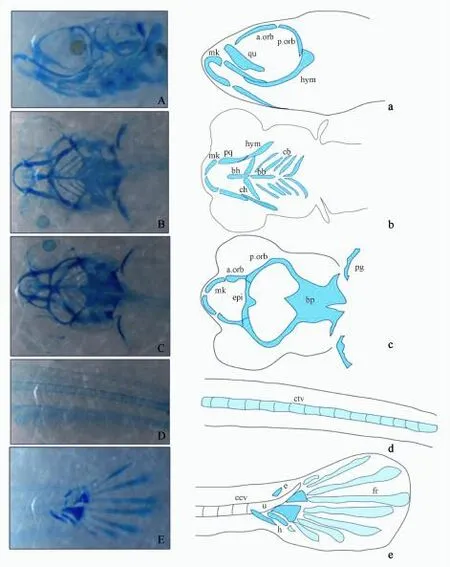
图1 海水青鳉初孵仔鱼骨骼染色及解剖示意图Fig.1 The staining and anatomical schematic pictures of bones in marine medaka larvae
对照组中各个骨骼参数数值及3个实验组间骨骼参数的差异显著性分析结果,如表2所示。对实验鱼28个骨骼参数进行了测量,经统计分析后,酸化处理对实验鱼所测量的骨骼长度影响均不显著。而且,经过酸化处理后,所测定的28个骨骼长度并不呈现一致的变化趋势,而是呈随机变化,与酸化处理水平之间没有相关性。
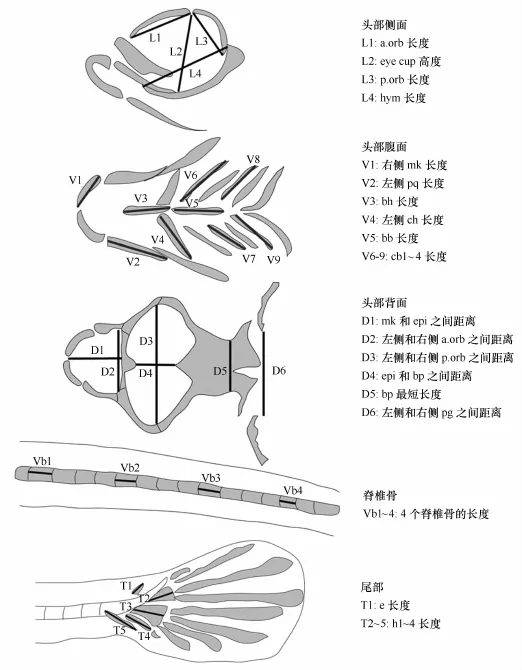
图2 实验中测量的各骨骼参数的起止点示意图Fig.2 The schematic pictures of measured skeleton parameters which start and ending points were shown

表2 各组中骨骼参数平均长度以及这些参数的组间差异Tab.2 The average of lengths of parameters of skeletons in three groups and their differences among groups
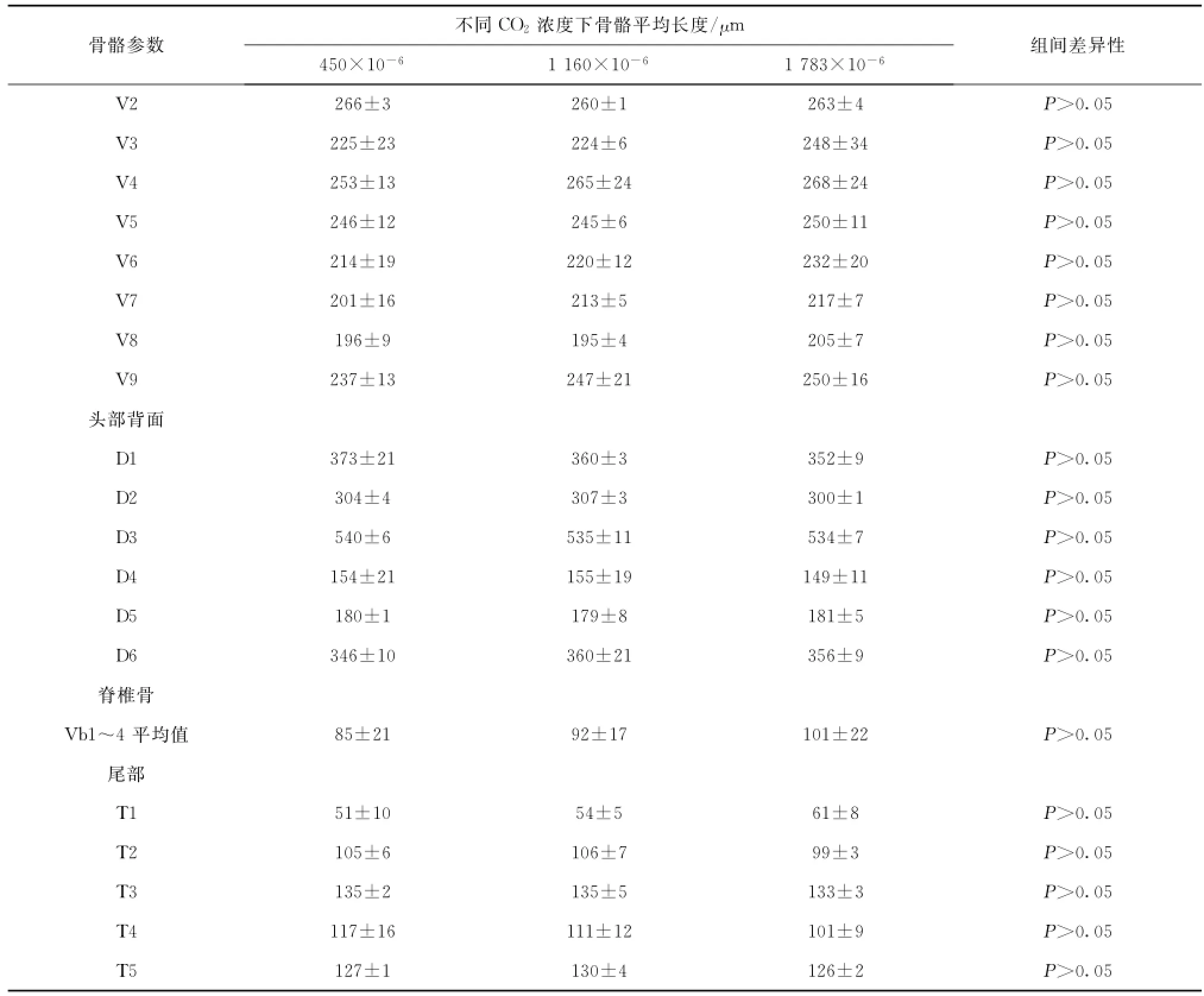
续表2
4 讨论
目前空气中CO2平均浓度已超过380×10-6,若以每年0.5%的速度增加,推测至本世纪末将CO2浓度将至1 000×10-6,至2300年将至1 900× 10-6[1,19—20]。本文的研究提示,未来100~200年间海洋酸化对海水青鳉的胚胎及初孵仔鱼的骨骼发育没有明显的影响。
鱼类的骨骼主要是由磷酸钙和软骨质物质组成[21],而非碳酸钙,所以海洋酸化对骨骼的直接影响较少,但是酸化情况下伴随鱼体内碳酸氢盐和非碳酸氢盐的缓冲调节系统的改变,可能间接的影响骨骼发育。骨骼的主要成分磷灰石有多种存在形式,在生物体内各种磷灰石的形成,受p H、温度和组成成分的影响,而且在HCO-3或者CO2-3存在的p H呈中性或碱性时,也会促使不同溶解度的磷灰石成分之间的转换[12]。体外实验也证明,骨骼矿化过程中,从非结晶磷酸钙到羟化磷灰石的转变会受到CO2-3浓度的影响[22]。在本文的实验条件下,未来100~200年间海水酸化水平,对青鳉鱼的胚胎及初孵仔鱼的骨骼发育没有明显的影响。同样,在CO2分压为850μatm情况下,多棘雀鲷仔稚鱼29个骨骼参数与对照组相比,也没有显著差别[14]。鱼类由于生活于水中,与陆生动物相比,需要呼出更多CO2以获得足够的氧气,因此正常情况下其体内HCO-3浓度较低。处于酸化水体中的鱼类,体内HCO-3浓度会相应升高,但由于鱼类成体具备较好的酸碱调节机制,通过鳃表面、肾、肠等组织,能够排出体内过多的HCO-3和H+[23]。然而,在仔稚鱼阶段,其体内的组织器官发育不成熟,对酸化处理较敏感。但是本研究中海洋酸化没有明显影响海水青鳉鱼胚胎期骨骼发育。推测主要原因是海水青鳉原产于CO2自然变化范围较大的沿海,使其对实验中CO2变化耐受力较高。海水青鳉原产于印度和孟加拉国沿海[24],沿海地区是具有重要生态价值和经济价值的海洋生物的主要栖息地,同时由于生物量的季节变化、河流冲淡水、上升流和沿岸人类活动影响等原因,造成水体中CO2浓度自然变化较大,变化幅度远远超过外海的CO2自然变化[25]。
全球气候变化效应的研究中,温度与CO2是紧密相联的。在海洋生态系统中,温度升高、缺氧与酸化等环境胁迫因子可能同时存在,它们之间共同作用对海洋生物的影响可能比单一海洋酸化的影响更为严重[26—27]。Pimental等报道,升温和酸化综合处理塞内加尔鳎(S.senegalensis)稚鱼,严重影响其骨骼发育[15]。目前,海洋酸化引起鱼体碳酸盐体系的变化对于骨骼发育、磷酸钙形成的影响机制还未见报道。淡水青鳉鱼已经完成基因组测序,海水青鳉鱼与其亲缘关系较近,因此,在将来的研究中,可以利用分子生物学技术,深入研究海洋酸化与其他环境因子协同作用下,海水青鳉鱼体内碳酸盐系统和磷酸盐系统之间的生理调节机制。
[1] Meehl G A,Stocker T F,Collins W D,et al.Global climate projections[M]//Solomon S,Qin D,Manning M,et al.Climate Change 2007:The Physical Science Basis.Contribution of Working GroupⅠto the Fourth Assessment Report of the Intergovernmental Panel on Climate Change.Cambridge,UK:Cambridge University Press,2007:747-846.
[2] Raupach M R,Marland G,Ciais P,et al.Global and regional drivers of accelerating CO2emissions[J].Proceedings of the National Academy of Sciences of the United States of America,2007,104(24):10288-10293.
[3] 唐启升,陈镇东,余克服,等.海洋酸化及其与海洋生物及生态系统的关系[J].科学通报,2013,58(14):1307-1314.
Tang Qisheng,Chen Zhendong,Yu Kefu,et al.The effects of ocean acidification on marine organisms and ecosystem[J].Chinese Science Bulletin,2013,58(14):1307-1314.
[4] Tseng Y,Hu M Y,Stumpp M,et al.CO2-driven seawater acidification differentially affects development and molecular plasticity along life history of fish(Oryziaslatipes)[J].Comparative Biochemistry and Physiology Part A,2013,165(2):119-130.
[5] Franke A,Clemmesen C.Effect of ocean acidification on early life stages of Atlantic herring(ClupeaharengusL.)[J].Biogeosciences,2011,8(12):3697-3707.
[6] Frommel A Y,Maneja R,Lowe D,et al.Severe tissue damage in Atlantic cod larvae under increasing ocean acidification[J].Nature Climate Change,2012,2:42-46.
[7] Bignami S,Enochs I C,Manzello D P,et al.Ocean acidification alters the otoliths of a pantropical fish species with implications for sensory function[J].Proceedings of the National Academy of Sciences,2013,110(18):7366-7370.
[8] Checkley Jr D M,Dickson A G,Takahashi M,et al.Elevated CO2enhances otolith growth in young fish[J].Science,2009,324(5935):1683.
[9] Toppe J,Albrektsen S,Hope B,et al.Chemical composition,mineral content and amino acid and lipid profiles in bones from various fish species[J].Comparative Biochemistry and Physiology,2007,146(3),395-401.
[10] Johns P.The structure and components of collagen containing tissues[M]//Ward A G,Cours A.The Science and Technology of Gelatin.London:Academic Press,1977:31-72.
[11] Kay M I,Young R A,Posner A S.Crystal structure of hydroxyapatite[J].Nature,1964,204(4963):1050-1052.
[12] LeGeros R Z.Calcium phosphate-based osteoinductive materials[J].Chemical Reviews,2008,108(11):4742-4753.
[13] Dorozhkin S V,Epple M.Biological and medical significance of calcium phosphates[J].Angewandte Chemie International Edition,2002,41(17):3130-3146.
[14] Munday P L,Gagliano M,Donelson J M,et al.Ocean acidification does not affect the early life history development of a tropical marine fish[J].Marine Ecology Progress Series,2011,423:211-221.
[15] Pimentel M S,Faleiro F,Dionísio G,et al.Defective skeletogenesis and oversized otoliths in fish early stages in a changing ocean[J].The Journal of Experimental Biology,2014,217(12):2062-2070.
[16] Kong R Y C,Giesy JP,Wu RSS,et al.Development of a marine fish model for studying in vivo molecular responsesin ecotoxicology[J].Aquatic Toxicology,2008,86(2):131-141.
[17] Kasahara M,Naruse K,Sasaki S,et al.The medaka draft genome and insights into vertebrate genome evolution[J].Nature,2007,444(7145):714-719.
[18] Lewis E,Wallace D.Program developed for CO2system calculations[CP].ORNL/CDIAC-105a.Oak Ridge,Tennessee:Carbon dioxide information analysis center,Oak Ridge National Laboratory,U.S.A.Department of Energy,2006.
[19] Caldeira K,Wickett M E.Oceanography:anthropogenic carbon and ocean p H[J].Nature,2003,425(6956):365.
[20] Caldeira K,Wickett M E.Ocean model predictions of chemistry changes from carbon dioxide emissions to the atmosphere and ocean[J].Journal of Geophysical Research:Oceans,2005,110(C9):C09S04.
[21] Witten P E,Huysseune A,Hall B K.A practical approach for the identification of the many cartilaginous tissues in teleost fish[J].Journal of Applied Ichthyology,2010,26(2):257-262.
[22] Blumenthal N C,Betts F,Posner A S.Effect of carbonate and biological macromolecules on formation and properties of hydroxyapatite[J].Calcified Tissue Research,1975,18(1):81-90.
[23] Claiborne J B,Edwards S L,Morrison-Shetlar A I.Acid-base regulation in fishes:cellular and molecular mechanisms[J].Journal of Experimental Zoology,2002,293(3):302-319.
[24] Abraham R.The IUCN Red List of Threatened Species[Z].Version 2013:e.T172408A6886249.http://www.iucnredlist.org/details/172408/0.
[25] Baumann H,Wallace R B,Tagliaferri T,et al.Large natural p H,CO2and O2fluctuations in a temperate tidal salt marsh on diel,seasonal,and interannual time scales[J].Estuaries and Coasts,2015,38(1):220-231.
[26] Gobler CJ,DePasquale E L,Griffith A W,et al.Hypoxiaand acidification haveadditiveand synergistic negative effects on the growth,survival,and metamorphosis of early life stage bivalves[J].PLoS One,2014,9(1):e83648.
[27] Enzor L A,Zippay M L,Place S P.High latitude fish in a high CO2world:synergistic effects of elevated temperature and carbon dioxide on the metabolic rates of Antarctic notothenioids[J].Comparative Biochemistry and Physiology,Part A,2013,164(1):154-161.
Impact of ocean acidification on skeletal development in embryonic marine medaka
Wang Xiaojie1,2,3,Xiao Xiao1,Li Chao1,Yue Na1
(1.Institute for Marine Biosystem and Neurosciences,Shanghai Ocean University,Shanghai 201306,China;2.International Center of Marine Study,Shanghai Ocean University,Shanghai 201306,China;3.Key Laboratory of Exploration and Utilization of A-quatic Genetic Resources,Shanghai Ocean University,Shanghai 201306,China)
In this study,the impact of ocean acidification on the skeletal development in embryonic marine medaka was investigated.The seawater carbonate system in the water was maintained stable by aerating with ambient air(450×10-6CO2)and CO2-enriched air(1 160×10-6or 1 783×10-6CO2).Newly fertilized medaka eggs were exposed to three levels ofpCO2/p H(8.14,7.85 and 7.67)until to the main hatch occurring.Skeletons of 30 newhatched larvae from each CO2treatment were cleared,stained and photographed.Lengths of well stained 28 skeletal elements for ecah fish was measured using digital photograph and analyzed by image analysis software.Results showed that,the effects of exposure to elevated CO2concentrations on the length of representative skeletal elements were not significant.It suggested that the skeletal development of marine medaka would not be seriously affected by the changes in CO2concentrations that are predicted to occur over the next 100 to 200 years.
Oryziasmelastigma;ocean acidification;skeletal development
X174
A
0253-4193(2015)12-0116-07
王晓杰,肖潇,李超,等.海洋酸化对海水青鳉胚胎骨骼发育的影响[J].海洋学报,2015,37(12):116—122,
10.3969/j.issn.0253-4193.2015.12.012
Wang Xiaojie,Xiao Xiao,Li Chao,et al.Impact of ocean acidification on skeletal development in embryonic marine medaka[J].Haiyang Xuebao,2015,37(12):116—122,doi:10.3969/j.issn.0253-4193.2015.12.012
2015-02-09;
2015-09-29。
国家自然科学基金项目(41306097);中国科学院海洋生态与环境科学重点实验室开放课题(KLMEES2013)。
王晓杰(1979—),女,山东省龙口市人,讲师,研究方向:海洋生态学、鱼类神经生物学。E-mail:xj-wang@shou.edu.cn
