MSCs 2种分离培养方法及其培养液中的VEGF、SDF-1α浓度比较*
2015-06-01潘家义周胜华白忠乐
潘家义,周胜华,黄 峰,白忠乐
(1.贵阳医学院附属医院心内科,贵阳 550004;2.中南大学湘雅二医院心内科,长沙 410011)
论著·基础研究
MSCs 2种分离培养方法及其培养液中的VEGF、SDF-1α浓度比较*
潘家义1,周胜华2△,黄 峰2,白忠乐2
(1.贵阳医学院附属医院心内科,贵阳 550004;2.中南大学湘雅二医院心内科,长沙 410011)
目的 通过2种分离培养方法所得骨髓间充质干细胞(MSCs)的生长特征和微环境中细胞因子的比较,提供一种可以快速、安全、高效地为临床和实验提供大量优质MSCs的方法。方法 提取C57BL/c小鼠的骨髓,分别作密度梯度离心法和全骨髓贴壁培养分离法分离培养MSCs,通过流式细胞仪检测细胞表面CD29+、CD31-、CD34-、CD45-表达水平,并比较各自所得细胞的生长曲线;ELISA检测培养液中的血管内皮生长因子(VEGF)、SDF-1α浓度并比较二者的差异。结果 与密度梯度离心法比较,全骨髓贴壁分离法所得原代细胞有较快的生长速度,较短的生长周期;培养液中VEGF和SDF-1α浓度也稍高于密度梯度离心法。结论 全骨髓贴壁培养法可以快速、方便、有效地为临床和实验提供大量MSCs,所得细胞的培养环境优于密度梯度离心法,减少了对细胞功能的损害。
密度梯度离心法;全骨髓贴壁分离法;骨髓间充质干细胞
骨髓间充质干细胞(mesenchymal stem cells,MSCs)是具有多向分化潜力的非造血干细胞,由于具有低免疫源性和取材方便等特点,成为缺血心脏病干细胞治疗的首选干细胞。目前,提取骨髓MSCs方法包括全骨髓贴壁分离法、密度梯度离心法、流式细胞仪和免疫磁珠分离法。后二者由于提取过程中MSCs功能受到很大影响,费用昂贵,很难方便、快速地为临床提供大量MSCs,因此,全骨髓贴壁分离法、密度梯度离心法才是比较常用的提取方法。Xue等利用富含血小板的血浆代替胎牛血清来培养MSCs,认为这种血浆为MSCs提供了更为有益、安全的生长条件;Lucarelli等[1]证实富含血小板的血浆中含有不同浓度的、微量的各种生长因子。凡此种种尝试让作者提出了培养微环境的概念,不少文献也证实了少量生长因子可以为MSCs营造适宜生长环境,促进其增殖。本研究比较了密度梯度离心法和全贴壁离心法,并将培养液中生长因子浓度作比较,试图从微环境的角度评价2种方法的优劣。
1 材料与方法
1.1 材料
1.1.1 实验动物 6周龄C57BL/c小鼠(由湖南省斯莱克达实验动物有限公司提供)。
1.1.2 试剂 小鼠干细胞细胞分离液(中国生命科学院),青霉素、链霉素(CLONTECH公司),低糖DMEM(Hyclone公司),胎牛血清(Gibco公司),含0.02%EDTA的0.25%胰蛋白酶(美国Sigma公司),兔抗鼠CD31FITC抗体、兔抗鼠CD45 FITC抗体、兔抗鼠CD29 FITC抗体、兔抗鼠CD34 FITC抗体(Santa Cruz公司)。
1.2 方法
1.2.1 C57BL/c小鼠骨髓MSCs分离、培养的2种方法 取6周龄C57BL/c小鼠4只,体质量16~20 g,用10%的水合氯醛麻醉致死,浸泡在75%乙醇中进行表面消毒5~10 min;在工作台无菌操作下切开皮肤、分离皮下组织、肌肉,暴露股骨、胫骨;截取胫骨和股骨,剪去干骺端,使用装有消毒磷酸盐缓冲液(PBS)的1 mL一次性无菌注射器反复冲洗骨髓腔4~5遍,直到骨髓腔变为白色。(1)密度梯度离心法:将冲洗液小心加入到2倍体积小鼠干细胞细胞分离液Percol分离液的表面,28 ℃下2 000 r/min离心15 min,小心吸取第2层的细胞,移入另一试管,加入2 mL PBS,28 ℃下1 000 r/min离心5 min,冲洗MSCs,倒掉上清液,加入含有15% PBS、链霉素100 U/mL、青霉素100 U/mL的低糖DMEM培养液,反复吹打细胞,制成单细胞悬液,滴一小滴细胞悬液于血小板计数仪上计数,配成约1×106个/mL的细胞密度,接种于塑料培养瓶中。置于37 ℃、5% CO2温箱中培养。(2)全骨髓贴壁培养方法:将冲洗液小心加入离心管,28 ℃下2 000 r/min离心15 min;倒掉上清液,如上述方法加入培养液(细胞密度1×106个/mL),接种于塑料培养瓶中。置于37 ℃、5% CO2温箱中培养。
1.2.2 骨髓MSCs的扩增和传代 待MSCs长到80%~90%融合时,倾倒出瓶中培养液,用PBS液冲洗3次,滴入0.25%胰蛋白酶消化液,在37 ℃恒温培养箱中消化2 min。显微镜下可见细胞脱壁、团缩变圆,滴入10%胎牛血清的低糖DMEM培养液终止消化,吹打、轻拍瓶底后,收细胞入离心管,1 000 r/min离心5 min,弃上清液,加入上述培养液4 mL,吹打管底,制成细胞悬液,按细胞密度1×106个/mL,重新接种到培养瓶中,按1∶2的比例进行传代。置入恒温培养箱中继续培养。
1.2.3 细胞生长曲线制作 (1)准备好计数板,取生长状态良好的P3代细胞,制成单细胞悬液,细胞以4×104个/mL的密度接种在24孔培养板内,共接种24个孔,每孔加入培养液0.2 mL。接种后第2天开始每隔24 h对3个孔的细胞稍作胰酶消化,制成混悬液,再利用计数板进行计数细胞,共计数8 d;以培养时间为横轴,细胞数为纵轴,描绘在半对数坐标上。连接成曲线后即成该细胞的生长曲线。
1.2.4 流式细胞仪骨髓MSCs表面抗原鉴定 收集C57BL/c小鼠间充质干细胞至少3瓶(1×106个/mL细胞密度),倒掉培养基,用PBS液冲洗2遍,加入消化酶1 mL,37 ℃孵育2 min,轻拍后加入培养基3 mL终止消化,收集细胞至15 mL离心管,900 r/min离心8 min,弃上清液,PBS 6 mL重悬,重复离心再弃上清液,用450 μL重悬,取6 μL出来稀释10倍,计数细胞液浓度为1×105个/mL为好,取500 μL细胞悬液分入5个流式管(此后均避光),各管分别加入FITC标记CD29、CD34、CD31、CD45抗体各20 μL,一管作为空白对照,4 ℃避光孵育30 min,各管内加入600 μL PBS液,弹均或吹均,1 500 r /min离心8~9 min,弃上清液,若细胞数可达106个/管,则加300 μL PBS液重悬,吹均,若不能达此数目,可酌情加入100~200 μL,于流式仪机上分析,检测荧光值。
1.2.5 ELISA法检测培养液中血管内皮生长因子(VEGF)、SDF-1α的浓度 加入稀释好后的标准品50 μL于反应孔、加入待测样品50 μL于反应孔内,立即加入50 μL的生物素标记的抗体。盖上膜板,混匀,37 ℃温育1 h;甩去孔内液体,加满洗涤液,振荡30 s,甩去洗涤液,用吸水纸拍干并重复3次。每孔加入80 μL的亲和酶素-HRP混匀,37 ℃温育30 h。再次甩去洗涤液、拍干3次(方法同前)。每孔加入底物A、B各50 μL,混匀,37 ℃温育10 min,避光。取出酶标板,加入50 μL终止液后测定结果。在450 nm波长处测定各孔的光密度(OD)值;根据标准品OD值指定标准曲线,根据各检测样本的OD值,按标准曲线计算得出各样本浓度。

2 结果
2.1 2种方法取得MSCs的形态观察 细胞接种培养瓶24 h后,倒置相差显微镜下观察,可见大量悬浮细胞存在,全骨髓贴壁培养法经过2~3次换液后可去除悬浮细胞,可见贴壁细胞中有单个或几个细胞呈短棒状变化;观察中可见全骨髓贴壁原代培养时,经几次换液后瓶底可见更多棒状细胞并渐出现较为集中的集落,一般第2~5天为生长潜伏期,细胞增殖较慢,第6~14天为细胞的快速增殖期,集落中的细胞不断增殖并逐渐增大变形,并向附近迁移扩大,较大集落可见细胞呈梭形且作放射状排列,15~18 d细胞融合可达90%;密度梯度离心法所得细胞有更长的生长周期,增殖明显慢于全骨髓贴壁培养法,有的要达90%融合可能需要3~4周时间,方法差别的影响可以影响2~4代,此后差别慢慢消失。细胞生长也渐趋均匀一致,可呈菊花状和放射状生长(图1~8)。

图1 密度梯度离心P0D1(×20)

图2 全骨髓贴壁培养刚从骨髓P0D0(×20)
2.2 流式细胞仪鉴定骨髓MSCs的表面抗原 流式细胞仪表面抗原分析结果,检测显示培养第3代细胞表面抗原阳性表达率分别为CD29(93.02%)、CD45(5.71%)、CD31(9.51%)、CD34(4.57%),则所得细胞阳性表达CD29,阴性表达CD45、CD31、CD34,与以往文献报道的MSCs表达的表面抗原特征相符,见图9~12。
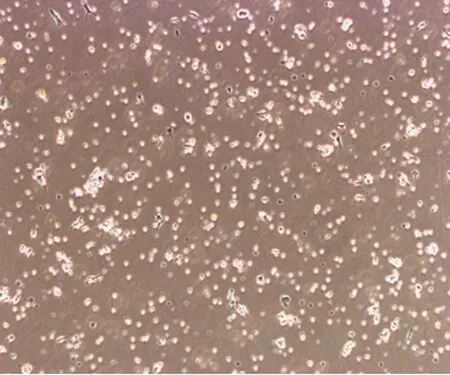
图3 密度梯度离心P0D3(×20)

图4 全骨髓贴壁培养刚从骨髓P0D3(×20)
图5 密度梯度离心P0D7(×20)
2.3 骨髓MSCs的生长曲线 原代代细胞培养有较长的生长周期,全骨髓贴壁分离培养法可见有较快的增长速度;4代后两组细胞潜伏期均缩短为2 d左右,从第3天起细胞增殖开始加快,进入指数增殖期,至第6~7天,细胞增殖速度再次减慢,处于增殖平台期,第4~12代生长曲线渐趋一致(图13)。多次传代后细胞增殖缓慢,细胞变得阔大,折光性变差,细胞凋亡逐渐增多。

图6 全骨髓贴壁P0D7(×20)
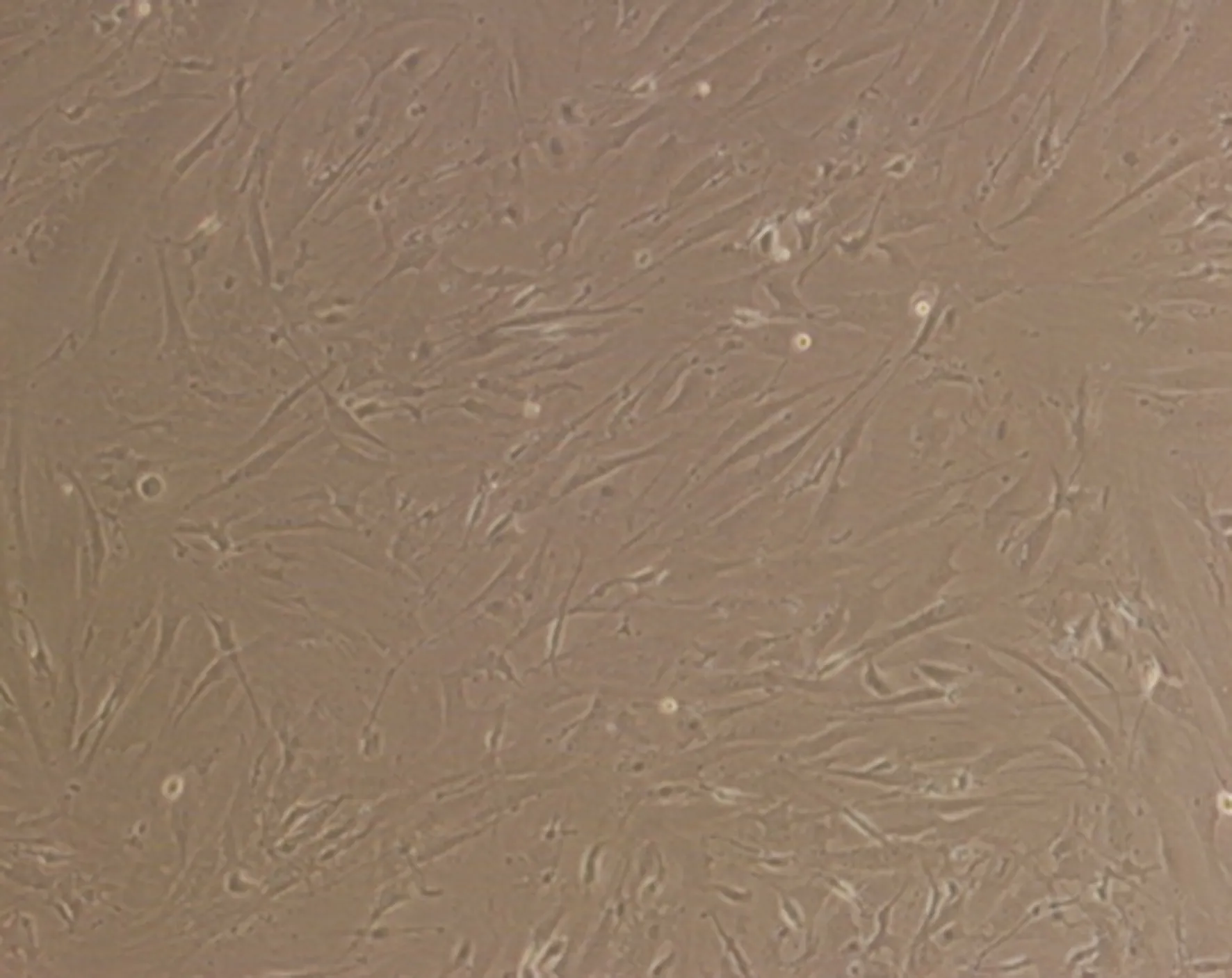
图7 密度梯度离心P3D16(×20)

图8 全骨髓贴壁P3D12(×20)
2.4 2、3代细胞培养液中的VEGF、SDF-1α的变化 留取2、3代细胞培养换液时的培养液作ELISA检测其中VEGF、SDF-1α的浓度,可见培养液中始终维持着低浓度的VEGF、SDF-1α。全骨髓贴壁培养组的细胞培养液中的VEGF、SDF-1α平均浓度均高于密度梯度离心组,差异有统计学意义(P<0.05)。全骨髓贴壁培养组、密度梯度离心组比较,可见培养第3天的VEGF、SDF-1α浓度低于第5天和第7天,差异有统计学意义(P<0.05),而第5天、第7天的VEGF、SDF-1α浓度比较,差异无统计学意义(P>0.05)。见图12~13、表1。
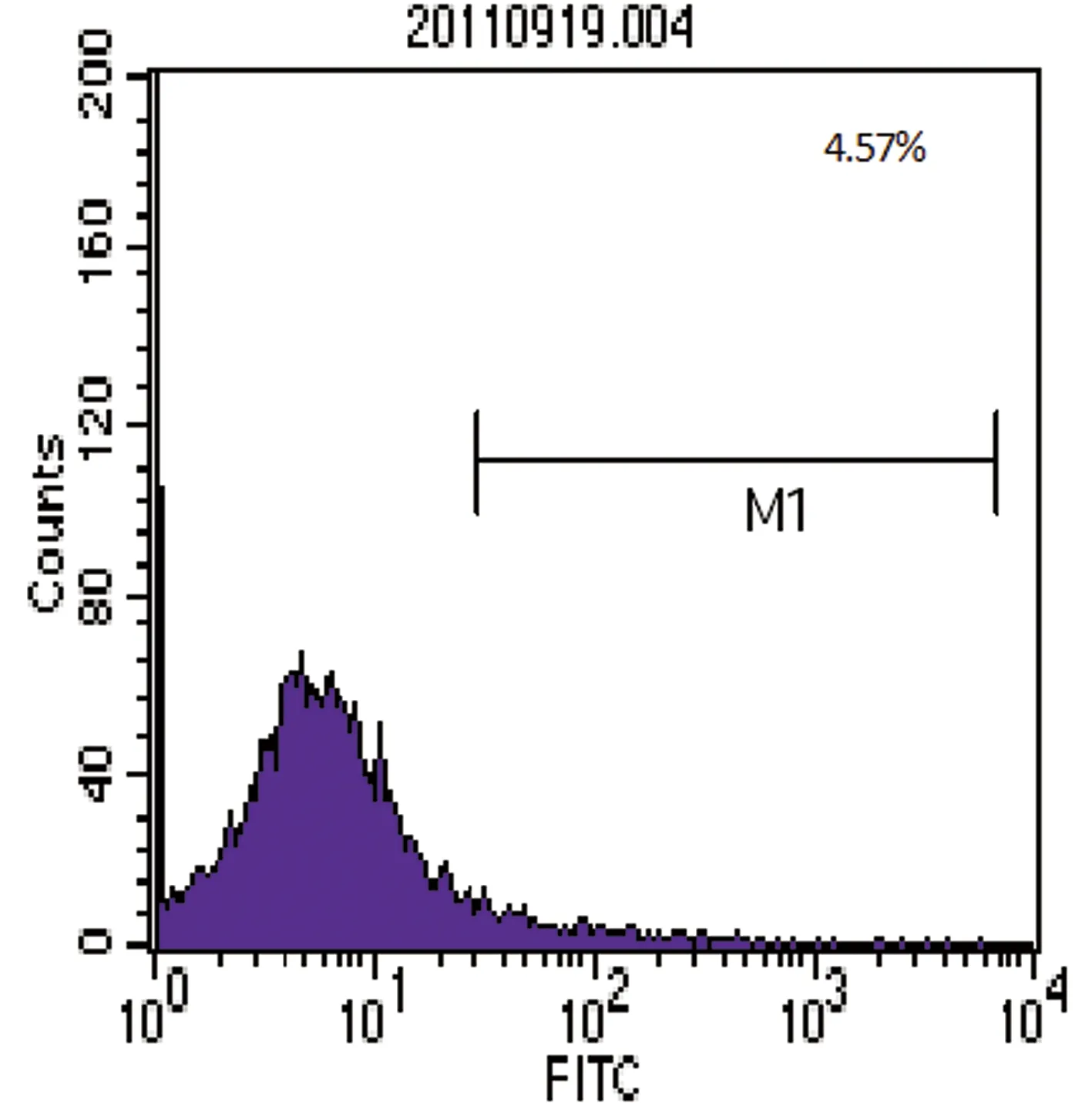
图9 CD34-
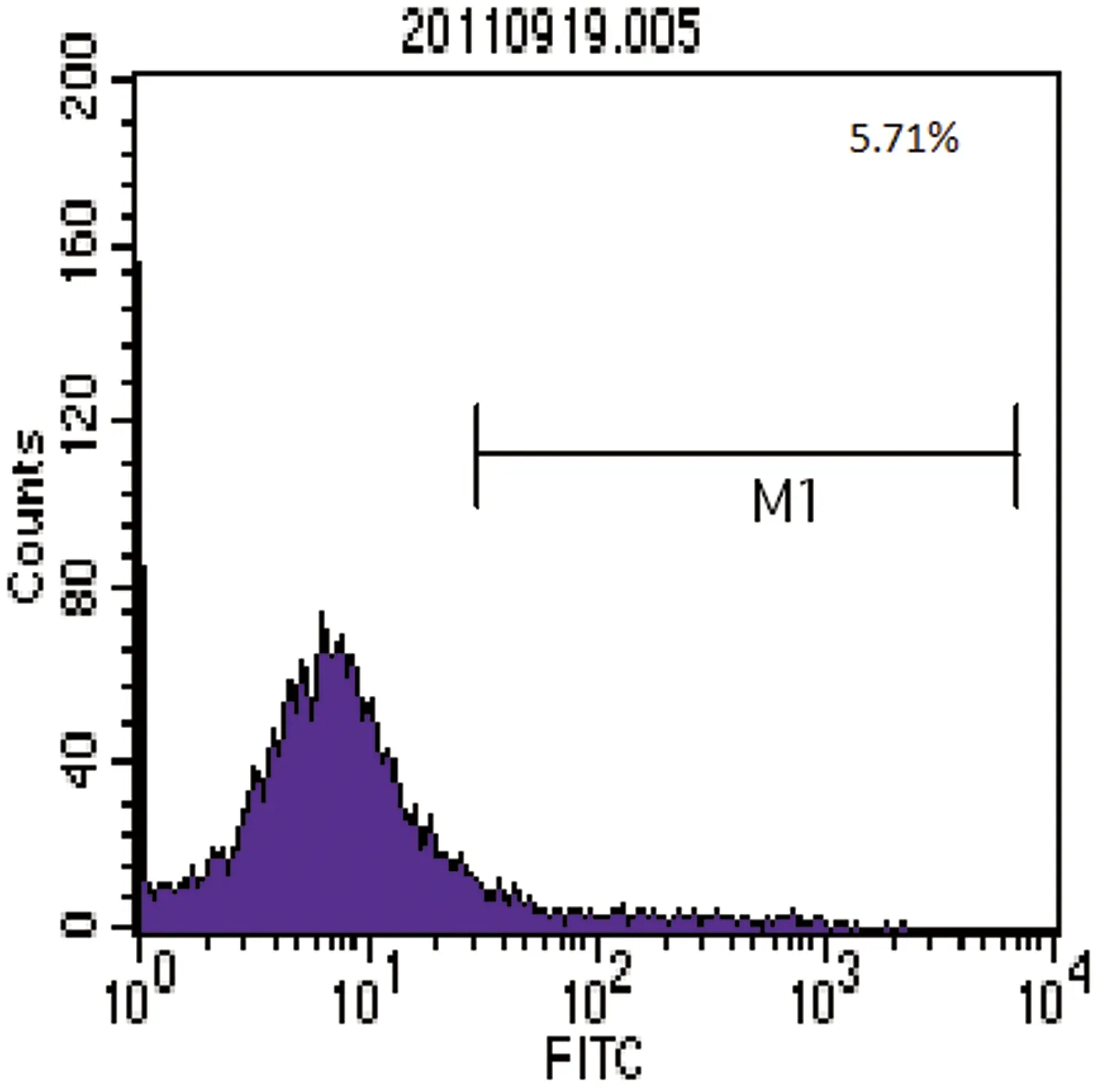
图10 CD45-
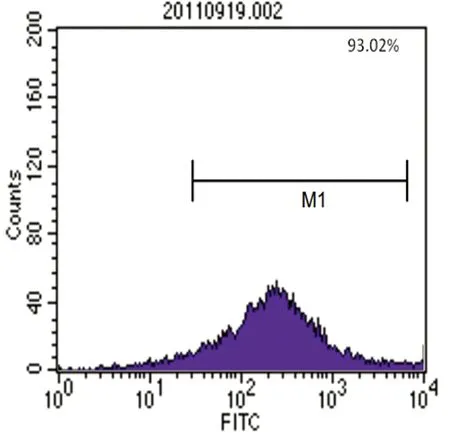
图11 CD29+
表1 2种方法细胞培养液中VEGF、SDF-1α浓度比较
★:P<0.01,与第3天时比较。
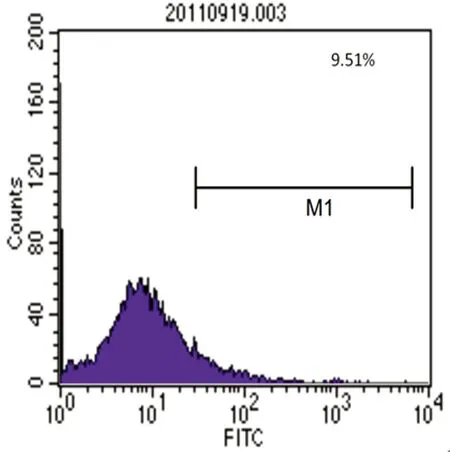
图12 CD31-
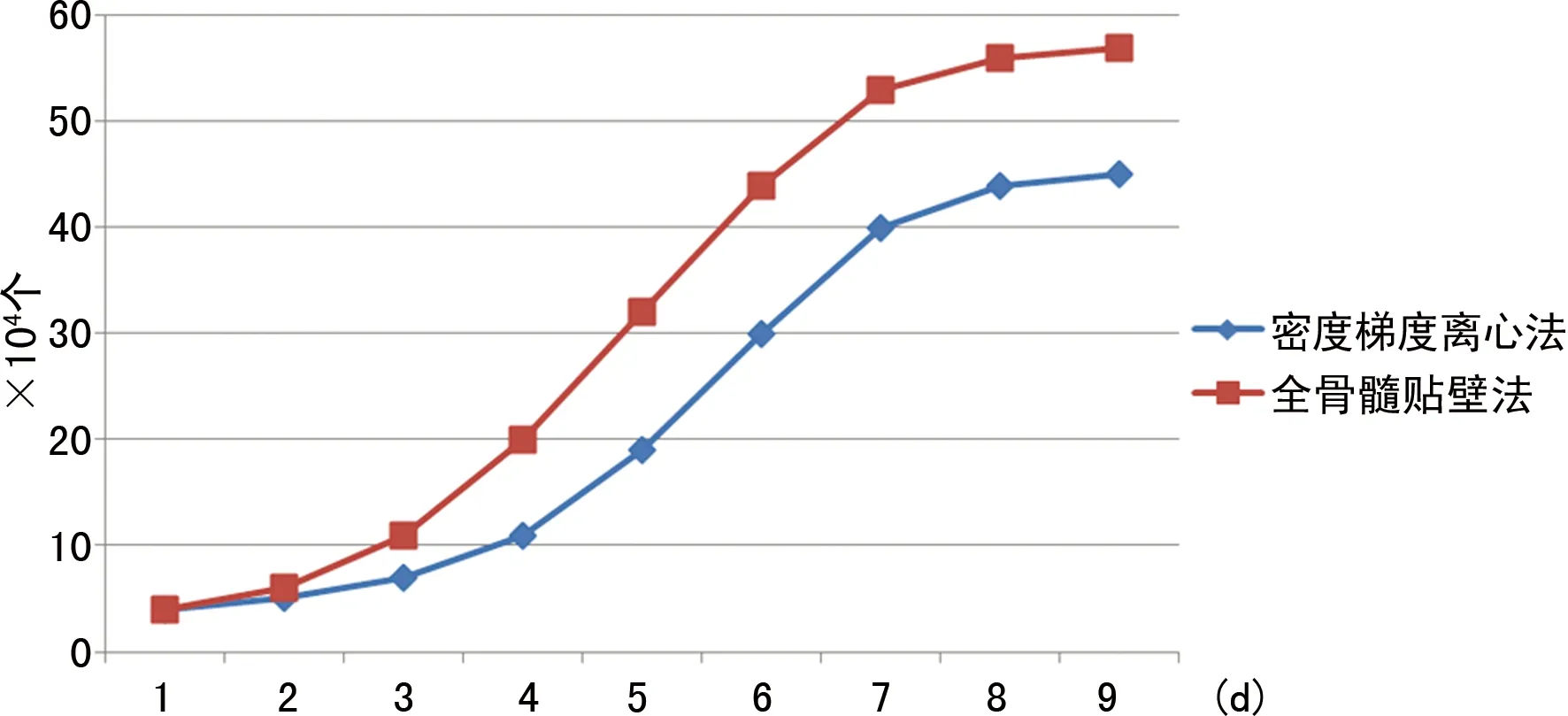
图13 不同方法所得MSCs的不同生长曲线
3 讨论
骨髓MSCs是有着多向分化潜力的非造血干细胞,可以分化成脂肪、骨骼肌、骨、软骨和结缔组织细胞,也能够分化成心肌细胞,这一点对心脏修复是很有吸引力的,因而,其在缺血性心脏病干细胞治疗中研究较多。除具有自我更新和多向分化潜能外,该干细胞还具有来源充足、细胞培养成活率高、低免疫排异反应、易于外源基因的转染和表达等优点,因此,引起学者们的广泛关注。但人骨髓中的MSCs水平极低,在骨髓单核细胞所占比例仅为0.01%,难以满足组织工程学的需要。因此,需选择最有效率的方法进行体外扩增也成为干细胞治疗最为关注的一方面。
本研究将Friedenstein等[2]建立的全骨髓贴壁细胞分离法和密度梯度离心法做了比较,发现密度梯度离心法也可以有效地将红细胞、白细胞、单核细胞分层且对细胞活性影响较小,但也破坏了MSCs生长的骨髓微环境;而全骨髓贴壁分离法操作简便、快速;虽然所得细胞成分复杂,却可以根据MSCs贴壁生长而造血细胞悬浮生长的特性对二者进行分离,对细胞活性影响小,且由于保留了骨髓中有利于生长的细胞因子和促黏附物质,有着更为适宜的干细胞生长微环境,促使MSCs生长增殖旺盛,并且经换液传代2~3代后细胞纯度可达到98%以上。
骨髓MSCs培养的适宜环境研究一直是众多研究者关心的问题,包括选择适宜培基、适宜的细胞接种密度、各种信号分子对骨髓MSCs的增殖分化影响等。目前,研究培养基有α-MEM、L-DMEM、IMDM等,其中,以L-DMEM和α-MEM为佳。本研究采用L-DMEM和10%的胎牛血清获得了较好的培养效果。另外,首次接种密度也很重要,接种密度太低会影响细胞间信息传递而使细胞生长受限,本实验首次接种密度一般在4.0×105~6个/mL左右。目前,对于首次换液的时间目前无统一标准,本培养法采用12 h后全量换液,这样便于更好地去除悬浮细胞,得到更为纯化的原代细胞。原代细胞生长缓慢,细胞初成圆形,贴壁后呈梭形、多边形、集落样生长。本研究中,全骨髓贴壁分离法约生长14~18 d左右可达80%~90%细胞融合,可进行传代;而密度梯度离心法则需3~4周左右可达80%~90%细胞融合,甚至更长,传3、4代后生长特性方渐趋相近。本研究还观察到全骨髓贴壁法所得MSCs传至10代仍可保持旺盛的生长,而密度梯度离心法细胞则变得宽大、折光性差。本研究认为2种方法表现出的不同生长特性和其两者的细胞生长微环境的差异有关。
MSCs培养中可以自分泌或旁分泌各种细胞因子、黏附分子、生长因子,构成了培养中的微环境,促进MSCs增殖和分化。据研究,MSCs可以分泌表达IL-1、IL-6、SDF-1α、FGF、EGF等[3]。Lucarelli等[1]实验显示FGF、EGF、PDGF信号促进了MSCs的生长,无这些生长因子,细胞生长缓慢、形态扁平,可向纤维母细胞发展[4]。另有研究表明IGF可提高增殖速度,并缩短对数增长时间,而且这种促进作用呈浓度依赖性[5]。MSCs分泌的各种细胞因子也可促进细胞迁移分布,不同的生长因子对细胞特异分化方向也有重要意义,例如FGF和TGF在向软骨细胞分化中起着一定作用[6],而VEGF可促进MSCs向内皮细胞分化,有利于伤口或损伤的愈合[7]。本研究在可见全骨髓贴壁培养组的VEGF、SDF-1α等的分泌水平高于密度梯度离心分离组,这也说明了密度梯度离心方法对MSCs细胞功能活性有一定的负面影响,考虑与分离液和高速离心对细胞的损害有关。步骤复杂、提取时间较长也会使得一部分MSCs在这过程中失活、死亡。因此,密度梯度离心组的细胞要达到适当的细胞融合度需更长的生长周期。实验中还观察到两组细胞始终维持着低浓度的VEGF、SDF-1α,相信这对培养细胞维持持续的增长有重要的意义。对那些MSCs培养失败个别培养板做生长因子检测,发现在最初的几天VEGF、SDF-1α可以维持一定的浓度,此后的过程中发现其VEGF、SDF-1α浓度渐渐下降,细胞生长也难以维持。因此,有研究者尝试在培养液中适当加以各种生长因子如VEGF、IGF、FGF、SDF-1α[8-9],可促进MSCs自分泌和旁分泌的作用,也大大促进其增殖生长,成效可见。但有研究者认为,MSCs在特定环境中有一定的生长因子分泌模式,某一因子分泌过多会促使其向特定细胞群分化,例如成脂分化、成骨细胞分化[10-12]等,而且生长因子会对MSCs的表型产生的怎样影响也需进一步探讨。微环境是MSCs增殖生长的土壤,MSCs通过旁分泌自分泌各种生长因子为自身营造最佳环境,密度梯度离心过程中,各种因素对细胞的损害,也伤及其自分泌旁分泌的作用,使得在其后的生长中难以营造最佳微环境。另外,有报道认为全骨髓贴壁会增加污染的机会,这一点与作者观察的相反,本研究中密度梯度离心却表现更多污染率,可能与复杂的过程、提取时间过长有关,本研究则认为污染与操作的过程和培养环节有关。
[1]Lucarelli E,Beretta R,Dozza B,et al.A recently developed bifacial platelet-rich fibrin matrix[J].Eur Cell Mater,2010,20:13-23.
[2]Friedenstein AJ,Latzinik NW,Grosheva AG,et al.Marrow microenvironment transfer by heterotopic transplantation of freshly isolated and cultured cells in porous sponges[J].Exp Hematol,1982,10(2):217-227.
[3]Novotny NM,Markel TA,Crisostomo PR,et al.Differential IL-6 and VEGF secretion in adult and neonatal mesenchymal stem cells:role of NFkB[J].Cytokine,2008,43(2):215-219.
[4]Ng F,Boucher S,Koh S,et al.PDGF,TGF-beta,and FGF signaling is important for differentiation and growth of mesenchymal stem cells(MSCs):transcriptional profiling can identify markers and signaling pathways important in differentiation of MSCs into adipogenic,chondrogenic,and osteogenic lineages[J].Blood,2008,112(2):295-307.
[5]Longobardi L,Granero-Moltó F,O′Rear L,et al.Subcellular localization of IRS-1 in IGF-I-mediated chondrogenic proliferation,differentiation and hypertrophy of bone marrow mesenchymal stem cells[J].Growth Factors,2009,27(5):309-320.
[6]Ronziere MC,Perrier E,Mallein-Gerin F,et al.Chondrogenic potential of bone marrow and adipose tissue derived adult human mesenchymal stem cells[J].Biomed Mater Eng,2010,20(3):145-158.
[7]Rustad KC,Wong VW,Sorkin M,et al.Enhancement of mesenchymal stem cell angiogenic capacity and stemness by a biomimetic hydrogel scaffold[J].Biomaterials,2012,33(1):80-90.
[8]Huang YL,Qiu RF,Mai WY,et al.Effects of insulin-like growth factor-1 on the properties of mesenchymal stem cells in vitro[J].J Zhejiang Univ Sci B,2012,13(1):20-28.
[9]Molchanova EA,Bueverova EI,Starostin VI,et al.The sensitivity of mesenchymal stromal cell subpopulations with different times of adhesion property manifestation and derived from hemopoietic organs to growth factors EGF,bFGF,and PDGF[J].Izv Akad Nauk Ser Biol,2011,24(2):133-144.
[10]Coutu DL,Francois M,Galipeau J.Inhibition of cellular senescence by developmentally regulated FGF receptors in mesenchymal stem cells[J].Blood,2011,117(25):6801-6812.
[11]Caplan AI,Correa D.PDGF in bone formation and regeneration:new insights into a novel mechanism involving MSCs[J].J Orthop Res,2011,29(12):1795-1803.
[12]Graham S,Leonidou A,Lester M,et al.Investigating the role of PDGF as a potential drug therapy in bone formation and fracture healing[J].Expert Opin Investig Drugs,2009,18(11):1633-1654.
Comparison of isolation ways of MSC and VEGF and SDF-1α concentration in respective culture medium*
PanJiayi1,ZhouShenghua2△,HuangFeng2,BaiZhongle2
(1.DepartmentofCardiology,theAffiliatedHospitalofGuiyangMedicalCollege,Guiyang,Guizhou550004,China;2.DepartmentofCardiology,theSecondXiangyaHospitalofCentralSouthUniversity,Changsha,Hunan410011,China)
Objective To choose one protocol that can quickly,safely and effectively provide amount enough of bone marrow derived mesenchymal stem cells(MSCs) for use of clinical or experimental test through comparison of their growth characteristics and growth factors levels in culture solution.Methods Cells extracted from bone marrow of C57BL/C mice respectively underwent two different isolation protocols:whole bone marrow adherent culture(WBMAC) or gradient density separation(GDS);characteristic surface antigens of MSCs were identified by flow cytometry on cells isolated in different ways;the distinct growth curve of primary stem cells cultured in vitro described their different proliferation rate;levels of vascular endothelial growth factor(VEGF) and stromal cell-derived factor-1α(SDF-1α) in culture medium were detected by ELISA.Results Primary MSCs obtained by WBMAC proliferated at higher speed and exhibited shorter growth cycle than those separated by GDS;on MSCs from both groups,surface antigens CD29 were detected positively,and antigens including CD31,CD34 and CD45 were assayed negatively;concentration of VEGF and SDF-1α in both two nutrient solution primarily keep at low levels,comparatively,level of VEGF and SDF-1α in the dishes which contain MSCs by WBMAC was higher than the one in the dishes which contain MSCs by GDS.Conclusion MSCs extracted by WBMAC shows unimpaired cell function,can build automatically more suitable microenviroment for their growth;this classic method was qualified for clinical and experimental use in a safe,rapid,effective way.
BMSCs;whole bone marrow adherent culture;gradient density separation
10.3969/j.issn.1671-8348.2015.08.003
国家自然科学基金资助项目(30871053)。 作者简介:潘家义(1973-),主治医师,博士,主要从事心脏病研究。△
,Tel:13707483674;E-mail:zhougqin@21cn.com。
R329
A
1671-8348(2015)08-1017-05
2014-10-16
2014-12-25)
