雷公藤红素增强多柔比星抑制肝癌细胞系Huh7细胞活性的实验研究
2015-06-01丁成国
丁成国
雷公藤红素增强多柔比星抑制肝癌细胞系Huh7细胞活性的实验研究
丁成国
目的 观察雷公藤红素增强多柔比星对肝癌细胞的杀伤活性及机制。方法 设0.5、1、2μmol/L浓度的雷公藤红素为雷公藤红素1、2、3组,设0.1、1g/mL浓度的多柔比星为多柔比星1、2组;MTT法检测多柔比星单独治疗及联合雷公藤红素治疗对肝癌细胞系Huh7的杀伤活性。荧光定量PCR方法检测人正常胎肝细胞系L-O2及肝癌细胞系Huh7、HepG2和PLC的PKM2表达水平。MTT法检测PKM2表达载体转染对雷公藤红素联合多柔比星杀伤Huh7细胞疗效的影响。结果与对照组Huh7细胞活力零抑制率比较,雷公藤红素1、2、3组分别为(2.6±0.9)%、(4.7±1.3)%(P均<0.05)、(8.8±1.9)%(P<0.05);多柔比星1、2组分别为(7.5±1.9)%、(61.4±4.2)%(P均<0.05);1μmol/L雷公藤红素联合0.1、1g/mL多柔比星较多柔比星1、2组,Huh7细胞活力抑制率明显上升[(58.7±3.8)%比(7.5±1.9)%,P<0.05;(89.7±6.7)%比(61.4±4.2)%,P<0.05]。PKM2相对表达水平,相对人正常肝细胞系L-O2细胞系的(1.0±0.05),Huh7细胞系为(15.2±0.6)(P<0.05),HepG2细胞系为(11.8±0.5)(P<0.05),PLC细胞系为(13.4±0.7)(P<0.05);雷公藤红素1、2、3组分别下调为(0.70± 0.05)(P<0.05)、(0.42±0.04)(P<0.05)、(0.31±0.03)(P<0.05);多柔比星组无下调作用;1μmol/L雷公藤红素联合0.1、1g/mL多柔比星后PKM2相对表达水平较多柔比星1、2组明显下降 [(0.44±0.04)比(0.98±0.07),P<0.05;(0.41±0.03)比(1.01±0.07),P<0.05]。转染PKM2表达载体后,1μmol/L雷公藤红素联合0.1、1g/mL多柔比星对Huh7细胞活力抑制率较未转染组下降 [(60.5±4.3)%比(19.3± 2.0)%,P<0.05;(91.6±6.9)%比(69.6±4.5)%,P<0.05]。结论 雷公藤红素通过下调PKM2的表达抑制肿瘤细胞的糖代谢,增强多柔比星对肝癌细胞系Huh7的杀伤活性。
肝癌细胞系;Huh7;雷公藤红素;PKM2;糖代谢;多柔比星
肝癌是世界上发病率最高的恶性肿瘤之一,其致死率居恶性肿瘤第三位[1]。多柔比星是一种抗肿瘤抗生素,通过抑制肿瘤细胞DNA/RNA的生物合成起到杀伤肿瘤细胞的目的。多柔比星是治疗肝癌的常规化疗药物,但肿瘤细胞的药物抵抗制约了多柔比星的临床应用[2]。因此,寻找其他的药物与多柔比星进行联合用药以增强多柔比星的抗肿瘤活性是目前肿瘤治疗研究的重点。据报道,雷公藤红素有一定的抗肿瘤活性[3-4]。本研究探讨雷公藤红素是否能增强多柔比星对肝癌细胞的杀伤活性,并研究其具体机制。
1 材料与方法
1.1 细胞培养 人肝癌细胞系Huh7、HepG2、PLC及人正常肝细胞系L-O2购于上海中科院生物化学与细胞生物学研究所。所有细胞系培养在含10%胎牛血清的DMEM培养基中,并将细胞置于37°C恒温培养箱中培养,通入5%CO2。
1.2 材 料 多柔比星、噻唑蓝(3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide,MTT)、雷公藤红素购于美国Sigma-Aldrich。DMEM培养基购于美国Gibco。Trizol试剂、逆转录试剂盒、pcDNA3.1(plasmid complementory DNA 3.1,真核表达载体)、Lipofectamine 2000购于美国Invitrogen。葡萄糖检测试剂盒(Amplex Red Glucose/Glucose Oxidase assay kit)购于美国Molecular Probes公司,乳酸检测试剂盒(Lactate assay kit)购于美国BioVision公司。SYBR Green试剂购于日本 TaKaRa。PKM2(pyruvate kinase M2,丙酮酸激酶M2)和GAPDH(内参)PCR引物由上海生工生物工程有限公司合成,序列如下:PKM2上游:5’-GCCTGGCGCCCATTACCA-3’,下游:5’-CCCACTGCAGCACTTGAAG-3’;GAPDH上游:5′-CACTCCTCCACCTTTGA-3′,GAPDH下游:5′-CCACCACCCTGTTGCTG-3′。
1.3 实验分组 设0.5、1、2μmol/L浓度的雷公藤红素为雷公藤1、2、3组,设0.1、1g/mL浓度的多柔比星为多柔比星1、2组。对照组不加药物。
1.4 荧光定量PCR检测PKM2的表达 所有细胞的总RNA用Trizol试剂提取,之后用逆转录试剂盒按照说明书步骤进行cDNA的合成。以该cDNA为模板,在PCR体系中加入PKM2或GAPDH的引物,再加入SYBR Green试剂,按照SYBR Green操作说明书步骤进行PKM2基因的定量PCR实验,PKM2的相对表达由2-△△CT法计算[5]。
1.5 Huh7细胞葡萄糖的摄取及乳酸的检测 用葡萄糖检测试剂盒检测DMEM培养基中的葡萄糖浓度,用C0表示。将Huh7细胞按1×104/孔接种在96孔板上,加入200μL DMEM培养基,在培养基中加入雷公藤红素及多柔比星处理2h(对照组不加药物处理2h),按照试剂盒说明书步骤检测培养基中的葡萄糖浓度,用C表示,则各组葡萄糖绝对摄取量ΔC= C0-C。葡萄糖的相对摄取量用以下公式计算:葡萄糖相对摄取量=(ΔC对照组-ΔC治疗组)/ΔC对照组。乳酸的相对生成量检测步骤及计算方法与葡萄糖相同。
1.6 质粒构建及转染 将PKM2基因的开放阅读框架全序列(Gene ID:NM-001206796)以分子克隆的方法与pcDNA3.1连接后构建成pcDNA3.1-PKM2重组真核表达质粒[6],质粒的转染使用Lipofectamine 2000按照试剂操作说明书步骤进行,将pcDNA3.1-PKM2(2μg/mL)转染入Huh7细胞中,培养24h。
1.7 MTT法检测药物对肿瘤细胞杀伤活性 将Huh7细胞按 5×103/孔接种在 96孔板上。将pcDNA3.1-PKM2(2μg/mL)转染入Huh7细胞中,孵育24h。然后再加入雷公藤红素,及多柔比星培养48h。之后加5mg/mLMTT 20μL继续培养4h。弃上清,在570nmol/L波长下用酶标仪检测OD值,细胞活力抑制率用以下公式计算:抑制率=(OD对照组-OD治疗组)/OD对照组×100%。
2 结果
2.1 雷公藤红素提高多柔比星对Huh7细胞的杀伤活性 雷公藤红素单治疗对Huh7的杀伤活性较弱,见表1。1μmol/L雷公藤红素联合多柔比星治疗,可显著提高多柔比星对Huh7细胞的杀伤活性,见表2。
2.2 肝癌细胞系高表达PKM2 三种肝癌细胞系Huh7、HepG2和 PLC的 PKM2表达水平分别为(15.2±0.6)、(11.8±0.5)、(13.4±0.7),均显著高于正常肝细胞系L-O2的(1.0±0.05),差异有统计学意义(P<0.05)。
表1 雷公藤红素对Huh7细胞的抑制作用(±s)

表1 雷公藤红素对Huh7细胞的抑制作用(±s)
注:与对照组比较,*P<0.05
对照组雷公藤红素1组雷公藤红素2组雷公藤红素3组3333 0 0.5 12 0 2.6±0.9 4.7±1.3* 8.8±1.9*
2.3 雷公藤红素显著下调Huh7细胞PKM2的表达水平并抑制其糖代谢 雷公藤红素能显著下调Huh7细胞PKM2的表达水平并抑制其葡萄糖的摄取和乳酸的生成,而多柔比星则对PKM2表达水平及糖代谢无影响。见表3。
表2 各组Huh7细胞抑制作用比较(±s)

表2 各组Huh7细胞抑制作用比较(±s)
注:与对照组比较,*P<0.05;与多柔比星1组比较;#P<0.05;与多柔比星2组比较,△P<0.05
孔数 雷公藤红素浓度(μmol/L) 多柔比星浓度(μg/mL)组别对照组雷公藤红素组多柔比星1组多柔比星2组雷公藤红素+多柔比星1组雷公藤红素+多柔比星2组333333 010011 00 0.1 1 0.1 1细胞活力抑制率(%)0 4.7±1.3 7.5±1.9* 61.4±4.2* 58.7±3.8*#89.7±6.7*△
表3 各组Huh7细胞PKM2表达及糖代谢比较(±s)

表3 各组Huh7细胞PKM2表达及糖代谢比较(±s)
注:与对照组比较,*P<0.05;与多柔比星1组比较,#P<0.05;与多柔比星2组比较,△P<0.05;PKM2:丙酮酸激酶M2
组别对照组雷公藤红素1组雷公藤红素2组雷公藤红素3组多柔比星1组多柔比星1组雷公藤红素2组+多柔比星1组雷公藤红素2组+多柔比星2组孔数33333333雷公藤红素浓度(μmol/L)0 0.5多柔比星浓度(μg/mL)120011 0000 0.1 1 0.1 1 PKM2相对表达水平1.0±0.03 0.70±0.05* 0.42±0.04* 0.31±0.03* 0.98±0.07 1.01±0.07 0.44±0.04*#0.41±0.03*△葡萄糖相对摄取量1.0±0.05 0.85±0.05* 0.69±0.04* 0.63±0.04* 1.02±0.06 0.99±0.06 0.71±0.05*#0.68±0.06*△乳酸相对生成量1.0±0.06 0.86±0.06* 0.61±0.05* 0.52±0.04* 0.98±0.05 1.02±0.07 0.63±0.06*#0.60±0.05*△
表4 雷公藤红素对Huh7细胞PKM2表达及糖代谢的影响(±s)
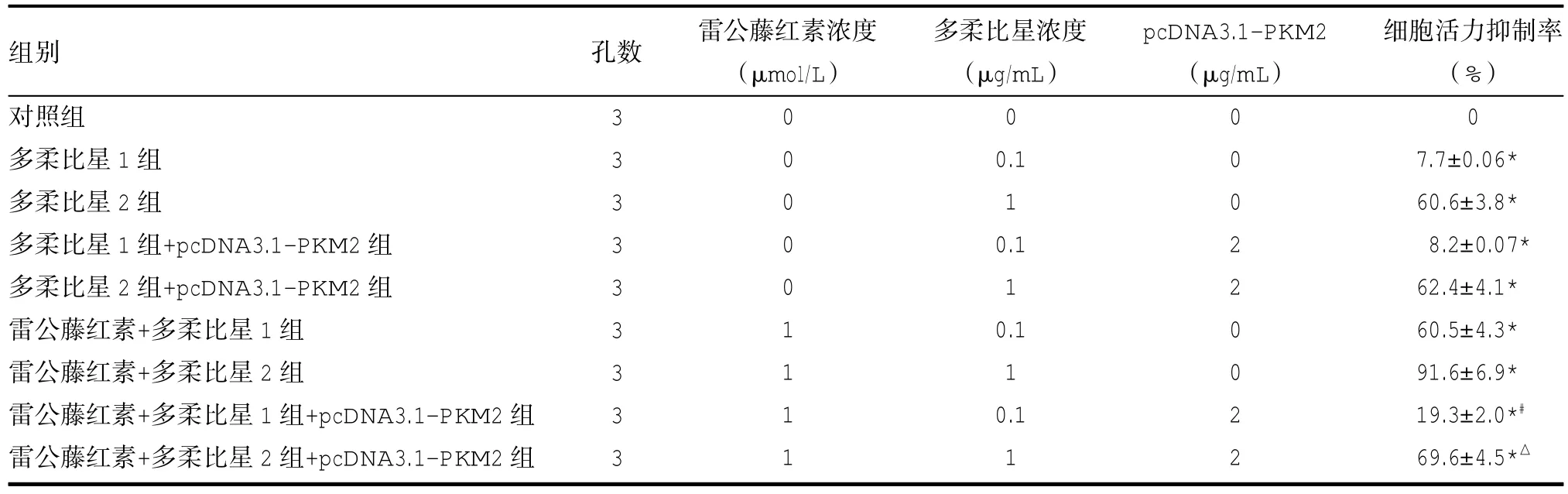
表4 雷公藤红素对Huh7细胞PKM2表达及糖代谢的影响(±s)
注:与对照组比较,*P<0.05;与雷公藤红素+多柔比星1组比较,#P<0.05;与雷公藤红素+多柔比星2组比较,△P<0.05;pcDNA3.1:真核表达载体
组别对照组多柔比星1组多柔比星2组多柔比星1组+pcDNA3.1-PKM2组多柔比星2组+pcDNA3.1-PKM2组雷公藤红素+多柔比星1组雷公藤红素+多柔比星2组雷公藤红素+多柔比星1组+pcDNA3.1-PKM2组雷公藤红素+多柔比星2组+pcDNA3.1-PKM2组孔数 雷公藤红素浓度(μmol/L)pcDNA3.1-PKM2(μg/mL)333333333 000001111多柔比星浓度(μg/mL)0 0.1 1 0.1 1 0.1 1 0.1 1 000220022细胞活力抑制率(%)0 7.7±0.06* 60.6±3.8* 8.2±0.07* 62.4±4.1* 60.5±4.3* 91.6±6.9* 19.3±2.0*#69.6±4.5*△
2.4 过表达PKM2显著抑制雷公藤红素对多柔比星抗肿瘤作用的协同效应 体外转染PKM2表达载体对多柔比星单治疗组的细胞活力抑制率无影响,但过表达PKM2能显著抑制雷公藤红素对多柔比星抗肿瘤作用的协同效应,见表4。
3 讨论
雷公藤红素是一种具有多种生物活性的三萜类化合物,来源于中药雷公藤的根皮,目前临床上主要用于治疗类风湿性疾病[7]。最近的研究发现,雷公藤红素还具有一定的抗肿瘤效应,如雷公藤红素在体外能抑制前列腺癌细胞的增殖[3],还能通过激活JNK/ ATF2途径增强顺铂对非小细胞肺癌的抗肿瘤活性[4]。在本研究中,笔者同样发现雷公藤红素单独治疗有微弱的抗肝癌细胞的生物活性,而更为重要的是,雷公藤红素还能显著提高化疗药物多柔比星对肝癌细胞的治疗效果。
肿瘤细胞的一个重要特征是其与正常细胞相比,它们的糖代谢异常旺盛。肿瘤细胞能摄取更多的葡萄糖,但大部分葡萄糖却不进入氧化磷酸化释放能量,反而进行有氧糖酵解合成更多的中间产物,最后生成乳酸,而这些中间产物往往是合成核酸和蛋白质的原料[8]。丙酮酸激酶M2(PKM2)是有氧糖酵解过程中的关键酶,肿瘤细胞PKM2往往异常高表达以促进有氧糖酵解的进行[9-10]。有文献[11-12]报道,肿瘤细胞的化疗药物耐药和肿瘤细胞的糖代谢异常有关,本研究进一步研究雷公藤红素对多柔比星的协同效应是否和肿瘤细胞的糖代谢有关。
本实验研究发现,与正常肝细胞系相比,肝肿瘤细胞系的PKM2水平显著高表达,表明肿瘤的发生可能和PKM2的异常表达有关。进一步研究发现雷公藤红素能显著降低Huh7细胞的PKM2表达水平,并减弱Huh7细胞对葡萄糖的摄取和乳酸的生成,表明雷公藤红素能显著抑制肝癌细胞的糖代谢和有氧糖酵解。为证实雷公藤红素增强多柔比星杀伤活性依赖于PKM2的下调,我们构建了PKM2重组表达质粒,使PKM2在Huh7细胞中过表达。发现当Huh7细胞中PKM2发生过表达后,雷公藤红素对多柔比星的协同抗肝癌作用受到显著抑制,同时,PKM2的过表达不影响多柔比星单治疗组对Huh7的杀伤活性。这些结果证实雷公藤红素增强多柔比星抗肿瘤效应的机制是靶向于PKM2基因。
本研究显示,雷公藤红素具有化疗药物增效的作用,其分子机制可能为通过下调PKM2的表达抑制肿瘤细胞的糖代谢以增强化疗药物对肝癌细胞的杀伤活性。这些实验结果为雷公藤红素与化疗药物的联合治疗方案提供了理论依据。
[1] Siegel R,Naishadham D,Jemal A,et al.Cancer statistics 2012[J].CA Cancer JClin,2012,62(1):10-29.
[2]Xu F,Wang F,Chen Y,et al.Differential drug resistance acquisition to doxorubicin and paclitaxel in breast cancer cells[J].Cancer Cell Int,2014,14(1):538.
[3]Ji N,Li J,Deng Y,et al.Effect of celastrol on growth inhibition of prostate cancer cells through the regulation of hERG channel in vitro[J].Biomed Res Int,2015,2015:308475.
[4]Lo Iacono M,Monica V,Scagliotti GV,et al.ATF2 contributes to cisplatin resistance in non-small cell lung cancer and celastrol induces cisplatin resensitization through inhibition of JNK/ATF2 pathway[J].Int J Cancer,2015,136(11):2598-2609.
[5]K.J.Livak,T.D.Schmittgen.Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T))Method[J].Methods,2001,25(4):402-408.
[6]Sun JG,Xiang J,Liu FY,et al.Clitocine induces apoptosis and enhances the lethality of ABT-737 in human colon cancer cells by disrupting the interaction of Mcl-1 and Bak[J].Cancer Lett,2014,355(2):253-263.
[7]Venkatesha SH,Astry B,Moudgil KD,et al.Suppression of autoimmune arthritis by Celastrus-derived Celastrol through modulation of pro-inflammatory chemokines[J].Bioorg Med Chem,2012,20(17):5229-5234.
[8]Wu S,Le H.Dual roles of PKM2 in cancermetabolism[J]. Acta Biochim Biophys Sin(Shanghai),2013,45(1):27-35.
[9]Israelsen WJ,Dayton TL,Bellinger G,et al.PKM2 isoformspecific deletion reveals a differential requirement for pyruvate kinase in tumor cells[J].Cell,2013,155(2):397-409.
[10]Yang W.Structural basis of PKM2 regulation[J].Protein Cell,2015,6(4):238-240.
[11]Zhou Y,Tozzi F,Wang J,et al.Intracellular ATP levels are a pivotal determinant of chemoresistance in colon cancer cells[J].Cancer Research,2012,72(1):304-314.
[12]Ginés A,Bystrup S,Martínez-Balibrea E.PKM2 Subcellular Localization Is Involved in Oxaliplatin Resistance Acquisition in HT29 Human Colorectal Cancer Cell Lines[J].PLoSOne,2015,10(5):e0123830.
(收稿:2015-06-12 修回:2015-07-10)
Celastrol Enhances the Cytotoxicity of Doxorubicin via Inhibiting the G lucose M etabolism in Hepatocellular Carcinoma Cell Line Huh7
DING Chengguo.Hangzhou First People's Hospital,Hangzhou(310006),China
Objective To investigate the effect of celastrol on doxorubicin therapy in hepatocellular carcinoma(HCC)in vitro.M ethods HCC cell line Huh7 cells were treated with celastrol alone at 0.5,1,2μmol/L or doxorubicin alone at concentration of 0.1 and 1g/mL or the combination of celastrol(1μmol/L)and doxorubicin(0.1 and 1g/mL).MTT assay was performed to determine the viability inhibition of doxorubicin plus celastrolon Huh7 cells.RT-qPCR analysis was performed to detect the expression of PKM2 in normal liver cell line L-O2 and HCC cell lines Huh7,HepG2,and PLC.PKM2 expression vector was constructed and then transfected into Huh7 cells treated with celastrol plus doxorubicin.The effect of PKM2 vectors on celastrol plus doxorubicin therapy was detected by MTT assay.Results The Huh7 cell viability inhibition rate was 2.6%±0.9%in 0.5μmol/L celastrol group,4.7%±1.3%in 1μmol/L celastrol group,8.8%±1.9%in 2μmol/L celastrol group;7.5%±1.9%in 0.1μg/mL doxorubicin single group,61.4%±4.2%in 1μg/mL doxorubicin single group,all with a significant difference to that of control group(all P<0.05).Compared with doxorubicin single group,the cell viability inhibition rate increased to 58.7%±3.8%in 1μmol/L celastrol+0.1μg/mL doxorubicin group and 89.7%±6.7%in 1μmol/L celastrol+1μg/mL doxorubicin group(P<0.05).The relative expression of PKM2 was as follows:1.0±0.05 on L-O2,15.2±0.6 on Huh7,11.8±0.5 on HepG2,and 13.4±0.7 on PLC(P<0.05).Celastrol decreased the expression of PKM2 on Huh7(0.70±0.05),HepG2(0.42±0.04),and PLC(0.31±0.03)cells(P<0.05).No effect was observed in doxorubicin single groups,but the expressions of PKM2 in 1μmol/L celastrol+0.1μg/mL doxorubicin group and 1μmol/L celastrol+1μg/ mL doxorubicin group were lower than those of doxorubicin single group(0.44±0.04 vs 0.98±0.07;0.41±0.03 vs 1.01±0.07;all P<0.05).The synergism of celastrol to doxorubicin was inhibited after the transfection of PKM2,and the cell viability inhibition rate was as follows:60.5%±4.3%in 1μmol/L celastrol+0.1μg/mL doxorubicin group, 91.6%±6.9%in 1μmol/L celastrol+1μg/mL doxorubicin group,19.3%±2.0%in 1μmol/L celastrol+0.1μg/mL doxorubicin+pcDNA3.1-PKM2group,69.6%±4.5%in 1μmol/L celastrol+1μg/mL doxorubicin+pcDNA3.1-PKM2 group(P< 0.05).Conclusion Celastrol enhances the cytotoxicity of doxorubicin via inhibiting the glucose metabolism in HCC cell line Huh7.This may relate to the downregulation of PKM2 in Huh7 cells.
hepatocellular carcinoma cell line;Huh7;celastrol;PKM2;glucose metabolism;doxorubicin
杭州市第一人民医院检验科(杭州 310006)
