右美托咪定对颅内动脉瘤手术患者脑血流代谢和脑保护作用
2015-05-29林赛娟田国刚姚欢琦王颖林董盛龙王召燕朱少飞
林赛娟 田国刚 姚欢琦 田 毅 王颖林 董盛龙 王召燕 朱少飞
(海口市人民医院麻醉科,海南 海口 570208)
颅内动脉瘤手术易发生脑动脉痉挛,甚至造成脑血管破裂,是其最危险的手术并发症,同时因为手术牵拉、压迫或止血等常导致不同程度的脑组织损伤。右美托咪定作为一种新型α2肾上腺素受体激动剂,具有抑制交感神经兴奋达到镇静和镇痛等的效果,且可负反馈调节儿茶酚胺释放以控制血压〔1〕。也有研究证实其可能对脑海马部有保护功能〔2〕。在动物体内的短暂性脑局部缺血实验中已发现其有防止局部缺血性脑神经损伤的作用〔3〕。有研究〔4〕提示其可能成为神经外科手术中重要的麻醉辅助药物。本研究旨在进一步探讨颅内动脉瘤患者手术中右美托咪定的生物学作用。
1 资料与方法
1.1 临床资料 收集2013年1月至2014年6月我院全身麻醉下行颅内动脉瘤手术的60例患者,男33例,女27例,平均年龄(56.6±10.5)岁,均为美国麻醉师协会(ASA)Ⅰ~Ⅱ级,纳入患者术前均神志清楚,生化、心肺功能等检查基本正常,对有认知功能障碍或精神类疾病、心脑血管疾病、使用镇静药或抗交感药物的患者予以排除,所有患者均无麻醉药物过敏史,并将在术中发生破裂大出血的患者排除。采用随机数字表法分为研究组和对照组各30例,研究组在麻醉诱导前给予右美托咪定,对照组同期给予等量生理盐水。两组患者的年龄、性别、体质量等基线资料比较无统计学差异(P>0.05)。所有患者均签署手术和麻醉知情同意书,并经我院伦理委员会同意。
1.2 麻醉方式 患者常规开放静脉通路后心电监护(S/5多功能监测仪,Datex-Ohmeda公司,芬兰;BIS VISTA,Aspect公司,美国)、面罩吸氧,并留置中心静脉导管,麻醉机为Drager Primus(Drager公司,德国)。研究组在麻醉诱导前给予右美托咪定(批号:12061234,江苏恒瑞医药股份有限公司)1.0μg/kg泵注,15 min内注入完毕,输注结束后依次给予咪达唑仑0.1 mg/kg、丙泊酚 2 mg/kg、芬太尼 6 μg/kg、顺阿曲库铵0.15 mg/kg以麻醉诱导,同时插入气管导管,并注意控制患者呼吸,麻醉维持则持续给予泵注瑞芬太尼0.15μg·kg-1·min-1和七氟醚吸入,并间断静脉注顺阿曲库铵。对照组诱导前给予与右美托咪定等量的生理盐水静脉泵注,其余麻醉诱导及维持方法均同研究组。采用JYH-ICP型颅内压无创综合检测分析仪和MicroMaxx便携式经颅多普勒超声仪检测患者颅内压(ICP)及脑血流量(CBF),采用i-STAT便携式血气分析仪测定动脉血氧饱和度(SaO2)、颈内静脉血氧饱和度(SjvO2)、动脉血氧分压(PaO2)和颈内静脉血氧分压(PjvO2),采用酶联免疫吸附(ELISA)法测定髓鞘碱性蛋白(MBP)和神经元特异性烯醇化酶(NSE)(试剂盒由美国RD公司提供)、S100β(试剂盒由上海江莱生物科技有限公司提供)。
1.3 观察指标 分别在入室时(T0)、全身麻醉后(T1)、手术开始时(T2)、阻断供瘤动脉时(T3)、阻断颅内动脉瘤时(T4)、恢复供瘤动脉时(T5)及手术结束时(T6)记录两组患者的心率(HR)、平均动脉压(MAP)、颅内压(ICP)和脑血流量(CBF)。并分别记录两组患者自主呼吸恢复时间和Steward评分情况,满分为6分,其中4分以上患者可离开复苏室。并在各时刻根据FICK公式计算出动脉-颈内静脉球部血氧差〔D(a-jv)O2〕和脑氧摄取率(CEO2)。于 T0、T6、6 h(T7)、12 h(T8)和 24 h(T9)测定患者血清MBP、NSE和S100β水平。
1.4 统计学方法 应用SPSS11.5软件进行统计分析,计量资料数据以x±s表示,采用方差分析、t检验或非参数检验方法,计数资料采用χ2检验。
2 结果
2.1 两组患者HR、MAP、ICP和CBF比较 研究组中有2例患者HR下降至40次/min以下,在给予阿托品对症处理后恢复正常。两组患者T0时间点的HR和MAP比较无统计学差异(P>0.05),研究组在T1~T6时间点的HR和MAP均较T0时间点有显著性降低(P<0.05),且与对照组的T1~T6时间点比较均有统计学差异(P<0.05);进一步监测发现研究组的T1和T4时间点ICP和CBF均明显低于对照组(P<0.05),两组T0时间点的ICP和CBF比较无统计学差异(P>0.05)。见表1。
2.2 两组患者的复苏情况比较 研究组的自主呼吸恢复时间〔(7.11 ±1.09)h〕显著短于对照组〔(9.10 ±1.35)h〕(P=0.000,t=6.282);同时,研究组的 Steward 评分为(5.38 ±0.34),明显高于对照组的(4.02 ±0.30)(P=0.000,t=16.428)。
2.3 两组患者D(a-jv)O2和CERO2水平比较 研究组T2和T3时间点的D(a-jv)O2和CERO2水平均明显低于T1时间点,且同一时间点比较均低于对照组(P<0.05),两组患者T0和T1时间点的脑氧代谢水平比较无统计学意义(P>0.05)。见表2。
2.4 两组患者MBP、NSE和S100β水平比较 两组患者T0和T6时间点的各脑损伤相关指标分别比较无统计学差异(P>0.05),研究组T9时间点的MBP和NSE血清水平均明显低于对照组T6~T8时间点,且T7~T9时间点的S100β水平均明显低于对照组T6时间点(P<0.05)。见表3。
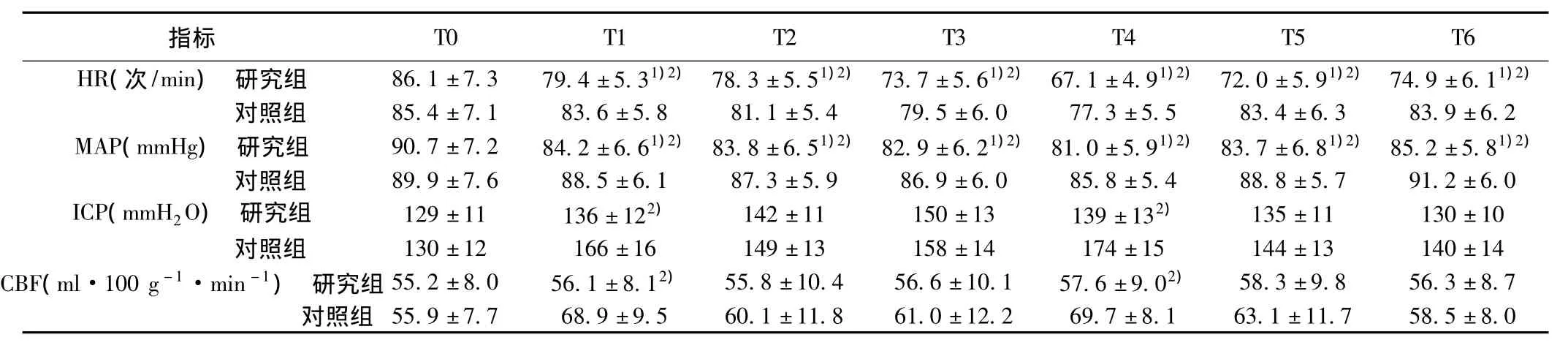
表1 两组患者的血流动力学情况比较(x ± s,n=30)

表2 两组患者的脑氧代谢情况比较(x ± s,n=30)

表3 两组患者的脑损伤情况比较(x ± s,n=30)
3 讨论
右美托咪定通过对神经节突触前膜上的a2肾上腺素能受体激活,进而负反馈抑制节前神经肾上腺素的释放,发挥其抗交感神经兴奋的生物学作用,另外可通过对神经节突触后膜上的β2肾上腺素能受体激活,进而起到抑制节后神经释放去甲肾上腺素的作用以降低交感神经兴奋〔5〕。国外已有相关研究证实,右美托咪定可明显减弱颅内肿瘤手术插管等有害刺激,并有维持心血管稳定、减少脑血流和显著提高麻醉后恢复的功能〔6〕。本研究进一步证实了右美托咪定在全麻过程中具有降低心血管压力和维持心血管稳定的作用。目前对于早期脑低氧状态的监测指标主要是CBF和ICP。本研究发现,右美托咪定能较好地调节脑部血供和供氧平衡状态,尤其在插管全身麻醉后和阻断颅内动脉瘤时较对照组基本无强烈CBF和ICP的参数波动,进一步提示了其对减少脑血流和维持脑氧供需的重要保护功能。另外,本研究也进一步说明了右美托咪定良好的镇静功能,促进了患者的较快复苏。右美托咪定脑保护功能的可能机制主要有两点:(1)通过增加bcl-2和mdm-2的表达,进而降低脑缺血时线粒体膜通透性;(2)减少兴奋性神经递质释放〔7〕。目前用于评价脑氧代谢的重要指标是D(a-jv)O2、CERO2和SjvO2,均可较有效地评估全脑血流代谢情况〔8〕。其中D(a-jv)O2和CERO2水平降低均提示了脑氧供充足或脑血流灌注改善〔9〕。本研究发现,给予右美托咪定的患者在手术开始和阻断供瘤动脉时能较好增加和维持脑氧供和脑灌注,进而降低了脑氧代谢,通过维持脑氧供需平衡发挥脑保护的生物学功能。
在颅内动脉瘤手术过程中,供血区脑的缺血缺氧性损害可引起多种酶或蛋白质的变化,其中NSE和S100β均是提示脑损伤的敏感生化指标。有中枢神经髓鞘破坏时,MBP也可释放至中枢神经系统或血液中,同样可以通过生化检测方法进行检测和评估〔10〕。NSE是存在于神经细胞和神经内分泌细胞中的特异胞内蛋白,对于神经元损伤其有较好的监测作用〔11〕,其水平增高程度可有效反映神经元损伤情况。S100β则存在于星形胶质细胞和少突胶质细胞等神经胶质细胞中,其水平可一定程度上反映神经胶质细胞的损伤情况〔12〕。本研究中这三者生化指标的检测结果可能与脑组织不同细胞的损伤先后出现差异有关。此结果从生化角度进一步提示了右美托咪定在颅内动脉瘤手术和麻醉中的脑保护作用。有学者认为,右美托咪定可能通过加速星形胶质细胞对谷氨酸盐的代谢,进而减弱了谷氨酸盐的神经毒性以发挥脑保护作用〔13〕。国外有学者〔14〕发现,右美托咪定可不依赖α2受体增加蛋白激酶K1和K2的表达,这可能与其神经保护作用有关,但具体机制尚待进一步研究。
1 王 香,顾达民,张 科,等.右美托咪定对腹腔镜下胆囊切除术患者血流动力学的影响〔J〕.中国医药,2013;8(1):69-71.
2 Cosar M,Eser O,Fidan H,et al.The neuroprotective effect of dexmedetomidine in the hippocampus of rabbits after subarachnoid hemorrhage〔J〕.Surg Neurol,2009;71(1):54-9.
3 Kuhmonen J,Pokorny J,Miettinen R,et al.Neuroprotective effects of dexmedetomidine in the gerbil hippocampus after transient global ischemia〔J〕.Anesthesiology,1997;87(2):371-7.
4 Bekker A,Sturaitis MK.Dexmedetomidine for neurological surgery〔J〕.Neurosurgery,2005;57(1 Suppl):1-10.
5 张 伟,张加强,孟凡民,等.不同负荷剂量右旋美托咪定对成人行清醒气管插管的影响〔J〕.中华实用诊断与治疗杂志,2011;25(11):1075-98.
6 Tanskanen PE,KyttäJV,Randell TT,et al.Dexmedetomidine as an anaesthetic adjuvant in patients undergoing intracranial tumour surgery:a double-blind,randomized and placebo-controlled study〔J〕.Br JAnaesth,2006;97(5):658-65.
7 Kumagai M,Horiguchi T,Nishikawa T,et al.Intravenous dexmedetomidine decreases lung permeability induced by intracranial hypertension in rats〔J〕.Anesth Analg,2008;107(2):643-7.
8 Schmidt B,Klingelhöfer J,Perkes I,et al.Cerebral autoregulatory response depends on the direction of change in perfusion pressure〔J〕.JNeurotrauma,2009;26(5):651-6.
9 Diringer MN,Scalfani MT,Zazulia AR,et al.Cerebral hemodynamic and metabolic effects of equi-osmolar doses mannitol and 23.4%saline in patients with edema following large ischemic stroke〔J〕.Neurocrit Care,2011;14(1):11-7.
10 Chekhonin VP,Gurina OI,Dmitrieva TB,et al.Myelin basic protein.Structure,properties,function and role in diagnosing demyelinating diseases〔J〕.Vopr Med Khim,2000;46(6):549-63.
11 贺 勇,尤志珺,周少华,等.短暂性脑缺血发作患者血清S-100和神经元特异性烯醇化醇的测定及临床意义〔J〕.实用医学杂志,2005;21(1):37-8.
12 邹以席,黄方炯.S100β蛋白作为脑损伤标记物的研究进展〔J〕.中华实用诊断与治疗杂志,2009;23(8):731-4.
13 Huang R,Chen Y,Yu AC,et al.Dexmedetomidine-induced stimulation of glutamine oxidation in astrocytes:a possible mechanism for its neuroprotective activity〔J〕.JCereb Blood Flow Metab,2000;20(6):895-8.
14 Dahmani S,Paris A,Jannier V,et al.Dexmedetomidine increases hippocampal phosphorylated extracellular signal-regulated protein kinase 1 and 2 content by an alpha 2-adrenoceptor-independent mechanism:evidence for the involvement of imidazoline I1 receptors〔J〕.Anesthesiology,2008;108(3):457-66.
