PPAR-γ和P38MAPK蛋白在肝细胞癌中的表达及临床意义
2015-05-29乔治斌何洪涛梁占强
张 萌 彭 利 乔治斌 何洪涛 周 烨 梁占强 徐 卓
(河北医科大学第四医院肝胆外科,河北 石家庄 050011)
过氧化物酶体增殖物激活受体γ(PPAR-γ)与恶性肿瘤的关系及其配体的治疗作用正受到广泛的关注,研究发现PPAR-γ配体具有抑制肿瘤细胞生长、诱导肿瘤细胞凋亡、抑制肿瘤血管生成及降低肿瘤侵袭力等作用,此类作用与PPAR-γ激活后参与调控多条细胞内信号传导通路有关〔1〕。P38MAPK通路是丝裂原活化蛋白激酶(MAPKs)家族的重要成员,受细胞外信号的刺激而激活,通过磷酸化下游转录因子,参与细胞的增殖、分化和凋亡〔2〕。有研究发现PPAR-γ激活后可经P38MAPK通路诱导肾癌细胞的凋亡〔3〕,但二者在肝细胞癌的研究甚少。本实验采用免疫组织化学方法检测肝癌组织及正常肝组织中PPAR-γ和P38MAPK蛋白的表达,分析其与肝细胞癌临床病理特征的关系及相互关系,探讨其在肝细胞癌中表达的意义及其预后价值。
1 材料与方法
1.1 一般资料 收集河北医科大学第四医院肝胆外科2007年1月至2010年3月手术切除并经病理证实的随访资料完整的肝细胞癌标本57例。所有患者术前均未经过任何抗肿瘤治疗。其中男51例,女6例,年龄34~75岁,中位年龄57岁。标本切除离体立即固定于10%中性甲醛溶液,石蜡包埋。57例肝细胞癌组织中,27例直径≤5 cm,30例直径>5 cm;侵及邻近脏器或淋巴结转移共11例,未侵及邻近脏器或无淋巴结转移46例;有门静脉瘤栓7例,无门静脉瘤栓50例;47例为单发肿瘤,10例为肝内多发肿瘤。临床分期根据TNM分期,Ⅰ期1例,Ⅱ期23例,Ⅲ期32例,Ⅳ期1例。另取肝血管瘤患者之肝组织20例作为对照。由两位有经验病理医师进行病理组织学诊断。
1.2 主要试剂 PPAR-γ(E-8)鼠抗人单克隆抗体及P38MAPK(H-147)兔抗人单克隆抗体均购自美国Santa Cruz公司。即用型非生物素免疫组化EliVisionTMsuper检测试剂盒(KIT-9922)、即用型快捷免疫组化MaxVisionTM2试剂盒(KIT-5920)均购自福州迈新生物技术开发有限公司。
1.3 免疫组织化学染色方法 采用免疫组织化学一步法(EliVisionTMsuper试剂盒)检测标本。切片均用2%APES处理,4μm连续切片。橘橼酸盐缓冲液进行抗原热修复。PPAR-γ和P38MAPK抗体均以1∶100稀释。以磷酸盐缓冲液(PBS)代替一抗作为阴性对照;PPAR-γ的阳性对照为已知阳性的乳腺癌切片;P38MAPK的阳性对照为已知阳性的胰腺癌切片。
1.4 结果判定 PPAR-γ蛋白阳性染色集中于细胞核,少数为胞核、胞质均着色,呈棕黄色至深棕色粗颗粒状。参照文献〔4〕判定标准,阳性细胞所占比例<10%者为阴性,阳性细胞所占比例≥10%者为阳性。P38MAPK蛋白阳性表达为细胞质和细胞核内出现棕黄色颗粒。根据文献〔5〕综合细胞染色强度及阳性细胞所占百分率进行评分,每张切片细胞的着色程度得分和着色细胞的百分率得分相乘,即为阳性系数。阳性系数≤2分为低表达,阳性系数>2为高表达。
1.5 随访情况 随访所有病例均有完整随访资料,研究自手术之日起,至本研究结束(2013-1-1)止,随访时间单位为月,研究终点(阳性结局)定义为患者因肝癌或相应并发症死亡,研究结束时仍未出现阳性结局者定为删失。随访时间1.0~71.1个月,中位随访时间为27.2个月。
1.6 统计学分析 采用SPSS17.0软件进行χ2检验及Fisher确切概率计算法;相关分析采用Spearman相关分析,生存分析采用Kaplan-Meier生存曲线,并经Log-rank检验。
2 结果
2.1 PPAR-γ蛋白在肝细胞癌组织中的表达与临床病理特征的关系 PPAR-γ蛋白在57例肝细胞癌组织中的阳性表达率(45.6%)显著高于正常肝组织(15.0%)(P<0.05,见图1)。PPAR-γ蛋白在门静脉癌栓组的阳性表达率显著高于无门静脉癌栓组(P<0.05);PPAR-γ蛋白的阳性表达率在TNM分期各组之间差异显著,分期越晚阳性率越高(P<0.05)。PPAR-γ蛋白表达在患者年龄、性别、肿瘤数目、肿瘤直径、有否转移各组之间差异无统计学意义(P>0.05,表1)。
PPAR-γ蛋白阳性表达组的 1、3、5年生存率分别为53.8%、42.3%、0.0%;阴性表达组的1、3、5年生存率分别为54.8%、48.4%、39.9%;两组间差异无统计学意义(P>0.05)。
2.2 P38MAPK蛋白在肝细胞癌组织中的表达与临床病理特征的关系 57例肝细胞癌组织中P38MAPK蛋白的高表达率为64.9%,显著高于正常肝组织(14.3%,P<0.05,见图1)。但P38MAPK蛋白高表达在患者年龄、性别、门静脉癌栓、肿瘤数目、肿瘤直径、TNM分期、有否转移各组之间差异无统计学意义(P >0.05,表1)。
P38MAPK蛋白高表达组的 1、3、5年生存率分别为67.7%、45.5%、43.1%;低表达组的 1、3、5 年生存率分别为42.5%、39.2%、0%;两组间差异无统计学意义(P>0.05)。

表1 PPAR-γ与P38MAPK蛋白在肝细胞癌中的表达与临床病理特征的关系〔n(%)〕
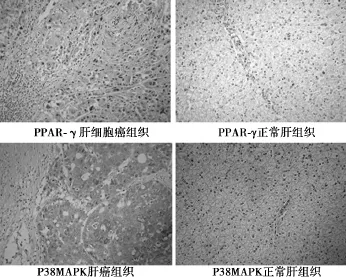
图1 PPAR-γ与P38MAPK蛋白在不同组织中的表达 (IHC,×200)
2.3 PPAR-γ和P38MAPK蛋白在肝细胞癌组织中的表达相关性 在肝细胞癌组织中PPAR-γ蛋白与P38MAPK蛋白表达呈明显正相关(r=0.378,P=0.004)。
3 讨论
近年研究发现PPAR-γ在多种恶性肿瘤组织中表达上调。在胃癌组织中,PPAR-γ表达显著高于胃黏膜异型增生及慢性萎缩性胃炎,且与淋巴结转移和组织分化程度无关,提示PPAR-γ 的高表达是胃癌发生的早期事件之一〔4〕;Wang等〔6〕研究发现PPAR-γ表达上调在正常食管组织向巴雷特食管和食管癌发展的过程中发挥重要作用。本实验结果说明PPAR-γ蛋白的阳性表达与肝癌的发生、发展、侵袭、转移有密切关系,PPAR-γ蛋白有可能为患者的不良预后提供参考;但是经Kaplan-Meier生存分析显示PPAR-γ蛋白的表达与肝癌患者预后无关,进一步扩大样本量或延长随访时间有可能得出阳性结论。Giaginis等〔7〕在65例胰腺癌组织中发现49例(75%)PPAR-γ蛋白表达阳性,并且与肿瘤分期、直径和预后有关,认为PPAR-γ可以作为胰腺癌的独立预后因素。
MAPKs家族是细胞内主要的信号转导系统之一,可将胞外刺激信号传递到细胞核,从而参与和调控细胞的多种生理病理过程〔8〕。其中P38MAPK主要参与细胞应激反应和炎症反应,但近年来研究发现其参与调节肿瘤细胞的增殖和凋亡,并且在肿瘤发病、耐药、转移中也起重要作用〔9〕。P38MAPK在许多人类肿瘤,如乳腺癌、胃癌、前列腺癌等呈普遍持续的过度表达。我们的研究发现,P38MAPK蛋白在肝细胞癌组织中的表达显著上调,同国内学者徐正府等〔10〕的研究结果一致。但是本研究发现,P38MAPK的过度表达与肝细胞癌的临床病理特征无关,与患者的预后无关,提示P38MAPK通路可能主要在肝细胞癌形成的早期发挥作用,磷酸化P38MAPK为其活性形式,致癌因素等细胞外信号磷酸化激活P38MAPK通路后,其再作用于多种转录因子,通过调控下游基因发挥生物细胞学效应〔11〕。而且目前研究证实,P38MAPK激活后导致的效应具有细胞类型依赖性和刺激类型依赖性,即不同细胞在受到不同刺激影响时,P38MAPK所导致的最终结果可能是完全不同的〔12〕。
本实验结果说明在肝细胞癌的发生和发展过程中二者存在密切联系。Fujita等〔3〕研究发现,曲格列酮与PPAR-γ结合后可通过激活P38MAPK通路在体外诱导肾癌细胞的凋亡,并引发细胞的G2/M期阻滞。国内学者刘加军等〔13〕的实验显示,PPAR-γ与配体结合后可诱导白血病HL-60细胞的凋亡,并认为这与p38MAPK通路及 caspase-3的激活有关。PPAR-γ与P38MAPK蛋白在肝细胞癌中的高表达与其被激活后发挥的抑癌作用之间有何联系,其具体机制如何,有待进一步研究明确。
1 Reka AK,Goswami MT,Krishnapuram R,et al.Molecular cross-regulation between PPAR-γand other signaling pathways:implications for lung cancer therapy〔J〕.Lung Cancer,2011;72(2):154-9.
2 del Barco Barrantes I,Nebreda AR.Roles of p38 MAPKs in invasion and metastasis〔J〕.Biochem Soc Trans,2012;40(1):79-84.
3 Fujita M,Yagami T,Fujio M,et al.Cytotoxicity of troglitazone through PPARγ-independent pathway and p38 MAPK pathway in renal cell carcinoma〔J〕.Cancer Lett,2011;312(2):219-27.
4 Yao L,Liu F,Sun L,et al.Upregulation of PPARgamma in tissue with gastric carcinoma〔J〕.Hybridoma(Larchmt),2010;29(4):341-3.
5 Lee SD.Immunohistochemical analysis of nuclear factor,p38,and cyclin D1 proteins in premalignant lesions and carcinomas of the colorectal mucosa〔J〕.Korean JGastroenterol,2008;52(6):359-67.
6 Wang W,Wang R,Zhang Z,et al.Enhanced PPAR-gamma expression may correlate with the development of Barrett's esophagus and esophageal adenocarcinoma〔J〕.Oncol Res,2011;19(3-4):141-7.
7 Giaginis C,Katsamangou E,Tsourouflis G,et al.Peroxisome proliferatoractivated receptor-gamma and retinoid X receptor-alpha expression in pancreatic ductal adenocarcinoma:association with clinicopathological parameters,tumor proliferative capacity,and patients'survival〔J〕.Med Sci Monit,2009;15(5):148-56.
8 Keshet Y,Seger R.The MAP kinase signaling cascades:a system of hundreds of components regulates a diverse array of physiological functions〔J〕.Methods Mol Biol,2010;661:3-38.
9 De la Cruz-Morcillo MA,Valero ML,Callejas-Valera JL,et al.P38MAPK is a major determinant of the balance between apoptosis and autophagy triggered by 5-fluorouracil:implication in resistance〔J〕.Oncogene,2012;31(9):1073-85.
10 徐正府,任雪霞,黄介飞,等.MMP-13及P38MAPK在肝细胞癌侵袭和转移中的作用〔J〕.苏州大学学报(医学版),2008;28(6):966-9.
11 Kim EK,Choi EJ.Pathological roles of MAPK signaling pathways in human diseases〔J〕.Biochim Biophys Acta,2010;1802(4):396-405.
12 刘 瑞,高维娟.丝裂原活化蛋白激酶信号通路及其在细胞凋亡中的作用〔J〕.中国老年学杂志,2012;32(18):4089-92.
13 刘加军,徐 妍,刘文迭,等.环格列酮通过PPARr及P38MAPK信号途径诱导白血病HL-60细胞凋亡〔J〕.中华医学杂志,2010;90(32):2270-4.
