微氧条件下硫酸盐还原菌颗粒污泥处理废水中铀(Ⅵ)的实验研究
2015-05-25谢水波马华龙唐振平曾涛涛王劲松
谢水波,马华龙,唐振平,凌 辉,曾涛涛,陈 胜,王劲松
(1.南华大学污染控制与资源化技术湖南省重点实验室,湖南衡阳 421001;2.南华大学铀矿冶生物技术国防重点学科实验室,湖南衡阳 421001)
微氧条件下硫酸盐还原菌颗粒污泥处理废水中铀(Ⅵ)的实验研究
谢水波1,2,马华龙1,唐振平1,凌 辉1,曾涛涛1,陈 胜1,王劲松1
(1.南华大学污染控制与资源化技术湖南省重点实验室,湖南衡阳 421001;2.南华大学铀矿冶生物技术国防重点学科实验室,湖南衡阳 421001)
通过驯化培养得到了以硫酸盐还原菌(SRB)为优势菌属的活性颗粒污泥,研究了微氧条件(氧浓度为0.6~1.0mg/L)下其对废水中U(Ⅵ)的去除性能,利用傅里叶红外光谱(FTIR)、扫描电镜(SEM)和X射线能谱(EDS)分析了其对U(Ⅵ)的去除机理,采用连续提取法考察了铀在颗粒污泥上的沉积形态。实验结果表明,微氧条件下SRB颗粒污泥结合并转化U(Ⅵ)的过程主要分为两步:初期(前30min)吸附和后期微生物还原沉淀作用,SRB颗粒污泥对U(Ⅵ)的去除率达98.89%。FTIR、SEM和EDS分析表明,颗粒污泥表层上酰胺基、羧基、羟基、磷酸基等均参与了对U(Ⅵ)的沉积,同时Na+、Mg2+等与UO2+2存在离子交换作用。形态分析表明,在颗粒污泥上,铀主要以残渣态形式沉积,生物有效性差,可迁移能力弱,不易造成二次污染。
硫酸盐还原菌;颗粒污泥;微氧;U(Ⅵ);沉积
铀具有重金属毒性及放射性,铀矿冶废水中的铀进入食物链后会对人类健康和生态环境造成极大的威胁[1]。地浸与堆浸渗出废水中铀的浓度一般在5mg/L以下,在余酸较多或存在凸镜体时,坑道渗出液中铀的浓度有时可达25mg/L。在我国,有的已退役治理的尾矿还存在“返酸”现象,渗出水的pH值为4.0~4.5,铀的浓度为0.1~1.0mg/L。铀的常见价态是六价(U(Ⅵ))和四价(U(Ⅳ)),U(Ⅵ)常以铀酰离子(UO2+2)的形式存在,在水环境中易迁移扩散,而U(Ⅳ)常以UO2形式存在,迁移能力有限,因而将U(Ⅵ)转化为难溶性U(Ⅳ)是含铀废水处理或资源回收的重要方法之一。有研究[2-5]表明,硫酸盐还原菌、铁还原菌、发酵菌等微生物均具有将U(Ⅵ)还原为稳定U(Ⅳ)的能力,有铀污染修复的潜在应用价值,因此含铀废水的微生物修复技术已成为研究热点。
但现有研究多集中于厌氧条件下单一菌种对U(Ⅵ)的还原行为,而在自然与工程实践中,微生物主要以混合群落的形式存在,一般地浸与堆浸环境中不可避免地存在溶解氧,因而研究混合菌落在有氧条件下对U(Ⅵ)的还原更具实际意义。厌氧颗粒污泥是厌氧反应系统中微生物自固定形成的特殊生物膜,其比表面积大、生物多样性丰富、沉降性能好、易于固液分离[6-7],较单一菌种有更强的重金属抗性和耐受性,有可能作为生物材料用于处理含U(Ⅵ)废水或铀资源回收。前期研究表明,在较低浓度下,微生物对铀的吸附作用对于水中铀的去除发挥了重要作用。本文在得到以硫酸盐还原菌(SRB)为优势菌属的颗粒污泥的基础上,通过实验探讨微氧条件下SRB颗粒污泥对废水中U(Ⅵ)的作用过程与还原效能,运用FTIR、SEM和EDS等手段分析其机理,并采用连续提取法考察铀的沉积形态,以揭示微氧条件下SRB颗粒污泥处理含铀废水的规律。
1 材料与方法
1.1 主要实验材料和仪器
实验材料:活性颗粒污泥取自湖南某柠檬酸厂的厌氧反应器,厌氧冷藏;称取一定量U3O8(分析纯),按GBW04201方法配制标准铀溶液(100mg/L);其他试剂均为分析纯。
主要仪器:IRPrestige-21型傅里叶变换红外光谱仪(FTIR),日本岛津公司;FEI Quanta-200型环境扫描电镜(SEM)、Genesis型能谱仪(EDS),美国FEI公司。
1.2 颗粒污泥驯化培养
驯化培养基:NH4Cl,230mg/L;KH2PO4,65mg/L;NaHCO3,1 250mg/L;酵母浸膏,500mg/L;FeSO4·4H2O,32mg/L;CaCl2· 2H2O,38mg/L;MgSO4·7H2O,42mg/L;葡萄糖,3 300mg/L;Na2SO4,4 437mg/L。
模拟废水:化学需氧量(COD)为3 000mg/L;COD、氮、磷的质量浓度比为200∶5∶1;COD与硫酸根的质量浓度比为1。
颗粒污泥的驯化培养:称取80g湿颗粒污泥,去离子水淘洗过筛(60目)后,接种于含有600mL驯化培养基的锥形瓶中,用1.0mol/L NaOH和HCl溶液调节其pH值为7.2±0.2,密封锥形瓶,35℃振荡培养(转速120r/min);每隔两天更换一次培养基,保持污泥有机负荷为220mg/g;连续驯化3个月,测得培养基中SO2-4的去除率大于80%,污泥粒径为0.5~3mm,挥发性悬浮固体(VSS)和总悬浮固体(TSS)分别为0.051、0.072g/g(湿污泥)。在扫描电镜下观察到污泥中有大量微生物生长,以杆菌和球菌为主,另有部分丝状菌和弧菌。以上各项指标表明,通过驯化得到了以SRB为优势菌属的颗粒污泥。
1.3 SRB颗粒污泥去除U(Ⅵ)的实验
取铀标准溶液20mL与高温灭菌的驯化培养基10mL置于150mL血清瓶中,用去离子水定容至100mL,此时培养液U(Ⅵ)浓度为20mg/L。将驯化后的颗粒污泥淘洗两遍并快速称重、转移至血清瓶,用1.0mol/L NaOH和HCl溶液调节pH值,于35℃下振荡培养,初始保持血清瓶上部50mL空气(0.1MPa)为微氧条件,液体中溶解氧浓度为0.6~1.0mg/L。定时取样,以8 000r/min离心10min,测定上清液中U(Ⅵ)和挥发性脂肪酸(VFA)的浓度。U(Ⅵ)浓度采用5Br-PADAP分光光度法测定,VFA浓度采用滴定法测定。实验设置灭活对照组,在将颗粒污泥转移至血清瓶前于121℃、0.1MPa下灭菌20min,其他条件同上。
实验主要考察SRB颗粒污泥对U(Ⅵ)的初期去除作用,以及溶解氧、pH值(2.0、3.0、4.0、5.0、6.0)、颗粒污泥投加量(以VSS计,分别为0、0.153、0.306、0.612、1.224g/L)对U(Ⅵ)去除性能的影响。
实验中先对U(Ⅵ)的初始浓度(5~25mg/L)对其去除性能的影响进行研究。结果显示,实验再现性较好,U(Ⅵ)浓度为20mg/L时实验结果最为稳定,因此其他条件实验均以此为基础。
1.4 SRB颗粒污泥去除U(Ⅵ)的机理研究
将处理U(Ⅵ)前后的颗粒污泥冷冻干燥,与KBr混匀,在研钵中充分研磨,压片,在相同的扫描频率下测定红外光谱,以分析U(Ⅵ)与颗粒污泥的作用基团;将处理前后的颗粒污泥冷冻干燥,切片喷金制备成电镜样品,用扫描电镜观察颗粒污泥表层和内核形貌,并用Genesis型能谱仪分析样品表层和内核的元素,以分析U(Ⅵ)在颗粒污泥上的沉积位点;将处理U(Ⅵ)后的颗粒污泥自然干燥(平均室温33℃),称取0.5g,采用修正的Tessier法[8]连续提取,以分析铀在颗粒物上的沉积形态。
2 结果与分析
2.1 SRB颗粒污泥对U(Ⅵ)的去除
1)U(Ⅵ)的初期去除
在溶液初始pH值为6.0,U(Ⅵ)初始浓度为20mg/L,污泥VSS投加量为0.612g/L条件下,SRB颗粒污泥对废水中U(Ⅵ)的初期去除实验结果如图1所示。从图1可看出,短时间内部分U(Ⅵ)被活性颗粒污泥快速去除。在20min左右时,U(Ⅵ)去除率达25%。随后U(Ⅵ)去除率略有下降,这可能是被吸附的U(Ⅵ)发生了部分解吸。由VFA浓度变化曲线可看出,20min后VFA浓度开始明显增大。这可能是因为反应初期葡萄糖并未参与代谢,缺乏还原可溶性U(Ⅵ)的电子供体。据此推测,U(Ⅵ)的初期去除主要是吸附作用。灭活颗粒污泥30min后U(Ⅵ)去除率基本保持不变,说明30min内初期吸附已达到平衡,这与Hawari等[9]利用厌氧颗粒污泥吸附Pb2+、Cd2+、Cu2+、Ni2+的研究结果类似。而30min后,活性颗粒溶液中剩余U(Ⅵ)浓度再次降低,去除率明显升高,说明反应机理发生了变化,微生物还原作用开始显著[5,10-11]。

图1 U(Ⅵ)的初期去除率和产生的VFA浓度随时间的变化Fig.1 Variation of U(Ⅵ)initial removal rate and VFA concentration with time
2)溶解氧对U(Ⅵ)去除的影响
相关文献[2-4,10-12]中对含U(Ⅵ)废水的生物还原实验多数是在严格厌氧条件下进行的,而实际含U(Ⅵ)废水中溶解氧是存在的,这在一定程度上影响了微生物对U(Ⅵ)的异化还原。在溶液初始pH值为6.0、U(Ⅵ)初始浓度为20mg/L、污泥VSS投加量为0.612g/L时,探讨了厌氧和微氧(氧浓度为0.6~1.0mg/L)条件下U(Ⅵ)去除率随时间的变化,结果如图2所示。由图2可见,反应的前6h,微氧环境下U(Ⅵ)的去除率略低于厌氧环境的,6h后二者的U(Ⅵ)去除率趋于一致,45h后均大于96%,最终稳定在约98.89%。分析认为,反应初始阶段,微氧环境中颗粒污泥表面的兼性厌氧菌通过代谢作用消耗O2,O2与U(Ⅵ)竞争电子,U(Ⅵ)不是唯一的电子受体,所以呈现出较慢的U(Ⅵ)去除速率。随着反应的进行,溶解氧浓度降低,U(Ⅵ)对电子的竞争优势更加明显,其去除速率加快,最终会与严格厌氧条件下的相当。Nancharaiah等[13]研究了好氧颗粒污泥还原固定U(Ⅵ),其X射线光电子能谱(XPS)表明,U(Ⅵ)被还原为U(Ⅳ)。可见,在颗粒污泥微生态系统中溶解氧的存在并不是制约U(Ⅵ)还原的决定性因素。

图2 溶解氧对U(Ⅵ)去除率的影响Fig.2 Effect of dissolved oxygen on U(Ⅵ)removal rate
3)pH值对U(Ⅵ)去除的影响
设定溶液初始pH值分别为2.0、3.0、4.0、5.0、6.0,U(Ⅵ)初始浓度为20mg/L,污泥VSS投加量为0.612g/L,考察pH值对U(Ⅵ)去除性能的影响,结果如图3所示。从图3可知,pH值对U(Ⅵ)的初期吸附去除影响很大,30min时pH值为2.0、3.0、4.0、5.0、6.0的去除率分别为11.53%、37.57%、64.04%、87.48%、24.98%。pH值较低时,颗粒污泥上菌体的活性官能团被质子化,对UO2+2有较强的排斥作用,pH值越低,初期吸附去除量越小;pH值为6.0时,溶液中的CO2、HCO-3与铀酰离子生成不易吸附的碳酸铀酰络合物导致去除率降低[14]。pH值不仅影响颗粒污泥表面的电性,而且影响U(Ⅵ)的存在形态,以及微生物的代谢活性,最终影响颗粒污泥对U(Ⅵ)的去除。pH值为2.0时,U(Ⅵ)的最终去除率仅为35%左右,此时SRB的U(Ⅵ)还原活性受到严重抑制;pH值在3.0~6.0范围内,反应完全时U(Ⅵ)去除率均达98%以上,原因可能是颗粒污泥结构密实,对溶液pH值有一定的缓冲作用,减弱了酸性环境对SRB还原活性的抑制作用,维持了其对U(Ⅵ)的还原能力。但pH值为3.0时初期吸附较pH值为6.0时的强,而6h后二者去除率已趋于一致,可见pH值为6.0时微生物活性更强,U(Ⅵ)还原去除速率更快。SRB生长最适宜pH值为偏中性范围,为维持SRB颗粒污泥较高的生物活性,其他实验选定pH值为6.0。
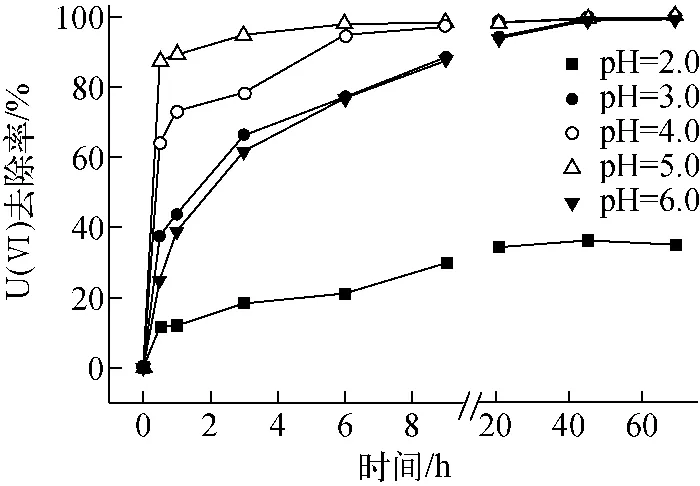
图3 初始pH值对U(Ⅵ)去除率的影响Fig.3 Effect of initial pH on U(Ⅵ)removal rate
4)颗粒污泥投加量对U(Ⅵ)去除的影响
当颗粒污泥VSS投加量分别为0、0.153、0.306、0.612、1.224g/L,溶液初始pH值为6.0,U(Ⅵ)初始浓度为20mg/L时,考察颗粒污泥投加量对U(Ⅵ)去除率的影响,并以灭活颗粒为对照组(其VSS投加量为0.612g/L),结果如图4所示。由图4可知,U(Ⅵ)的去除率随颗粒污泥投加量的增加而逐渐增大。当反应进行到21h时,投加1.224g/L颗粒污泥,U(Ⅵ)的去除率为94.54%,此时颗粒污泥投加量为0.153、0.306、0.612g/L的实验组,U(Ⅵ)的去除率分别为57.08%、76.93%和88.00%。当反应进行到70h时,颗粒污泥投加量为0.306、0.612、1.224g/L的U(Ⅵ)去除率均大于96%。可见,颗粒污泥投加量达到0.306g/L后再增加污泥投加量,对U(Ⅵ)的最终去除率影响不显著。且投加量成倍增加时,U(Ⅵ)的去除率并不成倍增加,这与汤洁等[15]关于微生物除Cr(Ⅵ)的结果类似。VSS投加量为0g/L的实验组,U(Ⅵ)浓度基本无变化,说明培养基对U(Ⅵ)无去除能力,灭活对照组9h后,U(Ⅵ)去除率开始大幅升高,这可能是由于污泥中某些嗜热SRB、芽孢杆菌等具有较强的耐热性,高温下在颗粒污泥中不易被杀死[16],随着时间的延长,U(Ⅵ)的还原能力逐渐恢复。

图4 颗粒污泥投加量对U(Ⅵ)去除率的影响Fig.4 Effect of dosing quantity of granular sludge on U(Ⅵ)removal rate
2.2 SRB颗粒污泥去除U(Ⅵ)的机理分析
1)U(Ⅵ)与颗粒污泥的作用基团分析
活性颗粒污泥处理U(Ⅵ)前后的FTIR谱如图5所示。从图5可看出,处理前后—OH的伸缩振动峰位由3 442.9cm-1移动到3 288.6cm-1,说明在结合铀酰离子时,O原子参与络合UO22+,使O—H键的键长增大,振动峰红移[17]。1 649.1cm-1处为酰胺Ⅰ带,主要是源于310-螺旋二级结构的蛋白质,处理后移动到1 656.9cm-1处,说明污泥中微生物细胞蛋白的二级结构被铀修饰[18]。1 240.2cm-1处为羧基中C O的弯曲振动和C—PO23-中P O的伸缩振动,结合2 924.1cm-1处—CH2的不对称伸缩振动,可判断颗粒污泥中有糖醛酸、腐殖酸、脂类存在[19],实验后的颗粒污泥在1 240.2cm-1处波峰消失,表明羧基和磷酸基[20]参与了铀的吸附。在1 200~950cm-1峰位处是糖类和醇类的C—O、C—C、C—H键,以及磷酸基PO2+和P(OH)2的伸缩振动,这些官能团可能来自污泥中微生物细胞的磷脂、核酸、肽聚糖,以及胞外聚合物(胞外多糖、胞外蛋白),实验后的颗粒污泥在1 197.8cm-1处出现一个新峰,1 105.2cm-1移向1 101.4cm-1,1 033.9cm-1移向1 039.6cm-1,这些变化可能归因于U(Ⅳ)的氧化物形成过程中的U—O不对称伸缩振动[21]。在550~1 000cm-1范围内,峰的位置和强度的变化可归因于UO22+的不对称伸缩振动以及U(Ⅳ)和U(Ⅵ)与O缔合后的伸缩振动[18,20],如在829.4cm-1处出现了一个含铀特征峰,这可能是U(Ⅵ)与污泥中官能团作用后U O对称伸缩振动造成的。从整个FTIR谱来看,由于铀的原子质量大,处理铀后的特征吸收峰向长波方向位移,而价态或配位数的变化可能产生相反结果。蛋白质的酰胺基、蛋白质和多糖的羧基和羟基、磷酸基等参与了U(Ⅵ)的沉积。

图5 SRB颗粒污泥处理U(Ⅵ)前、后的FTIR谱Fig.5 FTIR spectra of SRB granular sludge before and after uranium removed
2)U(Ⅵ)在颗粒污泥上的沉积位点分析
颗粒污泥结合U(Ⅵ)后表层和内核的SEM和EDS分析谱分别示于图6、7。由图6可见,颗粒表层区域(图6a)为多孔疏松结构,亮度较高,内核区域(图6b)相对致密,亮度较低,亮度差异是由于喷金不均匀造成的。图7中,在结合能为3.0~3.5keV处,表层区域出现显著的U峰,而内核区域相对较弱,铀在颗粒表层和内核所占的原子百分含量分别为0.72%和0.21%。铀在颗粒污泥表层含量高于内核,与Hullebusch等[22]研究颗粒污泥吸附钴的结果相似。原因是一方面由于传质阻力制约了其在颗粒内部的聚集,另一方面SRB多分布于颗粒污泥外层,导致U(Ⅵ)主要被吸附和再还原沉淀在颗粒污泥表层。通过与处理U(Ⅵ)前EDS数据对比发现,颗粒表面Na、Mg元素的含量分别降低了75.1%和59.5%,说明在吸附过程中Na+、Mg2+等与UO2+2发生了离子交换;P含量增大,说明有磷酸基参与,这与FTIR分析结果一致。

图6 SRB颗粒污泥颗粒表层(a)与内核(b)的SEM照片Fig.6 SEM pictures for SRB granular sludge of edge(a)and middle(b)
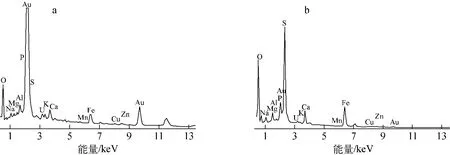
图7 SRB颗粒污泥颗粒表层(a)与内核(b)的EDS谱Fig.7 EDS spectra for SRB granular sludge of edge(a)and middle(b)

图8 SRB颗粒污泥中铀形态含量分布Fig.8 Speciation analysis of U in SRB granular sludge
3)U(Ⅵ)在颗粒污泥上的沉积形态分析修正的Tessier法适用于提取颗粒污泥中的重金属。本文采用该提取法考察了U(Ⅵ)在颗粒污泥上的沉积形态,结果如图8所示。由图8可见,铀主要以残渣态形式存在于颗粒污泥中,占总提取量的76.38%;迁移活性强、生物有效性高的可交换态与碳酸盐结合态所占比例较低,仅为6.00%和2.74%;硫化物及有机结合态为14.89%。可能是由于吸附于污泥上的U(Ⅵ)被还原为稳定的U(Ⅳ)形成了沉淀,在前两相态不易被提取,在第三相态提取中U(Ⅳ)被H2O2部分氧化,提取量增加。文献[10,23]通过XRD、XPS分析等证实了颗粒污泥将U(Ⅵ)全部还原为U(Ⅳ);采用三步提取法发现铀主要以残渣态(固相)的U(Ⅳ)形式存在于颗粒污泥中。本实验通过连续提取得到的铀总量(9.654mg/g)小于铀的总去除量(11.110mg/g),可能是提取时每步操作均有污泥损失造成的。
3 结论
1)SRB颗粒污泥去除废水中U(Ⅵ)主要分为两步,即初期吸附作用和后期微生物还原沉淀作用。在初始pH=6.0、U(Ⅵ)浓度20mg/L、污泥投加量0.612g/L及35℃条件下,SRB颗粒污泥对U(Ⅵ)初期吸附去除率达25%,30min达到初期吸附平衡。
2)在微氧条件下,颗粒污泥表面兼性厌氧菌能消耗水中的溶解氧,为U(Ⅵ)还原细菌创造还原U(Ⅵ)的环境,最终U(Ⅵ)去除率达98.89%。溶液pH值对初期吸附影响很大,pH值为5.0时初期吸附去除率达87.48%。低pH值对U(Ⅵ)生物还原不利。U(Ⅵ)去除率随污泥投加量的增加而逐渐增大,但投加量超过0.306g/L后,对U(Ⅵ)的最终去除率影响不显著。
3)FTIR、SEM和EDS分析表明,铀主要沉积在颗粒表层,与其作用的基团有酰胺(Ⅰ)基、蛋白质和多糖的羧基和羟基、磷酸基等,同时UO2+2可能与Na+、Mg2+等发生了离子交换。铀在颗粒污泥上主要以残渣态的形式沉积,生物有效性差,可迁移能力弱,不易造成二次污染。
[1] GIAMMAR D.Geochemistry of uranium at mineral-water interfaces:Rates of sorption-desorption and dissolution-precipitation reactions[D].Pasadena,USA:California Insititute of Technology,2001.
[2] BOONCHAYAANANT B,KITANIDIS P K,CRIDDLE C S.Growth and cometabolic reduction kinetics of a uranium-and sulfate-reducing desulfovibrio/clostridia mixed culture:Temperature effects[J].Biotechnology and Bioengineering,2008,99(5):1 107-1 119.
[3] 谢水波,张亚萍,刘金香,等.腐殖质AQS存在条件下腐败希瓦氏菌还原U(Ⅵ)的特性[J].中国有色金属学报,2012,22(11):3 285-3 291.
XIE Shuibo,ZHANG Yaping,LIU Jinxiang,et al.Characteristics of reducing U(Ⅵ)by Shewanella putrefaciens in presence of anthraguinone-2-sulfonate(AQS)[J].The Chinese Journal of Nonferrous Metals,2012,22(11):3 285-3 291(in Chinese).
[4] ZHANG C,DODGE C J,MALHOTRA S V,et al.Bioreduction and precipitation of uranium in ionic liquid aqueous solution by Clostridium sp.[J].Bioresource Technology,2013,136:752-756.
[5] 吴唯民,CARLEY J,WATSON D,等.地下水铀污染的原位微生物还原与固定:在美国能源部田纳西橡树岭放射物污染现场的试验[J].环境科学学报,2011,31(3):449-459.
WU Weimin,CARLEY J,WATSON D,et al.Bioreduction and immobilization of uranium in situ:A case study at a USA Department of Ener-gy radioactive waste site,Oak Ridge,Tennessee[J].Acta Scientiae Circumstantiae,2011,31(3):449-459(in Chinese).
[6] LIU W T,CHAN O C,FANG H H P.Characterization of microbial community in granular sludge treating brewery wastewater[J].Water Research,2002,36(7):1 767-1 775.
[7] BALOCH M I,AKUNNA J C,KIERANS M,et al.Structural analysis of anaerobic granules in aphase separated reactor by electron microscopy[J].Bioresource Technology,2008,99(5):922-929.
[8] HULLEBUSCH E D,UTOMO S,ZANDVOORT M H.Comparison of three sequential extraction procedures to describe metal fractionation in anaerobic granular sludges[J].Talanta,2005,65(2):549-558.
[9] HAWARI A H,MULLIGAN C N.Biosorption of lead(Ⅱ),cadmium(Ⅱ),copper(Ⅱ)and nickel(Ⅱ)by anaerobic granular biomass[J].Bioresource Technology,2006,97(4):692-700.
[10]TAPIA-RODRÍGUEZ A,LUNA-VELASCO A,FIELD J A,et al.Anaerobic bioremediation of hexavalent uranium in groundwater by reductive precipitation with methanogenic granular sludge[J].Water Research,2010,44(7):2 153-2 162.
[11]BEYENAL H,SANI R K,PEYTON B M,et al.Uranium immobilization by sulfate-reducing biofilms[J].Environmental Science &Technology,2004,38(7):2 067-2 074.
[12]HU K G,WANG Q L,TAO G Q,et al.Experimental study on restoration of polluted groundwater fromin situ leaching uranium mining with sulfate reducing bacteria and ZVI-SRB[J].Procedia Earth and Planetary Science,2011,2:150-155.
[13]NANCHARAIAH Y V,VENUGOPALAN V P,FRANCIS A J.Removal and biotransformation of U(Ⅵ)and Cr(Ⅵ)by aerobically grown mixed microbial granules[J].Desalination and Water Treatment,2012,38(1-3):90-95.
[14]XIE Shuibo,ZHANG Chun,ZHOU Xinghuo,et al.Removal of uranium(Ⅵ)from aqueous solution by adsorption of hematite[J].Journal of Environmental Radioactivity,2009,100(2):162-166.
[15]汤洁,王卓行,徐新华.铁屑-微生物协同还原去除水体中Cr(Ⅵ)研究[J].环境科学,2013,34(7):2 650-2 657.
TANG Jie,WANG Zhuoxing,XU Xinhua.Removal of Cr(Ⅵ)by iron filings with microorganisms to recover iron reactivity[J].Environmental Science,2013,34(7):2 650-2 657(in Chinese).
[16]沈良,严群,阮文权,等.不同预处理方式对颗粒污泥厌氧发酵产氢性能的影响[J].太阳能学报,2009,30(4):532-537.
SHEN Liang,YAN Qun,RUAN Wenquan,et al.Effect of different pretreatment of granular sludge on hydrogen production[J].Acta Energiae Solaris Sinica,2009,30(4):532-537(in Chinese).
[17]刘明学,张东,康厚军,等.铀与酵母菌细胞表面相互作用研究[J].高校地质学报,2011,17(1):53-58.
LIU Mingxue,ZHANG Dong,KANG Houjun,et al.The interaction between uranium and yeast cell surface[J].Geological Journal of China Universities,2011,17(1):53-58(in Chinese).
[18]MARTINS M,FALEIRO M L,da COSTA A M R,et al.Mechanism of uranium(Ⅵ)removal by two anaerobic bacterial communities[J].Journal of Hazardous Materials,2010,184(1-3):89-96.
[19]ZHANG D,WANG J,PAN X.Cadmium sorption by EPSs produced by anaerobic sludge under sulfate-reducing conditions[J].Journal of Hazardous Materials,2006,138(3):589-593.
[20]KAZY S K,D’SOUZA S F,SAR P.Uranium and thorium sequestration by aPseudomonas sp.:Mechanism and chemical characterization[J].Journal of Hazardous Materials,2009,163(1):65-72.
[21]CRǍCIUN C,RUSU D,POP-FANEA L,et al.Spectroscopic investigation of several uranium(Ⅳ)polyoxometalate complexes[J].Journal of Radioanalytical and Nuclear Chemistry,2005,264(3):589-594.
[22]van HULLEBUSCH E D,GIETELING J,ZHANG M,et al.Cobalt sorption onto anaerobic granular sludge:Isotherm and spatial localization analysis[J].Journal of Biotechnology,2006,121(2):227-240.
[23]TAPIA-RODRIGUEZ A,TORDABLE-MARTINEZ V,SUN W,et al.Uranium bioremediation in continuously fed upflow sand columns inoculated with anaerobic granules[J].Biotechnology and Bioengineering,2011,108(11):2 583-2 591.
Study of U(Ⅵ)Removal by Sulfate Reducing Bacteria Granular Sludge under Micro-aerobic Condition
XIE Shui-bo1,2,MA Hua-long1,TANG Zhen-ping1,LING Hui1,
ZENG Tao-tao1,CHEN Sheng1,WANG Jin-song1
(1.Hunan Provincial Key Laboratory of Pollution Control and Resources Technology,University of South China,Hengyang421001,China;2.Key Discipline Laboratory for National Defence for Biotechnology in Uranium Mining and Hydrometallurgy,University of South China,Hengyang421001,China)
The bioremediation behavior and mechanism of sulfate reducing bacteria(SRB)granular sludge which was artificially domesticated were studied.U(Ⅵ)removal by SRB granular sludge was investigated under micro-aerobic condition with the concentration of oxygen 0.6-1.0mg/L,then the removal mechanism was analyzed with FTIR,SEM and EDS,and finally the deposit morphology of uranium was studied with the se-quential extraction procedure.The results show that U(Ⅵ)removal by SRB granular sludge mainly occurs following a 2-step process which is initial adsorption(the first 30min)and microbial reduction process.The ultimate removal rate of U(Ⅵ)reaches 98.89%.Analyses of FTIR,SEM and EDS indicate that groups-amide group,carboxyl,hydroxyl and phosphoric acid group coming from the surface of SRB granular sludge are involved in uranium deposition.Ion exchange happens between Na+or Mg2+and UO2+2.Finally,U(Ⅵ)mainly deposites on granular sludge in the form of residual state that has poor bioavailability,bad migratory aptitude and less secondary pollution.
sulfate reducing bacteria;granular sludge;micro-aerobic;U(Ⅵ);deposition
TL941.29;X771
:A
:1000-6931(2015)01-0026-08
10.7538/yzk.2014.youxian.0007
2013-10-29;
2014-01-20
国家自然科学基金资助项目(11175081,21177053,51408293);高等学校博士学科点专项基金资助项目(2013432110003);湖南省高校创新平台资助项目(13K085,13K086)
谢水波(1964—),男,湖南岳阳人,教授,博士,从事环境生物技术研究
