三种方法进行结核分枝杆菌-乙胺丁醇药物敏感性试验的比较
2015-05-20孙庆赵丽丽陈燕赵秀芹吴移谋万康林
孙庆 赵丽丽 陈燕 赵秀芹 吴移谋 万康林
·论著·
三种方法进行结核分枝杆菌-乙胺丁醇药物敏感性试验的比较
孙庆 赵丽丽 陈燕 赵秀芹 吴移谋 万康林
目的 比较3种以细菌培养为基础的药物敏感性试验(简称“药敏试验”)方法检测结核分枝杆菌对乙胺丁醇的药物敏感性。方法 采用改良罗氏培养基比例法(L-J法)、 Bactec MGIT 960检测系统法(960法)和微孔板Alamar blue显色法[最低抑菌浓度法(MIC法)]同步对126株结核分枝杆菌临床分离株进行乙胺丁醇药敏试验,比较分析3种方法的药敏试验结果。试验数据采用SPSS 17.0软件进行分析处理。Kappa值在0.4~0.75为一致性较好,Kappa值≥0.75为一致性极佳,Kappa值<0.4为一致性差。结果 3种方法总体一致率为75.4%(95/126)。若以L-J法测定结果为判断标准,则960法和MIC法的敏感度、特异度和一致率分别为62.8%(49/78)、100.0%(48/48)、77.0%(97/126)和82.1%(64/78)、97.9%(47/48)、88.1%(111/126),MIC法与L-J法一致性极佳(Kappa=0.76),而960法与L-J法比较显示一致性较好(Kappa=0.56)。若以960法测定结果为判断标准,则L-J法和MIC法的敏感度、特异度和一致率分别为100.0%(49/49)、62.3%(48/77)、77.0%(97/126)和98.0%(48/49)、77.9%(60/77)、85.7%(108/126),L-J法和MIC法均显示与960法有较好一致性(Kappa≥0.70)。若以MIC法测定耐药结果为判断标准,则L-J法和960法的敏感度、特异度和一致率分别为98.5%(64/65)、77.0%(47/61)、88.1%(111/126)和73.8%(48/65)、98.4%(60/61)、85.7%(108/126)。3种方法的不一致性主要表现在MIC值4.0~16.0 μg/ml的药物浓度范围。结论 3种方法对乙胺丁醇进行药敏试验具有较好的一致性,但也存在一定差异。L-J法和960法均与MIC法具有较高一致性,且MIC法性价比更高,适于耐乙胺丁醇结核病的早期诊断。
结核分枝杆菌; 乙胺丁醇; 微生物敏感性试验
近年来,全球耐药结核病的发病率呈上升态势[1-2],已严重威胁着人类的身体健康,结核分枝杆菌的耐药问题也成为全球关注的热点问题。耐药结核病主要是由于滥用抗生素和不规范治疗引起[3-4];因此,合理的临床治疗对于控制耐药结核病极为重要,快速、准确的药物敏感性试验(简称“药敏试验”)是制定合理有效的个体化抗结核化疗方案的关键。目前,主要的结核病药敏试验有常被用作诊断耐药金标准的罗氏培养基比例法(L-J法),快速诊断耐药结核病的 Bactec MGIT 960检测系统法(简称“960法”)及快速、经济的微孔板Alamar blue显色法[最低抑菌浓度法(MIC法)],等等[5-6]。这些药敏试验方法在现阶段实验室均有应用,然而大量的文献表明其检测结果存在一定的差异,其中对乙胺丁醇(EMB)的符合率最低[7-10]。因此,笔者分别比较了L-J法、960法及MIC法检测结核分枝杆菌对于乙胺丁醇的药敏试验结果,并探讨其符合率低的缘由。
材料和方法
一、菌株来源及试剂
1.菌株来源: 126株结核分枝杆菌临床株及质控菌株H37Rv由中国疾病预防控制中心传染病预防控制所结核病室传代保存。
2.主要试剂:① EMB药物纯品,购自美国Sigma公司。② L-J法用改良罗氏培养基,按照《结核病诊断实验室检验规程》(下简称《规程》)配制[11]。③ Bactec MGIT 960 培养管及添加剂均由美国BD公司生产。④ Middlebrook 7H9培养基干粉、Middlebrook OADC(油酸、白蛋白、右旋糖和过氧化氢酶)购自美国BD公司。⑤ 阿尔玛蓝(Alamar blue)染料购自英国AbD Serotec公司,现配现用。⑥ McFarland标准比浊管由中国疾病预防控制中心传染病所结核室提供。
3. 主要仪器设备:① 培养基蒸汽凝固箱:北京新中大业仪表公司生产。② Bactec MGIT 960系统:美国BD公司生产。③ 培养箱:上海一恒科技有限公司生产。
二、检测方法
(一)培养基制备
(1) 改良罗氏培养基:按照《规程》进行,每组含2支不含药物的对照培养基和2支含EMB药物的试验培养基(终浓度2 μg/ml)。(2)Bactec MGIT 960 培养基每组2支MGIT 培养管,加入0.8 ml OADC增菌剂,一支为对照管,一支为含药管(EMB终浓度5 μg/ml)。(3) 7H9液体培养基每1000 ml由4.7 g 7H9干粉、2 ml甘油定容到900 ml蒸馏水中配制而成,于121 ℃高压灭菌10 min后置4 ℃保存,临用时加入100 ml OADC增菌剂。
(二)药敏试验
126株结核分枝杆菌分别用L-J法、960法、MIC法测试其对EMB的药物敏感性。
1.菌悬液制备:在磨菌瓶内加入1~2滴5%吐温-80,取菌龄2~3周的结核分枝杆菌新鲜培养物于磨菌瓶内,漩涡震荡后静置10~15 min,取上清加入生理盐水配成1个麦氏比浊浓度[3×108菌落形成单位(CFU)/ml]。L-J法中,菌液加生理盐水稀释至3×104CFU/ml和3×102CFU/ml;960法中,菌液稀释至0.5个麦氏浓度(1.5×108CFU/ml);MIC法中,按文献报道以1∶20用7H9培养基稀释菌液[12]。
2.接种、孵育、显色: ① L-J法:方法参照《规程》执行,对照培养基与含药培养基分别接种3×102CFU/ml 和3×104CFU/ml菌液,37 ℃培养28 d后观察结果。② 960法:分别取0.5 ml、1.5×108CFU/ml的菌液接种到对照管和含药管中,装入专用药敏架中,扫描,置Bactec MGIT 960系统内孵育(37 ℃)。③ MIC法:参照文献[10]和[13],在96孔板中每孔加入100 μl 7H9培养基,第1列再加入98 μl 7H9及2 μl EMB溶液(51.2 mg/ml),倍比稀释至第11列,得到从256~0.25 μg/ml的药物梯度,最后一列为空白对照;每株菌接种一行,每孔加入100 μl稀释菌液,每批次均做H37Rv为阴性对照;另做一块空白板(不含药),每孔加入100 μl 7H9培养基和100 μl 稀释菌液,每株菌加4个孔;微孔板用封口膜密封;37 ℃温箱孵育5 d。第6天开始在空白板每株菌的第1孔中加入70 μl显色剂(Alamar blue∶5%吐温-80=2∶5),隔天观察颜色变化情况,若颜色从蓝色变成紫红色或粉色,则在对应菌株的实验板中每孔加入显色剂显色;若未变色或变色程度浅,则继续在空白板的第2孔中加入显色剂,直至变色(或至第4孔)为止。
3.结果判读标准: ① L-J法:根据耐药百分比判别,耐药百分比=含药培养基上生长的菌落数/对照培养基上生长的菌落数×100%,若该比值大于1%,则判断耐药(R),若该比值小于1%,则判断为敏感(S)。② 960法:由Bactec MGIT 960系统根据生长单位指数统计,自动报告耐药与敏感结果,WHO推荐的临界浓度为5.0 μg/ml。③ MIC法: 药物MIC被定义为蓝色完全没有发生改变的孔所对应的药物浓度的最小值。耐药界定浓度为EMB≥5.0 μg/ml[13]。
三、质量控制
每批药敏试验均用结核分枝杆菌标准株H37Rv(ATCC 27294)作为敏感对照。
四、数据分析
试验数据采用SPSS 17.0软件进行分析处理。Kappa值在0.4~0.75为一致性较好,Kappa值≥0.75为一致性极好,Kappa值≤0.4时为一致性差[14]。
结 果
一、EMB采用3种药敏试验方法检测的结果
对126株结核分枝杆菌临床分离株进行EMB
的药敏试验检测,3种方法药敏试验结果均一致的菌株为95株,总体一致率为75.4%(95/126)。960法检测耐药的49株结核分枝杆菌分离株中,L-J法检测均为耐药,MIC法也仅1株检测为敏感(MIC值为4.0 μg/ml),其余均耐药。结果的不一致性主要表现为16株L-J法和MIC法检测为耐药而960法检测为敏感(51.6%,16/31)和13株菌株L-J法检测为耐药而960法和MIC法检测为敏感(41.9%,13/31)。在不同MIC值,3种方法药敏试验结果一致率最低的位于MIC值为4.0~16.0 μg/ml的浓度梯度,仅为59.7%(43/72);MIC值<4 μg/ml和>16.0 μg/ml的菌株中,3种方法一致率分别为94.7%(36/38)和100.0%(16/16),一致性较好,见表1。各MIC值所对应L-J法和960法的一致率差异,可见二法差异性集中体现的MIC值范围,见图1。
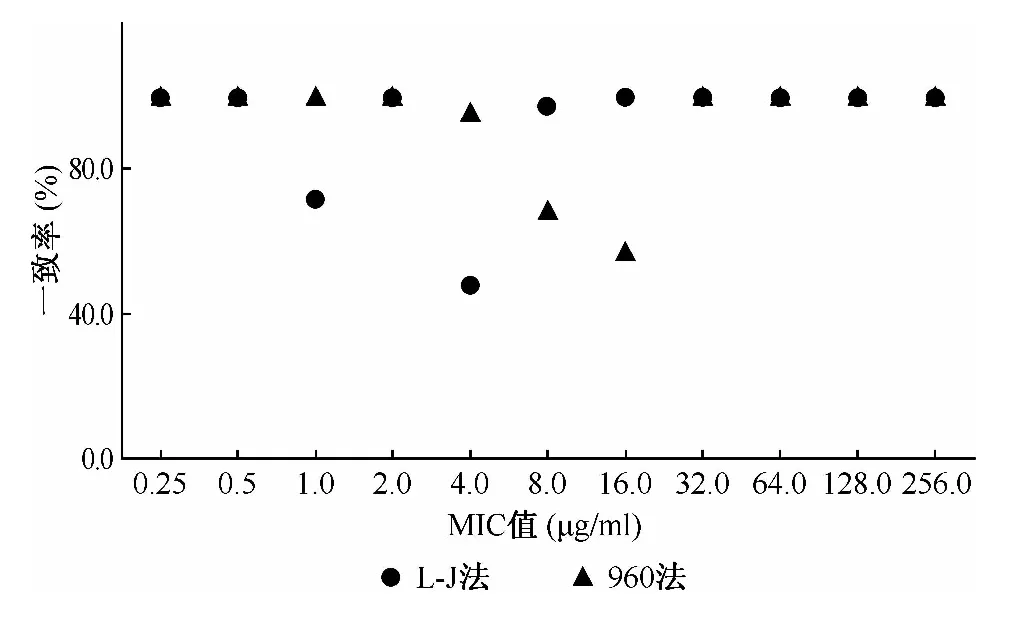
图1 EMB药敏试验各MIC值对应的L-J法和960法一致率
二、 EMB采用3种药敏试验方法检测结果的比较
若以L-J法测定结果为判断标准,则960法和MIC法的敏感度、特异度和一致率分别为62.8%(49/78)、100.0%(48/48)、77.0%(97/126)和82.1%(64/78)、97.9%(47/48)、88.1%(111/126)(表2)。若以960法测定结果为判断标准,则L-J法和MIC法的敏感度、特异度和一致率分别为100.0%(49/49)、62.3%(48/77)、77.0%(97/126)和98.0%(48/49)、77.9%(60/77)、85.7%(108/126)(表3)。若以MIC法测定耐药结果为判断标准,则L-J法和960法的敏感度、特异度和一致率分别为98.5% (64/65)、77.0%(47/61)、88.1%(111/126)和73.8%(48/65)、98.4%(60/61)、85.7%(108/126)(表4)。
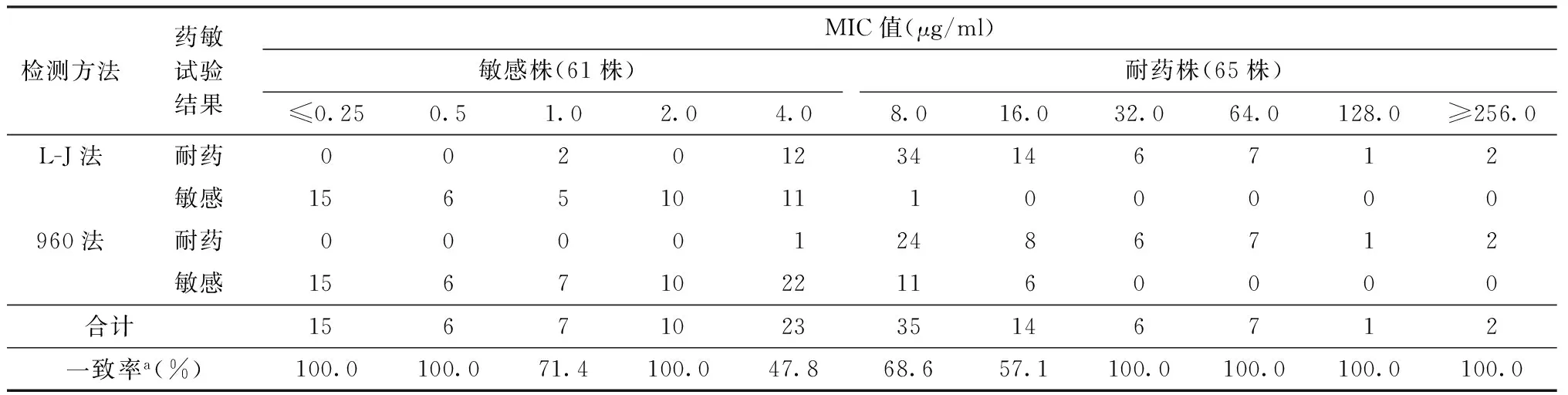
表1 L-J法和960法EMB药敏试验结果与MIC值比较(株)
注a:3种检测方法结果一致的比率
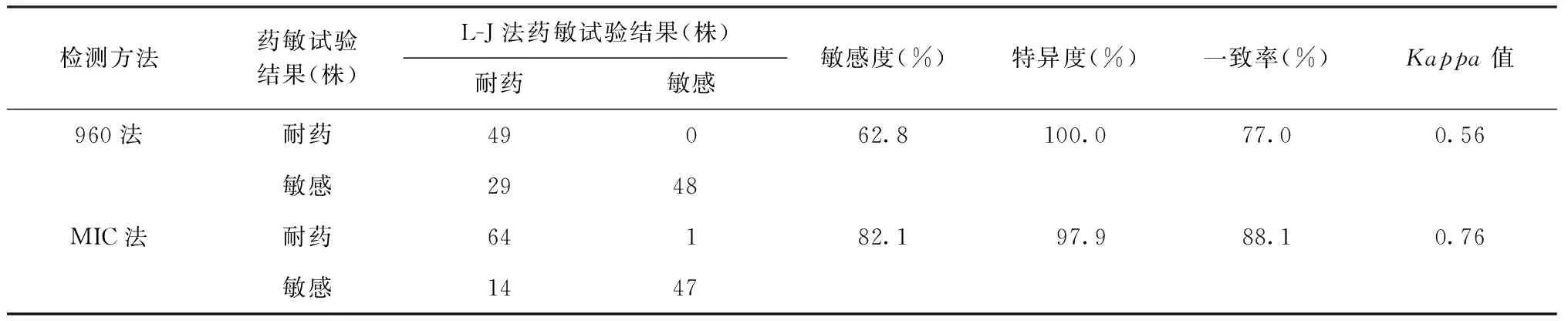
表2 960法和MIC法EMB药敏试验结果与L-J法结果比较

表3 L-J法和MIC法EMB药敏试验结果与960法结果比较
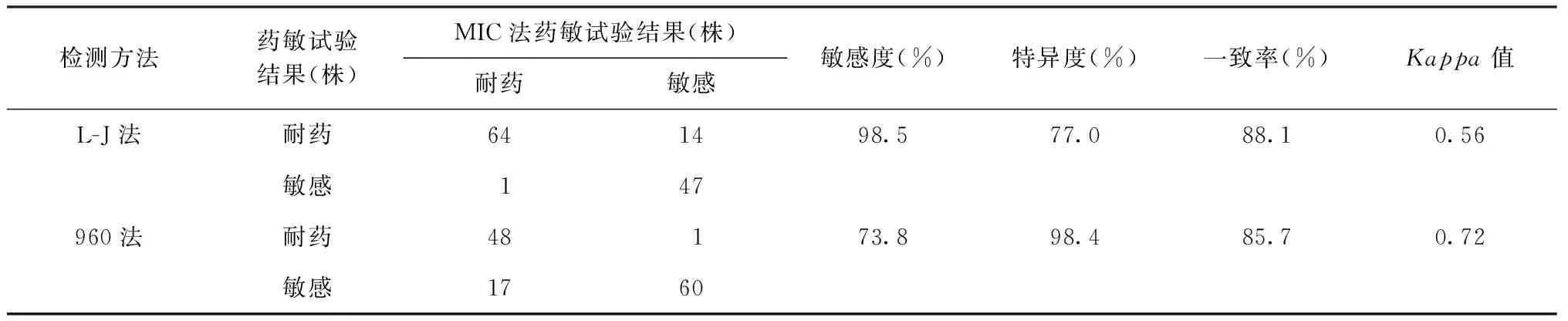
表4 L-J法和960法EMB药敏试验结果与MIC法结果比较
讨 论
快速、准确的结核分枝杆菌药敏试验是耐药结核病防控的首要条件。然而,传统药敏试验各方法检测结果的不一致性是各实验室无法避免的问题。从国内外大量文献报道中可知,检测一线抗结核药物中异烟肼和利福平药敏试验结果一致率不低于90%,而检测EMB的结果一致率常处于较低水平[8-9, 12]。
本研究结果显示:3种药敏方法结果的一致率为75.4%。MIC值<4.0 μg/ml和>16.0 μg/ml的菌株中,3种方法一致率分别为94.7%(36/38)和100.0%(16/16),均处于较高的水平,而MIC值4.0~16.0 μg/ml的72株菌中,仅43株药敏试验结果一致,一致率仅59.7%,提示结果不符合的情况主要发生于低浓度耐药的菌株中。两两比较中L-J法和960法一致率77.0%,而L-J法、960法均与MIC法的一致率在85.0%以上,此结果低于蔡杏珊等[15]的报道,比Krüüner等[8]报道的符合率稍高。尽管地域性和菌株耐药程度等差异存在,但国内相关报道通常样本量较小,耐药率较低,不足以说明EMB耐药性的实际情况。国外大样本量研究表明:EMB药敏试验结果不符的菌株,绝大部分显示L-J法检测为耐药而960法敏感[8],与本研究结果基本一致。本实验中L-J法检测为耐药而960法和MIC法检测为敏感的菌株有13株,占41.9%,同时,2株MIC值为1.0 μg/ml的菌株L-J法检测为耐药,提示L-J法检测结果耐药率偏高。此外,本研究中16株L-J法和MIC法检测为耐药而960法检测为敏感(16/31,51.6%),提示960法检测耐药率可能偏低。从MIC值梯度来看,不一致集中在4.0~16.0 μg/ml的药物浓度范围,其中14株MIC值16.0 μg/ml的菌株中,L-J法显示均为耐药,而960法检测6株为敏感,亦提示960法检测耐药率偏低,但由于菌株数量限制,需要更大样本量的研究来确认或解释此现象。
分析导致结果不一致的原因,首先可能与细菌对EMB的异质性耐药有关,即临床分离株中可含有耐药克隆和敏感克隆2种亚群,且研究认为,EMB耐药与菌株的基因突变有密切关联,而基因突变会降低菌株环境适应度[16],导致耐药株生长速率比敏感株要缓慢,罗氏培养基和液体培养基中耐药株比敏感株要晚2~10 d生长[8]。该假说可解释本研究中L-J法耐药率偏高或960法(或MIC法)耐药率偏低现象,即临床分离株中耐药克隆在L-J法中28 d后生长良好而报告阳性,而在960法和MIC法中(4~13 d)部分耐药克隆尚未生长而报告阴性。再者,L-J法耐药率偏高还可能与制备含药罗氏培养基中的高温加热步骤有关,而960法和MIC法中药物未经高温加热,且培养时间较短,不可控因素也相对减少,但此推测尚需进一步认证。此外,尽管960法与MIC法临界浓度都推荐使用5.0 μg/ml,但MIC法中的临界浓度5.0 μg/ml介于4.0~8.0 μg/ml中间,二者在MIC法读结果时只有一孔之差,在变色与不变色的判读中有人为因素及实验误差的存在[17];事实上,MIC值在4.0~5.0 μg/ml之间应判定为敏感而5.0~8.0 μg/ml之间应判定为耐药。本研究中MIC值处于临界浓度范围(4.0~8.0 μg/ml)的菌株中,3种方法一致率仅为60.3%(35/58),差异性也在一定程度上取决于此。但从表2~3可以看出,MIC法无论与L-J法还是960法比较Kappa值都在0.7以上,证明该因素在药敏试验检测结果的判定中影响甚微。
传统L-J法现在仍是WHO推荐的药敏检测方法,其简单、经济等优势明显,但耗时较久,且其制作流程中加热对于药物效价的影响等环节无法避免成为了其方法上的缺陷,在很多情况下无法满足临床的需要;960法现已越来越多地应用于实验室及医院的药敏检测,该法4~13 d即可自动出检测报告,敏感度和特异度较高,有利于患者的早期诊断和治疗,但检测成本较高是其无法应用于各基层实验室的重要原因;MIC法也有国内外多篇文献报道,该法虽对实验室人员的技术水平要求较高,但其凭借简便、敏感、快速、价廉(比L-J法略贵)等优势,正越来越多地应用于临床和科研的药敏检测。此外,探寻更适合临床乙胺丁醇耐药检测的新方法是接下来工作亟待解决的重要问题[18]。
[1] Aziz MA, Wright A, Laszlo A, et al. Epidemiology of antituberculosis drug resistance (the Global Project on Anti-tuberculosis Drug Resistance Surveillance): an updated analysis. Lancet, 2006, 368 (9553): 2142-2154.
[2] Wright A, Zignol M, Van Deun A, et al. Epidemiology of antituberculosis drug resistance 2002—07: an updated analysis of the Global Project on Anti-Tuberculosis Drug Resistance Surveillance. Lancet, 2009, 373 (9678): 1861-1873.
[3] 王胜芬, 赵冰, 宋媛媛, 等. 我国耐药结核病的危险因素——2007年全国结核病耐药基线调查资料分析. 中国防痨杂志, 2013, 35(4): 221-226.
[4] 肖和平. 抗结核药物的合理使用是控制耐药结核病流行的基石. 中华结核和呼吸杂志, 2014, 37(10):723-724.
[5] 唐神结.耐药结核病综合治疗的回顾与展望.结核病与肺部健康杂志,2014,3(3):141-147.
[6] 曾熙玲,初乃惠,刘志敏.耐药结核病辅助治疗的进展. 结核病与肺部健康杂志,2013,2(4):222-227.
[7] 马晓薇, 胡忠义, 王洁, 等. 噬菌体法与 BACTEC-960 检测结核分枝杆菌乙胺丁醇耐药性的比较研究. 中华内科杂志, 2005, 44 (3): 202-205.
[8] Krüüner A, Yates MD, Drobniewski FA. Evaluation of MGIT 960-based antimicrobial testing and determination of critical concentrations of first-and second-line antimicrobial drugs with drug-resistant clinical strains ofMycobacteriumtuberculosis. J Clin Microbiol, 2006, 44 (3): 811-818.
[9] Adjers-Koskela K, Katila ML. Susceptibility testing with the manual mycobacteria growth indicator tube (MGIT) and the MGIT 960 system provides rapid and reliable verification of multidrug-resistant tuberculosis. J Clin Microbiol, 2003, 41 (3): 1235-1239.
[10] 张楠, 胡继红, 赵秀芹, 等. 比例法药敏试验检测乙胺丁醇耐药适合药物浓度的初步探讨. 中国人兽共患病学报, 2009, 25(11): 1049-1053.
[11] 中国防痨协会基础专业委员会.结核病诊断实验室检验规程. 北京: 中国教育文化出版社,2006.
[12] Leonard B, Coronel J, Siedner M, et al. Inter-and intra-assay reproducibility of microplate Alamar blue assay results for isoniazid, rifampicin, ethambutol, streptomycin, ciprofloxacin, and capreomycin drug susceptibility testing ofMycobacteriumtuberculosis.J Clin Microbiol, 2008, 46 (10): 3526-3529.
[13] World Health Organization. Guidelines for surveillance of drug resistance in tuberculosis. Geneva:World Health Organization,2009.
[14] 李立明. 流行病学.5版.北京:人民卫生出版社,2003.
[15] 蔡杏珊, 张院良, 谭耀驹. 三种不同方法检测结核分枝杆菌药物敏感性分析. 国际医药卫生导报, 2010, 16 (9): 1092-1096.
[16] Mariam DH, Mengistu Y, Hoffner SE, et al. Effect ofrpoBmutations conferring rifampin resistance on fitness ofMycobacteriumtuberculosis. Antimicrob Agents Chemother, 2004, 48 (4): 1289-1294.
[17] Chauca JA, Palomino JC, Guerra H. Evaluation of the accuracy of the microplate Alamar Blue assay for rapid detection of MDR-TB in Peru. Int J Tuberc Lung Dis, 2007, 11 (7): 820-822.
[18] 程松,李园园,胡忠义,等. 基因测序检测embB基因诊断结核分枝杆菌乙胺丁醇耐药性的Meta分析. 中国防痨杂志, 2014,36(11): 958-965.
(本文编辑:王然 薛爱华)
Comparision on the detection effects of three methods forMycobacteriumtuberculosisethambutol sensitivity test
SUNQing*,ZHAOLi-li,CHENYan,ZHAOXiu-qin,WUYi-mou,WANKang-lin.
*PathogenicBiologyInstitute,UniversityofSouthChina,Hengyang421001,China
WANKang-lin,Email:wankanglin@icdc.cn;WUYi-mou,Email:yimouwu@sina.com
Objective To compare the detection effects and the accordance of three drug sensitivity test (DST) methods based on bacterial culture for testingMycobacteriumtuberculosis(M.tuberculosis) sensitivity to ethambutol (EMB). Methods One hundred and twenty-sixM.tuberculosisclinical isolates sensitivity to EMB were detected with three methods, including L-J proportion method, Bactec MGIT 960 system (960 system) and microplate Alamar blue assay (MIC assay), and their results were compared interactively. The test data were analyzed using SPSS 17.0 software. TheKappavalue between 0.4-0.75 represents moderately consistency, andKappavalue ≥0.75 shows excellent concordance, whereasKappavalue less than 0.4 means poor consistency. Results The EMB sensitivity of 126 clinicalM.tuberculosisisolates was tested by the three methods, the total consistency was 75.4%(95/126). If L-J proportion method was used as the standard control, the sensitivity, specificity and consistency of 960 system and MIC assay were 62.8% (49/78), 100.0% (48/48), 77.0% (97/126) and 82.1% (64/78), 97.9% (47/48), 88.1% (111/126), respectively. MIC method showed a better consistency with L-J proportion method (Kappa=0.76), while 960 system represented a moderate concordance with L-J method (Kappa=0.56). If 960 system were taken as the standard control, the sensitivity, specificity and consistency of 960 system and MIC assay were 100.0% (49/49), 62.3% (48/77), 77.0% (97/126) and 98.0% (48/49), 77.9% (60/77), 85.7% (108/126), respectively. Both L-J proportion method and MIC assay showed high consistency with 960 system (Kappa≥0.70). If MIC assay was set as the standard control, the sensitivity, specificity and consistency of L-J proportion method and 960 system were 98.5% (64/65), 77.0% (47/61), 88.1% (111/126), and 73.8% (48/65),98.4% (60/61), 85.7% (108/126), respectively. The inconsistency among the three methods exis-ted in the MIC value of the drug concentration range 4.0 to 16.0 μg/ml. Conclusion There were better consistency among the three detecting methods for testingM.tuberculosissensitivity to EMB, but in which discrepancies existed on a certain extent. The results between 960 system and MIC assay were superb consistent. The MIC assay is more cost-effective, and more suitable for early diagnosis ofM.tuberculosisresistance to EMB.
Mycobacteriumtuberculosis; Ethambutol; Microbial sensitivity tests
10.3969/j.issn.1000-6621.2015.04.008
国家自然科学基金(81201348);“十二五”国家科技重大专项(2013ZX10003002-001)
421001 衡阳,南华大学病原生物学研究所[孙庆、吴移谋、万康林(特聘教授)];中国疾病预防控制中心传染病预防控制所 传染病预防控制国家重点实验室 [孙庆(联合培养研究生)、赵丽丽、陈燕、赵秀芹、万康林];杭州感染性疾病诊治协同创新中心[赵丽丽、陈燕、赵秀芹、万康林(均为特聘研究人员)]
万康林, Email:wankanglin@icdc.cn;吴移谋, Email:yimouwu@sina.com
2014-11-27)
