丙酮丁醇梭菌的基因编辑工具及代谢工程改造
2019-10-12杜广庆
薛 闯,杜广庆
(大连理工大学 生物工程学院,辽宁 大连 116023)
1 丙酮丁醇梭菌发酵
丙酮丁醇梭菌是严格厌氧的革兰阳性菌,可以利用多种五碳糖和六碳糖作为碳源生产有机溶剂,包括丙酮、丁醇和乙醇,是目前研究最为广泛的用于丁醇生产的工业微生物[1]。丁醇是一种重要的化工原料,也是极具潜力的可以替代石油的新型生物燃料[2]。生物丁醇的生产原料和生产工艺与乙醇相近,但是与乙醇相比,丁醇具有更明显的优势。例如,丁醇具有与汽油相近的高能量密度,蒸汽压低,腐蚀性小,与汽油混合时对水的宽容度大,并且能够与汽油以更高的混合比混合,还可直接用于未经改造的汽车发动机等,这些优势在能源利用上都具有重大意义[3]。近年来,由于石油价格波动和人们对环境污染问题的重视,以石油为原料生产丁醇的成本日趋增加,弊端也愈加凸显,使得通过微生物发酵生产丁醇的方法重新受到关注[4]。微生物法生产丁醇主要是通过丙酮-丁醇-乙醇(ABE)发酵法生产,发酵菌株主要包括丙酮丁醇梭菌(Clostrdiumacetobutylicum)、拜氏梭菌(C.beijerinckii)、糖丁酸梭菌(C.saccharobutylicum)和糖乙酸多丁醇梭菌(C.saccharoperbutylacetonicum)[5-8]。目前,ABE发酵生产丁醇的主要问题是丁醇对梭菌细胞具有毒性抑制作用,使得发酵过程的产物浓度很低,进而导致后期的分离成本偏高,因此需要对现有的菌株进行改造来满足工业化生产的需求[9]。丙酮丁醇梭菌ATCC 824作为丁醇生产的模式菌株,基因组已经于2001年测序完成,其基因组由3 940 kb组成,并含有一个192 kb的大质粒pSOL[10]。随着基因组学和基因编辑技术的发展,丙酮丁醇梭菌基本的生理和代谢过程已经被揭示,通过基因编辑和代谢工程来提高丙酮丁醇梭菌的发酵性能(丁醇浓度,得率和生产强度)成为当前的研究热点。本文对当前可用于丙酮丁醇梭菌分子改造的基因编辑工具进行了总结,并概述了利用基因编辑提高丙酮丁醇梭菌发酵性能的研究进展。
2 丙酮丁醇梭菌基因编辑工具
丙酮丁醇梭菌作为重要化学品和重要生物燃料丁醇的主要生产菌,受到学术界的广泛关注。为实现生物丁醇产业化,对丙酮丁醇梭菌进行菌株改造是一项重要工作。近年来,随着基因编辑技术的发展,越来越多的基因编辑工具应用于丙酮丁醇梭菌的分子改造过程。
1996年,Green等[11-13]利用自杀质粒同源重组的方法,成功敲除了梭菌中的aad、pta、buk和solR基因。但是,这种方法的转化率和重组效率很低,因此没有应用到后续的研究中。1999年,Desai 和Papoutsakis利用反义RNA技术弱化丙酮丁醇梭菌中buk和ptb基因的表达,使得buk编码的丁酸激酶和ptb编码的磷酸丁酰转移酶活性分别下降了85%和70%[14]。2002年,基于复制型同源重组实现基因敲除的方法得到发展,由于复制型质粒在细胞中可以复制,增加了同源重组的概率,从而提高了转化成功率,该方法成功用于spo0A基因的敲除[15]。2007年,基于II型内含子的基因失活技术迅速发展,该方法的基本原理是位于乳酸菌ltrB基因的内含子可在特定宿主中表达,然后通过自剪切脱离mRNA前体,与辅助蛋白LtrA结合后可识别并插入DNA的靶标序列,然后反转录合成互补链,进而以双链DNA形式插入靶向位点,从而实现基因的插入型失活[16]。Minton教授团队和姜卫红研究员团队分别构建了适用于梭菌的内含子插入型基因失活质粒pMTL007和pSY6,在丙酮丁醇梭菌的分子改造中得到广泛的应用[17-18]。II型内含子基因失活技术虽然存在一定的局限性(需要靶标DNA插入位点具有特定的结构,并且内含子可能插入非靶点基因,只适用于基因的插入失活,不能用于缺失型失活),但是由于该方法操作简单,转化率高,内含子片段插入目的基因的成功率高,使其仍然是丙酮丁醇梭菌中应用最为广泛的基因编辑工具。基于CRISPR-Cas9系统的基因编辑技术是近年来迅速发展的一系列基因编辑手段,由sgRNA引导,并通过Cas9、Cas9n及dCas9蛋白对基因组进行编辑或干预转录,广泛应用于生物工程和生物医学方面[19-20]。2016年,Li等[21]成功地利用CRISPR-Cas9技术将pyrE、adc和agrA基因中的20 bp片段分别更换为EcoRV、EcoRV和PstI限制性内切酶识别序列,实现基因功能的缺失。Wasels等[22]将编码Cas9蛋白的序列和gRNA序列分别连接到两个不同的载体上,其中Cas9蛋白编码序列源自于酿脓链球菌并经过密码子优化,使用脱水四环素诱导启动子表达,实现了在基因组上的单碱基替换、基因敲除和大片段的插入。目前为止,并没有其他研究报道CRISPR-Cas9在丙酮丁醇梭菌的应用,主要原因是相对于II型内含子基因敲除技术,CRISPR-Cas9更多地应用于真核生物中,在丙酮丁醇梭菌中的转化率很低。
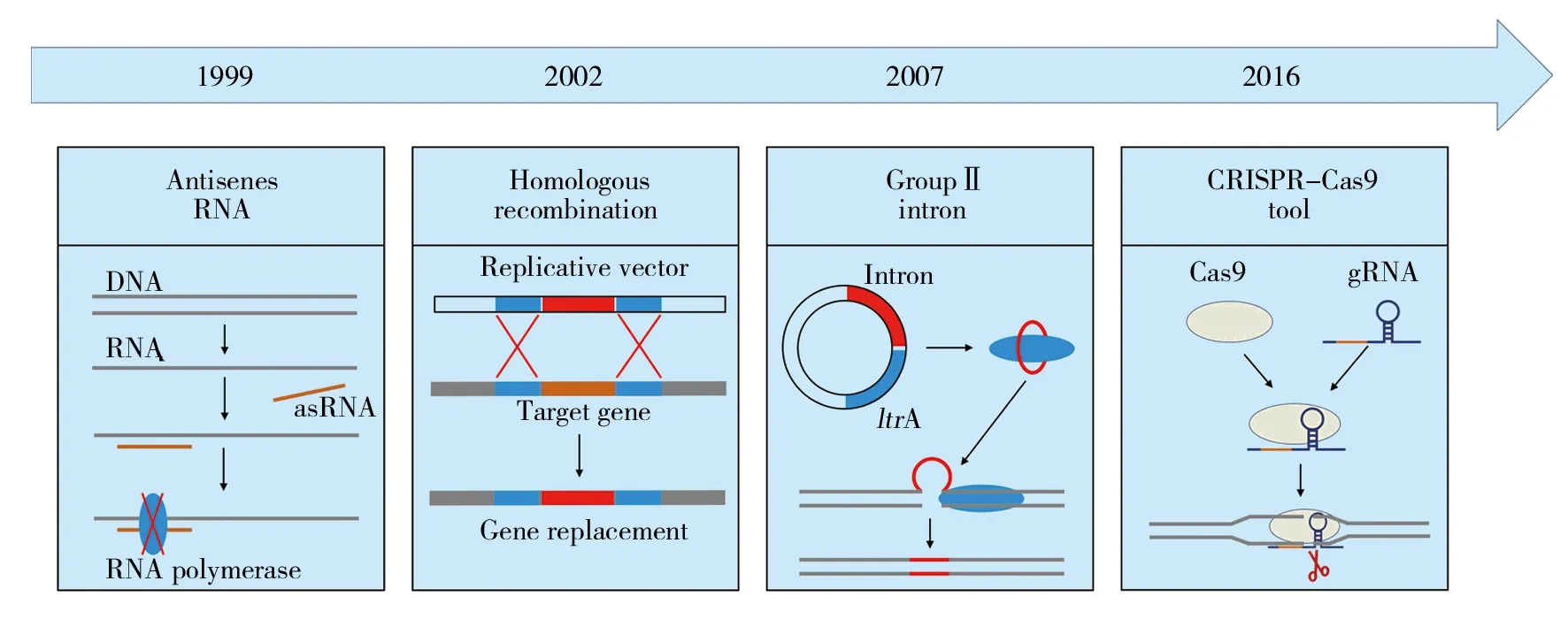
图1 丙酮丁醇梭菌基因编辑工具的发展Fig.1 Development of genome editing tools for Clostridium acetobutylicum
3 丙酮丁醇梭菌的代谢工程改造
3.1 碳代谢途径
在ABE发酵中,丙酮丁醇梭菌最常用的碳源为葡萄糖,可以将葡萄糖通过糖酵解途径转化为丙酮酸,然后丙酮酸通过中心碳代谢途径转化为有机酸和ABE溶剂。目前,对丙酮丁醇梭菌糖酵解途径的基因研究较少,Ventura等[23]通过在丙酮丁醇梭菌ATCC 824中同时过表达糖酵解途径的6-磷酸果糖激酶基因pfkA和丙酮酸激酶基因pykA,提高了细胞内ATP和NADH的浓度和细胞对丁醇的胁迫耐性,从而使丁醇的产量提高了29.4%,在后续批次补料发酵过程中丁醇浓度可达到19.1 g/L。
木质纤维素是自然界中最丰富的生物质资源,主要由纤维素、半纤维素和木质素组成,其水解产物主要有六碳葡萄糖和五碳木糖及阿拉伯糖[24]。在微生物发酵过程中能否利用纤维素水解后的混合糖是衡量发酵性能的一个重要指标,丙酮丁醇梭菌在发酵过程中虽然可以利用五碳糖中的木糖和阿拉伯糖,但是存在严重的碳分解代谢物阻遏作用(CCR),即在混合糖发酵过程中优先利用葡萄糖,并抑制其他碳源代谢相关的基因表达[25]。Gu等[26]在丙酮丁醇梭菌中过表达大肠埃希菌中的转醛缩酶基因talA,改造菌株824-TAL在以木糖或以葡萄糖、木糖的混合糖为碳源的发酵中,木糖利用率和产溶剂能力均显著提高。Ren等[27]发现分解代谢物控制蛋白CcpA与丙酮丁醇梭菌中的CCR效应相关,失活CcpA的突变菌株824ccpA可以有效解除CCR效应,同时利用混合糖中的葡萄糖和木糖,发酵终点丁醇浓度可以达到12.1 g/L。在后续研究中,Wu等[28]发现CcpA蛋白中第302位的缬氨酸是其行使蛋白功能的关键氨基酸,将该氨基酸替换为精氨酸后CCR效应减弱,木糖利用率提高,同时,组成sol操纵子的3个基因ctfA、ctfB和adhE1表达均上调。Bruder等[29]进一步阐述了CcpA的作用机制,CcpA蛋白复合体可结合到木糖代谢基因上游的CRE序列,抑制其表达,通过表达不含有CRE序列的木糖代谢基因可以将木糖的利用率提高7.5倍。Xiao等[30]发现参与磷酸葡萄糖转移酶系统(PTS)的GlcG也与CCR效应相关,失活GlcG后的菌株在有葡萄糖存在的发酵条件下,可以同时利用木糖和阿拉伯糖,通过在GlcG失活菌株中过表达木糖代谢途径的限速酶基因xylA、xylB和xylT,突变菌株对木糖和阿拉伯糖的利用率进一步提高。Jin等[31]在丙酮丁醇梭菌ATCC 824中过表达磷酸戊糖途径中的4个关键酶基因,包括转酮酶基因tal、转醛酶基因tkl、核糖-5-磷酸异构酶基因rpe和核酮糖-5-磷酸差向异构酶基因rpi,提高了菌株对木糖的利用率,溶剂产量相对于野生菌株提高了42%。这些研究表明,丙酮丁醇梭菌经过改造,可以实现同时利用木质纤维素中的六碳糖和五碳糖,这是促进ABE发酵实现工业化的一个重要方面。
3.2 中心代谢途径
ABE发酵过程主要包括两个阶段:产酸期和产溶剂期。产酸期主要生产乙酸和丁酸。在产溶剂期,产酸期合成的乙酸和丁酸被重吸收用于合成丙酮、乙醇和丁醇[32]。直接对产酸和产溶剂途径的基因进行改造是调控溶剂合成最简单有效的方式。由ctfA、ctfB和adhE1基因组成的sol操纵子,直接负责丙酮丁醇梭菌中丁醇的合成,敲除其中任何一个基因,均造成丁醇产量显著降低,乙酸和丁酸产量提高[33-35]。Mermelstein等[36]过表达由adc、ctfA和ctfB组成的ace操纵子,丙酮、丁醇和乙醇的产量与野生菌株相比分别提高了95%、37%和90%。Sillers等使用ptb强启动子过表达adhE1基因,下调CoAT表达,在提高丁醇和乙醇产量的同时,降低了副产物丙酮的产量,最终总溶剂浓度达到30 g/L[37]。与丁醇合成直接相关的编码醇醛脱氢酶的其他基因还包括adhE2、bdhA、bdhB和cap0059。阻断adhE2、bdhA和bdhB基因表达对丙酮丁醇梭菌的发酵产物没有显著影响,而阻断cap0059基因表达,乙酸和丁酸产量降低,丁醇产量提高,其机理尚未明确[33]。由于有机酸积累会抑制菌株生长和ABE合成,一些研究通过阻断有机酸合成途径来调控溶剂代谢。Cooksley等[33]阻断ack基因表达,乙酸产量降低,丁醇产量提高了23%,浓度达到8.6 g/L,而阻断丁酸合成途径基因ptb的表达,只有微量的丙酮和丁醇产量合成,同时乙醇产量大幅度提高。Jang等[34]阻断有机酸代谢途径基因pta、ptb和buk的表达,丁醇产量分别提高了46%、18%和22%,浓度分别达到了17.2、13.9和15.2 g/L。这些研究均表明阻断有机酸的合成有利于丙酮丁醇梭菌的产溶剂代谢过程[38]。
丙酮是ABE发酵生产丁醇过程中最主要的副产物,消除副产物丙酮有利于提高丁醇的得率。丙酮合成途径对碳源利用和有机酸重吸收有重要作用,直接阻断adc基因的表达,有机酸重吸收过程被抑制,造成有机酸积累,丁醇产量降低[39]。Jiang等[40]在阻断adc基因表达后,通过添加CaCO3和甲基紫精,在丙酮产量维持在微量的前提下,丁醇产量恢复到野生菌水平,同时乙酸浓度降低,最终丁醇在总溶剂中的比例提高至82%。可见,通过对代谢途径基因进行改造,可以有效提高丁醇的比例和产量。然而,虽然通过外源添加CaCO3和甲基紫精可以弥补adc敲除菌丁醇产量降低的缺陷,但是由于添加物的成本问题,不利于丁醇的工业化生产。Liu等[41]通过异源表达枯草芽胞杆菌中的乙偶姻合成途径基因alsD和2,3-丁二醇合成途径基因bdhA,在不改变丙酮合成途径的前提下,将丙酮浓度降低到0.3 g/L,丁醇浓度从11.4 g/L提高到12.1 g/L,同时2,3-丁二醇浓度可以达到7.2 g/L,为减少副产物丙酮的合成提供了新思路。
3.3 丁醇胁迫耐性
ABE发酵终点丁醇浓度难以提高的一个限制性因素,是丁醇对细胞的毒害作用使得梭菌对丁醇的耐受浓度不到2%,主要原因包括丁醇进入膜后会改变细胞膜的流动性,降低了细胞内的ATP浓度,影响了细胞对葡萄糖的吸收,因此提高发酵菌株对丁醇的胁迫耐性是提高丁醇产量的一个重要策略[42]。细胞膜的流动性与饱和脂肪酸和不饱和脂肪酸的比例相关,在ABE发酵过程中,随着发酵产物丁醇浓度的增高,或者外源添加丁醇,细胞膜中饱和脂肪酸和不饱和脂肪酸的比例均会提高[43]。Zhao等[44]在丙酮丁醇梭菌ATCC 824中过表达环丙烷脂肪酸合酶基因cfa,改造菌对丁醇的耐受性大大提高,但是丁醇的产量降低。Bui等在含有丁醇合成途径的大肠埃希菌中过表达参与脂肪酸合成的FabD编码基因,提高了大肠埃希菌对丁醇的耐受性。虽然调控脂肪酸代谢基因的表达可以改善菌株对丁醇的耐受性,但是并不能提高丁醇产量[45]。丙酮丁醇梭菌响应丁醇胁迫的另一种方式是表达热激蛋白,Tomas等[46]通过过表达热激蛋白编码基因groESL,总溶剂浓度相对于野生菌株提高了40%。Zingaro和Papoutsakis发现在1%丁醇胁迫条件下,过表达groESL的改造菌株在固体培养基中培养时,菌落数相对于野生型菌株增加了4倍[47]。在大肠埃希菌中异源表达丙酮丁醇梭菌的groESL基因,同样可以提高菌株的丁醇胁迫耐性[48]。这些研究说明热激蛋白GroESL不但与丙酮丁醇梭菌对丁醇的胁迫耐性相关,还参与调控丁醇的合成代谢。此外,Mann等[49]发现过表达热激蛋白编码基因grpE和htpG,菌株对丁醇的耐受性提高,但是丁醇产量没有显著变化,说明提高菌株对丁醇的胁迫耐性和提高丁醇产量并没有必然的联系。
3.4 孢子分化
丙酮丁醇梭菌是严格厌氧的革兰阳性菌,在发酵过程中会分化出孢子,由于形成孢子的细胞不再具有溶剂代谢能力,阻断孢子形成过程将有利于丁醇的生产[50]。Spo0A是丙酮丁醇梭菌中最重要的转录调控因子,Spo0A磷酸化后可启动孢子形成,并同时启动溶剂化形成[51]。Harris等[52]发现失活Spo0A的突变菌株SKO1基本不产溶剂,也不形成孢子,而过表达Spo0A编码基因可加速孢子形成,诱导产溶剂相关基因提前表达,并提高胁迫耐性相关基因的表达,但是丁醇产量并没有提高。后续研究集中于控制孢子形成的sigma因子和其他一些调控因子,以达到阻断孢子分化且不影响丁醇合成的目的。Jones等[53]通过失活σF将孢子周期阻滞在细胞不对称分裂之前,并将丁醇产量维持在野生型菌株水平。Tracy等[54]构建了σE和σG失活菌株,均有效地阻断了孢子分化过程,且不影响溶剂合成,但是丁醇产量并没有提高。Scotcher等[55]通过RNA干扰技术下调spoIIE基因的表达,延迟了孢子形成,并使丙酮、丁醇和乙醇的浓度相对于对照菌株分别提高了43%、110%和225%,说明可以通过抑制孢子形成进程来提高丁醇产量。解除孢子和溶剂合成关联的另一个方法是以缺失大质粒pSOL1的菌株(既不产孢子,也不合成溶剂)为出发菌,过表达丁醇合成途径基因aad,使得缺失pSOL1的菌株可以合成与野生菌株等量的丁醇,而且由于丙酮合成途径基因adc也在pSOL1上,该菌株可以在保持丁醇产量的前提下,不产生孢子,也不生产副产物丙酮,具有一定的优越性[56]。虽然这些研究均成功地抑制了孢子生成,但是丁醇浓度均不超过12 g/L,仍然是ABE发酵最大的瓶颈。
由于通过改造受Spo0A调控的Sigma因子虽然可以阻断孢子合成,但是并不能提高菌株的产溶剂能力,一些研究便开始集中于对Spo0A上游基因进行调控。由于Spo0A磷酸化后才能调控下游基因表达,Steiner等[57]研究了Spo0A的磷酸化途径,发现组氨酸激酶Cac3319、Cac0323和Cac0903参与Spo0A磷酸化,Cac0437参与Spo0A的去磷酸化,通过失活Cac3319、Cac0323和Cac0903,孢子数量分别减少至野生菌的1%、4%和5%,而失活Cac0437,孢子数量增加了30倍,说明可以通过组氨酸激酶实现Spo0A磷酸化水平的调控,进一步调控孢子周期,但是该研究并未报道组氨酸激酶与丁醇合成的关系。然而,由于Spo0A直接参与溶剂合成的调控,Spo0A磷酸化水平的改变也被推测有可能调控丁醇合成。Xu等[58]通过比对经过驯化的高产丁醇菌株JB 200(可合成丁醇~20 g/L)和出发菌株ATCC 55025的基因组发现,JB 200的组氨酸激酶Cac3319丢失一个氨基酸造成移码突变,并经研究表明通过II型内含子基因敲除技术失活Cac3319后的突变菌株HKKO在ABE发酵中的丁醇浓度可以达到18.2 g/L,与JB 200基本接近,且对丁醇的胁迫耐性提高。Herman等[59]发现敲除多酮类物质合成基因pks,可以抑制淀粉粒合成和孢子形成,同时提高丁醇产量。虽然该研究并未揭示其内在机理,但是敲除pks和cac3319得到了类似的实验结果,说明两者可能存在内在关联。总之,通过改造Spo0A上游基因来实现对Spo0A磷酸化水平的精密调控,为同时提高ABE各项发酵性能提供了新的思路。
4 代谢工程改造存在问题
丙酮丁醇梭菌作为丁醇的主要生产菌株,丁醇产量相对较高,但是由于需要在厌氧条件下培养,其分子操作过程会更加繁琐。Dong等[60]通过失活响应氧胁迫的抗性基因cac2634,提高了梭菌细胞的耐氧能力,并可实现在空气中进行转化操作,但是其转化率要低于厌氧操作条件,说明空气中的氧气对菌株的存活仍然有负面作用。丙酮丁醇梭菌中存在Cac824I二型限制修饰系统,可以降解外源DNA入侵,保护自身DNA不被破坏,增加了丙酮丁醇梭菌基因改造的难度[61]。为了解决这一问题,Mermelstein等[62]利用含有枯草芽胞杆菌噬菌体Ф3TI甲基化酶的pAN1质粒对需要转化的质粒进行甲基化修饰,可以防止外源质粒被降解,实现质粒的成功转化,但是甲基化修饰延长了分子操作时间。Dong等[63]尝试在丙酮丁醇梭菌中阻断二型限制性内切酶基因cac1502的表达,成功解除了限制修饰系统的限制,使外源DNA无需甲基化即可转入梭菌中,这种方法也应用到后续的一些研究中。
迄今为止,用于梭菌的基因编辑技术主要有五种,其中基因敲除技术如自杀质粒基因敲除,反义RNA干扰和复制型质粒同源重组操作过程繁琐且转化率不高,而应用最为广泛的II型内含子基因敲除技术只能通过插入内含子片段阻断基因表达,并不能保证基因功能完全丧失。基于CRISPR-cas9系统的基因编辑技术虽然可以实现基因的整段删除、替换和抑制表达等,但是在丙酮丁醇梭菌中的应用案例较少,基因操作不成熟,转化率不高。可见,对丙酮丁醇梭菌的基因改造仍需要更简单高效的基因编辑工具。
近年来,研究学者为了提高丙酮丁醇梭菌的发酵性能,构建了很多性能优良的发酵菌株,旨在提高发酵菌株的丁醇产量、丁醇在总溶剂中的比例以及丁醇的胁迫耐性,缩短发酵时间,阻断孢子周期,使发酵菌株可在长时间连续培养模式中持续合成丁醇。但是由于缺乏对丙酮丁醇梭菌生理特性及整个ABE代谢过程的理解,丁醇产量始终不能大幅度提高,或者只能提高菌株的部分性能,例如阻断孢子形成的菌株,丁醇产量均不超过~12 g/L,丁醇的生产强度不超过0.12 g/L/h,而对代谢途径基因进行改造,丁醇产量可以提高至~18 g/L,但是由于孢子分化的影响,不能连续培养,这些均限制了实现丁醇的工业化生产。而且,通过对丙酮丁醇梭菌进行各种定向的分子改造,所得突变菌株所能合成的最高丁醇浓度,均未能达到化学诱变菌株拜氏梭菌BA 101和驯化菌株丙酮丁醇梭菌JB 200发酵生产的丁醇浓度(~20 g/L)[64-65]。
5 展 望
迄今为止,通过ABE发酵生产生物丁醇已经有100多年的历史,由于原料价格高,丁醇转化率低以及丁醇生产强度低,制约了丁醇发酵产业的发展。伴随分子生物学技术的快速发展,丙酮丁醇梭菌的分子遗传改造取得了很大进步,并且随着代谢网络模型、系统代谢工程、转录组学和蛋白质组学的快速发展,丙酮丁醇梭菌的生理特性和代谢机理也被进一步揭示。今后对丙酮丁醇梭菌研究的重点将集中于以下几个方面:①丙酮丁醇梭菌中有35个组氨酸激酶,目前只有参与Spo0A磷酸化和去磷酸化的5个组氨酸激酶功能被揭示,而其他组氨酸激酶的功能尚不明确,仍需研究丙酮丁醇梭菌中组氨酸激酶参与的双组分系统功能,以及组氨酸激酶如何参与细菌中的细胞分裂、鞭毛运动、群体效应、孢子分化和产物代谢等多个过程,对这些组氨酸激酶进行系统研究将对了解丙酮丁醇梭菌的生理特性和代谢调控具有重要指导意义;②深入研究Spo0A对孢子分化和溶剂形成的作用机制,进一步研究如何通过调控Spo0A的转录水平和磷酸化水平来有选择性的抑制孢子分化,促进丁醇合成;③优化发酵工艺,提高梭菌细胞活性、培养密度和对丁醇的耐受性,使得梭菌细胞可以在长时间的连续发酵中不自溶、不退化;④直接利用纤维素原料生产丁醇,丙酮丁醇梭菌中存在降解纤维素的纤维小体,但是活性很低,不能直接利用纤维素原料,通过合成生物学的方法提高丙酮丁醇梭菌降解纤维素的活性,将极大地降低原料成本,提高ABE发酵生产丁醇的经济性。
总之,通过系统调控丙酮丁醇梭菌的生理和代谢,使其可以持续地将碳源转化为丁醇,从而使微生物发酵生产生物丁醇实现工业化。丁醇作为理想的石油替代品或者添加剂,随着ABE发酵上游基因改造和下游过程工程技术的完善,将在生物燃料市场中发挥重要作用。
