结核性脑膜炎临床分离株表型耐药特点及其治疗效果研究
2015-05-20王婷赵雁林逄宇冯国栋宋媛媛欧喜超彭晋湘赵钢战丽萍
王婷 赵雁林 逄宇 冯国栋 宋媛媛 欧喜超 彭晋湘 赵钢 战丽萍
·论著·
结核性脑膜炎临床分离株表型耐药特点及其治疗效果研究
王婷 赵雁林 逄宇 冯国栋 宋媛媛 欧喜超 彭晋湘 赵钢 战丽萍
目的 研究分析结核性脑膜炎(tuberculous meningitis, TBM)的致病菌对抗结核药的耐药特点及抗结核药对致病菌的治疗效果。方法 500例疑似TBM患者脑脊液标本经MGIT(mycobacteria growth indicator tube)960液体培养出25株临床分离株,再用16S rRNA基因测序法进行菌种鉴定。继而对这25株结核分枝杆菌临床分离株分别进行14种抗结核药物的MGIT 960液体药敏试验和12种抗结核药物的传统比例法固体药敏试验、16种抗结核药物的最低抑菌浓度(MIC)测定。通过计算血药浓度峰值(Cmax)/MIC值的大小来判断药物对菌株杀菌率的高低,并由此推断药物对该致病菌的治疗效果。结果 液体药敏试验结果和固体药敏试验结果均显示了任意耐药的TBM临床分离株有13株(13/25), 耐多药的TBM临床分离株有3株(3/25);利福平、莫西沙星、左氧氟沙星、氯法齐明、对氨基水杨酸的Cmax/MIC值分别为19.880、63.333、19.149、75.000、50.855。结论 莫西沙星、氯法齐明、对氨基水杨酸、左氧氟沙星、利福平的Cmax/MIC值较高,提示临床上使用高剂量利福平和氟喹诺酮类药物联合治疗TBM可以提高疗效;对氨基水杨酸和氯法齐明对耐多药TBM临床分离株可能有较好效果。
结核, 脑膜/药物疗法; 表型; 微生物敏感性试验; 治疗结果
截至2011年,全球耐多药结核病(MDR-TB)已出现310 000例,耐多药结核性脑膜炎(MDR-TBM)也相继出现报道[1],全世界约有200万例潜伏感染患者并可能复发,成为结核病防治的重大难题之一[2]。中枢神经系统Mtb感染占肺外结核的5%,其中结核性脑膜炎(tuberculous meningitis, TBM)危害最严重。耐药结核病的出现降低了现有标准治疗方案的效果,亟需精确的药物敏感性试验(简称“药敏试验”)数据来实施个体化的治疗。抗结核药物最低抑菌浓度(minimum inhibitory concentration, MIC) 能精细地反映Mtb的耐药程度,对治疗MDR-TB具有重要价值。MIC值的测定也是筛选新抗结核药物的重要环节[3]。以前Mtb药敏试验标准临界浓度的设置有所不同。1963年,Canetti 等[4]注意到Mtb菌群具有不均一性,每个培养的野生型Mtb菌落可能含有很小比例(<1%)的耐药菌株。研究人员根据这1%比例的耐药突变,制定了标准的临界药物浓度以区分敏感和耐药菌株,此后确定了一线抗结核药物的体外药敏试验临界值并沿用至今[5],后来又陆续制定出二线抗结核药物药敏试验的临界浓度。目前,大部分抗结核药物的临界浓度和临床治疗结果之间并没有清晰的对应关系[6]。MIC快速检测方法药敏试验临界值的设置是通过与传统检测方法相对比,绘制受试者工作特征曲线(receiver operating characteristic curves,ROC) 来得到一个与传统方法符合率最高的临界值[7]。这种临界值的确定既缺乏足够的样本量,又常忽略Mtb菌群差异对临界值的影响。因此,建立规范、有效的Mtb药敏试验MIC的检测方法及设置有效的临界值,对于结核病个体化治疗、快速耐药检测方法的研究和新型抗结核药物筛选等领域具有重要意义,也是控制MDR-TB产生和传播的关键。而大部分抗结核药物均属于浓度依赖型抗生素,其杀灭致病菌的效果主要取决于血药浓度峰值(Cmax)与MIC的比值[8]。因此,笔者就TBM致病菌对抗结核药物的表型耐药、MIC及其临界值的特点做了初步研究。并通过计算Cmax/MIC值的大小来研究抗结核药物对菌株的杀菌率,并由此推断药物对该致病菌的治疗效果,以了解TBM的致病菌对抗结核药物的耐药特点及抗结核药物对致病菌的治疗效果。
材料和方法
一、一般资料
1. 菌株获取:本实验从2010年7月至2011年6月收集了500例疑似TBM患者的脑脊液标本,这些患者来自全国22家大中型医院。所选TBM患者的诊断标准均参照2009年5月南非国际结核性脑膜炎大会制定的临床诊断标准执行[9]。所有纳入患者HIV检测为阴性,并做了MGIT 960液体培养。有25例患者培养阳性,包括男8例,女17例,年龄范围3~82岁,平均年龄(35.68±23.36)岁,以H37Rv标准株(ATCC25177,来自国家参比实验室)作为药敏试验标准对照菌株。25株临床分离株均经PCR基因测序法鉴定为Mtb[10]。菌株均保存在-70 ℃,然后在37 ℃固体培养基上复苏2~3个星期。该研究所纳入的患者均已签署知情同意书,并得到西京医院伦理委员会的批准。
2. 诊断标准:500例疑似TBM患者至少同时符合以下3个诊断标准:(1)发热、头痛、呕吐、颈项强直;(2)脑脊液细胞增多,以白细胞和单核细胞为主,糖含量降低,蛋白含量增高,且没有其他致病菌感染;(3)影像学显示脑栓塞或脑积液,或有粟粒型肺结核。
3. 试剂和仪器:L-J固体培养基依据《结核病诊断实验室检验规程》[11]由国家参比实验室统一制备。全自动Bactec MGITTM960TB系统(美国BD公司生产),Middlebrook 7H9干粉和油酸、白蛋白、右旋糖和过氧化氢酶(OADC)培养液(美国BD公司生产);Alamar blue购自英国AbD Serotec公司;灭菌96孔板购自美国Corning公司;药品均购自美国Sigma-Aldrich公司。异烟肼(H)、乙胺丁醇(E)、链霉素(S)、卡那霉素(Km)、阿米卡星(Am)、卷曲霉素(Cm)、莫西沙星(Mfx)、对氨基水杨酸(PAS)、环丝氨酸(Cs)、克拉维酸(TLC)溶于双蒸水。克拉霉素(Clr)、苯乙烯基甲基甲酮缩氨硫脲(Thz)、利福平(R)、乙硫异烟胺(Eto)、美罗培南(MEC)、丙硫异烟胺(Pto)、氯法齐明(Cfz)溶于二甲基亚砜(DMSO)有机溶剂中;左氧氟沙星(Lfx)、氧氟沙星(Ofx)溶于NaOH(0.1N)中。所有药物置于-20~4 ℃存放。
4. MGIT 960药敏试验:根据2008年WHO最新指南[12]推荐药物和浓度,选择了14种抗结核药物[H(0.1 μg/ml)、R(1 μg/ml)、E(5 μg/ml)、Z(100 μg/ml)、S(1 μg/ml)、Km(2.5 μg/ml)、Am(1 μg/ml)、Cm(2.5 μg/ml)、Mfx(0.5或2.0 μg/ml)、Ofx(2.0 μg/ml)、Lfx(1.5 μg/ml)、PAS(4 μg/ml)、Eto(5 μg/ml)、Pto(2.5 μg/ml)]行液体药敏试验。孵育至仪器报阳,最多培养4周,如未能生长,仪器将报告为阴性[13]。
5. 传统比例法固体药敏试验:根据2008年WHO最新指南[11]推荐药物和浓度,选择12种抗结核药物[H(0.2 μg/ml)、R(40 μg/ml)、E(2 μg/ml)、S(4 μg/ml)、Km(30 μg/ml)、Am(30 μg/ml)、Cm(40 μg/ml)、Ofx(4 μg/ml)、Lfx(4 μg/ml)、 PAS(1 μg/ml)、Pto(40 μg/ml)、Cs(30 μg/ml)]进行比例法药敏试验;耐药结果判定:耐药百分比=(含药培养基的菌落数/对照培养基的菌落数)×100%。耐药百分比<1%为敏感,≥1%为耐药[14]。
6. MIC的测定:参照2008年的美国临床实验室标准化研究所(Clinical and Laboratory Stan-dards Institute,CLSI)推荐的药物浓度和Alamar blue显色法[15],选择了16种抗结核药物[H、R、E、Km、Am、Cm、Mfx、Lfx、PAS、Pto、Cs、Clr、阿莫西林-克拉维酸(Amx-Clv)、Thz、Cfz、MEC]进行MIC试验。
7. 数据的整理和统计学分析:统计菌株对各药物的MIC范围。其中MIC实验的准确度可利用ROC曲线评价,曲线下面积(AUC)越大,则认为该方法正确区分Mtb耐药和敏感的能力越大。ROC曲线可给出区分耐药和敏感的最佳耐药阈值(药敏界值),当AUC为1时,该阈值可正确将耐药和敏感菌株完全分开,当AUC≤0.5时,该阈值不能将耐药和敏感菌株完全分开。用SPSS 16.0软件进行ROC曲线分析,结合传统比例法固体和液体药敏试验的结果,并以此作为金标准,确定各抗结核药物的折点浓度,并计算菌株对该药物的AUC。
8. 计算药物对菌株杀菌率的高低:笔者通过计算Cmax/MIC值的大小来研究药物对菌株杀菌率的高低,并由此推断药物对该致病菌的治疗效果。因所选15种抗结核药均为浓度依赖性杀菌剂,故采用文献报道的浓度依赖性杀菌剂所用标准:对氨基糖苷类,若Cmax/MIC≥8~10,临床有效率可达90%;对氟喹诺酮类,若Cmax/MIC≥10~12,可达最高的杀菌率[20]。
9. 质量控制(简称“质控”):质控选取标准株H37Rv作为药敏试验参考标准菌株,以及空白培养基和无菌蒸馏水做空白对照。每部分实验均重复3次或3次以上。若一致,说明质控合格;若不一致,说明质控不合格,还需重新检测。
二、相关概念
MDR-TBM:是指同时耐H和R的TBM;广泛耐药结核性脑膜炎(XDR-TBM):是指同时耐H和R,也耐氟喹诺酮类药或二线抗结核注射药类中的任意一种[15]。
结 果
一、药敏试验结果
比例法和MGIT 960药敏试验检测结果基本一致(表1),综合固体和液体药敏试验结果后发现,任意耐药(包括一线和二线抗结核药物)的TBM临床分离株有13株(13/25),对一线4种抗结核药物(H、R、E、Z)全敏感者有15株;耐药菌株10株,其中表型耐H或R所占的比例较大,MDR-TBM有3株(3/25)。二线注射药(S、Km、Am、Cm)敏感株有19株(19/25);口服二线抑菌药(PAS、Pto、Eto、Cs)敏感株有20株(20/25);表型耐氟喹诺酮类药(Mfx、Ofx、Lfx)有2株(2/25),敏感株有23株(23/25)。
二、25株TBM临床分离株对16种抗结核药物的MIC及其与菌株耐药表型的关系
H、R、E、Km、Am、Cm、Mfx、Lfx、PAS、Pto、Cs、MEC、Clr、Thz、Cfz、Amx的敏感株MIC值中位数分别为25.60、0.50、5.00、4.00、2.00、5.00、0.08、0.16、0.31、5.00、20.00、64.00、12.50、20.00、0.32、480.00 μg/ml(表2)。
三、15种抗结核药物的最佳药敏界值分析
由于不同个体差异较大,Cmax(峰值血药浓度) 影响因素广泛,笔者参阅汇总了多篇国际上权威文献报道的Cmax值[16-23]。由于MEC、Amx、Cfz、Pto、Clr未做固体药敏试验,因此没有通过做ROC曲线来确定最佳药敏界值,所取药敏界值为大部分TBM临床分离株的MIC值(表3)。其余药物的ROC曲线下面积(AUC)数值大小均在0.500~1.000之间。其中R、Mfx、Lfx、Cfz、PAS的Cmax/MIC值较高,分别为19.880、63.333、19.149、75.000、50.855,均>12.000。E、MEC、Amx的Cmax/MIC值较低,分别为0.115、0.010、0.004。氨基糖苷类Km、Am、Cm的Cmax/MIC值分别为1.830、1.800、5.300,均<8.000。
讨 论
根据国际防痨和肺部疾病联合会和世界卫生组织对于结核病药敏试验药物浓度界限确定的原则[24],将肺结核临床分离株对H的MIC界值限定为4.00或8.00 μg/ml;R为0.25或1.00 μg/ml;E为1.00 μg/ml;Km为5.00 μg/ml;Am为4.00 μg/ml;Mfx为2.00 μg/ml;Lfx为2.00 μg/ml;PAS为2.00 μg/ml;Pto为5.00 μg/ml;Cs为32.00 μg/ml[25]。本实验中H、R、E、Km、Am、Cm、Mfx、Lfx、PAS、Pto、Cs分别为25.60、0.50、5.00、4.00、2.00、5.00、0.08、0.16、0.31、5.00、20.00 μg/ml,普遍较肺结核低。但TBM临床分离株对H、E的MIC界值(25.60,5.00)普遍较肺结核(4.00,1.00)临床分离株高。笔者查阅了原始数据资料并重复了4次试验,菌株重新接种后也更换了不同批次的药物,发现仍然是相同结果。目前,大多数文献报道的MIC值均是针对肺结核临床分离株的,而对TBM临床分离株的相关数据报道甚少,还没有权威文献可供参考。因此,笔者认为造成H和E的MIC界值普遍较高的原因可能有:肺结核临床分离株的MIC界值和TBM临床分离株的MIC界值不相同;H、E的Cmax/MIC值分别为0.600和0.115(表3),也可说明H、E对TBM临床分离株杀菌率较低,治疗效果不好;菌株数太少,导致数据代表性不强;但由于分离TBM临床菌株难度很大,造成本研究的菌株数十分有限。若在今后的工作中能继续扩大样本量,相信还会有更多发现。

表1 不同药物采用比例法固体和MGIT 960液体技术进行药敏试验的结果
注 H:异烟肼; R:利福平; Z:吡嗪酰胺; E:乙胺丁醇; S:链霉素; Km:卡那霉素; Am:阿米卡星; Cm:卷曲霉素; Mfx:莫西沙星; Ofx:氧氟沙星; Lfx:左氧氟沙星; PAS:对氨基水杨酸; Eto:乙硫异烟胺; Pto:丙硫异烟胺; Cs:环丝氨酸;“-”表示WHO暂未推荐做固体药敏试验或液体药敏试验
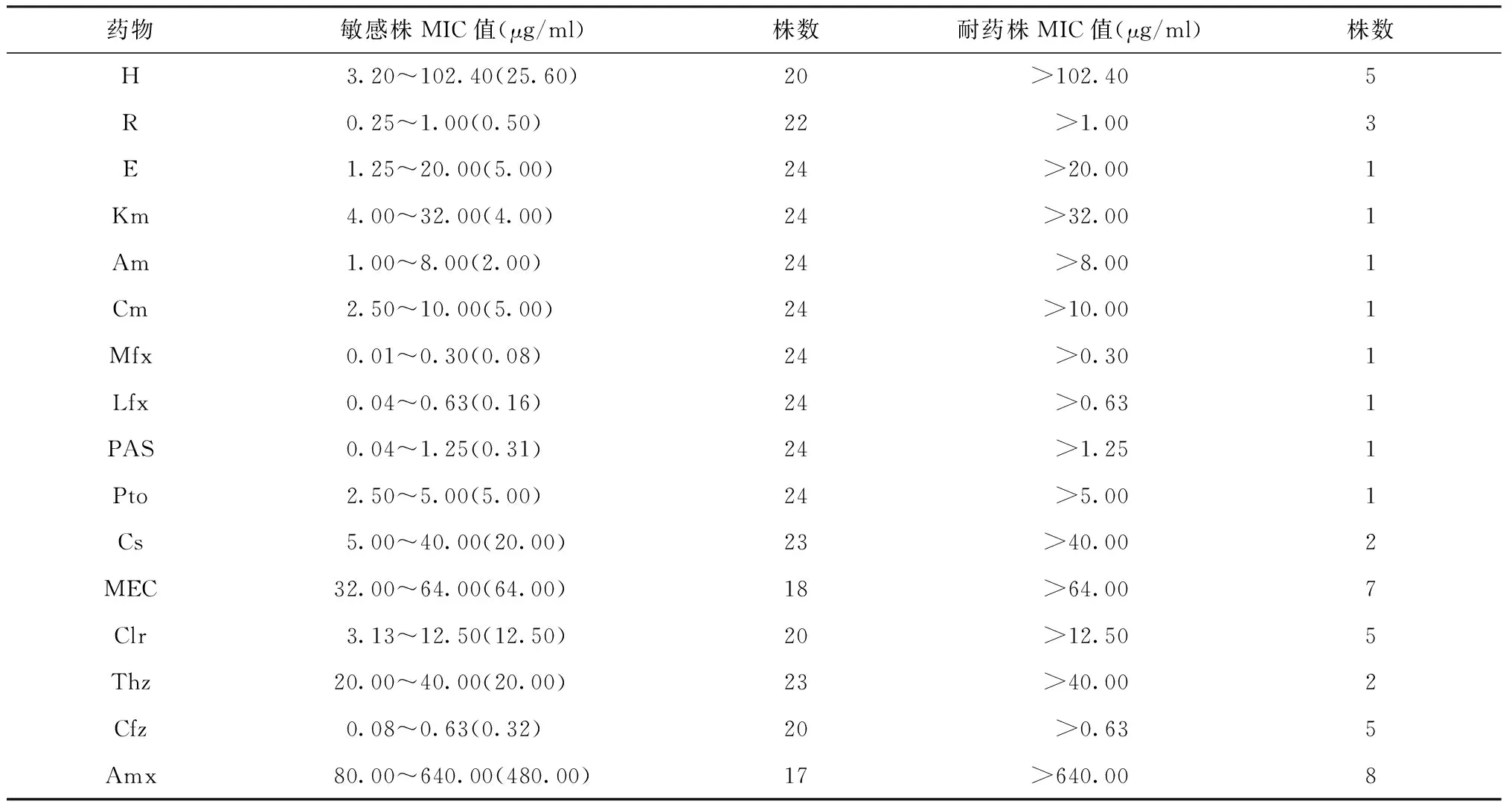
表2 25株TBM临床分离株对16种抗结核药物的MIC特征
注 括号内数值为中位数
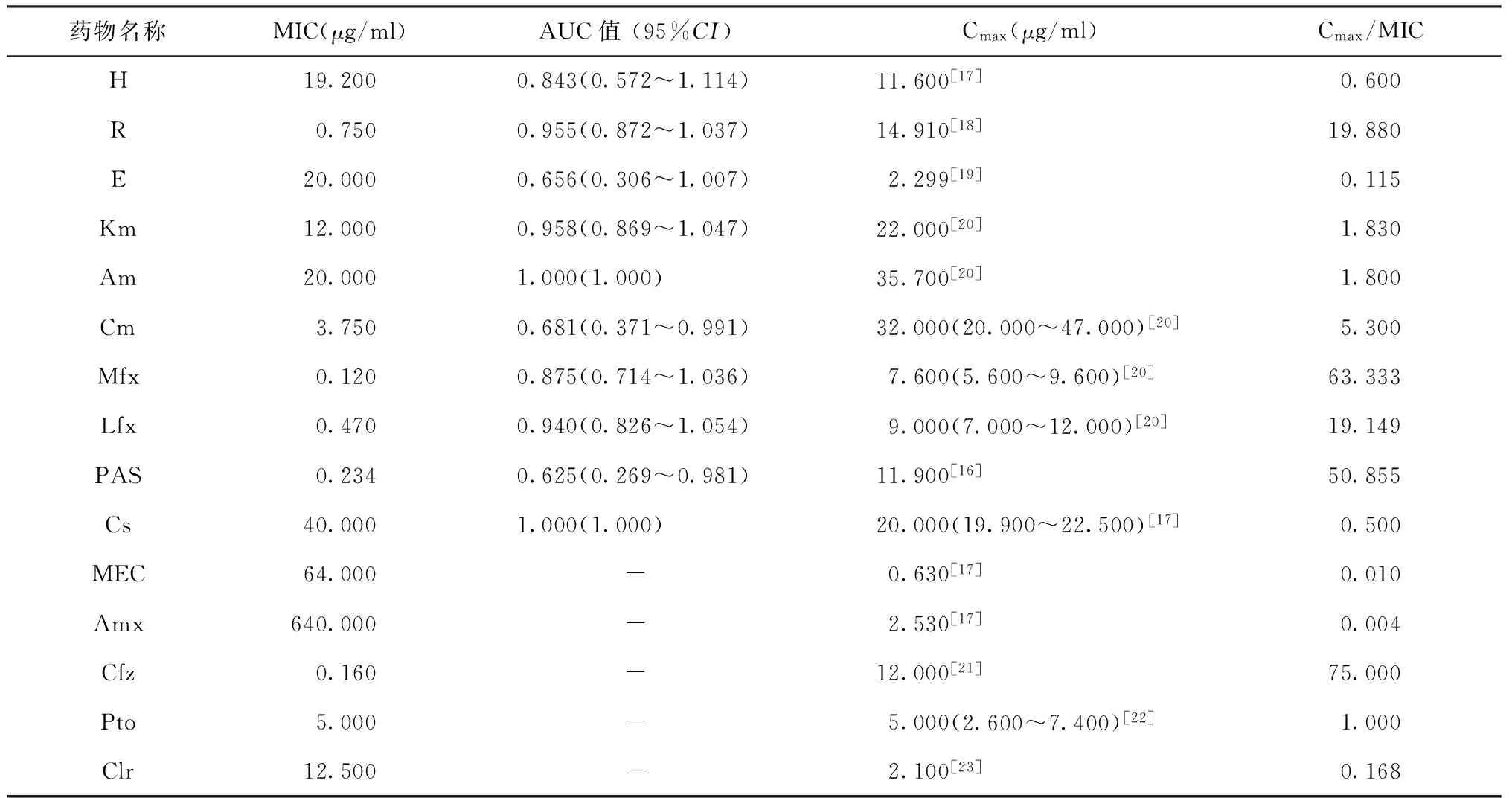
表3 15种药物最佳药敏界值分析
注 Cmax:血药峰值浓度,即用药后所能达到的最高血浆药物浓度,所选数值来自于参考文献;AUC:曲线下面积;-:未做比例法固体药敏试验;表中MIC值为大部分TBM临床分离株的MIC值
目前,临床对于TBM患者的治疗仍在延用肺结核的治疗方法[23],对于MDR-TB,通常采用二线抗结核药物和氟喹诺酮类药物进行治疗。其中氟喹诺酮类药物投入临床时间较长、应用的抗菌范围较广、不良反应小、价格低廉,已被WHO纳入MDR-TB的临床治疗方案,成为联合治疗的核心药物之一。MDR-TB治疗的成败与Mtb对氟喹诺酮类药物是否耐药密切相关[26]。据文献报道,氟喹诺酮类药物中Mfx治疗结核病效果最好[27]。但随着Mfx的广泛应用,未使用Mfx的患者感染耐药菌株的概率增大,可能导致MIC界限不清,难以确定耐药界限。对Mfx敏感的肺结核临床分离株MIC值多集中于0.200 μg/ml,耐Mfx的肺结核临床分离株MIC值多集中于6.000 μg/ml。本实验中对Mfx敏感的TBM菌株的MIC值多集中于0.080 μg/ml, 对Mfx耐药的TBM菌株的MIC值多集中于0.120 μg/ml(表2),明显低于肺结核临床分离株,且Cmax/MIC值高达63.333。由此提示,Mfx对TBM临床分离株的杀菌力较对肺结核的临床分离株高,可能会有不错的治疗效果。也有文献报道高剂量R和氟喹诺酮类药物联合治疗TBM可以提高疗效[24]。本研究也发现Mfx、Lfx、R的Cmax/MIC分别为63.333、19.149、19.880,均>12,其中R最低。提示联合高剂量R和氟喹诺酮类药物治疗TBM会有不错的疗效。
此外,关于TBM的治疗,不仅要考虑体外检测到的MIC和Cmax,还应考虑药物对血脑屏障的穿透能力和在脑脊液中能达到的实际浓度。由于血脑屏障的存在,使治疗时间更长,且可选择的药物少,对多耐药患者更是如此。血脑屏障能阻止约95%的药物进入脑组织[28],使疗效大大降低。H、Z、Pto能完全通过血脑屏障,R在脑组织中有较高的Cmax/MIC,据报道氟喹诺酮类药物与H、R有协同作用[29]。脑膜的病理性破坏可使血脑屏障的通透性增加,从而使能部分通过血脑屏障的药物进入脑组织的药量增加。由于Mtb属细胞内病原菌,大多被肺泡巨噬细胞(AM)所吞噬, 余者处于肺上皮细胞的衬液(ELF)中,故R、Lfx、Mfx在肺泡细胞(AC)、AM及ELF中的浓度反映了其在感染部位的实际分布, 在炎症条件下,可以部分通过血脑屏障[30],在脑脊液中有良好的分布,可用于治疗TBM[19]。氟喹诺酮类药物普遍具有良好的药物动力学性质,口服生物利用度≥78%,其血浆蛋白结合率较低(≤40%),易于透过细胞膜而达到治疗感染所需的组织浓度。由表3可看出MIC/Cmax值较低的为E和Amx,由此推断治疗TBM效果可能不好,即使加大剂量效果也一般。这可能是由于单用E时细菌可迅速产生耐药性,对胞内Mtb无效,且其不能渗入正常脑膜(TBM患者脑脊液中可有微量),因此杀菌效果不好。近几年Amx的广泛使用可能也是导致其耐药率增加的原因,因此必须与其他抗结核药联合应用。当用于曾接受抗结核药物治疗的患者时,应至少与一种二线药物合用,有文献报道Amx和Am联用可增加治疗效果[17]。MEC不易透过血脑屏障,若要治疗TBM,还需加大剂量。氨基糖苷类药物(如Am和km)的Cmax/MIC值均<8 μg/ml,H的Cmax/MIC值<1,因此其在TBM治疗中的应用还有待评价。本实验发现Pto、Clr用于治疗TBM效果一般;Cm、PAS治疗TBM可能会起到不错的效果。有文献报道Cfz对Mtb及耐多药Mtb均有较强的体外抗菌作用[31],其作用机制主要是干扰核酸代谢及能量代谢,不易产生耐药性,与现有抗结核药物无交叉耐药,与细胞色素P450酶没有内在的相互作用[19]。本实验也发现Cfz的Cmax/MIC值高达75.000(表3),因此使用较少剂量即可达到较大杀菌率。此外,有文献报道贝达喹啉(bedaquiline)和地依麦迪(delamanid)较易渗透血脑屏障,在治疗MDR-TBM中也会有很好前景[32]。
综上所述,关于TBM临床分离株耐药性、最低抑菌浓度及各类抗结核药对致病菌的治疗效果方面的研究,国内还未见类似报道。本课题很好地扩展了结核病的研究范围,有助于解决临床上的诸多问题。比如,同样是不耐药的Mtb,为何对肺结核疗效好的药物对TBM的疗效却不好?如何才能更快、更有效地治疗TBM?诸如此类问题将是结核病基础和临床研究的新方向,值得每位学者为之探索发现。
[1] Patel VB, Padayatchi N, Bhigjee AI, et al. Multidrug-resis-tant tuberculous meningitis in KwaZulu-Natal, South Africa. Clin Infect Dis, 2004, 38(6):851-856.
[2] Zumla A, Raviglione M, Hafner R, et al. Tuberculosis. N Engl J Med, 2013, 368(8):745-755.
[3] Khan A, Sarkar D. A simple whole cell based high throughput screening protocol usingMycobacteriumbovisBCG for inhibitors against dormant and active tubercle bacilli. J Microbiol Metho-ds, 2008, 73(1): 62-68.
[4] Canetti G, Froman S, Grosset J, et al. Mycobacteria: laboratory methods for testing drug sensitivity and resistance. Bull World Health Organ, 1963, 29(5): 565-578.
[5] Gumbo T. New susceptibility breakpoints for first-line antituberculosis drugs based on antimicrobial pharmacokinetic/pharmacodynamic science and population pharmacokinetic variability. Antimicrob Agents Chemother, 2010, 54(4): 1484-1491.
[6] Steingart KR, Henry M, Laal S, et al. A systematic review of commercial serological antibody detection tests for the diagnosis of extrapulmonary tuberculosis. Postgrad Med J, 2007, 83(985): 705-712.
[7] Luna-Herrera J, Martínez-Cabrera G, Parra-Maldonado R, et al. Use of receiver operating characteristic curves to assess the performance of a microdilution assay for determination of drug susceptibility of clinical isolates ofMycobacteriumtuberculosis. Eur J Clin Microbiol Infect Dis, 2003, 22(1): 21-27.
[8] Wise R. Maximizing efficacy and reducing the emergence of resistance. J Antimicrob Chemother, 2003, 51 Suppl 1: S37-42.
[9] Marais S, Thwaites G, Schoeman JF, et al. Tuberculous meningitis: a uniform case definition for use in clinical research. Lancet Infect Dis, 2010, 10(11): 803-812.
[10] 王婷,赵雁林,刘家云,等. 结核性脑膜炎临床分离株基因型和耐药表型的特征分析.中国防痨杂志,2013,35(9):660-667.
[11] 中国防痨协会基础专业委员会.结核病诊断实验室检验规程.北京:中国教育文化出版社,2006:54,56-57.
[12] Falzon D, Jaramillo E, Schünemann HJ, et al. WHO guidelines for the programmatic management of drug-resistant tuberculosis: 2011 update. Eur Respir J, 2011, 38(3):516-528.
[13] Kontos F, Maniati M, Costopoulos C, et al. Evaluation of the fully automated Bactec MGIT 960 system for the susceptibility testing ofMycobacteriumtuberculosisto first-line drugs: a multicenter study. J Microbiol Methods, 2004, 56(2): 291-294.
[14] Pang Y, Zhou Y, Zhao B, et al. Spoligotyping and drug resistance analysis ofMycobacteriumtuberculosisstrains from national survey in China. PLoS One, 2012, 7(3): e32976.
[15] Angra PK, Taylor TH, Iademarco MF, et al. Performance of tuberculosis drug susceptibility testing in U.S. laboratories from 1994 to 2008. J Clin Microbiol, 2012, 50(4): 1233-1239.
[16] Hong L, Jiang W, Pan H, et al. Brain regional pharmacokinetics of p-aminosalicylic acid and its N-acetylated metabolite: effectiveness in chelating brain manganese. Drug Metab Dispos, 2011, 39(10): 1904-1909.
[17] Di Paolo A, Gori G, Tascini C, et al. Clinical pharmacokine-tics of antibacterials in cerebrospinal fluid. Clin Pharmacokinet, 2013, 52(7): 511-542.
[18] Nuermberger E, Grosset J. Pharmacokinetic and pharmacodynamic issues in the treatment of mycobacterial infections. Eur J Clin Microbiol Infect Dis, 2004, 23(4): 243-255.
[19] Rubrichi S, Quaglini S. Summary of Product Characteristics content extraction for a safe drugs usage. J Biomed Inform, 2012, 45(2): 231-239.
[20] Garcia-Prats AJ, Rose PC, Hesseling AC, et al. Linezolid for the treatment of drug-resistant tuberculosis in children: a review and recommendations. Tuberculosis(Edinb), 2014, 94(2):93-104.
[21] Cholo MC, Steel HC, Fourie PB, et al. Clofazimine: current status and future prospects. J Antimicrob Chemother, 2012, 67(2): 290-298.
[22] Han M, Jun SH, Lee JH, et al. Method for simultaneous analysis of nine second-line anti-tuberculosis drugs using UPLC-MS/MS. J Antimicrob Chemother, 2013, 68(9): 2066-2073.
[23] Fish DN, Abraham E. Pharmacokinetics of a clarithromycin suspension administered via nasogastric tube to seriously ill patients. Antimicrob Agents Chemother, 1999, 43(5): 1277-1280.
[24] Shandil RK, Jayaram R, Kaur P, et al. Moxifloxacin, ofloxacin, sparfloxacin, and ciprofloxacin againstMycobacteriumtuberculosis: evaluation of in vitro and pharmacodynamic indices that best predict in vivo efficacy. Antimicrob Agents Chemo-ther, 2007, 51(2): 576-582.
[25] Hall L, Jude KP, Clark SL, et al. Evaluation of the Sensititre MycoTB plate for susceptibility testing of theMycobacteriumtuberculosiscomplex against first-and second-line agents. J Clin Microbiol, 2012, 50(11): 3732-3734.
[26] Wang JY, Lee LN, Lai HC, et al. Fluoroquinolone resistance inMycobacteriumtuberculosisisolates: associated genetic mutations and relationship to antimicrobial exposure. J Antimicrob Chemother, 2007, 59(5): 860-865.
[27] Thwaites GE. Advances in the diagnosis and treatment of tuberculous meningitis. Curr Opin Neurol, 2013, 26(3): 295-300.
[28] Pardridge WM. Drug transport across the blood-brain barrier. J Cereb Blood Flow Metab, 2012, 32(11): 1959-1972.
[29] Be NA, Lamichhane G, Grosset J, et al. Murine model to study the invasion and survival ofMycobacteriumtuberculosisin the central nervous system. J Infect Dis, 2008, 198(10): 1520-1528.
[30] Thwaites GE, Tran TH. Tuberculous meningitis: many questions, too few answers. Lancet Neurol, 2005, 4(3): 160-170.
[31] 桂徐蔚,肖和平,胡忠义,等. 氯法齐明对不同耐药类型结核分枝杆菌的体外抑菌活性研究. 中华结核和呼吸杂志,2011,34(8):579-581.
[32] Chaisson RE,Nuermberger EL.Confronting multidrug-resis-tant tuberculosis. N Engl J Med,2012,366(23):2223-2224.
(本文编辑:薛爱华)
Studies on the phenotypically resistant characteristics and therapeutic effect of antitubercular drugs onM.tuberculosisclinical isolates from the patients with tuberculous meningitis
WANGTing*,ZHAOYan-lin,PANGYu,FENGGuo-dong,SONGYuan-yuan,OUXi-chao,PENGJin-xiang,ZHAOGang,ZHANLi-ping.
*DepartmentofInternalMedicine,Yan’anHospitalAffiliatedtoKunmingMedicalUniversity,Kunming650200,China
ZHANLi-ping,Email: 2510765864@qq.com;ZHAOGang,Email:zhaogang@fmmu.edu.cn
Objective To study the phenotypically resistant characteristics and therapeutic effect of antitubercular drugs onM.tuberculosisclinical isolates from the patients with tuberculous meningitis (TBM). Methods Five hundred cerebrospinal fluid (CSF) from suspected patients with tuberculous miningitis were cultured with Bactec MGIT 960. Twenty-five strains were isotated, and then identified the species by 16S rRNA gene sequencing, detected 14 anti-tuberculous drug susceptibility by Bactec MGIT 960 and 12 anti-tuberculous drug susceptibility by the proportional method of conventional solid culture. The minimal inhibitory concentrations (MICs) of 16 anti-tuberculous drugs on these isolates were determined. The bacterial sterilization rate was determined by calculating the ratio of maximal plasma concentration (Cmax)/MIC to evaluated thetherapeutic effect of drugs onM.tuberculosis. Results Of 25M.tuberculosisisolates, 13 were resistant to any anti-tuberculous drugs, 3 were multidrug-resistant. The ratios of Cmax/MIC for rifampicin, moxifloxacin, levofloxacin, clofazimine, and p-aminosalicylic acid were 19.880, 63.333, 19.149, 75.000, and 50.855, respectively. Conclusion Most drug-resistant isolates from TBM patients were phenotypically resistant to isoniazid or rifampicin, the least isolates were phenotypically resistant to quinolone. The Cmax/MIC values of moxifloxacin, clofazimine, p-aminosalicylic acid, levofloxacin and rifampicin were higher, suggesting that the combination of high doses of rifampicin and fluoroquinolones might improve the therapeutic effect of TBM. P-aminosalicylic acid and clofazimine might play an better role in antituberculous treatment of TBM.
Tuberculosis, meningeal/drug therapy; Phenotype; Microbial sensitivity tests; Treatment outcome
10.3969/j.issn.1000-6621.2015.04.006
“十二五”国家科技重大专项(2012ZX10003004)
650051 昆明医科大学附属延安医院神经内科(王婷、战丽萍);第四军医大学西京医院神经内科[王婷(研究生)、冯国栋、赵钢];中国疾病预防控制中心结核病预防控制中心 国家参比实验室(赵雁林、逄宇、宋媛媛、欧喜超);解放军第四七八医院空勤科(彭晋湘)
注:王婷和赵雁林为并列第一作者
战丽萍,Email: 2510765864@qq.com;赵钢,Email: zhaogang@fmmu.edu.cn
2015-02-16)
