甲状腺乳头状癌BRAFV600E 突变表达及其与临床病理特征的相关性研究
2015-05-17林维浩马浙夫夏浩明中山大学附属第一医院乳腺甲状腺外科广东广州510080
林维浩,马浙夫,夏浩明 (中山大学附属第一医院乳腺甲状腺外科,广东 广州 510080)
甲状腺癌是最常见的内分泌系统恶性肿瘤,在头颈部肿瘤中居首位。近30 年来,我国的甲状腺癌发病率由10/100 万上升约30/100 万~40/100 万[1]。甲状腺癌的病理类型包括乳头状癌(PTC)、滤泡状癌(FTC),未分化癌(ATC)和髓样癌(MTC),其中PTC 占成人的60%和儿童甲状腺癌的全部[2]。甲状腺癌的发生包含了一系列高发的遗传学因素,如RAS 基因点突变、RET 基因重排、p53 基因失活等。BRAF 突变是近年来发现的一个重要基因突变,且BRAFV600E突变成为近年来研究的热点。本文通过检测BRAFV600E在PTC 中的表达,探讨其表达与PTC 临床病理特征关系,为预测PTC 的局部复发与治疗寻找新途径。
1 资料与方法
1.1 标本来源:选取2003 年1 月~2005 年8 月于中山大学附属第一医院行手术切除的PTC 石蜡包埋切片140 例,其中男35例,女105 例;年龄8 ~78 岁,平均(38.6±2.6)岁,中位年龄36.7 岁;Ⅰ~Ⅱ期88 例,Ⅲ~Ⅳ期52 例。所有患者术前均未行内、外放射治疗,首次术后原发灶无癌残留。临床资料见表1。
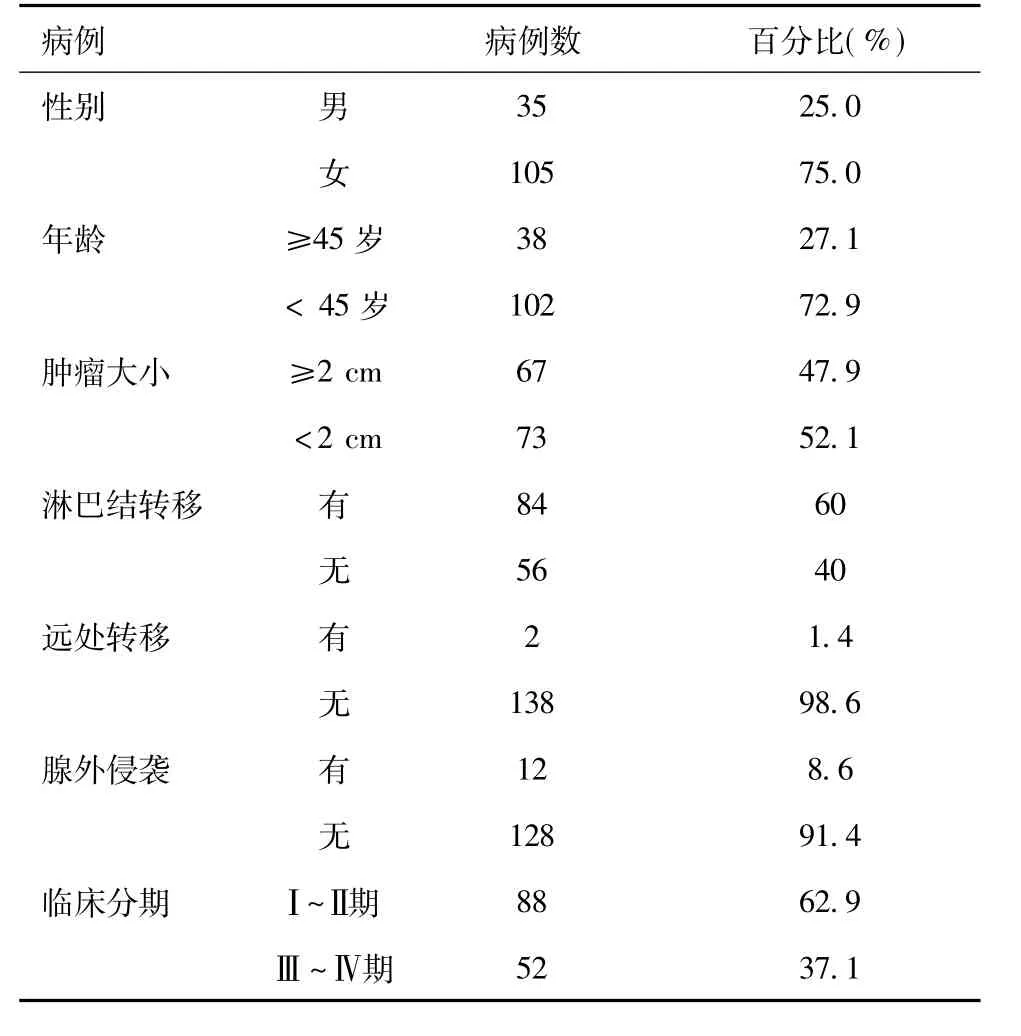
表1 140 例PTC 的临床资料
1.2 BRAF 突变检测:对140 例PTC 病理阅片,将石蜡包埋的甲状腺癌组织切片通过脱蜡、经典阴离子去污剂法进行基因组DNA 提取。将提取的DNA 行Taqman 荧光定量PCR 检测。
1.3 BRAFV600E突变结果的判断:以已知的PTC 细胞WRO 和KAT-5 细胞提取的DNA 作为对照。将PTC 细胞系WRO 作为BRAF 野生型为阴性对照,PTC 细胞系KAT-5 为BRAFV600E突变的阳性对照。
1.4 研究方法:对140 例PTC 病理学观察、DNA 提取,采用Taqman 荧光定量PCR 检测突变的结果,与已知PTC 细胞系WRO 作为BRAF 野生型、KAT-5 为BRAFV600E突变型的结果作对照,分析BRAFV600E突变在PTC 中不同亚型的表达与临床病理特征与预后的关系。
1.5 统计学方法:采用SPSS17.0 统计软件对实验数据进行分析,BRAFV600E基因突变与PTC 患者临床病理特征之间的关系用卡方检验,以P <0.05 为差异有统计学意义。
2 结果
2.1 BRAFV600E与PTC 临床病理特征的相关性:140 例患者中,BRAFV600E突变检测阳性75 例,阴性65 例,突变率为53.6%。BRAFV600E突变与性别、年龄、肿瘤大小、腺外侵袭之间的关系经χ2检验差异均无统计学意义(P >0.05),但有颈部淋巴结转移患者的BRAFV600E突变率显著高于无颈部淋巴结转移患者,差异具有显著统计学意义(P <0.01);Ⅰ~Ⅱ期和Ⅲ~Ⅳ期间的BRAFV600E突变率差异具有显著统计学意义(P <0.01),见表2。
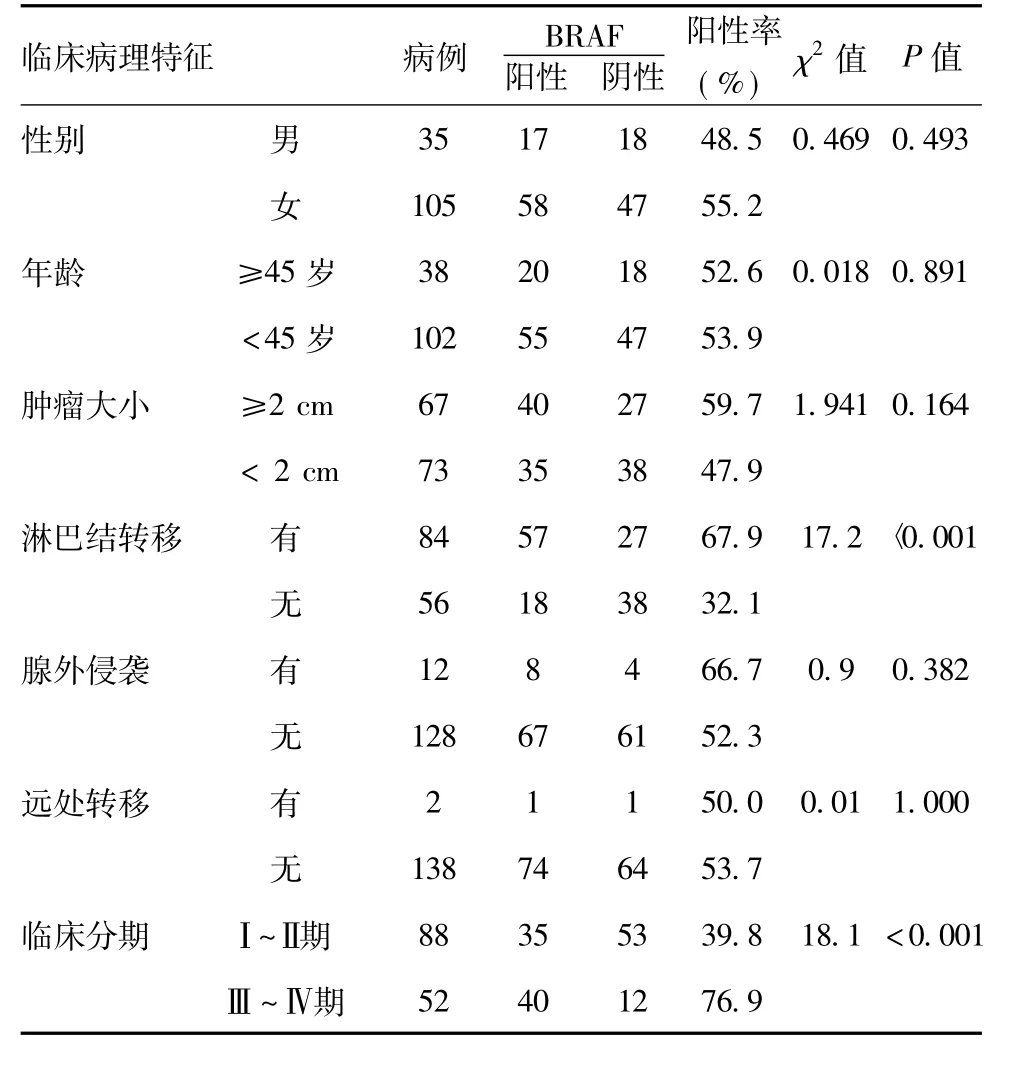
表2 BRAFV600E与PTC 临床病理特征的关系
2.2 随访:140 例PTC 患者均通过门诊、电话及信件等方式随访。随访时间96.3 ~120.1 个月,平均104.36 个月,20 例失访,随访率85%。14 例术后再次手术,其中10 例因局部淋巴结转移,检测BRAFV600E阳性8 例(8/14);4 例因局部复发,检测BRAFV600E阳性2 例(2/4)。3 例在术后5 年内死亡,死因为全身转移或局部复发窒息(检测BRAFV600E阳性2 例,阴性1 例)。BRAFV600E突变与复发率、死亡率经χ2检验差异无统计学意义,差异均无统计学意义。见表3。
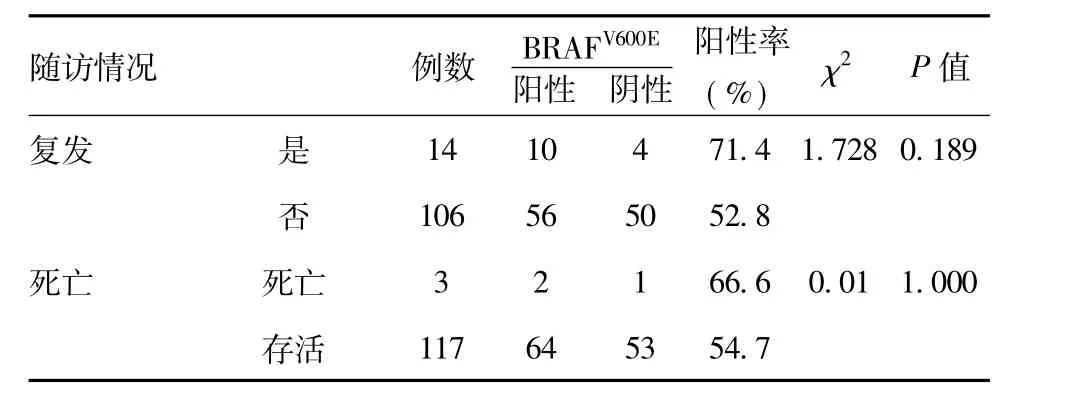
表3 BRAFV600E与PTC 术后随访的关系(n=120)
3 讨论
BRAF 基因属于RAF 基因家族,是MAPK 通路的一个重要蛋白激酶。它位于染色体7q34,编码一个分子量为67 ~99 kD的丝/苏氨酸蛋白激酶。RAF 基因家族共有三个成员,RAF-1、BRAF 和ARAF。在RAF 家族三种丝/苏氨酸蛋白激酶中,BRAF 是激活MAPK 通路的能力最强的的激活物。BRAF 突变在人类肿瘤最常见于黑色素瘤,其检出率占所有的黑色素瘤的66%,肠癌、肺癌、卵巢癌和甲状腺癌中也有一定的发生率[3]。大部分的BRAF 突变都限定于激酶结构域内,其热点突变在11和15 外显子上。超过80%的BRAF 突变都为第1799 位脱氧核苷酸的A-T 点突变,这种突变导致第600 位氨基酸由缬氨酸变为谷氨酸。这一突变带来的负电荷模拟了苏氨酸599 和丝氨酸602 的磷酸酰基化过程,导致激酶的持续活化,MAPK 通路持续激活,使前者原有丝分裂能力增强,引起细胞异常增殖和恶性转化,导致肿瘤的发生。BRAF 突变在PTC 中有很高的发生率,从29%至83%不等。西方国家PTC 中BRAFV600E突变的检出率较韩国低[4]。本研究BRAFV600E检出率为53.6%,与西方国家检出率相仿。
国外有不少关于BRAFV600E突变与甲状腺癌临床病理学参数相关性研究,但目前对于BRAFV600E可否作为预后不良的指标存在较大争议。有国外学者认为PTC 中BRAFV600E突变与远处转移和临床病理分期有显著相关性[5]。而国内的研究资料显示腺外侵犯、颈淋巴结转移和甲状腺癌处于进展期(Ⅲ~Ⅳ期)均与PTC 的BRAFV600E突变有显著相关性[6]但也有研究认为突变与各参数不存在相关性[7]。本研究发现BRAFV600E突变与患者的性别、年龄、肿瘤大小和腺外浸润不相关。由于远处器官转移的例数较少(n=2),暂不能得到BRAFV600E突变与远处转移不相关的结论。研究发现PTC 中BRAFV600E突变有较高的复发、死亡率,因为本研究中复发、死亡的PTC 病例较少,所以BRAFV600E突变与PTC 的关系还需要进一步研究。BRAFV600E突变与甲状腺癌的淋巴结转移和临床分期显著相关。这些结果提示,BRAFV600E突变与甲状腺癌的临床进展相关,其有可能参与了甲状腺癌的恶性演进。
检测BRAFV600E突变对PTC 患者治疗和术后预测复发有指导作用。初次手术方式和切除范围的选择是临床医生遇到的最常见的问题[8],如是否应该予以甲状腺全切术,是否应该行颈部淋巴清扫术,以及术后是否选择放射性碘治疗[8]。在美国和其他国家,甲状腺全切或甲状腺次全切除术后予以放射性碘治疗是高危PTC 患者的标准治疗方案[9]。高危的PTC 患者放射性碘治疗对预防复发,提高生存率的作用已经得到广泛证实。由于BRAFV600E阳性的患者在肿瘤复发后对碘放射治疗不敏感,建议手术切除范围应更广泛,并需要外放射治疗[6]。目前有人主张对于BRAFV600E阳性的患者,可以考虑预防性的中央组淋巴结清扫,因为这类患者可能存在肉眼下难以发现的微转移,且甲状腺细胞功能摄碘功能受损,对放射性碘治疗不敏感,复发和死亡风险更大。此外BRAFV600E阳性的患者肿瘤有较高的复发率,术后需更严格随访以检测是否复发。本文研究发现BRAFV600E阳性有较高的复发率,及局部淋巴结转移。手术切除范围应更广泛,患者为此能否获益,需要进一步随访研究。
目前甲状腺癌治疗效果良好,然而,首次正规治疗后10 年仍有20%的患者复发。对于手术不能根治、内放射治疗不敏感的和分化程度较低的PTC 和ATC,目前仍缺乏有效治疗手段。PTC 对常规化疗药物不敏感,不良反应大,研究发现BRAF 突变与细胞的恶性转化密切相关,抑制BRAF 编码的丝氨酸/苏氨酸蛋白激酶活性对治疗PTC、改善患者预后具有重要意义。实验证明RAS 点突变或RET 基因重排,MAPK 激酶抑制剂对BRAF 突变阳性的甲状腺癌细胞具有强的生长抑制作用[9]。抑制MAPK 活性还可以恢复碘代谢相关基因的正常表达,提高对放射碘治疗不敏感PTC 患者的摄碘率[10-11]。近年发现MAPK激酶的抑制剂Selumetinib 可以提高抗碘的甲状腺癌患者的摄碘率[12]。针对MAPK 激酶途径的抑制剂可望会成为有效的PTC 治疗药物。
[1] 陈思睿,曹仁贤.BRAF 基因与甲状腺癌分子诊疗的研究进展[J].中国医学创新,2013,10(2):161.
[2] Yu GP,Li JC,Branovan D,et al.Thyroid cancer incidence and survival in National Cancer Institute survcillance'epidemiology'and end results race/ethnicity groups[J].Thyroid,2010,20(5):465.
[3] 石光清,曹 艳.Survivin 蛋白和BRAF 基因在甲状腺癌中的表达[J].中国现代医学杂志,2012,22(19):61.
[4] Kim SJ,Lee KE,Myong JP,et al BRAFV600Emutation is associated with tumor aggressiveness in papillary thyroid cancer[J].World J Surg,2012,36(2):310.
[5] Basolo F,Torregrossa L,Giaannini R,et al.Correlation between the BRAFV600Emutation and tumor invasivenese in papillary thyroid carcinomas smaller than 20 millimeters:analysis of 1060 cases[J].J Clin Endocrinol metab,2010,95(9):4197.
[6] 易文君,钟 德,邹琼燕.BRAF 基因突变与甲状腺乳头状癌的相关性[J].中南大学学(医学版),2012,37(4):370.
[7] Sassolas G,Hafdi-Nejjari Z,Ferraro A,et al.Oncogenic alterations papillary thyroid cancers of young patients[J].Thyroid,2012,22(1):17.
[8] 孟宪瑛,王广义,谭毓铨.分化型甲状腺癌的规范性治疗[J].吉林医学,2009,30(5):462.
[9] Cooper DS,Doherty GM,Haugen BR,et al.Revised management guidelines for patients with thyroid nodules and differentiated thyroid cancer[J].Thyroid,2009,19(11):1167.
[10] Kleiman DA,Buitrago D,Crowley MJ,et al.Thyroid stimulating hormone increases iodine uptake by thyroid cancer cells during BRAF silencing[J].The Journal of surgical research,2013,182(1):85.
[11] Barollo S,Pennelli G,Vianello F,et al.BRAF in primary and recurrent papillary thyroid cancers:the relationship with(131)I and 2-[(18)F]fluoro-2-deoxy-D-glucose uptake ability[J].Eur J Endocrinol,2010,163(4):659.
[12] Ho AL,Grewal RK,Leboeuf R,et al.Selumetinib-enhanced radioiodine uptake in advanced thyroid cancer[J].N Engl J Med,2013,368(7):623.
