抑制肌球蛋白轻链激酶活性对内皮素-1诱导的大鼠肺动脉平滑肌细胞增殖及凋亡失衡的影响*
2015-05-16杨永曜杨天和蒋清安杨龙唐峰谭洪文
杨永曜,杨天和,蒋清安,杨龙,唐峰,谭洪文
(贵州省人民医院心内科,贵州 贵阳 550002)
抑制肌球蛋白轻链激酶活性对内皮素-1诱导的大鼠肺动脉平滑肌细胞增殖及凋亡失衡的影响*
杨永曜,杨天和△,蒋清安,杨龙,唐峰,谭洪文
(贵州省人民医院心内科,贵州 贵阳 550002)
目的:观察抑制肌球蛋白轻链激酶(MLCK)对内皮素-1(ET-1)诱导的大鼠肺动脉平滑肌细胞(pulmonary artery smooth muscle cells,PASMCs)增殖与凋亡失衡的影响。方法:细胞分成3组:对照组;内皮素-1组;内皮素-1+肌球蛋白轻链激酶抑制剂组(ET-1+M组)。干预72 h后,免疫印迹法测定细胞内MLCK表达水平;甘油凝胶电泳和免疫印迹法检测肌球蛋白轻链(MLC)的磷酸化水平,MTT比色法及[3H]-TdR掺入法检测PASMCs的增殖情况,流式细胞仪检测PASMCs的细胞周期变化及凋亡率。结果:同对照组比较,ET-1刺激后肺动脉平滑肌细胞MLCK蛋白表达显著增强、MLC磷酸化上调、增殖增多、凋亡率明显降低(均P<0.05);加入MLCK抑制剂干预后,MLCK表达明显下降(P<0.05)、MLC去磷酸化显著增强、逆转了ET-1对PASMCs增殖及凋亡的影响。结论:抑制MLCK能显著逆转内皮素-1诱导的大鼠肺动脉平滑肌细胞增殖与凋亡的失衡。
肌球蛋白轻链激酶;内皮素-1;肺动脉平滑肌细胞;细胞增殖;细胞凋亡
目前已知肺动脉高压(pulmonary artery hypertension,PAH)的病理学基础是通过肺血管收缩和肺血管结构重构两个基本的机制使肺血管阻力增加,在早期肺血管收缩中起主要作用,后期则以肺血管结构重构为主[1]。内皮素(endothelin,ET)作为一种强烈的促进细胞增殖的启动生长因子,使肺血管平滑肌细胞增生肥厚,促进血管壁的增生和狭窄;因此ET在PAH的肺血管张力的维持和肺血管重构方面均起重要作用[2]。肌球蛋白轻链激酶(myosin light chain kinase,MLCK)是仅知的催化不同Ca2+/CaM依赖性肌球蛋白II轻链磷酸化的一种蛋白激酶,是平滑肌收缩最重要的限速因子。但MLCK在肺动脉高压血管重构中的地位和作用尚缺乏重视和研究。
本研究拟从细胞及分子水平验证抑制肌球蛋白轻链(myosin light chain,MLC)磷酸化的钙依赖途径MLCK对ET-1诱导的大鼠肺动脉平滑肌细胞(pulmonary artery smooth muscle cells,PASMCs)增殖与凋亡失衡的影响。
材料和方法
1 主要试剂和材料
胎牛血清、高糖DMEM培养基及胰蛋白酶III型(Hyclone);二甲基亚砜(DMSO)、I型胶原酶、小鼠抗MLCK单克隆抗体、小鼠抗MLC单克隆抗体和辣根过氧化物酶(HRP)标记的II抗(Sigma);小鼠抗大鼠α-actin抗体(武汉博士德公司);FITC标记山羊抗小鼠抗体(中杉公司);MTT细胞增殖及细胞毒性检测试剂盒和BCA蛋白浓度测定试剂盒(碧云天公司);[3H]-TdR(上海原子能研究所);ET-1(Bachem); MLCK抑制剂ML-7(Calbiochem);Kodak 4400CF图像分析系统(PELS)。其余试剂均为国产试剂。
2 大鼠肺动脉平滑肌细胞的培养、鉴定与分组
[3]对大鼠肺动脉平滑肌细胞进行原代培养、纯化和鉴定,用0.25%的胰蛋白酶消化传代,接种于新培养瓶扩大培养。传代培养后改用含有10%胎牛血清的DMEM培养液,倒置相差显微镜下观察,细胞呈典型“谷”、“峰”状生长。培养出的细胞用α-actin免疫组化鉴定,实验应用第3~5代细胞。
当传代的细胞生长到70%~80%融合,以无血清培养基替换原培养液,继续同步化培养24 h。采用随机排列表法将细胞分为3组:①对照组(control组)培养液中只加DMSO,不加ET-1(为使实验条件一致,各组均同样要加入DMSO,终浓度为0.1%),继续培养72 h;②内皮素-1组(ET-1组)干预前均预先给予1%胎牛血清饥饿24 h,再加入10-8mol/L的ET-1刺激;③ET-1+肌球蛋白轻链激酶抑制剂组(ET-1+M组)以MLCK特异性抑制剂ML-7 20 μmol/L在ET-1加入前预处理细胞30 min,72 h后收获细胞,检测各项指标。
3 主要实验方法
3.1 MLC磷酸化的测定按参考文献[4]方法,用甘油凝胶电泳和免疫印迹法检测肌球蛋白轻链的磷酸化水平。MLC磷酸化水平以磷酸化MLC(p-MLC)与总MLC比值(%)表示。
3.2 Western blotting检测蛋白水平收集细胞加入4℃预冷的细胞裂解液提取总蛋白,Bradford法测定蛋白浓度后各取等量蛋白上样,12%SDS-PAGE后电转移至PVDF膜上。用小鼠抗MLCK单克隆抗体(1∶1 000)作为Ⅰ抗于4℃孵育过夜,洗膜,加HRP标记的Ⅱ抗(1∶5 000)常温孵育60 min,以增强化学发光法显色、曝光,定量测定各条带密度,以内参照蛋白β-actin进行校正。
3.3 MTT比色法测定PASMCs的增殖参考文献方法[3],于酶标仪测570 nm处吸光度值(A),每孔A值减去空白孔A值为测试孔A的真值。
3.4 [3H]-TdR掺入法检测细胞的DNA合成应用[3H]thymidine试剂盒检测细胞增殖[3]。以液体闪烁计数器测定每分钟的脉冲数(counts per minute,CPM)反映细胞内DNA的合成。
3.5 流式细胞仪检测细胞周期及凋亡率参考文献方法[5],收集培养瓶中的各组平滑肌肌细胞加入5 μL Annexin V-FITC和10 μL 20 mg/L的PI溶液,混匀后于室温避光孵育15 min(试剂盒购自深圳晶美生物公司)。在反应管中加入400 μL PBS,应用流式细胞仪(Beckman Counter)检测细胞周期分布及定量分析凋亡细胞百分率。
4 统计学处理
实验数据以均数±标准差(mean±SD)表示。多组间比较采用单因素方差分析(one-way ANOVA)分析,各组两两比较用Newman-Keuls检验。以P<0.05为差异有统计学意义。
结果
1 内皮素-1对MLCK表达的的影响
倒置显微镜下大鼠PASMCs呈“谷”、“峰”状生长,特异性兔抗鼠α-actin单克隆抗体免疫荧光鉴定可见排列的束状肌丝被染成红色,证明培养细胞为平滑肌细胞,见图1。在PASMCs内MLCK(分子量210 kD)表达变化的定量分析结果表明,ET-1组与正常对照组比较,MLCK表达显著上升(P<0.05);而ET-1+M组较ET-1组明显减少,差异有统计学意义,见图2。
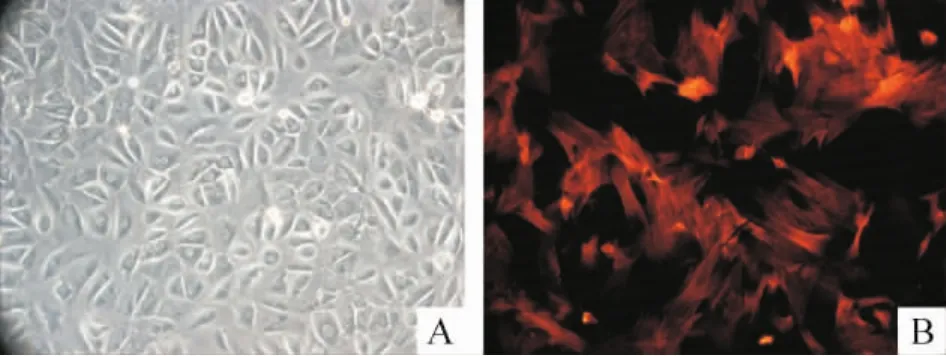
Figure 1.Identification of the rat PASMCs.A:the typical“hill and valley”appearance;B:α-smooth muscle actin positiveexpression(immunofluorescencestaining,×200).图1 大鼠肺动脉血管平滑肌细胞的鉴定

Figure 2.The protein expression of MLCK in rat PASMCs determined by Western blotting.Mean±SD.n=4.*P<0.05 vs control group;#P<0.05 vs ET-1 group.图2 各组大鼠PASMCs中MLCK蛋白表达的比较
2 抑制MLCK对MLC磷酸化的影响
用ET-1刺激PASMCs后,PASMCs的MLC磷酸化水平明显升高(P<0.01),ML-7预处理可拮抗ET-1升高MLC磷酸化水平的作用(P<0.01),见图3。
3 MLCK抑制对ET-1刺激的PASMCs增殖的影响
ET-1组与正常对照组相比增殖活性有显著性差异(P<0.05),提示ET-1可以使PASMCs增殖能力增强;而予MLCK抑制剂ML-7预处理后相对ET-1组,增殖活性显著降低(P<0.05)。提示MLCK抑制后,ET-1刺激的PASMCs增殖反应受到明显抑制,见表1。
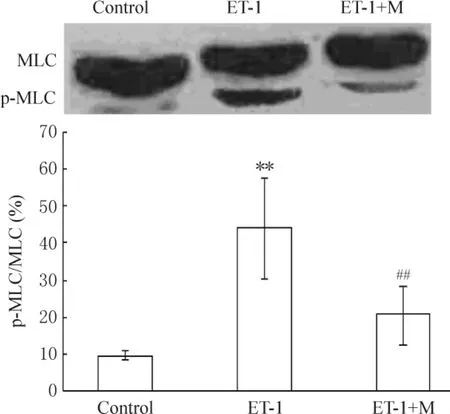
Figure 3.The influence of MLCK inhibition on MLC phosphorylation in rat PASMCs.Mean±SD.n=4.**P<0.01 vs control group;##P<0.01 vs ET-1 group.图3 抑制MLC对大鼠PASMCs的MLCK磷酸化的影响

表1 抑制MLCK活性对对ET-1刺激PASMCs增殖反应的影响Table 1.The effect of inhibiting myosin light chain kinase on the proliferation of ET-1-induced PASMCs(Mean±SD.n=5)
4 MLCK抑制对ET-1刺激PASMCs后细胞周期的影响
相对正常对照组,ET-1刺激可使G0/G1期(静止期)细胞比例显著降低,S+G2/M期(DNA合成期+有丝分裂期)细胞比例显著增加(均P<0.05),提示ET-1可促进PASMCs有丝分裂进入增殖期,而ET-1+M组与对照组比较无明显差异(P>0.05)。提示抑制MLCK信号途径能抑制ET-1导致的PASMCs增殖,见图4、表2。
5 MLCK抑制对ET-1介导的PASMCs凋亡的影响
流式细胞术检测可见,与对照组比较,ET-1刺激后PASMCs凋亡率显著下降(P<0.05);而ET-1+M组的细胞凋亡率相对ET-1组升高(P<0.01),见图5。
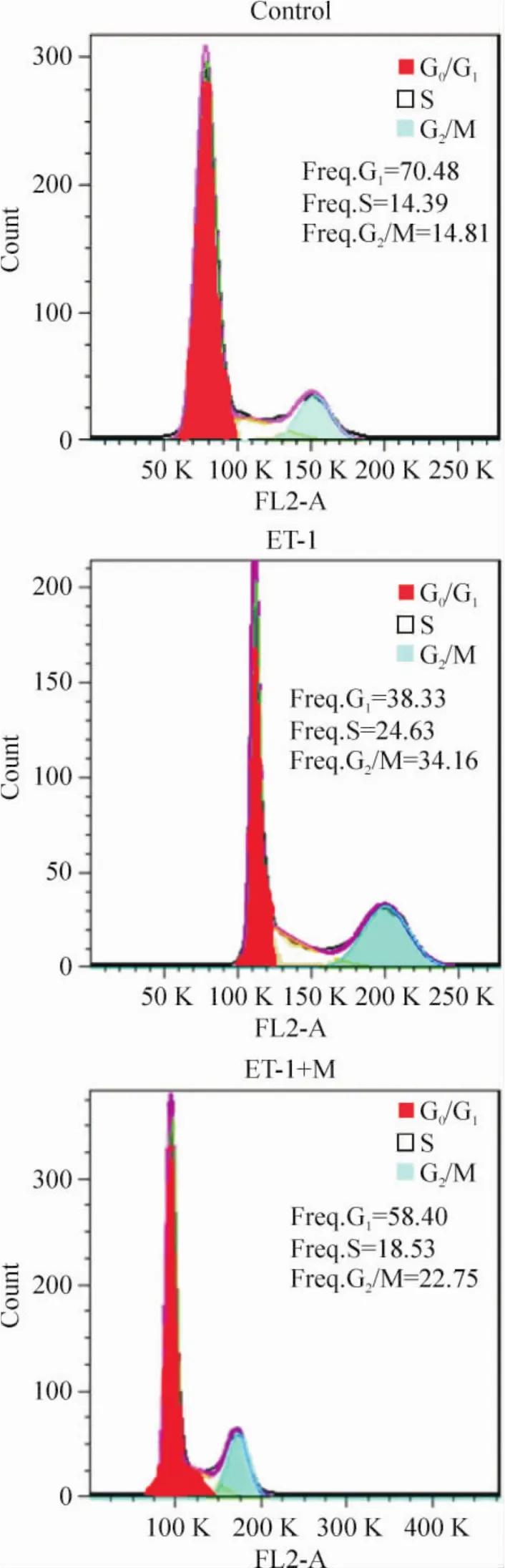
Figure 4.Flow Cytometry analysis of PASMCs.图4 增殖流式细胞图

表2 MLCK抑制对ET-1刺激PASMCs后细胞周期的影响Table 2.The effect of inhibiting myosin light chain kinase on the stimulation with ET-1(Mean±SD.n=5)
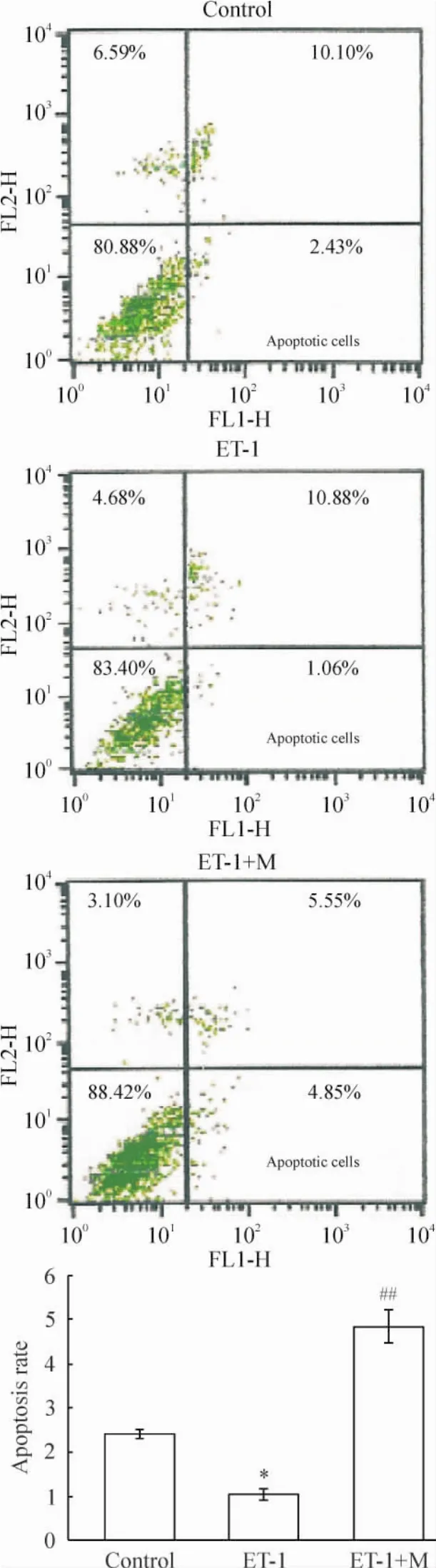
Figure 5.The flow cytometry analysis scatterplot of the PASMCs with Annexin V-FITC/PI double staining.Mean±SD.n=5.*P<0.05 vs control group;##P<0.01 vs ET-1 group.图5 流式细胞术检测PASMCs的Annexin V-FITC/PI检测结果
讨论
肺动脉高压中肺血管平滑肌的收缩及重构是其中心环节,在平滑肌的收缩过程中,MLC磷酸化水平是决定肌肉收缩程度及一系列细胞反应的一个重要因素,Ca2+依赖性的MLC磷酸化对组织细胞的收缩、移动非常重要。有充分的证据表明,MLC除磷酸化发挥收缩效应外,还介导了一系列细胞生物学反应如迁移、增殖、凋亡等[6]。另外有研究通过基因干扰比较MLCK和血小板衍生生长因子(platelet derived growth factor,PDGF)对MLC的作用,证实了MLCK在血管平滑肌MLC磷酸化中的核心地位,还发现MLCK的活化促进了平滑肌的迁移[7]。目前的综述也阐明了Ca2+依赖途径的MLCK通过对MLC磷酸化的平衡调节,诱导血管平滑肌的舒缩,对各种微血管功能障碍性疾病如缺血-再灌注损伤、动脉粥样硬化及糖尿病等的内皮功能调节起了重要的作用,该途径中心是MLCK[8]。最新的国内文献[9]通过采用慢病毒转染方式上调或下调大鼠肺血管平滑肌细胞表达MLCK水平,发现MLCK促进肺血管平滑肌细胞增殖,可能是通过促进内皮素受体实现,支持MLCK对血管平滑肌增殖的调节作用。然而,尽管MLCK在平滑肌收缩研究中已得到充分研究,但其在平滑肌增殖及凋亡中的作用至今仍尚少见报导。
本实验通过观察ET-1对大鼠肺动脉平滑肌的影响,首先发现ET-1刺激肺动脉平滑肌细胞后MLCK蛋白表达显著增强,MLC磷酸化上调,通过MTT法及[3H]-TdR掺入法证明PASMCs增殖显著;而我们已知细胞周期进程中G1期向S期转化是细胞增殖调控的重要节点,一旦细胞越过G1晚期,则不可逆地进入细胞周期并进行DNA复制[10],本研究进一步通过流式细胞仪检测了细胞周期及凋亡率,发现ET-1抑制了PASMCs凋亡,与以往研究基本相符[11]。研究发现缺氧增加ET-1等细胞因子活性,而ET-1可激活血管平滑肌RhoA[12],故推测MLC磷酸化非Ca2+依赖的Rho/Rho激酶信号通过调节肺血管对ET等的反应引起肺血管重构。有实验也证实慢性缺氧PAH大鼠肺动脉环对ET的收缩反应是依赖Rho/Rho激酶和酪氨酸激酶而非PKC信号通路[13]。但在肺动脉高压PASMCs重构进程中ET-1与MLCK的关系缺乏研究,本研究从细胞层面证实了ET-1也通过MLCK信号途径起作用。MLCK途径是一个Ca2+→CaM→MLCK→MLC的调节环节,该途径的中心环节是MLCK,CaM与Ca2+结合后,能激活MLCK,导致MLC第19位丝氨酸磷酸化,进而肌球蛋白ATP酶活化,平滑肌收缩。Ca2+浓度下降使MLCK失活,MLCP使19位丝氨酸脱磷酸化,ATP酶失活,平滑肌舒张[14]。本研究证实在肺动脉平滑肌重构中Ca2+依赖途径的MLCK也起了重要作用,发现在细胞和分子水平,抑制MLCK信号途径后,MLC磷酸化程度显著下降同时,也抑制了ET-1诱导的PASMCs增殖,同时促进PASMCs凋亡。
可见通过对MLCK的抑制,能调节PASMCs的细胞周期及凋亡率,逆转了ET-1刺激对大鼠肺动脉平滑肌细胞增殖与凋亡失衡的影响,提示MLCK在肺动脉高压肺血管重构过程中可能发挥了重要作用,可望成为肺动脉高压基因治疗的新靶点。
[参考文献]
[1]Wei B,Du JB,Qi JG,et al.L-Arginine impacts pulmonary vascular structure in rats with an aortocaval shunt[J].J Surg Res,2002,108(1):20-31.
[2]Jacobs A,Preston IR,Gomberg-Maitland M.Endothelin receptor antagonism in pulmonary arterial hypertension-a role for selective ET(A)inhibition?[J].Curr Med Res Opin,2006,22(12):2567-2574.
[3]胡红玲,汪涛,张珍祥,等.Diazoxide缺氧大鼠肺动脉平滑肌细胞内氧自由基的变化及细胞增殖的作用[J].中国病理生理杂志,2007,23(10):2002-2006.
[4]Li S,Tanaka H,Wang HH,et al.Intracellular signal transduction for migration and actin remodeling in vascular smoothmusclecellsaftersphingosylphosphorylcholine stimulation[J].Am J Physiol Heart Circ Physiol,2006,291(3):H1262-H1272.
[5]吴强,杨永曜,李隆贵,等.非诺贝特和吡格列酮对血管紧张素Ⅱ介导的心肌细胞肥大和凋亡的干预作用[J].中华高血压杂志,2007,15(3):233-237.
[6]Kamm E,Stull JT.Dedicated myosin light chain kinases with diverse cellular functions[J].J Biol Chem,2001,276(7):4527-4530.
[7]Kohama K.Targeting of myosin light chain kinase in smooth muscle cell[J].Nippon Yakurigaku Zasshi,1999,114(Suppl 1):71-74.
[8]Shen Q,Rigor RR,Pivetti CD,et al.Myosin light chain kinase in microvascular endothelial barrier function[J].Cardiovasc Res,2010,87(2):272-280.
[9]李德来,邓为民,李宏钊.肌球蛋白轻链激酶对大鼠平滑肌细胞增殖的影响[J].中国老年学杂志,2014,7 (34):3952-3953.
[10]Coleman ML,Marshall CJ,Olson MF.RAS and RHO GTPases in G1-phase cell-cycle regulation[J].Nat Rev Mol Cell Biol,2004,5(5):355-366.
[11]Jankov RP,Kantores C,Belcastro R,et al.Endothelin-1 inhibits apoptosis of pulmonary arterial smooth muscle in the neonatal rat[J].Pediatr Res,2006,60(3): 245-251.
[12]Sakurada S,Okamoto H,Takuwa N,et al.Rho activation in excitatory agonist-stimulated vascular smooth muscle[J].Am J Physiol Cell Physiol,2001,281(2):C571-C578.
[13]Eigand L,Sylvester JT,Shimoda LA.Mechanisms of endothelin-1-induced contraction in pulmonary arteries from chronically hypoxic rats[J].Am J Physiol Lung Cell Mol Physiol,2006,290(2):L284-L290.
[14]Kuhr FK,Smith KA,Song MY,et al.New mechanisms of pulmonary arterial hypertension:role of Ca2+signaling[J].Am J Physiol Heart Circ Physiol,2012,302(8): H15466-H1562.
Effects of inhibiting myosin light chain kinase on endothelin-1 induced proliferation and apoptosis of pulmonary arterial smooth muscle cells in rats
YANG Yong-yao,YANG Tian-he,JIANG Qing-an,YANG Long,TANG Feng,TAN Hong-wen
(Department of Cardiology,Guizhou Provincial People’s Hospital,Guiyang 550002,China.E-mail:yangyy19@hotmail.com)
AIM:To investigate the effect of inhibiting myosin light chain kinase(MLCK)on endothelin-1 (ET-1)induced proliferation and apoptosis of rat pulmonary artery smooth muscle cells(PASMCs).METHODS:Rat PASMCs were cultured and stimulated with ET-1.The cells were randomly divided into control group,ET-1 group and ET-1+MLCK inhibitor group(ET-1+M).Western blotting,MTT assay,[3H]-TdR incorporation and flow cytometry were employed to test the expression of myosin light chain(MLC)and MLCK,cell proliferation,cell cycle and apoptotic rate of PASMCs,respectively.The phosphorylation of MLC was determined by glycerol-PAGE coupled with Western blotting.RESULTS:Compared with control group,the protein expression of MLCK and MLC phosphorylation significantly enhanced after ET-1 stimulation.ET-1 markedly induced the proliferation and decreased the percentage of apoptotic rate in the PASMCs.However,pretreatment with ML-7,a MLCK inhibitor,significantly reversed the above effects induced by ET-1.CONCLUSION:MLCK inhibitor effectively inhibits the ET-1-induced proliferation and the cell cycle progression.
Myosin light chain kinase;Endothelin-1;Pulmonary artery smooth muscle cells;Cell proliferation;Apoptosis
R363;R393
A
10.3969/j.issn.1000-4718.2015.02.012
1000-4718(2015)02-256-05
2014-08-26
2014-10-28
贵州省科技攻关项目(黔科合SY字[2008]3065号);贵州省优秀科技教育人才省长资金(黔省专合字[2009]
33号)
△通讯作者Tel:0851-5922979;E-mail:yangyy19@hotmail.com
