限食8周对大鼠不同类型骨骼肌收缩功能及线粒体生物合成的影响*
2015-05-16邱霓李聪方伟进何玉莲韦雪梅熊燕
邱霓,李聪,方伟进,何玉莲,韦雪梅,熊燕
(广州医科大学药学院,广州蛇毒研究所,广东 广州 510182)
·论著·
限食8周对大鼠不同类型骨骼肌收缩功能及线粒体生物合成的影响*
邱霓▲,李聪▲,方伟进,何玉莲,韦雪梅,熊燕△
(广州医科大学药学院,广州蛇毒研究所,广东 广州 510182)
目的:探讨限食对不同类型骨骼肌收缩功能和线粒体生物合成的影响,为阐明限食的有益作用及机制提供实验依据。方法:每天按正常大鼠摄食量的60%饲养动物以制备限食8周大鼠模型,麻醉下分离比目鱼肌和趾长伸肌,记录电刺激诱导骨骼肌单次、强直和疲劳收缩,观测线粒体基因细胞色素C氧化酶I亚基(COX I)和核基因β-actin拷贝数的比值以反映线粒体生物合成,检测骨骼肌ATP含量以反映线粒体功能。结果:限食8周对电刺激诱导的比目鱼肌和趾长伸肌的单次和强直收缩均有增强作用,但仅提高比目鱼肌的抗疲劳作用;限食也增加两种肌肉的ATP含量,但对比目鱼肌更明显;限食虽对2种肌肉腺苷酸活化蛋白激酶(AMPK)的磷酸化具有增加作用,但只上调比目鱼肌内线粒体生物合成及其调节基因PGC-1α和NRF的转录。结论:限食8周增强大鼠比目鱼肌和趾长伸肌对电刺激的收缩反应,尤其对富含氧化型肌纤维的比目鱼肌更明显;其机制除与限食促进这2种肌肉AMPK活化、增加ATP供应以外,还与上调比目鱼肌线粒体生物合成及其调控因子有关。
限食;比目鱼肌;趾长伸肌;骨骼肌收缩;线粒体生物合成
线粒体能量代谢的调节功能下降常被作为疾病和衰老的标志。线粒体作为糖脂代谢和机体供能的重要场所,其主要分布在能量需求高的组织中,如骨骼肌、肝脏、心脏、棕色脂肪等。骨骼肌作为维持机体能量代谢平衡的主要器官之一,其收缩功能也依赖于线粒体提供ATP。肌肉质量和收缩能力的渐行性下降是骨骼肌衰老的一个主要特征,骨骼肌内线粒体DNA突变增加、线粒体相关酶活性降低、线粒体含量减少等线粒体功能衰退的表现都是导致骨骼肌衰老的主要原因[1]。
骨骼肌并非由单一肌纤维组成。在小腿骨骼肌中,比目鱼肌(soleus,SOL)主要为慢收缩纤维,其富含线粒体和氧化代谢酶,以有氧代谢为主要能量来源;趾长伸肌(extensor digitorum longus,EDL)内富含快收缩纤维,线粒体含量少,主要以糖酵解的方式获取能量。慢收缩纤维的葡萄糖、脂肪酸摄取率和氧化能力均较快收缩纤维高[2],有研究证实慢收缩纤维的胰岛素诱导葡萄糖摄取率比快收缩纤维要高出近2倍[3];衰老所致的胰岛素抵抗在慢收缩纤维中表现得更加明显[4];限食被证实可增加两类肌纤维的胰岛素敏感性,但胰岛素诱导的胰岛素信号通路蛋白Akt的下游效应分子Akt底物蛋白160(AS160)磷酸化仅在慢收缩纤维中有升高[5]。因此,不同类型骨骼肌除了线粒体含量存在差异外,其代谢特性也有明显的差别。
适当的限食(calorie restriction,CR;即在不引起营养不良的情况下,每日仅摄入正常饮食的60%~70%)被证实无论在哺乳动物还是单细胞生物中均可起到延缓衰老,延长寿命的作用[6],然而其机制尚不明确。限食干预对不同类型骨骼肌的收缩功能和线粒体功能的影响是否一致也尚未见报道。因此,本实验拟每天给予对照组动物摄食量的60%以制备限食8周大鼠模型,观测比目鱼肌和趾长伸肌收缩功能和线粒体生物合成的变化,比较其影响是否存在差异,并探讨存在差异的可能机制,为限食对抗衰老的研究提供新的实验依据。
材料和方法
1 动物喂养与分组
SPF级雄性SD大鼠40只,体重(200±15)g,购自于广东省实验动物中心,动物合格证号为SYXK (粤):2010-0104。所有动物适应性饲养1周后,随机分为2组,即自由饮食对照(control)组和CR组,每组10只,实验周期为8周。限食组投食量根据(正常组摄食量/正常组体重×限食组体重×60%)计算,每天分2次投放。
2 实验方法
2.1 骨骼肌收缩功能测定实验干预后,腹腔注射10%水合氯醛(300 mg/kg)麻醉大鼠,迅速分离左侧比目鱼肌和趾长伸肌,置于预冷充氧的K-H缓冲液中;将骨骼肌条穿过电极刺激环的中央,固定于恒温37℃、持续充以95%O2和5%CO2混合气体的KH缓冲液浴槽中,平衡10 min后,调整肌条到最适长度;随后分别给予单次刺激(10 V电压、100 ms波宽的脉冲电刺激肌条)、强直刺激[10 V电压、0.2 ms波宽、60 Hz(比目鱼肌)/90 Hz(趾长伸肌)频率的脉冲电刺激肌条2 s]以及疲劳刺激[10 V电压,0.5 ms波宽,60 Hz(比目鱼肌)/90 Hz(趾长伸肌)频率的脉冲电刺激肌条,电刺激1 s,休息1 s,依次交替地进行,持续120 s],采用Power Lab八道电生理记录仪和Labchart7数据采集分析系统控制电刺激强度,并记录数据。每次刺激前均需使肌条在恒温37℃、持续充以95%O2和5%CO2混合气体的K-H缓冲液中平衡15 min。
2.2 骨骼肌ATP含量检测采用荧光素酶法检测ATP含量,并通过各样本的蛋白含量进行最终标化。ATP检测试剂盒和BCA蛋白测定试剂盒均购自碧云天生物技术有限公司。
2.3 线粒体生物合成测定酚/氯仿法提取比目鱼肌和趾长伸肌的基因组DNA,取总DNA 100 ng为模板,加入到20 μL PCR反应体系中,反应条件为94℃3 min;95℃3 min,60℃20 s,72℃30 s,22个循环;72℃7 min。PCR产物经1.5%琼脂糖凝胶电泳后进行凝胶图像分析,以细胞色素C氧化酶I亚基(cytochrome C oxidase subunit I,COX I)与β-actin的比值反映线粒体生物合成情况。引物序列见表1。
2.4 RT-PCR检测过氧化物酶体增殖物激活受体γ辅激活因子1α(peroxisome proliferator-activated receptor γ coactivator 1α,PGC-1α)和核呼吸因子(nuclear respiratory factor,NRF)mRNA表达Trizol法提取比目鱼肌和趾长伸肌的RNA,取总RNA 500 ng为模板,用MMLV cDNA合成试剂盒进行逆转录反应合成cDNA。取50 ng cDNA加入到20 μL PCR反应体系中,反应条件为94℃3 min;95℃3 min,58℃20 s,72℃30 s,28个循环;72℃7 min。PCR产物经1%琼脂糖凝胶电泳后进行凝胶图像分析。引物序列见表1。
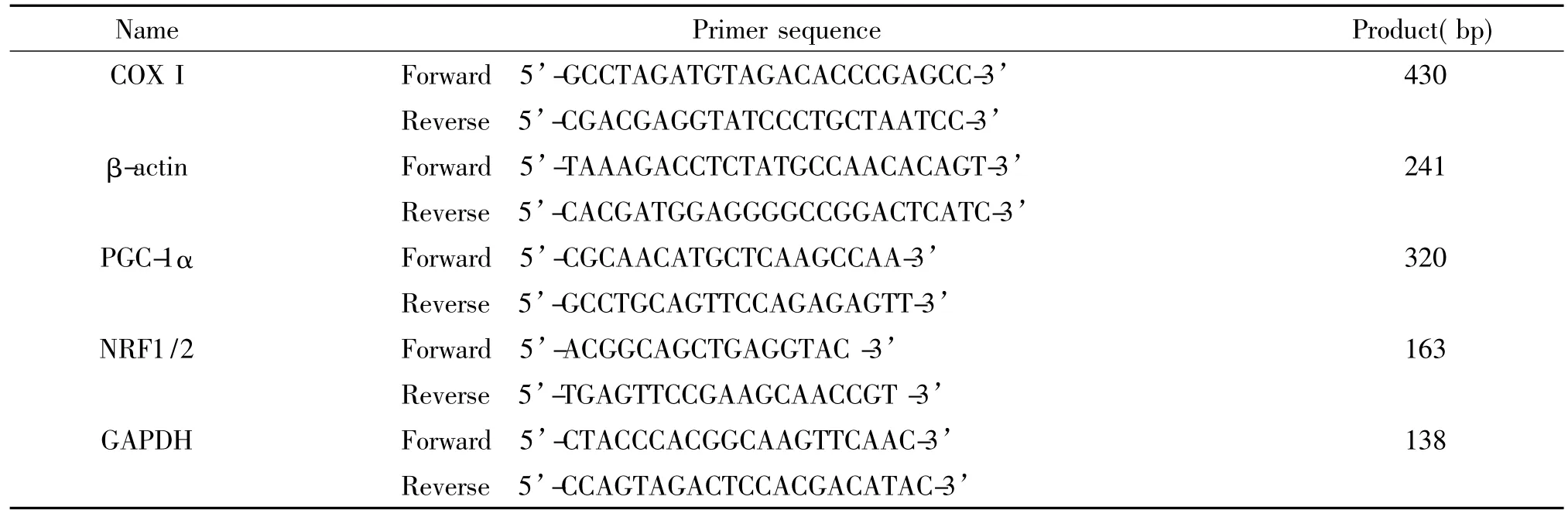
表1 引物序列Table 1.The sequences of primers for PCR
2.5 Western blotting检测腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)和磷酸化AMPK蛋白的表达取50 mg比目鱼肌和趾长伸肌样本置于500 μL预冷的RIPA裂解液中,冰上电动匀浆20 s,于4℃以12 000×g离心15 min,取上清。采用BCA蛋白测定试剂盒测定蛋白浓度。取30 μg蛋白进行SDS-PAGE,湿转法将蛋白转至PVDF膜上,分别孵育相应的I抗和II抗,ECL发光液显影后,通过ChemiDoxTMXRS+凝胶成像系统采集图像,使用ImageJ软件进行灰度扫描。其中p-AMPK (Thr172)、AMPK抗体购自Cell Signaling Technology。2.6骨骼肌一氧化氮合酶(NO synthetase,NOS)活性、NO含量、超氧化物歧化酶(superoxide dismutase,SOD)活性及丙二醛(malondialdehyde,MDA)含量测定采用比色法检测NOS活性,采用硝酸还原酶法检测NO含量,试剂盒购于南京建成生物有限公司。采用WST催化-抑制法检测总SOD活性,采用硫代巴比妥酸法测定MDA含量,试剂盒购于广州碧云天生物技术有限公司。各样本中的蛋白含量通过广州碧云天生物技术有限公司的BCA蛋白测定试剂盒测定,各指标均需通过各样本的蛋白含量进行最终标化。
3 统计学处理
所有数据均以均数±标准差(mean±SD)表示,利用SPSS 11.5和Prism 5.0统计软件分析。所有数据进行正态性检验。两组样本均数比较采用两个独立样本的t检验,以P<0.05为差异有统计学意义。
结果
1 限食8周对大鼠骨骼肌收缩功能的影响
无论是比目鱼肌还是趾长伸肌,限食8周均可导致肌肉重量明显减少,其中以趾长伸肌重量下降更显著(P<0.01)。与对照组相比,限食组比目鱼肌和趾长伸肌给予单次刺激和强直刺激后,其收缩能力明显高于正常对照组(P<0.05)。疲劳刺激120 s后,比目鱼肌的收缩力仍然维持在35%以上,说明其抗疲劳能力明显强于正常对照组(P<0.05);而趾长伸肌疲劳刺激120 s后收缩水平将至10%以下,与正常对照组无明显差别,见图1。
2 限食8周对大鼠骨骼肌ATP含量的影响
限食8周后大鼠比目鱼肌和趾长伸肌内ATP含量均较正常对照组升高约2倍(P<0.01或P<0.05)。无论是正常对照组还是限食组,比目鱼肌ATP的含量均显著低于趾长伸肌,见图2。
3 限食8周对大鼠骨骼肌线粒体生物合成的影响
COX I是调控线粒体氧化磷酸化水平的主要线粒体呼吸链酶之一,仅在线粒体中有表达,故线粒体基因COX I和核基因β-actin拷贝数的比值可一定程度反映线粒体的含量。限食干预后,比目鱼肌内COX I/β-actin比值明显增加(P<0.01),而趾长伸肌内COX I/β-actin比值无改变,见图3。
4 限食8周对骨骼肌线粒体生物合成调节的影响
限食8周可显著诱导比目鱼肌中调控线粒体功能的PGC-1α及其下游NRF mRNA的表达(P<0.05);但对趾长伸肌内PGC-1α和NRF mRNA的表达无明显诱导作用,见图4。
5 限食8周对骨骼肌AMPK表达的影响
限食8周后,比目鱼肌和趾长伸肌中p-AMPK/ AMPK比值均较正常对照组明显升高(P<0.01或P<0.05),其中以比目鱼肌内p-AMPK/AMPK比值升高的幅度更显著,见图5。
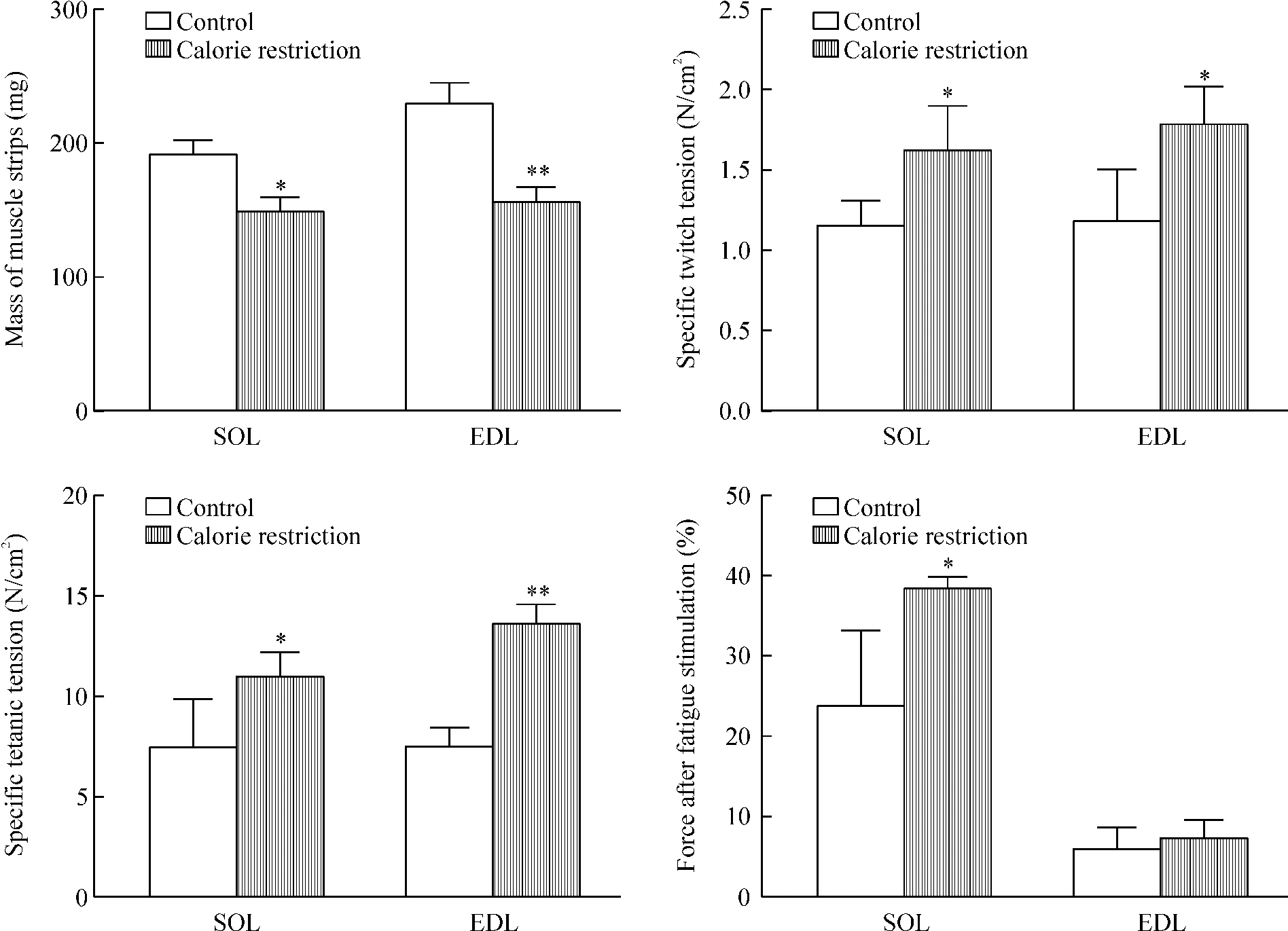
Figure 1.Calorie restriction for 8 weeks increased the contractility of SOL and EDL.Mean±SD.n=4~5.*P<0.05,**P<0.01 vs control.图1 限食8周增加比目鱼肌和趾长伸肌收缩功能
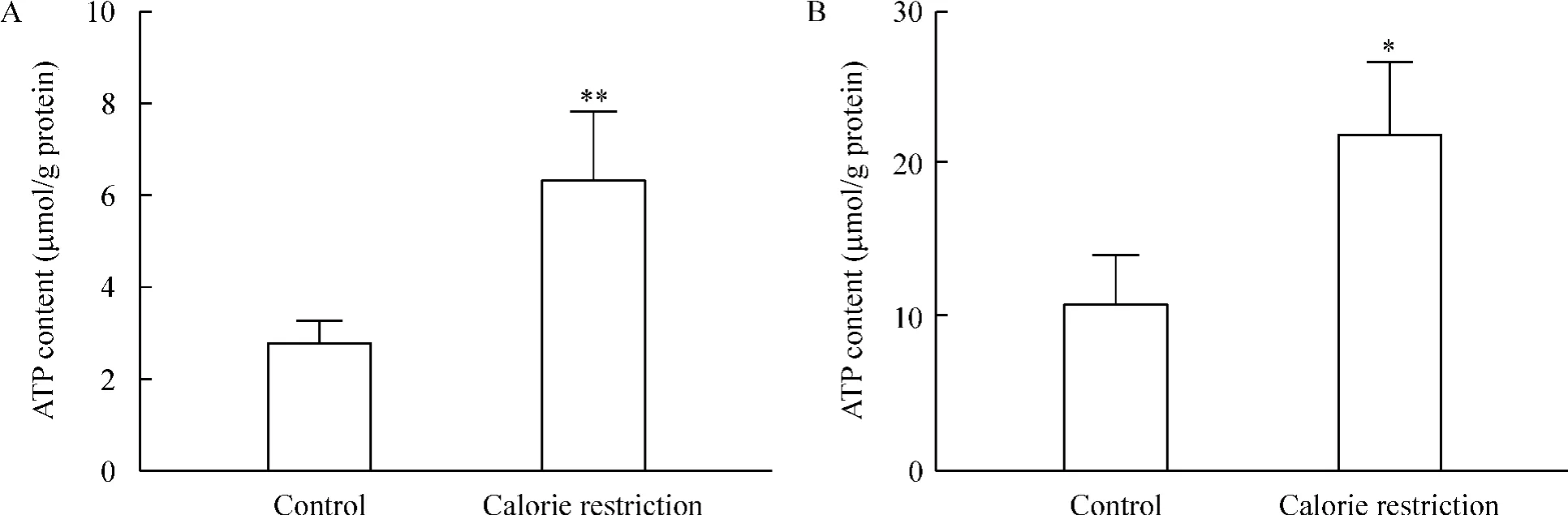
Figure 2.Calorie restriction for 8 weeks increased ATP content in SOL(A)and EDL(B).Mean±SD.n=4~5.*P<0.05,**P<0.01 vs control.图2 限食8周增加比目鱼肌和趾长伸肌ATP含量
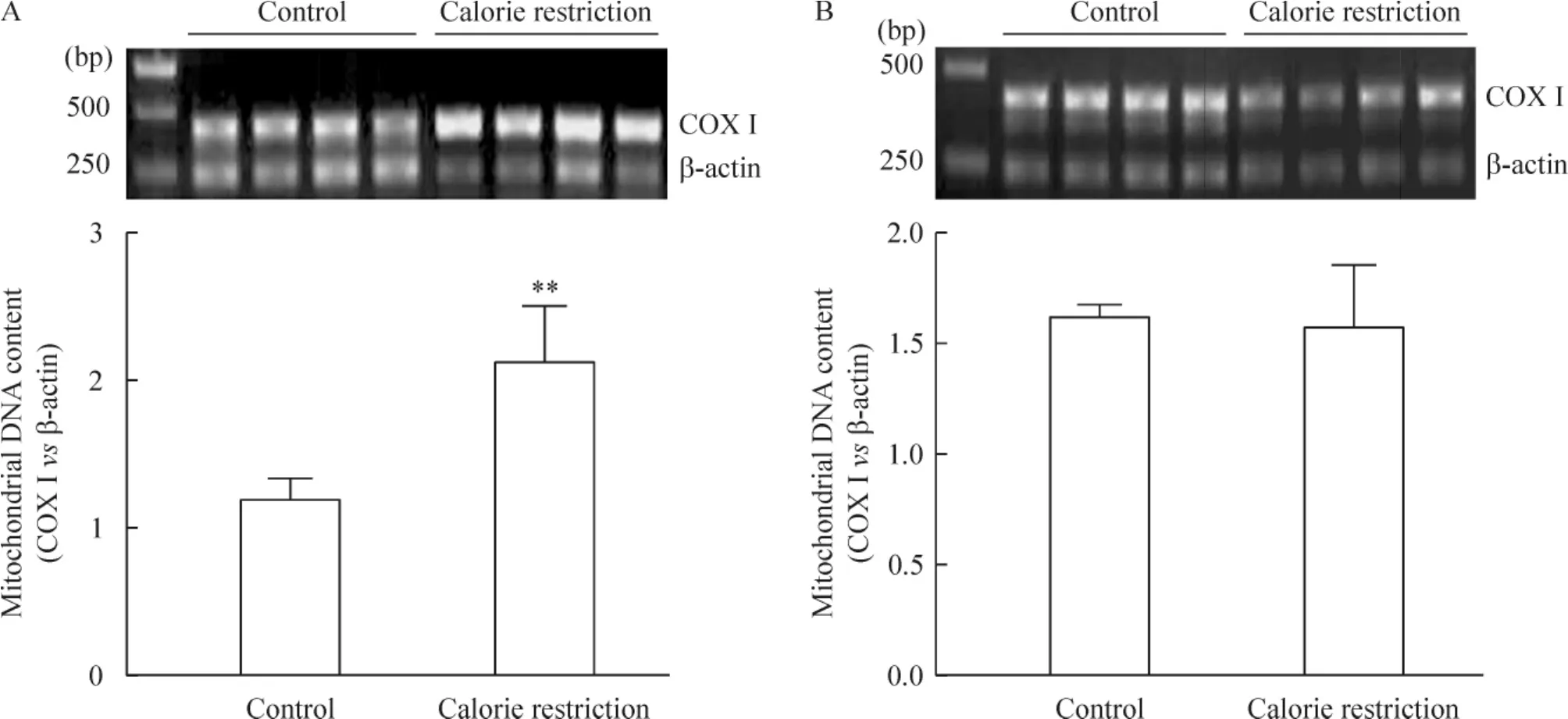
Figure 3.PCR results of COX I and β-actin DNA contents in SOL(A)and EDL(B)with or without calorie restrction for 8 weeks.Mean±SD.n=4.**P<0.01 vs control.图3 限食8周增加比目鱼肌线粒体生物合成
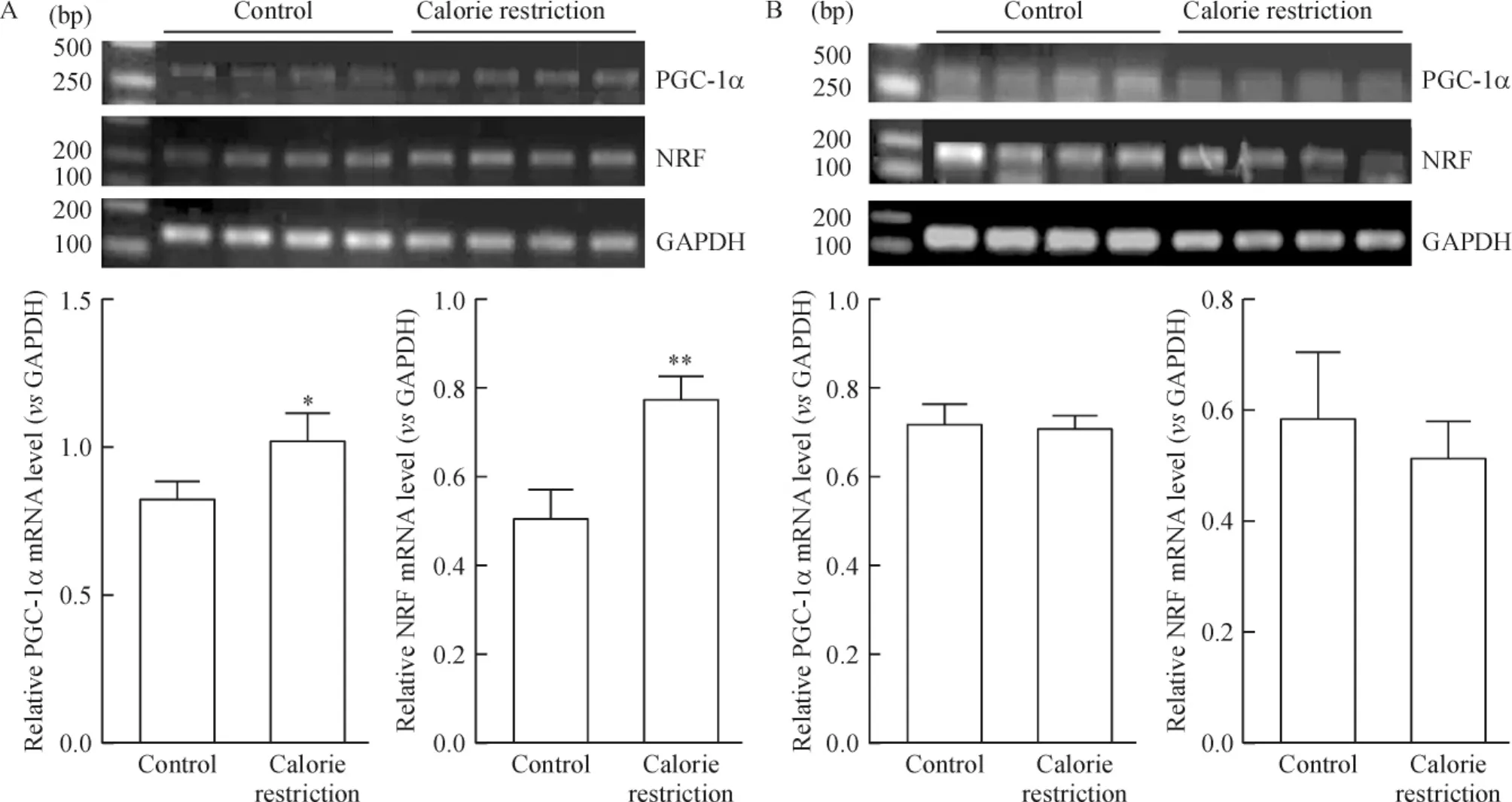
Figure 4.The results of RT-PCR for mRNA expression of PGC-1α,NRF and GAPDH in SOL(A)and EDL(B)with or without calorie restriction for 8 weeks.Mean±SD.n=3.*P<0.05 vs control.图4 限食8周上调比目鱼肌PGC-1α和NRF mRNA表达
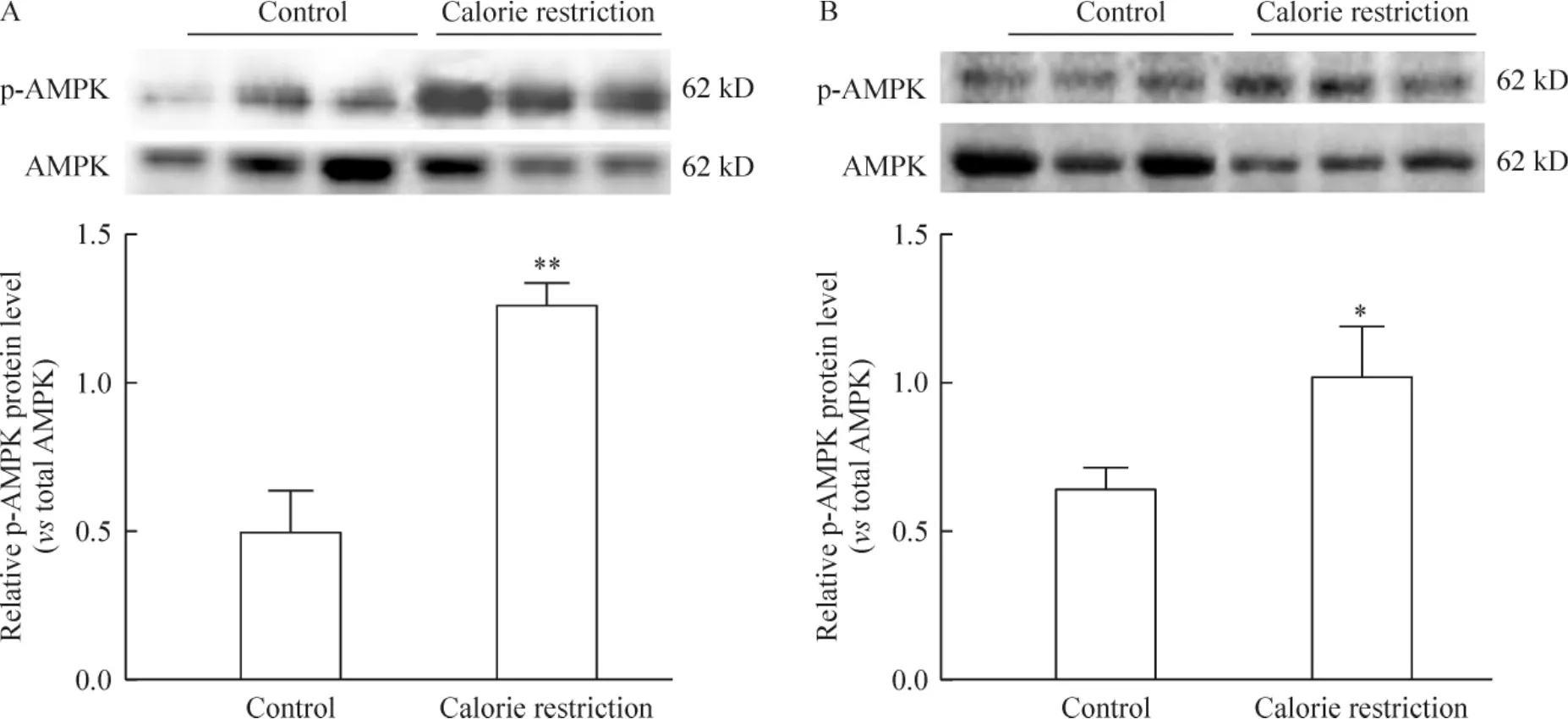
Figure 5.The results of Western blotting for p-AMPK and total AMPK protein levels in SOL(A)and EDL(B)with or without calorie restriction for 8 weeks.Mean±SD.n=3.*P<0.05,**P<0.01 vs control.图5 限食8周增加比目鱼肌和趾长伸肌AMPK蛋白磷酸化
6 限食8周对骨骼肌NOS活性和NO含量的影响
限食8周导致骨骼肌内NOS活性显著性增加,
伴随下游NO水平明显上调(P<0.05),见图6。
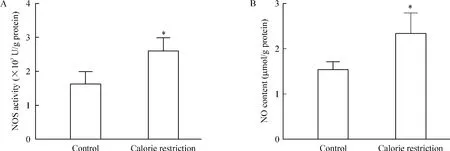
Figure 6.The effects of calorie restriction for 8 weeks on NOS activity(A)and NO content(B)in the skeletal muscles.Mean±SD.n=4~5.*P<0.05 vs control.图6 限食8周增加骨骼肌内NOS活性及NO含量
7 限食8周对骨骼肌内SOD活性和MDA含量的影响
限食8周可使骨骼肌内SOD的活性明显增加(P<0.01),同时骨骼肌内MDA水平显著降低(P<0.05),见图7。
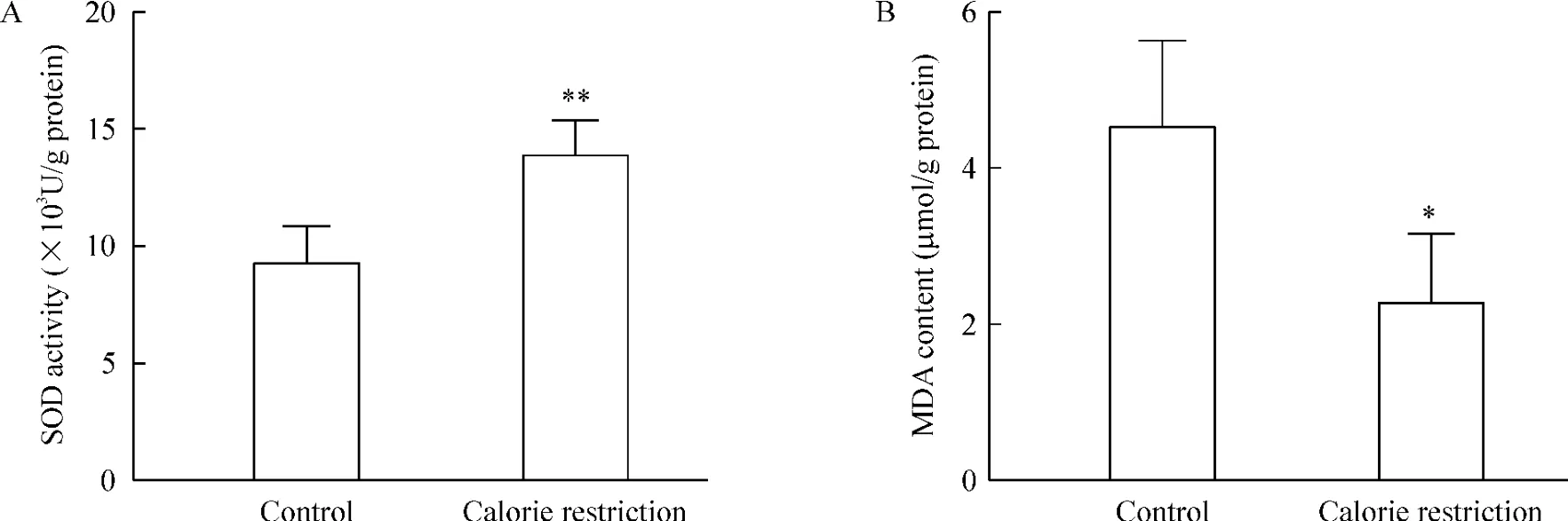
Figure 7.The effects of calorie restriction for 8 weeks on SOD activity(A)and MDA content(B)in the skeletal muscles.Mean± SD.n=4~5.*P<0.05,**P<0.01 vs control group.图7 限食8周缓解骨骼肌内氧化应激水平
讨论
比目鱼肌富含氧化型纤维,趾长伸肌富含糖酵解型纤维,因富含的肌纤维类型不同,导致两种类型的肌肉收缩能力及抗疲劳能力存在差异[7]。本研究发现,限食8周可增强比目鱼肌和趾长伸肌对于单次刺激和强直刺激所诱导的收缩反应,说明两种类型的肌肉在瞬间动员ATP的能力上并未存在明显的差异;但疲劳刺激120 s后,趾长伸肌的收缩力明显下降,基本低于初始收缩力的10%,而比目鱼肌的收缩水平仍维持35%以上,收缩力下降幅度小,表明氧化型纤维经有氧代谢获取能量,其ATP产生的数目多,可有效缓解肌肉疲劳。这些结果与不同类型肌纤维的特性相一致,因为氧化型纤维主要以有氧代谢为主要能量来源,可明显减少乳酸的积聚,从而有效减缓肌肉疲劳,维持运动的持续性。
限食可通过增加线粒体生物合成,增加线粒体DNA含量、线粒体生物合成调节基因如PGC-1a、NRF-1、Tfam的表达以及细胞色素C氧化酶的活性,从而缓解因衰老所致的线粒体功能衰退[8]。然而,限食对骨骼肌内线粒体生物合成的影响并不一致。转录辅激活因子PGC-1α作为能量代谢网络的关键因子,可与编码线粒体代谢的众多基因直接结合,促进线粒体基因的复制和转录,调控线粒体的呼吸速率,参与调节细胞能量代谢[9]。有研究发现,限食干预的雄性Wistar大鼠骨骼肌中PGC-1α mRNA和蛋白、线粒体相关基因mRNA、柠檬酸合成酶活性均未发生明显地变化[10];而Miller等[11]在限食雄性B6D2F1小鼠的骨骼肌中发现PGC-1α mRNA水平被明显上调;Hempenstall等[12]也观察到长期给予30%限食的C57BL/6小鼠腓肠肌内的PGC-1α蛋白以及线粒体相关基因,如PGC-1α、NRF1、COX IV等mRNA水平均明显增加。本研究结果显示,限食主要增加比目鱼肌中PGC-1α mRNA的表达,导致线粒体呼吸链关键酶之一COX I基因的表达升高和NRF的转录增加;但在趾长伸肌中并未出现此变化。这些结果提示,限食干预后,在能量代谢底物供给不足的情况下,机体为节约底物的消耗,更加倾向于通过有氧代谢来产生更多的能量,以满足机体需要,因此比目鱼肌细胞内线粒体的氧化代谢能力和生物合成明显增强;相反,糖酵解为主的趾长伸肌内线粒体的氧化代谢作用则相对降低。
AMPK作为能量的感受器,在维持细胞内能量平衡中起着主要作用。在限食等能量匮乏时,AMP/ ATP比值增加,AMPK被激活,导致分解代谢增加而合成代谢被抑制,葡萄糖转运、脂肪酸氧化以及线粒体呼吸相关基因的表达上调,脂肪合成相关基因的表达下调,ATP合成增多[13]。研究证实,小鼠骨骼肌特异性表达AMPK无功能基因或敲除AMPK基因,导致其骨骼肌无法在能量被剥夺的情况下做出适应性的改变,线粒体生物合成能力受损,限食诱导的脂肪酸氧化基因无法被激活[14]。另外,AMPK可直接磷酸化PGC-1α,增加PGC-1α的转录活性,因此无论在正常生理情况下还是能量需求情况下,AMPK对线粒体功能的调控中均发挥着重要作用[15-16]。本研究观察到限食8周可增加比目鱼肌和趾长伸肌中p-AMPK/AMPK比值,提示两种类型的肌纤维在能量代谢底物不足的情况下,均发生了代偿性的变化,以最大限度满足机体对能量的需求。比目鱼肌可能通过增加代谢底物的多样性,包括增加对脂肪酸氧化,增加线粒体数目等,达到增加ATP合成的效果;而趾长伸肌由于自身代谢特性,可利用的能量代谢底物较单一,因此仅能通过提高已存在的线粒体氧化代谢效率来增加ATP的合成。
线粒体不仅是产生能量的主要场所,也是细胞内氧自由基的主要来源。当线粒体功能障碍时,氧化应激增加,表现为细胞对氧自由基的清除能力降低,细胞内氧自由基生成增加,导致线粒体呼吸链复合物酶活性被抑制,诱导线粒体DNA发生突变,从而使线粒体出现损伤[17]。MDA是一种脂质过氧化的产物,其含量的增加被认为是自由基与脂质发生过氧化反应引起细胞膜损伤的结果;而SOD是线粒体重要的抗氧化酶,是清除自由基的重要物质。另外,NO不仅时促进线粒体生物合成的重要因子,也是机体清除自由基的重要物质,其水平也随着衰老而减少[18-19];NOS可通过合成NO直接调控PGC-1α的转录活性,或者通过AMPK协同影响PGC-1α的转录活性,从而达到调控线粒体生物合成的作用[20]。本研究观察到限食8周增加骨骼肌NOS活性,升高NO水平,显著增加SOD活性,明显降低MDA含量,提示限食可增加骨骼肌对自由基的清除,阻止线粒体膜脂质过氧化,提高骨骼肌线粒体的抗氧化能力,从而减少骨骼肌线粒体的氧化损伤。
本实验结果表明,限食可增加骨骼肌的收缩能力,改善线粒体功能,但在不同类型骨骼肌中作用有所差异。其中,限食干预可显著增加比目鱼肌的单次、强直收缩和抗疲劳能力,这可能与AMPK活化,上调PGC-1α转录活性,增加线粒体生物合成有关;而趾长伸肌经限食干预后虽因可改善其单次、强直收缩能力,但抵抗肌肉疲劳的作用效果不明显,可能与其线粒体氧化代谢和生物合成能力受限有一定的关系。
[1]Peterson CM,Johannsen DL,Ravussin E.Skeletal muscle mitochondria and aging:a review[J].J Aging Res,2012,2012:194821.
[2]Dyck DJ,Peters SJ,Glatz J,et al.Functional differences in lipid metabolism in resting skeletal muscle of various fiber types[J].Am J Physiol,1997,272(3 Pt 1): E340-E351.
[3]Sharma N,Arias EB,Bhat AD,et al.Mechanisms for increased insulin-stimulated Akt phosphorylation and glucose uptake in fast-and slow-twitch skeletal muscles of calorierestricted rats[J].Am J Physiol Endocrinol Metab,2011,300(6):E966-E978.
[4]Escriva F,Agote M,Rubio E,et al.In vivo insulin-dependent glucose uptake of specific tissues is decreased during aging of mature Wistar rats[J].Endocrinology,1997,138(1):49-54.
[5]Sharma N,Arias EB,Sajan MP,et al.Insulin resistance for glucose uptake and Akt2 phosphorylation in the soleus,but not epitrochlearis,muscles of old vs.adult rats[J].J Appl Physiol(1985),2010,108(6):1631-1640.
[6]Taormina G,Mirisola MG.Calorie restriction in mammals and simple model organisms[J].Biomed Res Int,2014,2014:308690.
[7]Schiaffino S.Fibre types in skeletal muscle:a personal account[J].Acta Physiol(Oxf),2010,199(4): 451-463.
[8]Rizza W,Veronese N,Fontana L.What are the roles of calorie restriction and diet quality in promoting healthy longevity?[J].Ageing Res Rev,2014,13:38-45.
[9]Scarpulla RC.Metabolic control of mitochondrial biogenesis through the PGC-1 family regulatory network[J].Biochim Biophys Acta,2011,1813(7):1269-1278.
[10]Hancock CR,Han DH,Higashida K,et al.Does calorie restriction induce mitochondrial biogenesis?A reevaluation[J].FASEB J,2011,25(2):785-791.
[11]Miller BF,Robinson MM,Bruss MD,et al.A comprehensive assessment of mitochondrial protein synthesis and cellular proliferation with age and caloric restriction[J].Aging Cell,2012,11(1):150-161.
[12]Hempenstall S,Page MM,Wallen KR,et al.Dietary restriction increases skeletal muscle mitochondrial respiration but not mitochondrial content in C57BL/6 mice[J].Mech Ageing Dev,2012,133(1):37-45.
[13]Long YC,Barnes BR,Mahlapuu M,et al.Role of AMP-activated protein kinase in the coordinated expression of genes controlling glucose and lipid metabolism in mouse white skeletal muscle[J].Diabetologia,2005,48(11): 2354-2364.
[14]Wang P,Zhang RY,Song J,et al.Loss of AMP-activated protein kinase-α2 impairs the insulin-sensitizing effect of calorie restriction in skeletal muscle[J].Diabetes,2012,61(5):1051-1061.
[15]Canto C,Auwerx J.PGC-1α,SIRT1 and AMPK,an energy sensing network that controls energy expenditure[J].Curr Opin Lipidol,2009,20(2):98-105.
[16]熊燕,张梅,陈菲,等.线粒体功能障碍与心血管疾病[J].中国病理生理杂志,2013,29(2):364-370.
[17]Wang CH,Wu SB,Wu YT,et al.Oxidative stress response elicited by mitochondrial dysfunction:implication in the pathophysiology of aging[J].Exp Biol Med(Maywood),2013,238(5):450-460.
[18]Borniquel S.Nitric oxide regulates mitochondrial oxidative stress protection via the transcriptional coactivator PGC-1α[J].FASEB J,2006,20(11):1889-1891.
[19]魏星,康毅,刘欣.NO对心肌细胞线粒体功能影响的病理生理学意义[J].中国病理生理杂志,2009,25(8):1656-1659.
[20]Lira VA,Brown DL,Lira AK,et al.Nitric oxide and AMPK cooperatively regulate PGC-1α in skeletal muscle cells[J].J Physiol,2010,588(18):3551-3566.
Effects of calorie restriction for 8 weeks on contractile function and mitochondrial biosynthesis in different types of rat skeletal muscles
QIU Ni,LI Cong,FANG Wei-jin,HE Yu-lian,WEI Xue-mei,XIONG Yan
(Guangzhou Institute of Snake Venom Research and School of Pharmaceutical Sciences,Guangzhou Medical University,Guangzhou 510182,China.E-mail:xiongyan2001@yahoo.com)
AIM:To investigate the influence of calorie restriction(CR)on contractility and mitochondrial biosynthesis in different types of rat skeletal muscles.METHODS:CR rat model was set up by feeding 60%normal food intake of control rat every day for 8 weeks.Soleus(SOL)and extensor digitorum longus(EDL)were isolated under anesthesia.The twitch tension,titanic tension and fatigue resistance of SOL and EDL in response to electrical stimulation were measured to reflect the contractile function of the muscles.The copy number ratio of mitochondrial gene cytochrome C oxidase subunit I(COX I)to nuclear gene β-actin was determined to evaluate the mitochondrial biosynthesis.ATP content was measured to mirror mitochondrial function.RESULTS:Compared with control group,CR for 8 weeks significantly increased twitch tension and titanic tension of both SOL and EDL,but only improved fatigue resistance in SOL.Markedly increase in ATP content in both skeletal muscles by CR intervention was observed,especially in SOL.Although CR activated AMP-activated protein kinase(AMPK)in both 2 muscles,up-regulation of mitochondrial biosynthesis and transcription of mitochondrial regulatory genes peroxisome proliferator-activated receptor γ coactivator 1α(PGC-1α)and nuclear respiratory factor(NRF)was only observed in SOL.CONCLUSION:CR for 8 weeks enhanced the contractility of both rat SOL and EDL in response to electrical stimulation,especially in SOL composed of slow-twitch fibers.The mechanisms may be related to the activation of AMPK and the promotion of mitochondrial biosynthesis in SOL.
Calorie restriction;Soleus;Extensor digitorum longus;Skeletal muscle contractility;Mitochondrial biosynthesis
R337;R339.3+8
A
10.3969/j.issn.1000-4718.2015.02.001
1000-4718(2015)02-193-08
2014-08-15
2014-11-06
国家自然科学基金资助项目(No.81170778);广东省科技计划(No.2013B021800098);广州市科技计划(No.2014J4100067)
△通讯作者Tel:020-81340352;E-mail:xiongyan2001@yahoo.com
▲并列第1作者
