线粒体蛋白SIRT5调节代谢性蛋白翻译后修饰作用研究进展
2015-05-11刘率男申竹芳
王 悦,刘率男,申竹芳
(中国医学科学院 北京协和医学院 药物研究所 天然药物活性物质与功能国家重点实验室,北京100050)
线粒体是参与细胞内能量代谢、信号通路传递及凋亡等过程的重要细胞器。其主要生理作用是维持氧化磷酸化过程、保持氧自由基正常水平以及维持其自身稳态[1],线粒体功能与维持正常细胞状态密切相关。蛋白翻译后修饰是蛋白功能调控的重要手段之一,其中赖氨酸残基是一系列翻译后修饰过程的主要作用位点,较为常见的翻译后修饰形式为酰基化,包括乙酰化、琥珀酰化和丙二酰化等[2],以上几种酰基化修饰形式均受到Sirtuin蛋白家族直接调控[3]。
Sirtuin(或Sir2,Silent information regulator 2 family)为高度保守的烟酰胺腺嘌呤二核苷酸(NAD+)依赖的去乙酰化酶及单个ADP-核糖基转移酶[4]。哺乳动物中共存在7种Sirtuin蛋白(Sirt1-7),其亚细胞分布有所差异。线粒体中主要有SIRT3、SIRT 4 及SIRT5 三种亚型[5-6],SIRT5 恰好位于线粒体内能量代谢的交叉点,可同时感知细胞内氧化还原状态以及代谢需求。另外,SIRT5的乙酰基供体分子,包括乙酰辅酶A、丙二酰辅酶A 以及琥珀酰辅酶A 等,均是能量代谢过程中的重要组分[7]。除赖氨酸乙酰化外,SIRT5 催化的蛋白去琥珀酰化也涉及到多种代谢过程中关键酶的翻译后修饰(如氨基酸降解、三羧酸循环及脂肪酸代谢)[8-9]。
随着对SIRT5 可能参与的代谢环节及生理功能的深入挖掘,其调节能量稳态的潜在作用逐渐为人们所关注。本文将对已报道的SIRT5在线粒体能量、物质代谢中及细胞氧化应激、凋亡过程中的调控作用作一综述。
1 SIRT5在能量代谢中的作用
SIRT5 具有去琥珀酰化作用,对呼吸链复合物V(respiratory chain complex V)中寡霉素敏感相关蛋白(oligomycin sensitivity conferring protein,OSCP)亚基上存在的多个琥珀酰化位点具有调控作用[10]。此外,SIRT5 还可通过调节丙酮酸脱氢酶复合体(pyruvate dehydrogenase complex,PDHC)和琥珀酸脱氢酶复合物(succinate dehydrogenase complex subunit A,SDHA)的生物活性,调控细胞的呼吸作用[9]。
针对小鼠模型进行的蛋白组学研究证明,赖氨酸乙酰化及琥珀酰化等现象存在于细胞及核蛋白中[11],并且可能对于线粒体外胞内蛋白翻译后修饰具有一定调控作用。SIRT5 敲除小鼠肝脏中的PDHC 以及小鼠胚胎成纤维细胞(mouse embryo fibroblast,MEF)中的SDHA 均发生过琥珀酰化,随后在体外实验中证明SIRT5 可抑制PDHC 活性;与此同时,人类胚胎肾细胞中也得到证明,SIRT5 对于PDHC 以及SDHA 酶活性具有负调控作用。上述研究均表明,SIRT5 可通过去琥珀酰化作用调控能量代谢相关酶。
2 SIRT5在物质代谢中的作用
目前,已知的SIRT5 去乙酰化靶蛋白多涉及脂肪酸代谢、酮体生成、TCA 循环以及ATP 合成等代谢相关通路。SIRT5 敲除小鼠会发生脂肪酸氧化过程障碍,肝脏和骨骼肌中脂肪酸氧化代谢中间产物蓄积;另外,在禁食条件下,SIRT5 敲除会导致肝脏酮体生成减少,并出现羟甲基戊二酰辅酶A 合成酶2(hydroxymethylglutaryl CoA synthase 2,HMGCS2)的高琥珀酰化。目前研究认为,SIRT5 参与调控多种代谢相关分子,其间相互影响,相互作用,对于机体维持能量和物质代谢稳态具有重要作用。
2.1 SIRT5 与尿素循环
除具有较弱的去乙酰化活性以外,SIRT5 针对氨甲酰磷酸合成酶(carbamoyl phosphate synthetase 1,CPS1)还存在去琥珀酰化及去丙二酰化的选择性作用。CPS1 在相同赖氨酸残基(K44、K287 和K1291)上,既存在乙酰化,又有琥珀酰化两种翻译后修饰方式,SIRT5 敲除后仅导致K1291位琥珀酰化水平上调,但并不影响K44 及K287的琥珀酰化以及3个位点的乙酰化水平,提示SIRT5 对蛋白的修饰作用可能具有一定选择性。
除上述作用外,SIRT5 还具有一种全新蛋白翻译后修饰方式,即赖氨酸去戊二酰化。现已知CPS1 也是SIRT5 赖氨酸去戊二酰化修饰的靶蛋白之一[12],至此,究竟CPS1的激活来源于SIRT5的哪一种修饰方式?是翻译后修饰还是涉及到其他乙酰化赖氨酸作用位点,其调节作用机制尚待进一步研究。
2.2 SIRT5 与脂肪酸代谢
SIRT5在某些特定的线粒体蛋白赖氨酸残基去丙二酰化过程中起到重要作用,并且可通过去丙二酰化作用抑制丙二酰辅酶A的活性[13]。丙二酰辅酶A 参与脂肪酸生物合成以及酮体生成,而胞内丙二酰辅酶A 含量与可逆羧化反应密切相关。丙二酰辅酶A 由胞浆内乙酰辅酶A 羧化酶(acetyl-CoA carboxylase,ACC)或人源细胞线粒体内丙酰辅酶A去羧化酶催化乙酰辅酶A(malonyl-CoA decarboxylase,MCD)产生[14]。MCD 可通过脱羧作用将胞浆和线粒体内的丙二酰辅酶A 转化为乙酰辅酶A[15]。除了充当脂肪酸生物合成的前体物质以外,丙二酰辅酶A 还可通过抑制线粒体内肉碱棕榈酰转移酶活性(carnitine palmitoyl transferase 1,CPT1),下调脂肪酸氧化[16]。因此,SIRT5 通过去丙二酰化作用可解除丙二酰辅酶A 对于脂肪酸氧化分解代谢的抑制作用,从而促进脂肪酸氧化。
3 SIRT5在细胞氧化应激及凋亡中的作用
3.1 SIRT5 与细胞氧化应激
SIRT5 可调节Cu/Zn 超氧化物歧化酶1(SOD1)的活性。SOD1是一种重要抗氧化酶,SOD1 缺乏与多种人类疾病相关。SOD1 经过琥珀酰化修饰后活性降低,而SIRT5 与其结合则可使SOD1 去琥珀酰化进而激活SOD1。当SOD1 与SIRT5 共表达时,可明显增强SOD1 调控的ROS 消除效应。另外,SOD1 琥珀酰化位点突变可以抑制肺癌细胞生长[17],该研究提示,SIRT5 对于氧化应激条件下的细胞可能具有一定的保护作用,属于一种细胞保护因子。
3.2 SIRT5 与细胞凋亡
氧化应激诱导的大鼠心肌细胞凋亡模型中,SIRT5表达水平显著降低[18],过表达SIRT5 对于H2O2诱导的心肌细胞凋亡具有保护作用,并且这种抗凋亡作用与SIRT5 和Bcl-XL 之间的相互作用密切相关。SIRT5在胞内与细胞色素C 共定位,并且具有细胞色素C 去乙酰化作用,可能与其抗凋亡功能相关[19],但SIRT5 对于细胞色素C的去乙酰化作用是否会对线粒体呼吸链产生影响?尚待进一步研究。
人类SIRT5 具有酶活性相关的多态性[20-21],SIRT5 启动子区域的基因多态性可导致基因表达水平下降。由于SIRT5 突变基因与颈动脉斑块(动脉粥样硬化标志物)相关,SIRT5 基因突变可能提高动脉粥样硬化风险[22]。
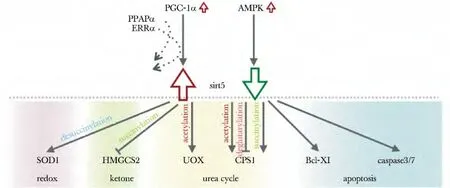
图1 SIRT5 上游及下游调节蛋白Fig1 Downstream and upstream signal proteins of SIRT5
4 线粒体蛋白对于SIRT5的调控作用
除上述SIRT5 对代谢相关因子活性的调节外,SIRT5 自身的表达水平或活性也受到线粒体中其他因子的调节。在小鼠原代肝细胞内,过表达过氧化物酶体增殖物激活受体γ 辅助活化因子1(peroxysome proliferator-activated receptor γ coactivator 1α,PPARγ coactivator 1α,PGC-1)可通过氧化物酶体增殖物激活受体α(peroxysome proliferator-activated receptor α,PPARα)及雌激素相关受体α(ERRα)上调SIRT5的mRNA 及蛋白表达水平;同时,过表达AMPK 则可下调SIRT5的mRNA表达水平。过表达SIRT5 可使HepG2细胞ATP 合成以及氧消耗量增加,但不影响线粒体生物合成过程。
5 展望
目前已报道SIRT5 参与多个代谢通路,即线粒体中氧化还原反应、酮体合成、尿素循环以及细胞凋亡及增殖过程。各通路涉及到的SIRT5 靶蛋白如图1所示。
SIRT5 可对特定线粒体蛋白中不同赖氨酸残基进行多种翻译后修饰,是能量稳态调节的潜在作用因子之一。除去乙酰化外,其对赖氨酸残基的去丙二酰化、去琥珀酰化以及去戊二酰化也为线粒体功能和代谢稳定性调控提供了全新视角。线粒体内SIRT5 对于多种代谢酶的调控可能引发细胞内多种翻译后修饰发生相互作用,从而使线粒体内的代谢网络具备精确调控多种关键酶的能力。
现已明确,线粒体蛋白翻译后修饰的动态变化将影响能量代谢过程,而线粒体内Sirtuin 活性与线粒体内代谢及氧化还原过程密切相关。但迄今为止大多数研究都依赖于基因敲除小鼠模型,即只体现某一特定条件下的代谢表型,具有一定的孤立性;另外,从蛋白质组研究中获得并已鉴定的SIRT5的大量靶蛋白,也需要在分子层面进一步得到验证及鉴定,如其调节酰基修饰功能对于目的蛋白活性的影响,及其对代谢底物的后续效应等。
综上所述,线粒体SIRT5 蛋白可对机体代谢过程或线粒体能量利用过程产生有益调节,或可成为细胞物质、能量代谢的重要调节因子,这无疑将为治疗代谢性疾病(如肥胖和2型糖尿病)提供新的靶点和研究思路。
[1]Turner N,Heilbronn LK.Is mitochondrial dysfunction a cause of insulin resistance?[J].Trends Endocrin Met,2008,19:324-330.
[2]Denu JM,Gottesfeld JM.Minireview series on sirtuins:from biochemistry to health and disease[J].J Biol Chem,2012,287:42417-42418.
[3]Ono M,Shitashige M,Honda K,et al.Label-free quantitative proteomics using large peptide data sets generated by nanoflow liquid chromatography and mass spectrometry[J].Mol Cell Proteomics,2006,5:1338-1347.
[4]He W,Newman JC,Wang MZ,et al.Mitochondrial sirtuins:regulators of protein acylation and metabolism[J].Trends Endocrin Met,2012,23:467-476.
[5]Jiang H,Khan S,Wang Y,et al.SIRT6 regulates TNF-α secretion through hydrolysis of long-chain fatty acyl lysine[J].Nature,2013,496:110-113.
[6]Howitz KT,Bitterman KJ,Cohen HY,et al.Small molecule activators of sirtuins extend Saccharomyces cerevisiae lifespan[J].Nature,2003,425:191-196.
[7]Schwer B,Eckersdorff M,Li Y,et al.Calorie restriction alters mitochondrial protein acetylation [J].Aging cell,2009,8:604-606.
[8]Gertz M,Steegborn C.Function and regulation of the mitochondrial sirtuin isoform Sirt5 in Mammalia[J].Biochim Biophys Acta,2010,1804:1658-1665.
[9]Zhang Z,Tan M,Xie Z,et al.Identification of lysine succinylation as a new post-translational modification[J].Nat Chem Biol,2011,7:58-63.
[10]Wu YT,Lee HC,Liao CC,et al.Regulation of mitochondrial ATPase activity by Sirt3-catalyzed deacetylation and its deficiency in human cells harboring 4977 bp deletion of mitochondrial DNA [J].Biochimicaet Biophysica Acta(BBA)-Molecular Basis of Disease,2013,1832:216-227.
[11]Rardin MJ,He W,Nishida Y,et al.SIRT5 regulates the mitochondrial lysine succinylome and metabolic networks[J].Cell metabolism,2013,18:920-933.
[12]Tan M,Peng C,Anderson KA,et al.Lysine glutarylation is a protein posttranslational modification regulated by SIRT5[J].Cell metabolism,2014,19:605-617.
[13]Peng C,Lu Z,Xie Z,et al.The first identification of lysine malonylation substrates and its regulatory enzyme[J].Mol Cell Proteomics,2011,10.doi:10.1074/mcp.M111.012658.
[14]Abu-Elheiga L,Matzuk MM,Abo-Hashema KAH,et al.Continuous fatty acid oxidation and reduced fat storage in mice lacking acetyl-CoA carboxylase 2 [J].Science,2001,291:2613-2616.
[15]Du J,Zhou Y,Su X,et al.Sirt5 is a NAD-dependent protein lysine demalonylase and desuccinylase [J].Science,2011,334:806-809.
[16]Wolfgang MJ,Lane MD.Hypothalamic malonyl ‐ CoA and CPT1c in the treatment of obesity[J].FEBS journal,2011,278:552-558.
[17]Lin ZF,Xu HB,Wang JY,et al.SIRT5 desuccinylates and activates SOD1 to eliminate ROS[J].Biochem Bioph Res Co,2013,441:191-195.
[18]Liu B,Che W,Zheng C,et al.SIRT5:A safeguard against oxidative stress-induced apoptosis in cardiomyocytes[J].Cell Physiol Biochem,2013,32:1050-1059.
[19]Schlicker C,Gertz M,Papatheodorou P,et al.Substrates and regulation mechanisms for the human mitochondrial sirtuins Sirt3 and Sirt5[J].J Mol Biol,2008,382:790-801.
[20]Glorioso C,Oh S,Douillard GG,et al.Brain molecular aging,promotion of neurological disease and modulation by Sirtuin5 longevity gene polymorphism[J].Neurobiol Dis,2011,41:279-290.
[21]Allali-Hassani A,Wasney G,Chau I,et al.A survey of proteins encoded by non-synonymous single nucleotide polymorphisms reveals a significant fraction with altered stability and activity[J].Biochem.J,2009,424:15-26.
[22]Dong C,Della-Morte D,Wang L,et al.Association of the sirtuin and mitochondrial uncoupling protein genes with carotid plaque[J].PLoS one,2011,6:e27157.DOI:10.1371/journal.pone.0027157.
