药前酶基因修饰的骨髓间充质干细胞对黑色素瘤靶向治疗的研究*
2015-05-10胡晓彦王季石吴乘龙
胡晓彦, 王季石, 吴乘龙, 刘 霞, 钟 愉
(1.贵阳市第一人民医院 血液肿瘤科, 贵州 贵阳 550002; 2.贵州医科大学附院 血液科, 贵州 贵阳 550004; 3.贵州医科大学 微生物教研室, 贵州 贵阳 550004; 4.贵阳市中医学院 组织胚胎学教研室, 贵州 贵阳 550002; 5.贵州医科大学附属医院 病理教研室, 贵州 贵阳 550004)
药前酶基因修饰的骨髓间充质干细胞对黑色素瘤靶向治疗的研究*
胡晓彦1, 王季石2, 吴乘龙3, 刘 霞4, 钟 愉5
(1.贵阳市第一人民医院 血液肿瘤科, 贵州 贵阳 550002; 2.贵州医科大学附院 血液科, 贵州 贵阳 550004; 3.贵州医科大学 微生物教研室, 贵州 贵阳 550004; 4.贵阳市中医学院 组织胚胎学教研室, 贵州 贵阳 550002; 5.贵州医科大学附属医院 病理教研室, 贵州 贵阳 550004)
目的: 利用药前酶基因修饰的骨髓间充质干细胞(BMSCs)提高恶性黑色素瘤局部化疗效果。方法: 从雄性大鼠股骨、胫骨骨髓中分离、培养大鼠BMSCs并鉴定;将细胞色素氧化酶P4502E1(CYP2E1)以含增强绿色荧光蛋白(enhanced green fluorescent protein,EGFP)的重组腺病毒为载体转染BMSCs,用RT-PCR和荧光显微镜观察绿色荧光的方法来检测目的基因的表达;将人黑色素瘤细胞MV3注射到裸鼠背部皮下,建立裸鼠MV3移植瘤模型,将移植瘤模型分为4组,分别给予CYP2E1-BMSCs及达卡巴嗪,单用CYP2E1-BMSCs,单用达卡巴嗪以及生理盐水治疗,并检测各组的体内局部抗肿瘤效应。结果: 成功分离培养大鼠BMSCs,形态上均一,贴壁生长,以长梭形为主,体积小,核浆比大,呈明显的同向性改变,漩涡状盘旋排列;流式细胞术检测提示高表达CD29、CD71,低表达CD34、CD45;体外经不同诱导体系培养后提示具有成骨、成脂、成软骨潜能;鉴定后的BMSCs经重组腺病毒转染后,荧光显微镜可观察到转基因靶细胞EGFP表达,RT-PCR法从mRNA水平检测到目的基因在转基因细胞中表达;荧光显微镜观察治疗后裸鼠的肿瘤及各脏器的组织切片提示CYP2E1-BMSCs能聚集在肿瘤组织及转移灶周围,CYP2E1-BMSCs联合化疗药物组局部凋亡率明显高于单纯化疗组及空白对照。结论: CYP2E1-BMSCs在体内具有协同化疗药物抗肿瘤的作用,并有向肿瘤细胞聚集的特点。
骨髓间充质干细胞; 腺病毒科; 载体; 细胞色素P450 CYP2E1; 黑色素瘤
到目前为止,转移性恶性黑色素瘤一直缺乏有效的治疗方案, 美国食品药品监督管理局(FDA)仅批准了烷化剂达卡巴嗪作为治疗转移性黑色素瘤的药物,但治疗1年总生存率仅27%,中位生存期约5~11月[1]。因此多种治疗方法的联合应用成为治疗恶性黑色素瘤的新热点[2-4]。本研究设计腺病毒载体构建含人细胞色素氧化酶P4502E1(CYP2E1)cDNA的重组子转染大鼠骨髓间充质干细胞(bone marrow-derived mesenchymal stem cells,BMSCs),利用间充质干细胞向肿瘤部位聚集的特性,将达卡巴嗪的药前酶即CYP2E1带到肿瘤部位,CYP2E1氧化代谢达卡巴嗪,生成损伤DNA的代谢产物,以提高药物在肿瘤局部的抗肿瘤作用,现报道如下。
1 材料与方法
1.1 材料与试剂
1.1.1 质粒、实验动物及细胞株 含CYP2E1基因及增强绿色荧光蛋白(enhanced green fluorescent protein,EGFP)重组腺病毒颗粒(pAdCMV-2E1)由本课题组王季石教授提供。SD雄性大鼠,80~100 g,由贵州医科大学动物中心提供;BALB/cA-nude雄性裸鼠,16~18 g,4~6周龄,在SPF(specific pathogen free)条件下裸鼠室内饲养,由中国科学院上海实验动物中心提供(免疫证明书号:中科动检 No.0003276)。MV3细胞购于南京凯基生物科技发展有限公司。
1.1.2 主要试剂 Trizol试剂(美国Invitrogen原装),RT-PCR一步法试剂盒(Promega公司),RT-PCR 引物(上海生工合成),FITC标记小鼠抗CD34IgG(santa cruz),FITC标记小鼠抗CD45IgG(Biolegend),PE标记小鼠抗CD29IgG(Biolegend),PE标记小鼠抗CD71IgG(Biolegend),TransFastTMTransfection Reagent(promega);注射用达卡巴嗪(南京制药厂有限公司,0.1 g/瓶,工作液浓度4.5 mg/kg生理盐水稀释),percoll 淋巴细胞分离液 (Sigma公司,美国),TUNEL 细胞凋亡原位检测试剂盒(南京凯基生物科技发展有限公司),荧光染料Hoechst33342,兔抗人S-100抗体(Dako公司),鼠抗人HMB45抗体(Dako公司)。
1.2 方法
1.2.1 大鼠BMSCs的分离及培养 4周龄健康雄性SD大鼠,颈椎脱臼法处死,无菌条件下分离大鼠四肢骨,剪去骨两端,用低糖DMEM 培养基将骨髓冲出,并将冲洗下来的全骨髓细胞经1.073 g/mL的percoll细胞分离液离心后,取单核细胞层收集于一次性塑料细胞培养瓶置于37 ℃,体积分数为0.05的CO2饱和湿度培养箱中培养。培养的第1~6 d,每3 d换液,以后每2~3 d全量换液。第7~10 d,细胞铺满瓶底达到90%左右时1∶2比例传代,传代培养至第3代。
1.2.2 重组腺病毒pAdCMV-2E1感染大鼠BMSCs 将鉴定明确的BMSCs接种于25 mL培养瓶中,接种细胞数为1×106细胞/瓶。48 h后待细胞铺至瓶底60%左右,将培养液吸出,加入适量病毒液,感染强度(multiplicity of infection ,MOI)约为1 000蚀斑形成单位(plaque forming unit, pfu)/细胞的pAdCMV-2E1,置于37 ℃,体积分数为0.05的CO2饱和湿度培养箱中培养,每20 min“十”字摇晃一次,4 h后补加新L-DMEM完全培养基,于37 ℃,体积分数为0.05的CO2饱和湿度培养箱中继续培养。
1.2.3 建立裸鼠皮下移植瘤模型 人黑色素瘤细胞株(MV3)在RPMI1640完全培养基(含10%胎牛血清、100 U/mL青霉素和链霉素)于37 ℃ 、体积分数为0.05的CO2饱和湿度培养箱中培养。选取对数生长期MV3细胞制成悬液浓度为8.17×107个/mL的细胞悬液300 μL于无菌条件下接种于裸鼠背部皮下。
1.2.4 CYP2E1-BMSCs体内抗肿瘤效应 将移植瘤模型分为4组进行试验。1组:将CYP2E1-BMSCs体外Hoechst33342荧光染色后,调整浓度为1×106/mL细胞悬液,以400 μL/只经静脉(尾静脉,球后静脉)注入试验动物体内,1周后经静脉(尾静脉,球后静脉)进行化疗药物注射;2组:仅用CYP2E1-BMSCs经静脉注入试验动物体内;3组:仅用达卡巴嗪经静脉注入实验动物体内;4组:予生理盐水经静脉注入实验动物体内。1,2组所涉及CYP2E1-BMSCs细胞数量相同。按照达卡巴嗪标准治疗1疗程(10 d),达卡巴嗪给药剂量利用体重换算法根据公式 B种动物的剂量(mg/kg)=W×A种动物的剂量(mg/kg)换算,其中W为折算系数,人和小鼠间的折算系数为9.01。其中人的静脉注射剂量为2.5~6.0 mg/kg。
1.3 观察指标
1.3.1 BMSCs的鉴定 通过对细胞形态学观察、表面标志物鉴定(流式细胞术)及多向分化能力检测完成对分离培养的大鼠BMSCs的鉴定。多向分化能力检测方法:分别予成骨诱导体系、脂肪诱导体系、成软骨诱导体系培养14 d后,再分别用碱性磷酸酶染色、红油0染色及蕃红花于亮绿染色和n型胶原染色。
1.3.2 基因转染后BMSCs中CYP2E1表达检测 含目的基因重组腺病毒载体转染细胞48 h时用RT-PCR的方法和荧光显微镜观察绿色荧光的方法来检测目的基因的表达。
1.3.3 裸鼠皮下移植瘤模型的鉴定 人黑色素瘤细胞株(MV3)注射到裸鼠皮下后观察注射部位肿瘤灶形成并测量。以注射局部肿块直径为(1.0±0.1)cm的裸鼠为实验模型。
1.3.4 抗肿瘤效应检测 将移植瘤模型分组进行治疗,在疗程结束后,处死试验动物,并取出背部肿瘤及心、脑、肺、肝、脾、肾等重要脏器。将试验动物各脏器病理切片做S100蛋白和HMB45免疫组化染色以判断移植肿瘤在小鼠体内转移情况,并以荧光显微镜观察了解CYP2E1-BMSCs向肿瘤聚集的特性。将试验动物背部肿瘤病理切片,TUNEL 法检测各组肿瘤细胞凋亡情况。结果判定:DAB 显色后光学显微镜下观察,以细胞内出现棕黄色颗粒为凋亡细胞。每张切片随机取 5 个视野(100×),观察并计数 500 个细胞,以 TUNEL阳性细胞数作为 TUNEL 检测的结果判定。计算凋亡指数(PI)来表示各组细胞的凋亡程度,PI=(凋亡细胞数/肿瘤细胞总数)×100%。
1.4 统计学分析
数据处理采用SPSS 11.5统计软件包。数据以均数±标准差表示, 采用多个独立样本比较的秩和检验,P<0.05为差异有统计学意义。
2 结果
2.1 BMSCs分离、培养及鉴定
采用密度梯度分离法获得的 BMSCs 形态较为均一,呈大圆形单核; 培养24 h后,部分大圆形细胞开始贴壁生长,少量细胞呈现短梭形改变;培养48~72 h后,贴壁细胞明显增多,形态上以圆形和短梭形为主(图1);传至第3代时细胞增殖迅速,几乎全部贴壁生长,以长梭形为主,体积小,核浆比大,呈明显的同向性改变,漩涡状盘旋排列(图1)。流式细胞仪检测传代 BMSCs中高表达CD29,阳性细胞率为(96.62±0.42)%;部分表达CD71,阳性细胞率为(25.14±2.28)%;低表达CD34,阳性细胞率为(2.81±0.75)%;低表达CD45,阳性细胞率为(12.98±2.11)%(图2)。诱导2周后成骨诱导细胞碱性磷酸酶染色呈阳性;脂肪诱导体系中细胞经油红0染色,苏木素复染后,镜下观察细胞核呈浅兰色,胞浆内橘红色脂肪滴清晰可见。成软骨诱导体系中,蕃红花于亮绿染色和n型胶原染色阳性,证明该细胞能在体外经诱导分化为成骨细胞、脂肪细胞和成软骨细胞。
2.2 基因转染后BMSCs中CYP2E1表达检测
含CYP2E1的重组腺病毒载体转染BMSCs后,被转染的细胞在转录水平CYP2E1表达的量大于对照组,分子量标准由上至下分别为600、500、400、300、200及100 bp,目的条带所在位置约为365 bp(见图3)。荧光显微镜检测显示,BMSCs表达EGFP,提示含有EGFP的腺病毒载体已携带CYP2E1成功转染BMSCs(图4)。
2.3 裸鼠皮下移植瘤模型的鉴定
所有观察的裸鼠接种后4~5周接种部位均有局部皮下肿块隆起,之后逐渐增大,但未见明显的色素沉着,颜色加深,形成肿瘤结节,为单发,分叶或不分叶,表面光滑,部分有坏死或溃疡。肿瘤结节形成平均潜伏期为36 d(图5)。 2.4 转基因CYP2E1-BMSCs体内向肿瘤部位聚集
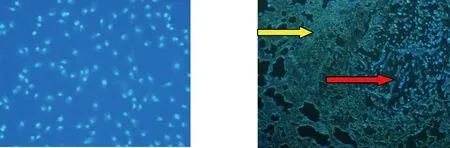
实验裸鼠各重要脏器病理组织切片HE染色提示肺、脾等脏器出现肿瘤转移灶,瘤组织排列结构复杂,呈巢状、或弥散分布,可见较多大小不等的黑色素颗粒。瘤细胞形态多种多样有上皮样、梭形、小痣细胞样、气球样细胞及单核或多核瘤巨细胞等类型。细胞体积大,多边形,核呈空泡状,核仁明显,胞浆丰富,淡染。部分可见核分裂象(图6)。用免疫组化Elivision二步法测定细胞内S100蛋白和HMB45,见胞浆,胞膜均呈棕黄色,提示为阳性反应(图7、8),进一步证实转移灶为黑色素瘤细胞。CYP2E1-BMSCs经荧光染色后,细胞核染成淡蓝色(图9)。将经荧光染色的CYP2E1-BMSCs注射到实验裸鼠后,可用荧光显微镜在转移灶内观察到发出蓝色荧光的细胞,体内无自发荧光细胞,所以它们是CYP2E1-BMSCs,这些细胞向肿瘤部位聚集,而不在周围正常组织中被发现(图10)。2.5 转基因CYP2E1-BMSCs体内抗肿瘤效应检测
试验动物背部肿瘤病理切片显示,CYP2E1-BMSCs联合达卡巴嗪协同治疗组(1组)肿瘤组织内发现大量的凋亡细胞,细胞核内有棕黄色颗粒,且明显多于BMSCs治疗组(2组)、达卡巴嗪治疗组(3组)及生理盐水治疗组(4组)(图11)。TUNEL法检测各组肿瘤细胞凋亡情况结果显示,各组肿瘤组织中细胞凋亡率(PI)分别为:CYP2E1-BMSCs及达卡巴嗪协同治疗组(35.2±2.1)%,CYP2E1-BMSCs治疗组(12±1.2)%,达卡巴嗪治疗组(21.2±0.4)%,生理盐水治疗对照组(11.2±1.1)%。
3 讨论
今天转移性黑色素治疗进入百家争鸣的时代,各种小分子靶向治疗,免疫治疗的涌现为改善患者的预后带来曙光,然而经典化疗并未退出历史舞台,一项含423例晚期黑色素瘤患者临床研究提示,生物化疗能延长患者的无复发生存期,疗效明显优于大剂量干扰素治疗[1]。提高经典化疗药物的治疗效果同样也是改善疾病预后的有效途径。
提高化疗药物肿瘤局部杀伤效应以减少全身治疗副反应是有效提高化疗效果的途径。而基因介导的酶前药治疗(gene directed enzyme prodrug therapy,GDEPT)应运而生[5]。GDEPT靶向杀伤肿瘤的效应是通过引入外源代谢酶基因和前药例如环磷酰胺、异环磷酰胺、达卡巴嗪,使其聚集在肿瘤周围,以引出一种强大的“旁观者效应”,杀伤周围不表达具有活化前药活性的酶的肿瘤细胞[5-6]。在肝脏的众多酶类中,以P450为代表的混合功能氧化酶系(mixed functional oxidase, MFO)起着重要作用,人类已合成的近25万个化合物中绝大多数为P450的底物的代谢酶[7]。本研究所涉及CYP2E1属于P450酶系的微粒体P450。在哺乳动物CYP2家族中,CYP2E1同功酶最为保守,表现在人和大鼠的CYP2E1共享75%核苷酸和78%氨基酸序列同源性;在大鼠、小鼠、家兔和人的CYP2E亚家族仅发现唯一基因CYP2E1。它主要存在于肝细胞和肾上腺皮质细胞内质网,参与药物、致癌物、类固醇激素和脂肪酸的氧化代谢,代谢底物达70多种,为前致癌物(procarcinogen)、前毒物(protoxin)和临床药物[7],其中包括了抗肿瘤药物达卡巴嗪,该药为治疗黑色素瘤等恶性肿瘤的重要化疗药物,其特点是本身并无毒性或致癌作用,但在体内经CYP2E1氧化代谢后,可生成损伤DNA的代谢产物,因此成为极有潜力的化疗前药[8-9]。将目的基因CYP2E1定位于肿瘤,使其能够联合前药发挥杀伤肿瘤的效应,是实现靶向治疗肿瘤的关键环节。BMSCs是一种多潜能干细胞,能在体外增殖维持非分化状态,并具有分化成骨、软骨、心肌、血管内皮细胞等中胚层组织的潜能。BMSCs易于培养和遗传修饰,多次传代后分化能力和增殖能力基本保持不变;进入宿主体内后能长期存活且能持续表达所携带的目的基因;另外BMSCs具有低免疫原性,小鼠BMSCs给大鼠注射,异种BMSCs未被排斥,在骨髓腔内持续存在[10-13]。更重要的是,BMSCs可以产生某种生物因子并定位于肿瘤,并证实了肿瘤的微环境构建过程中更优先的选择了骨髓间充质干细胞而不是其他的组织细胞,显示了BMSCs潜在的肿瘤靶向聚集的特点[14]。

A B注:A骨髓间充质干细胞培养72 h(200×),B骨髓间充质干细胞培养72 h(100×)

图2 骨髓间充质干细胞表型鉴定

图3 RT-PCR 电泳图检测CYP2E1表达 图4 BMSCs上EGFP的表达(400×)
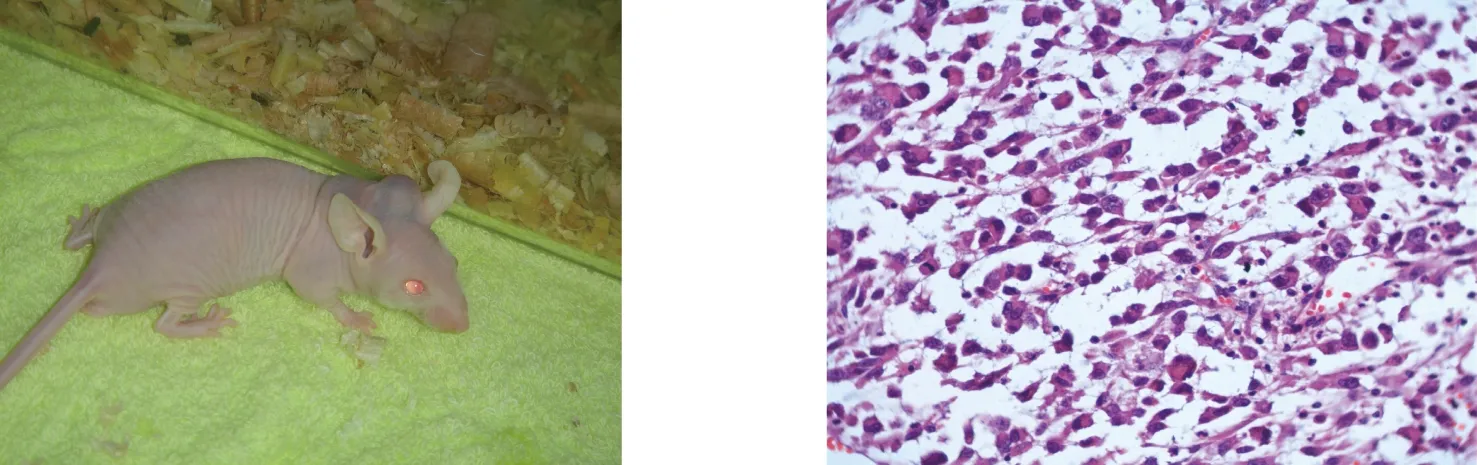
图5 人黑色素瘤裸鼠移植模型 图6 肿瘤组织切片HE染色(200×)

图7 肿瘤组织HMB45表达(Elivisian法,×200) 图8 肿瘤组织S-100表达(Elivisian法,×200)
注:黄色箭头所指为正常肺组织,红色 箭头所指为黑色素瘤转移灶

1组 2组 3组 4组
在本研究中,将转染了CYP2E1的大鼠BMSCs体外荧光染色后输入人黑色素瘤裸鼠模型体内,实验终止后对其肿瘤和重要器官组织的病理切片用倒置荧光显微镜观察,发现BMSCs聚集在肿瘤组织及脏器肿瘤转移灶,而不在其他非肿瘤组织中。提示CYP2E1-BMSCs有向肿瘤聚集及参与肿瘤构建的特点,这个结果与Matus Studeny等[14]人的研究结果一致。原位末端标记法(TUNEL 染色)检测结果显示CYP2E1-BMSCs联合达卡巴嗪协同治疗组及达卡巴嗪治疗组的肿瘤组织内有大量灶性分布的凋亡细胞,且前者较后者更多,CYP2E1-BMSCs联合达卡巴嗪可有效提高达卡巴嗪体内抗肿瘤作用,为提高恶性黑色素瘤化疗效果及综合治疗策略上提供了新的思路。
[1] Ives NJ,Stowe RL, Lorigan P, et al. Chemotherapy compared with biochemotherapy for the treatment of metastatic melanoma: a meta-analysis of 18 trials involving 2,621 patients[J] . J Clin Oncol, 2007(34):5426-5434.
[2] Flaherty LE, Moon J. Phase III trial of high-dose interferon alpha-2b versus cisplatin, vinblastine, DTIC plus IL-2 and interferon in patients with high-risk melanoma (SWOG S0008): An intergroup study of CALGB, COG, ECOG, and SWOG [J]. J Clin Oncol, 2012(15 Suppl): abstr 8504.
[3] Lian B, Mao LL, Cui CL, et al. Phase II randomized study of high-dose interferon alfa-2b(HDI) versus chemotherapy as adjuvant therapy in patients with resected mucosal melanoma[J].J ClinOncol, 2012(15 Suppl):abstr 8506.
[4] Seetharamu N, Ott PA, Pavlick AC. Muscosal melanomas: a case-based review of the literature [J]. Oncologist, 2010(7):772-781
[5] Marais R, Spooner RA, Light Y,et al. Gene-directed enzyme prodrug therapy with a mustard prodrug/carboxypeptidase G2 combination[J]. Cancer Res, 1996(20):4735-4742.
[6] Kyriakou CA. Human mesenchymal stem cells (hMSCs) expressing truncated soluble vascular endothelial growth factor receptor (tsFlk-1) following lentiviral-mediated gene transfer inhibit growth of Burkitt's lymphoma in a murine model[J].J Gene Med, 2006(3):253-264.
[7] Wang JS, Chen ZX, Xia XM, et al. A bicistronic retroviral vector to introduce drug resistance gene into human umbilical cord blood CD34+ cells to improve combination chemotherapy tolerance[J]. Chinese Medical Journal, 2001(1):25-29.
[8] Blum JS,Barry MA,Mikos AG,et al.In vivo evaluation of gene therapy vectors in ex vivo-derived marrow stromal cells for bone regeneration in a rat critical-sized calvarial defect mode1[J]. Hum Gene Ther, 2003(18):1689-1701.
[9] Turpeinen M, Raunio H, Pelkonen O. The functional role of CYP2B6 in human drug metabolism: substrates and inhibitors in vitro, in vivo and in silico[J]. Curr Drug Metab, 2006(7):705-714.
[10]Chen L, Waxman DJ. Intratumoral activation and enhanced chemotherapeutic effect of oxazaphosphorines following cytochrome P-450 gene transfer: development of a combined chemotherapy/cancer gene therapy strategy[J]. Cancer Res, 1995(3):581-589.
[11]Wei MX, Tamiya T, Chase M, et al. Experimental tumor therapy in mice using the cytochrome P450 2B1 gene[J]. Hum Gene Ther, 1994(5):969-978.
[12]On Kan, Leigh G, Dilair B, et al. Direct retroviral delivery of human cytochrome P450 2B6 for gene-directed enzyme prodrug therapy of cancer[J]. Cancer Gene Ther, 2001(7):473-82.
[13]McErlane V, Yakkundi A, McCarthy HO, et al. A cytochrome P450 2B6 meditated gene therapy strategy to enhance the effects of radiation or cyclophosphamide when combined with the bioreductive drug AQ4N[J]. J Gene Med, 2005(7):851-859.
[14]Studeny M, Marini FC, Champlin RE, et al. Bone marrow-derived mesenchymal stem cells as vehicles for interferon-ß delivery into tumors[J]. Cancer Research, 2002(62):3603-3608.
(2015-05-30收稿,2015-07-04修回)
中文编辑: 周 凌; 英文编辑: 刘 华
Stem Cells Modified by Mediated Prodrug Gene inTargeted Therapy of Human Melanoma
HU Xiaoyan1, WANG Jishi2, WU Chenglong3, LIU Xia4, ZHONG Yu5
(1.DepartmentofHematologyOncology,theFirstPeople'sHospitalofGuiyang,Guiyang550002,Guizhou,China; 2.DepartmentofHematology,theAffiliatedHospitalofGuizhouMedicalUniversity,Guiyang550004,Guizhou,China; 3.DepartmentofMicrobiology,GuizhouMedicalUniversity,Guiyang550004,Guizhou,China; 4.GuiyangUniversityofTCM,Guiyang550002,Guizhou,China; 5.DepartmentofPathology,GuizhouMedicalUniversity,Guiyang550004,Guizhou,China)
Objective: To enhance the local chemotherapy effect of human melanoma by utilizing rats' bone marrow mesenchymal stem cells(BMSCs) modified by mediated prodrug gene. Methods: BMSCs were separated from rat's bone marrow of femur and tibia, culturedinvitroand identified, which were transfected by recombinant adenovirus mediate CYP2E1 gene (pAd5CMV-CYP2E1-EGFP). RT-PCR method and fluorescence microscope were adoped to detect the expression of CYP2E1 in genetic modified BMSCs (CYP2E1-BMSCs). The cells of MV3 were injected subcutaneously into back of nude mice to build the MV3 transplantation tumor model. Then the MV3 transplantation tumor model mice were divided into 4 groups: group 1 received treatment of CYP2E1-BMSCs combined with dacarbazine; group 2 received treatment of CYP2E1-BMSCs alone; group 3 dacarbazin alone; goup 4 physiological saline alone(control group). Results: The rats' BMSCs were successfully separated and cultured. BMSCs were uniform in morphology, featured by adherent growth, small size, long spindle shape, large karyoplasmic ratio, obvious same direction change, and swirling and spiral arrangment. Flow cytometry detection indicated high expression level of CD29, CD71, and low expression level of CD29, CD71. Incubation in different induction systeminvitroindicated that BMSCs had potential in osteogenesis, adipogenesis and chondrogenesis. After identification and transfection, EGFP expression in transgenosis targeted cells could be observed under fluorescence microscope and CYP2E1 target gene expression in mRNA expression level could be detected by RT-PCR. Under fluorescence microscope, after treatment, tissue slice of nude mices' tumor and other organs showed that CYP2E1-BMSCs could gather around tumor tissue and metastatic foci, and the apoptosis rate of group 1 (CYP2E1-BMSCs combined with dacarbazine) was significantly higher than that of group 3 (dacarbazine alone) and control group (physiological saline alone). Conclusion: CYP2E1-BMSCs can significantly improve the potency of dacarbazineinvivo, and can gather around tumor tissue. Therefore CYP2E1-BMSCs play a role in synergistic effect of chemotherapy drugs on tumor.
bone mesenchymal stem cells; adenoviridae; vector; cytochrome P450 CYP2E1; melanoma
时间:2015-08-07
http://www.cnki.net/kcms/detail/52.5012.R.20150807.2303.042.html
R456.9; R739.5
A
1000-2707(2015)09-0947-07
