银杏提取物对血管紧张素II诱导的新生大鼠心肌细胞凋亡的影响*
2015-05-15罗振华付凌云沈祥春吴立荣刘兴德
李 伟, 罗振华, 付凌云, 沈祥春, 吴立荣, 刘兴德**
(1.贵州医科大学附院 心血管科, 贵州 贵阳 550004; 2.贵州省人民医院 中心实验室, 贵州 贵阳 550002; 3.贵州医科大学 药学院, 贵州 贵阳 550025)
·基础研究·
银杏提取物对血管紧张素II诱导的新生大鼠心肌细胞凋亡的影响*
李 伟1, 罗振华2, 付凌云3, 沈祥春3, 吴立荣1, 刘兴德1**
(1.贵州医科大学附院 心血管科, 贵州 贵阳 550004; 2.贵州省人民医院 中心实验室, 贵州 贵阳 550002; 3.贵州医科大学 药学院, 贵州 贵阳 550025)
目的: 探讨银杏叶提取物(GBE)对血管紧张素II(AngII)诱导的新生大鼠心肌细胞凋亡的影响。方法: 分离与培养新生SD大鼠原代心肌细胞,采用AngII诱导乳鼠心肌细胞凋亡后将细胞分阴性对照组(A组,细胞培养液)、AngII组(B组, AngII 10-5mol/L干预)、ALK5抑制剂组(C组,SB431542 6 mg/L及 AngII 10-5mol/L)、GBE低剂量组(D组,GBE 2 mg/L及AngII 10-5mol/L)及GBE 高剂量组(E组,GBE 20 mg/L及AngII 10-5mol/L),采用流式细胞仪和原位末端标记技术(TUNEL法)检测各组大鼠心肌细胞凋亡情况。结果: B组心肌凋亡率明显高于其他各组,差异有统计学意义(P<0.05);与B组比较,C、D及E组的心肌细胞凋亡率均降低,其中C组和E组细胞凋亡率与B组比较,差异有统计学意义(P<0.01)。结论: GBE能够抑制AngII诱导的心肌细胞凋亡,具有保护心肌细胞的作用。
银杏叶提取物; 血管紧张素II; 细胞凋亡; 心室重塑
细胞凋亡(apoptosis)亦称程序性细胞死亡(programmed cell death,PCD),是细胞在自身基因调控下的一种主动死亡,是组织细胞必要的代谢过程。但是,过度的细胞凋亡会导致严重后果,如心肌梗死后缺血缺氧导致的心肌细胞凋亡是心室重塑的重要病理原因之一[1]。心肌细胞凋亡发生后,该区域会出现坏死、液化及吸收过程,心室壁会逐渐变薄,心室进行性扩张,导致到心室重塑,最后发生心力衰竭,甚至诱发患者猝死[2-3]。研究发现,心肌细胞凋亡亦可发生在急性心肌梗死(acute myocardial infarction,AMI)后非梗死区[4]。因此,寻找合理有效的防治与逆转心肌重塑的药物,对降低AMI病死率有着重要意义。银杏叶提取物(ginkgo biloba extract,GBE)是从银杏叶中提取的一种混合物,具有独特药理活性,其中黄酮类和萜类内酯化合物是银杏叶提取物的主要有效成分[5]。GBE对心肌缺血的损伤具有保护作用,其机制可能与清除自由基和抗脂质过氧化、扩张冠脉血管、改善微循环、抗自由基诱导的细胞凋亡等作用有关[6-7],但目前关于GBE对AMI后心肌重塑的抑制或逆转作用国内外少见报道,本研究旨在观察GBE对血管紧张素II(angiotensin II,AngII)诱导的新生大鼠心肌细胞凋亡的影响,为探讨GBE对心肌重塑防治作用提供理论依据。
1 材料与方法
1.1 材料
1.1.1 实验动物及饲养环境 清洁级SD雌性大鼠24只,雄性大鼠8只,体重200~250 g,由中国人民解放军第三军医大学附属大坪医院实验动物中心提供。贵州医科大学动物伦理委员会(IAEC)审查允许,许可证号SCXK2013-0001。实验动物由贵州医科大学动物实验中心清洁级实验室饲养,实验室恒温、恒湿。雌、雄大鼠按照3∶1的比例共圈饲养,出生1~3 d的乳鼠作为实验用鼠。
1.1.2 实验药材 银杏叶提取物,批号WGBEXP130918,由贵州省工程中心研究员提供,呈黄色粉末,成分包括总黄酮26.16%(槲皮素醇苷11.06%、山奈素醇苷11.93%、异鼠李素醇苷3.17%)及银杏总内酯6.28%(银杏内酯C1.23%、白果内酯1.81%、银杏内酯A2.48%、银杏内酯B0.76%)。
1.1.3 主要试剂与仪器 AngII试剂盒(美国Sigma公司),Donkey Anti-Rabbit IgG (H+L) Antibody(美国life technologies公司),Anti-cardiac troponin antibody、α-Actin antibody试剂盒(美国Santa公司),Annexin V/PI apoptosis kit凋亡检测试剂盒(杭州联科生物技术股份有限公司),TUNEL细胞凋亡原位检测试剂盒(瑞士ROCHE公司),H1650R台式高速冷冻离心机(上海卢湘仪),Accuri C6流式细胞仪(美国BD公司)。
1.2 方法
1.2.1 新生SD大鼠原代心肌细胞的分离与培养 取出生1~3 d SD大鼠乳鼠,雌雄皆可,超净台内无菌操作取乳鼠心脏,仔细剥离心房及大血管组织,留心室组织。将心室组织置于冰浴的PBS中,浸泡洗涤3次,吸净PBS液后用虹膜剪将心室组织剪成大小约0.5~1 mm3碎块。加入0.1%胰蛋白酶消化组织碎块,反复吹打置37 ℃恒温水浴摇床消化,5 min/次,消化5~7次,收集每次消化液于10% FBS-DMEM中(第一次消化液弃)。100-200目筛网过滤,混匀细胞,1 000 r/min,10 min,用DMEM洗涤,再次混匀细胞,1 000 r/min,10 min,弃上清将细胞重悬于含10%胎牛血清的DMEM培养液中,将细胞培养瓶置于37 ℃,5% CO2恒温培养箱中差速贴壁2 h。2 h后收集未贴壁细胞接种于培养板中继续生长,培养24 h后细胞首次换液,48 h更换无血清DMEM继续培养12 h,细胞生长同步后做后续实验。
1.2.2 新生大鼠心肌细胞鉴定 将新生大鼠心肌细胞接种于放置有载玻片的12孔板中,1×105个/孔,加入含10%胎牛血清的DMEM培养液培养48 h后,换无血清DMEM培养基同步化后,采用免疫细胞化学SP染色法鉴定分离培养的心肌细胞,采用培养4 d的原代心肌细胞,观察细胞内是否表达大鼠心肌肌动蛋白(α-Actin)和肌钙蛋白(cardiac troponin),细胞胞质内出现棕黄色颗粒为阳性反应。
1.2.3 流式细胞仪( FCM)检测AngII诱导新生大鼠心肌细胞凋亡的浓度效应关系 取1~3 d乳鼠按照1.2.1步骤制备原代心肌细胞,在含10%胎牛血清的 DMEM培养液培养48 h,换无血清DMEM培养基培养12 h同步化后,分别加入最终浓度为10-8mol/L,10-7mol/L,10-6mol/L,10-5mol/L的AngII,给药后培养48 h。1 000 r/min离心10 min收集细胞,加入10 mol/L PBS (pH=7.2)缓冲液500 μL洗涤3次,弃上清,设置阴性对照组(不加染料)。加入1×Binding Buffer 100 μL重悬细胞,在反应体积加入5 Μl FITC探针和10 μL PI探针混匀,4 ℃避光孵育10 min,用BD AccuriTMC6流式细胞仪检测各组心肌细胞凋亡率。FITC激发波长488 nm,发射波长525 nm,绿色荧光FL1通道检测;PI-DNA复合物激发波长535 nm,发射波长615 nm,红色荧光FL2通道检测。用BD AccuriTMC6软件绘制双色散点图,FITC为横坐标,PI为纵坐标。每个样采集10 000 events。每组实验重复3次。根据实验结果,AngII诱导心肌细胞凋亡的最佳浓度为10-5mol/L以该浓度做后续实验。
1.2.4 实验分组 根据1.2.3中选出的AngII诱导心肌细胞凋亡的最佳浓度,共分为5组。(1)A组,阴性对照组,加入药物同容积的细胞培养液;(2)B组,AngII组, AngII(10-5mol/L)干预;(3)C组,SB431542抑制剂作用组,加入SB431542(6 mg/L)及 AngII(10-5mol/L);(4)D组,GBE低剂量组,加入GBE(2 mg/L)及 AngII(10-5mol/L);(5)E组,GBE 高剂量组, 加入GBE(20 mg/L)及AngII(10-5mol/L)。
1.2.5 FCM检测各组心肌细胞凋亡 按照1.2.3步骤,收集各组心肌细胞,上机检测细胞凋亡率。
1.2.6 原位末端标记技术(TUNEL法)检测心肌细胞凋亡 按照TUNEL细胞凋亡原位检测试剂盒(ROCHE)操作说明,采用4%多聚甲醛室温固定细胞爬片20 min,PBS漂洗2遍;加TUNEL反应混合液50 μL于标本上,用封口膜密封于暗湿盒中37 ℃反应60 min,PBS漂洗3次,每次5 min;加DAB底物50~100 μL,显微镜下控制显色,PBS终止显色;苏木精液染色5~10 min后,PBS漂洗2次后中性树胶封片,拍照观察。根据阳性细胞分布情况,每张切片200倍镜下选择10个阳性视野,计数200个细胞中的阳性细胞数(细胞核棕黄色)作为凋亡指数,计算细胞凋亡率(%)。
1.3 统计学方法
2 结果
2.1 原代心肌细胞的培养及鉴定
倒置显微镜下刚分离的心肌细胞呈圆球形、棒状,漂浮在培养液中;24 h后细胞逐渐开始向外突起伸展,贴壁后部分心肌细胞出现自发性搏动;48 h后细胞逐渐展开,心肌细胞呈梭形或多角形,含有1~2个核;72 h后细胞逐渐形成细胞簇并出现同步搏动,心肌细胞纯度达90%以上。免疫细胞化学SP法染色显示,阴性对照可见心肌细胞呈梭形或多角形,胞浆无色,胞核椭圆蓝色(图1A);加抗体组可见心肌细胞染成棕黄色,肌动蛋白和肌钙蛋白在胞内表达。免疫染色结果显示分离培养的心肌细胞纯度达95%以上,符合心肌细胞的特征(图1B、C)。
2.2 AngII诱导新生大鼠心肌细胞凋亡的浓度效应关系
在心肌细胞培养液中加入10-8mol/L,10-7mol/L,10-6mol/L和10-5mol/L AngII,48 h后流式细胞仪观察结果显示,随着AngII浓度的增加,心肌细胞凋亡率逐渐上升, 10-5mol/L AngII心肌凋亡率最高,为(8.5±0.8)%(图2),与对照比较差异具有统计学意义(P<0.05),根据实验结果和参考文献,选取10-5mol/L为AngII诱导凋亡的最佳浓度进行后续试验。
2.3 FCM检测各组心肌细胞凋亡
FCM检测结果显示,B组心肌凋亡率明显高于其他各组,差异具有统计学意义(P<0.05),说明AngII刺激心肌细胞发生凋亡造模成功。用药物干预后与B组比较,C、D及E组细胞凋亡率均降低,C组和E组细胞凋亡率与B组比较,差异有统计学意义(P<0.01),见图3。
2.4 TUNEL法检测心肌细胞凋亡
通过TUNEL染色心肌细胞后镜下可见,对照组心肌细胞保持正常形态,呈梭形或多角形,胞质呈伸展突起,胞核椭圆形,1~2个,胞核染色蓝色,胞浆均一染成浅蓝色(见图4A);B组贴壁细胞出现皱缩、变圆和脱落,出现凋亡细胞,细胞变小、变圆,细胞胞浆和胞核染色呈棕黄色,染色体固缩,呈深棕色(见图4B);细胞内染色质成块状,在细胞胞浆内形成圆形、深棕色的凋亡小体(见图4C),这些为TUNEL阳性凋亡细胞。C、D及E组镜下可见正常心肌细胞和少量的凋亡细胞(图4D、4E、4F)。与对照组比较,B、C、D及E组心肌细胞凋亡率均有所增加,差异具有统计学意义(P<0.05);与B组比较,C、D及E组细胞凋亡率均有所下降,其中C组和E组细胞凋亡率与B组比较,差异有统计学意义(P<0.05)。见图5。

注:A.阴性对照组;B.抗肌动蛋白染色;C.抗肌钙蛋白染色

注:与对照组比较,(1)P<0.05,(2) P<0.01。
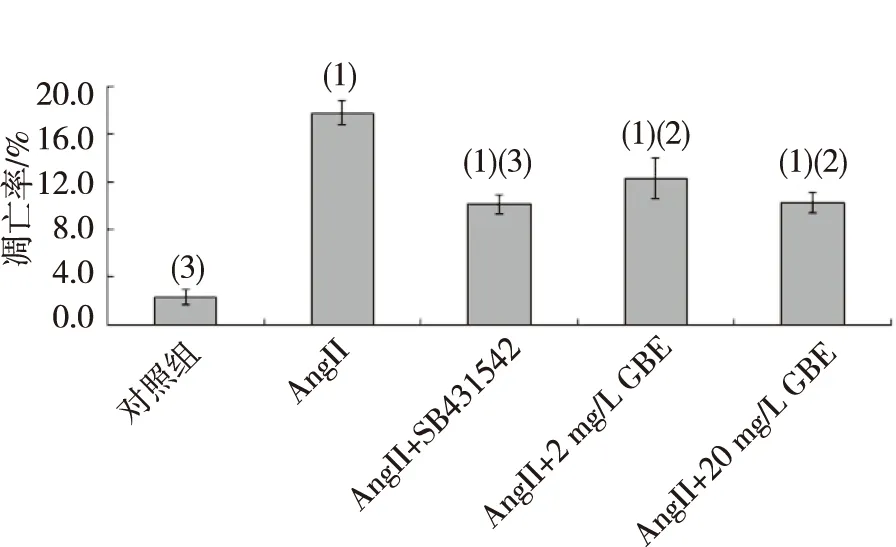
注:与对照组比较,(1)P<0.01;与AngII造模组比较,(2)P<0.05,(3)P<0.01
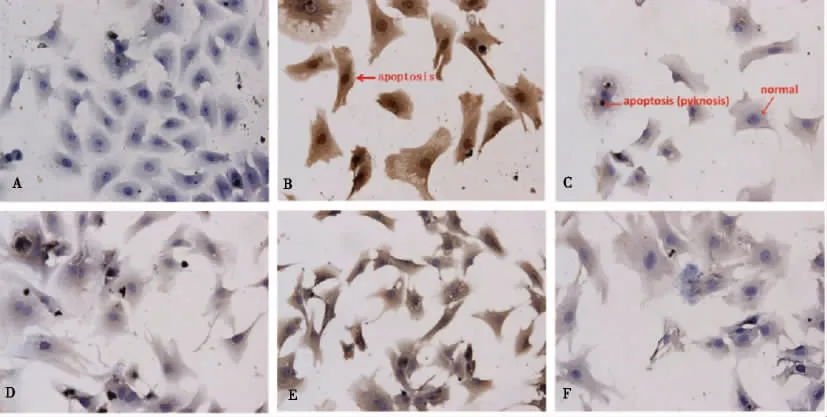
注:A为A组, B、C为B组,D为C组, E为D组, F为E组

与对照组比较,(1)P<0.05,(2)P<0.01;与AngII造模组比较,(3)P<0.05,(4)P<0.01
3 讨论
肾素-血管紧张素系统(renin-angiotensinsystem, RAS)或肾素-血管紧张素-醛固酮系统是人体内重要的体液调节系统,血管紧张素转换酶(angiotensin converting enzyme, ACE)和血管紧张素Ⅱ受体作为重要效应因子参与了肾素-血管紧张素系统的生理调节作用,尤其是AngII通过作用于相应组织器官上的受体,起到收缩血管平滑肌等重要作用。研究证实AngII能诱导心肌细胞凋亡,Kajstura J等[8]描述了在试验大鼠的心肌细胞中AngII诱导的凋亡反应。
GBE具有多种药理学活性,包括抗氧化及抗炎等,有研究表明银杏内酯B能促进视网膜神经节细胞轴突生长[9]。银杏叶提取物作用于阿霉素所致大鼠心肌损伤模型,能起到抗氧化和抗凋亡作用[10-11]。还有研究者发现银杏叶提取物作用于缺血/再灌注大鼠模型能显著抑制心肌Bax、Caspase-3及Cyt-c蛋白的表达[7]。黄迪南等[12]发现GBE化学活性成分EGb761能有效抑制TNF-α诱导的HeLa 细胞凋亡;刘彦等[13]发现GBE能够对大鼠在体缺血再灌注的心肌起到保护作用, 并促使心肌细胞凋亡的减少。本研究将GBE作用于AngII诱导的乳鼠心肌细胞凋亡模型,观察GBE的抗心肌凋亡作用。在心肌细胞培养液中加入10-8mol/L,10-7mol/L,10-6mol/L和10-5mol/LAngII,选择合适浓度制作AngII诱导的心肌细胞凋亡实验模型,48 h后用流式细胞仪观察每个浓度心肌细胞凋亡情况,发现随着AngII浓度的增加,心肌细胞凋亡率逐渐上升,当AngII浓度为10-5mol/L时心肌凋亡率最高,比对照组明显增加,表明AngII可促使心肌细胞调亡,选取10-5mol/L AngII为诱导凋亡的最佳浓度。培养48 h后,在倒置相差显微镜下观察心肌细胞,部分细胞体积变小,细胞变圆,部分胞体增大,形态不规则呈异型,丧失梭形形态,自发搏动明显减弱。TUNEL法观察造模组贴壁细胞出现皱缩、变圆和脱落,出现凋亡细胞,细胞变小、变圆,细胞胞浆和胞核染色呈棕黄色,染色体固缩,可见深棕色凋亡小体。加入药物干预后发现,ALK5抑制剂SB431542能够有效的抑制AngII诱导心肌细胞发生凋亡;在加入高浓度GBE后,流式细胞仪以及TUNEL法检测结果均显示,与AngII造模组比较高浓度GBE药物作用组的凋亡细胞数量明显减少,与AngII抑制剂使凋亡细胞数量减少的效果相类似。表明GBE能够显著的抑制由AngII引起的心肌细胞凋亡反应, GBE通过何种途径抑制AngII诱导的心肌细胞的凋亡,将做进一步的研究。
[1] Hojo Y, Saito T, Kondo H. Role of apoptosis in left ventricular remodeling after acute myocardial infarction[J]. Journal of Cardiology, 2012(2):91-92.
[2] Ren R, Oakley RH, Cruz-Topete D, et al. Dual role for glucocorticoids in cardiomyocyte hypertrophy and apoptosis[J]. Endocrinology, 2012(11): 5346-5360.
[3] Joseph B. Muhlestein. Adverse left ventricular remodeling after acute myocardial infarction: is there a simple treatment that really works[J].European Heart Journal, 2014(3):144-146.
[4] Pu J, Yuan A, Shan PR, et al. Cardiomyocyte-expressed farnesoid-X-receptor is a novel apoptosis mediator and contributes to myocardial ischaemia/reperfusion injury[J]. Eur Heart J, 2013(24):1834-1845.
[5] Liu XP, Luan JJ, Christopher EG. Comparison of the antioxidant activity amongst gigkobiloba extract and its main components[J].Chinese Medicinal Materials, 2009(5):736-740.
[6] Ranl K, Yangl DL, Chang YT, et al.Ginkgo biloba extract postconditioning reduces myocardial ischemia reperfusion injury[J].Genetics and Molecular Research, 2014(2):2703-2708.
[7] Qiao ZY, Huang JH, Ma JW et al. Ginkgo biloba extract reducing myocardium cells apoptosis by regulating apoptotic related proteins expression in myocardium tissues[J].Mol Biol Rep , 2014(41):347-353.
[8] Kajstura J, Cigola E, Malhotra A, et al. Angiotensin II induces apoptosis of adult ventricular myocytes in vitro[J]. J Mol Cell Cardiol, 1997(29):859-870.
[9]Wang ZYl, Mo XF, Jiang XH. Ginkgolide B promotes axonal growth of retina ganglion cells by anti-apoptosis in vitro[J]. Sheng Li Xue Bao, 2012(4):417-424.
[10]Boghdady NA. Antioxidant and antiapoptotic effects of proanthocyanidin and ginkgo biloba extract against doxorubicin-induced cardiac injury in rats[J].Cell Biochem Funct, 2013(4):344-351.
[11]Tsun JL, Yueh CY ,Chih TT , et al .Ginkgo biloba extract 761 reduces doxorubicin -induced apoptotic damage in rat heart s and neonatal cardiomyocytes[J].Cardiovascular Research, 2008(80):227-235 .
[12]黄迪南,侯敢.银杏叶提取物EGb761对TNF-a诱导HeLa 细胞凋亡的影响[J].实用癌症杂志, 2005 (1):31-33.
[13]刘彦, 杨玉双, 张泽冰.银杏提取物对缺血再灌注的心肌保护作用及作用机制[J]. 南京医科大学学报:自然科学版, 2008 (2):226-228.
(2015-05-18收稿,2015-06-30修回)
中文编辑: 周 凌; 英文编辑: 刘 华
The Effect ofGinkgobilobeExtract on Apoptosis of Neonate Rat Cardiac Myocytes Induced by AngII
LI Wei1, LUO Zhenhua2, FU Lingyun3, SHEN Xiangchun3, WU Lirong1, LIU Xingde1
(1.DepartmentofCardiovascularMedicine,AffiliatedHospitalofGuizhouMedicalUniversity,Guiyang550004,Guizhou,China; 2.CentralLaboratory,GuizhouProvincialPeople'sHospital,Guiyang550002,Guizhou,China; 3.Collegeofpharmacy,GuizhouMedicalUniversity,Guiyang550025,Guizhou,China)
Objective: To investigate the protective effect ofGinkgobilobaextract (GBE) on apoptosis of neonate rat cardiac myocytes induced by AngII. Methods: The neonate SD rat primary culture cardiac myocytes were separated and cultured. The injury of rat primary culture cardiac myocytes (RPCCM) was induced by AngII, and then incubated with GBE and ALK5 inhibitor. The experimental groups were randomly divided into 5 groups as following: group A: negative control group, the RPCCM+equality volume culture medium, group B: AngII group, RPCCM+AngII (10-5mol/L), group C: SB431542 inhibitor action group, RPCCM+SB431542 (ALK5 inhibitor, 6 g/mL) + AngII (10-5mol/L), group D: GBE low dose group, RPCCM+GBE (2 mg/L) + AngII (10-5mol/L), group E: GBE high dose group, RPCCM+GBE (20 mg/L) + AngII (10-5mol/L). The apoptotic morphology was detected by HE staining in the cardiac myocytes induced by AngII, and the cardiac myocytes apoptosis were detected by flow cytometry and TUNEL staining. Results: The myocardial apoptosis rate in group B (AngII group) was significantly higher than that in other groups(P<0.05). Compared with group B, the myocardial apoptosis rate in group C, group D and group E were decreased, and there was statistical significance between group C, group E and group B(P<0.01). Conclusion: GBE can significantly inhibit apoptosis induced by AngII and protect myocardial cells.
Ginkgobilobaextract; angiotensin II; apoptosis; ventricular remodeling
国家自然科学基金项目(No.81173586); 贵州省社会发展攻关项目[No.黔科合SY 字(2011)3011号]
时间:2015-08-07
http://www.cnki.net/kcms/detail/52.5012.R.20150807.2242.016.html
R541
A
1000-2707(2015)09-0910-05
**通信作者 E-mail:lxd@gmc.edu.cn
